ANTECEDENTES
Las malformaciones arteriovenosas uterinas son una causa excepcional de hemorragia uterina anormal; pueden ser congénitas o adquiridas como consecuencia de un procedimiento quirúrgico uterino. Sus síntomas pueden ser mínimos u originar hemorragia abundante que pone en riesgo la salud de la mujer y amerita transfusiones sanguíneas frecuentes si no se trata la causa.
El sangrado uterino anormal es el que rebasa los 80 mL y afecta la frecuencia, duración, regularidad y volumen del ciclo menstrual o que modifica negativamente la calidad de vida de la mujer.1
El protocolo diagnóstico debe conducir a identificar la causa que permita plantear un tratamiento que controle y desaparezca los síntomas; para esto deben tomarse en cuenta: la edad, el deseo de preservar la fertilidad o el útero, etc. La Federación Internacional de Ginecología y Obstetricia (FIGO) propuso en 2011 el acrónimo PALM-COEIN (pólipo, adenomiosis, leiomioma, malignidad e hiperplasia, coagulopatía, disfunción ovulatoria, endometrial, iatrogénica y no clasificadas) para sistematizar la identificación de la causa y elegir el tratamiento médico o quirúrgico apropiado para cada paciente. Esto se fundamenta en una historia clínica completa, examen físico y pruebas de laboratorio y gabinete.
En la categoría de malformaciones no clasificadas se incluyen: la endometritis crónica, hipertrofia miometrial y malformaciones arteriovenosas.1,2
Las malformaciones arteriovenosas uterinas implican el incremento de la vasculatura miometrial (que tiene una conexión anormal y no funcional) entre las venas y arterias uterinas que provoca dilataciones varicosas, aunque pocas veces con afectación capilar. La malformación arteriovenosa uterina se conoce también como: aneurisma cirsoideo, aneurisma arteriovenoso, fístula arteriovenosa y hemangioma cavernoso.
Estas malformaciones pueden ser congénitas o adquiridas (por lesiones traumáticas); las últimas son las más frecuentes y se asocian con cirugía uterina previa (dilatación y curetaje), aborto terapéutico, cáncer cervical o endometrial, enfermedad trofoblástica, traumatismo directo uterino y, en mayor medida, en mujeres en edad reproductiva. La variante congénita resulta de una falla en la diferenciación vascular embriológica que da como resultado múltiples conexiones vasculares que tienden a formar nidos u ovillos de pequeñas arterias que se comunican con venas, mientras que la adquirida casi siempre es una sola arteria que se comunica con otra vena.3,4
La malformación arteriovenosa uterina es sumamente rara, representa de 1 a 2% de todas las hemorragias genitales e intraperitoneales. Existen reportes de aproximadamente 100 casos; sin embargo, la incidencia aún no está establecida. La edad promedio son 30 años, según la revisión de Peitsidis;5 también puede aparecer en alrededor de 4% de las mujeres posmenopáusicas.
El cuadro clínico típico es con sangrado uterino masivo, variable en cantidad, tan significativo que a veces puede provocar hipotensión o anemia. Suele ser resistente al tratamiento farmacológico (hormonal) y con frecuencia se asocia al antecedente de algún procedimiento invasivo uterino. Este sangrado es habitual cuando existe erosión de los vasos de la malformación arteriovenosa uterina, desde o hacia el endometrio.5,6
Desde la perspectiva histórica, el diagnóstico de la malformación arteriovenosa uterina se establecía posterior a la histerectomía, mediante el estudio histopatológico. En la actualidad, el ultrasonido con Doppler color es la herramienta diagnóstica de elección, seguido de la tomografía computada, la resonancia magnética y la histeroscopia. Con el ultrasonido en escala de grises pueden observarse áreas hipoecogénicas o espacios anecoicos en el miometrio. Con Doppler color se observa el flujo vascular incrementado, de alta velocidad o multidireccional; el Doppler espectral muestra flujos de alta velocidad, baja resistencia, con índices de resistencia (IR) entre 0.25-0.55 y velocidades pico sistólicas (PSV) entre 40-100 cm por segundo.
La angiografía es una técnica diagnóstica indicada como complemento en caso de intervención quirúrgica o embolización terapéutica.6,7
Los diagnósticos diferenciales de malformación arteriovenosa uterina son: retención de restos de productos de la concepción, enfermedad trofoblástica gestacional y tumor del sitio trofoblástico, porque también tienen hipervascularidad con flujo turbulento.
El tratamiento clásico de las malformaciones arteriovenosas uterinas ha sido la histerectomía; en la actualidad se elige dependiendo de la localización y tamaño de la lesión, así como de la edad de la paciente y su deseo de preservar o no la fertilidad.
Si bien no hay consenso ante las opciones actuales a elegir, la embolización de las arterias uterinas es el tratamiento de elección en mujeres con deseo reproductivo (con la desventaja de aumento en el riesgo de embarazo con mala presentación fetal, cesárea, parto pretérmino y hemorragia posparto). La coagulación bipolar laparoscópica de los vasos uterinos es otra opción reportada en varias series, con buenos resultados.
En mujeres asintomáticas o con paridad no satisfecha, varios estudios también han considerado el tratamiento conservador porque, incluso, se ha observado regresión espontánea de las malformaciones.
En pacientes con síntomas leves o mientras se decide un tratamiento definitivo se recomienda la prescripción de: metilergonovina, análogos de hormona liberadora de gonadotropinas y danazol.7,8
Frente al reto de cuáles pacientes con malformación arteriovenosa uterina sintomática deben ser tratadas, se ha descrito lo siguiente:
Existe remisión espontánea de los síntomas en 6% de las pacientes.5
El tratamiento conservador es efectivo en dos terceras partes de los casos diagnosticados por ultrasonido, sobre todo cuando el PSV es menor de 40 cm por segundo.
En los casos con PSV mayor de 80 cm por segundo y corroborados por angiografía, el tratamiento definitivo parece ser la mejor opción.9
Los tratamientos invasivos incluyen la embolización arterial, ligadura de la arteria uterina y la histerectomía.
Ante la falta de consenso entre los diferentes tratamientos, y para los casos en los que no se dispone de embolización de arteria uterina, surge nuestra propuesta como una nueva opción cuando se desea conservar la fertilidad.
El objetivo de embolizar es ocluir el inicio del defecto arteriovenoso y así obliterar la fístula. Con base en este principio, de eliminar el principal trayecto anormal de los vasos, la remoción quirúrgica selectiva (similar a una miomectomía) parece ser otra opción.
Para conseguir una disección precisa que incluya el trayecto central de la fístula, sin afectar la mayor cantidad posible del tejido uterino sano, se propone delimitar el territorio afectado con ultrasonido Doppler transoperatorio; de esta forma se elimina el sitio principal de sangrado y los principales vasos nutricios.
En la revisión bibliográfica se encontró que hasta el momento no se han descrito técnicas quirúrgicas alternativas a la histerectomía, como la aquí descrita que es una técnica quirúrgica innovadora, guiada por ultrasonido Doppler, que permite la conservación del útero. (Cuadro 1)
Cuadro 1 Comparativo de diagnóstico y tratamiento de malformaciones arteriovenosas uterinas (continúa en la siguiente página)
| Autor | Tipo de estudio | Muestra | País | Antecedente | Evolución | Edad | P, A, C | Diagnóstico | Intervención | Histopatología |
|---|---|---|---|---|---|---|---|---|---|---|
| Wu y colaboradores (2001) | Reporte de caso | N/A | China | Legrado hemostático por sangrado uterino anormal | 5 años | 66 | 4, 0, 0 | Ultrasonografía Doppler Resonancia magnética | Coagulación bipolar laparoscópica de arterias uterinas | N/A |
| Peitsidis y colaboradores (2001) | Revisión sistemática | 85 reportes de casos de 100 mujeres | Reino Unido | 96% perimenopáusicas 4% postmenopáusicas | N/A | 30±9 | N/A | Ultrasonografía 86% Ultrasonido + angiografía 51% | Embolización uterina 59%. Histerectomía total abdominal 29% Resolución espontánea 6% Recurrencia 17% | N/A |
| Hashim y Nawawi (2012) | Reportede caso | N/A | Malasia | Parto, placenta retenida | 3 semanas | 33 | 3, 0, 0 | Ultrasonografía Doppler | Embolización e histeroscopia | N/A |
| Calzolari y colaboradores (2015) | Reportede caso | N/A | Francia | Parto | 2 meses | 33 | 1, 0, 0 | Ultrasonografía Doppler Histeroscopia | No determinado | N/A |
| Karadag y colaboradores (2016) | Reportede caso | N/A | Turquía | Legrado en dos ocasiones (aborto en el primer trimestre) | 2 semanas | 35 | 1, 1, 0 | Ultrasonografía Doppler | Embolización bilateral | N/A |
| Scribner y Fraser (2016) | Reporte de caso | N/A | EUA | Cesárea sin complicaciones | 5 semanas | 31 | Multí-para | Ultrasonografía Doppler, arteriografía. | Histerectomía obstétrica (24 h postcesárea) | N/A |
| Wildberger y colaboradores (2016) | Reportede caso | N/A | Paraguay | AMEU por embarazo molar | 4 años | 20 | 0, 1, 0 | Ultrasonido Doppler Angiorresonancia 3D | Embolización uterina | N/A |
| Timor y colaboradores (2016) | Retros ectivo | 27 | EUA | 21 postaborto 5 postcesárea 1 mola | N/A | 31.8 | N/A | Ultrasonido Doppler | Embolización uterina 29.6% Metotrexato 22.2% Histerectomía 7.4% Curetaje 3.7% | N/A |
| Badía y colaboradores (2016) | Reporte de caso | N/A | Chile | Aborto con medicamento, sin legrado | 2 meses | 37 | 1, 2, 0 | Resonancia magnética y angio-TAC | Embolización bilateral | N/A |
| Hernández- Escobar y colaboradores (2016) | Reporte de caso | N/A | México | Sangrado uterino anormal | 3 días | 31 | N/A | Ultrasonido Doppler. Resonancia magnética nuclear | Angiografía superselectiva y embolización de vasos de lesión. | N/A |
| Barral y colaboradores (2017) | Retrospectivo | 12 mujeres | Francia | Sangrado uterino anormal | N/A | 33±8 | N/A | Ultrasonido pélvico, resonancia magnética y confirmado con angiografía | Embolización bilateral con onyx Dos intentos y HTA posterior en 1 mujer | N/A |
| Evans y colaboradores(2017) | Reporte de caso | N/A | EUA | Legrado por abortos Sangrado uterino anormal | 1 semana | 33 | 0, 2, 0 | Ultrasonografía Doppler | Embolización uterina bilateral | N/A |
| Malin y colaboradores(2017) | Reporte de caso | N/A | Reino Unido | Hemofilia A Hemorragia en todos los eventos obstétricos Último parto | 6 semanas | 22 | 3, 2, 0 | Angiografía uterina | Embolización de arterias uterinas en los dos últimos embarazos | N/A |
| El-agwany (2017) | Reporte de casos | N/A | Egipto | Parto | 3 meses | 25 | 3, 0, 0 | Ultrasonido Doppler Histeroscopia | Curetaje | Vellosidades coriónicas degeneradas y canales vasculares intercalados |
| Parto 20 semanas | 2 meses | 28 | 1, 0, 0 | Ultrasonido Doppler Histeroscopia | Electrocuretaje | Vellosidades coriónicas degeneradas y canales vasculares intercalados | ||||
| Mekaru y colaboradores (2017) | Reporte de caso | N/A | Japón | 3 pacientes postaborto | 2-3 semanas | N/A | N/A | Ultrasonido Doppler | Metilergometrina por 3 semanas y GnRH con regresión espontánea en control posterior | N/A |
RC: Reporte de caso, RS: Revisión Sistémica; R: Retrospectivo; N/A no aplica; N/E no especificado; USG: Ultrasonido USG; RM: Resonancia Magnética; HTA histerectomía.
CASO CLÍNICO
Paciente de 22 años, con antecedentes de consumo de 1 g de cocaína durante dos años (de los 18-20 años) y desprendimiento de retina postraumático del ojo derecho. Menarquia a los 12 años, ritmo regular, 28/5, eumenorreica 1 embarazo, 1 aborto electivo en el primer trimestre, con misoprostol, citología cervicovaginal negativa a malignidad y exéresis de fibroadenoma. El padecimiento posterior al aborto se inició con hiperpolimenorrea progresiva. En ese mismo año, después de un episodio hemorrágico agudo, intenso, con descenso de la hemoglobina a 6.4 g/dL, la trataron con legrado hemostático. Se indicaron hormonales combinados durante dos meses (etinil-estradiol con levonorgestrel); ante la persistencia del sangrado se le colocó un endoceptivo intrauterino de liberación de levonorgestrel 52 mg (20 mcg/día).
Un par de meses después se reinició la hemorragia uterina anormal, acompañada de dismenorrea incapacitante. El reporte de ultrasonido del mes siguiente reportó: útero en anteversoflexión de bordes regulares, miometrio heterogéneo, eco medio endometrial de 4 mm, en pared anterior y lateralizada a la izquierda una imagen anecoica, alargada, irregular, con grosor de 5 mm, que llegaba al fondo desde donde se proyectaba un trayecto vascular con flujo de alta velocidad hacia el borde distal de la cavidad endometrial (Figura 1). La histeroscopia diagnóstica reportó una lesión de tipo polipoide, pulsátil, irregular, sincrónica a frecuencia cardiaca, de 0.6 x 0.5 mm, localizada en la cara anterior izquierda (Figura 2). La biopsia endometrial se reportó con endometrio asincrónico, compatible con consumo de progestágenos. Se inició el tratamiento secuencial con análogo de GnRH (goserelina), implante subdérmico de 3.6 mg una dosis, más 500 mg cada 8 h de etamsilato. A los 30 días, por falta de respuesta clínica, se aplicó una ampolleta intramuscular de 150 mg de medroxiprogesterona. Como complemento terapéutico, al año de iniciado el tratamiento se efectuó un nuevo legrado hemostático. En las siguientes semanas se corroboró por ultrasonido la sospecha de fístula arteriovenosa en el fondo del útero, y se envió al servicio de Radiología intervencionista, en donde propusieron la histerectomía como tratamiento definitivo.
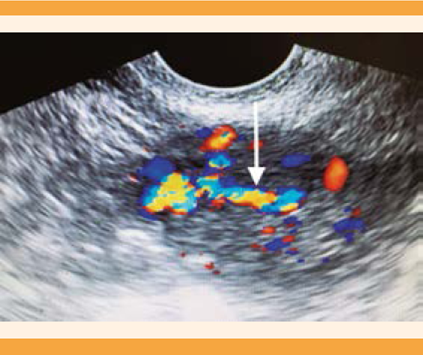
Figura 1 Ultrasonido Doppler de malformación arteriovenosa de útero. En el fondo uterino se observa un flujo Doppler de alta velocidad que se proyecta a la cavidad endometrial.

Figura 2 Imagen histeroscópica de malformación arteriovenosa uterina. Imagen histeroscópica del fondo de la cavidad uterina con lesión polipoide pulsátil.
El caso se discutió entre los especialistas del servicio de Ginecología y se propuso el tratamiento alternativo, ante el deseo de la paciente de preservar su fertilidad. Se inició el tratamiento con acetato de ulipristal a dosis de 5 mg al día durante un mes, sin hemorragia; enseguida, se programó la fistulectomía.
Procedimiento
Con previo bloqueo peridural se practica una incisión media infraumbilical. Se visualiza el útero, se practica un ultrasonido transquirúrgico con transductor de 3.5 mHZ, convexo, cubierto con funda quirúrgica estéril, directamente sobre la pared uterina, para identificar y delimitar el trayecto de la fistula con ultrasonido Doppler color. La velocidad de flujo del trayecto principal fue de 103 cm por segundo. Enseguida de delimitar el área de la fistula, cuyo trayecto principal mide 43 mm de largo x 5 mm de ancho, se infiltra el miometrio con 20 UI de vasopresina, diluida en 20 cc de solución fisiológica. Con bisturí del número 10 se hace un corte cuneiforme a dos milímetros sobre los bordes del trayecto fistuloso, a 45°. Se remueve el tejido adyacente a la malformación y se extrae por completo hasta llegar a la cavidad endometrial (no se hace corte con energía monopolar para evitar perder el margen de la malformación arteriovenosa por el daño térmico que se genera con su uso) (Figura 3). La hemostasia es con energía monopolar a 30 w y puntos hemostáticos con vycril 4-0. El cierre del miometrio es en tres planos, con sutura hemostática: primer plano invaginante, el segundo con puntos separados y el tercero sutura continua invaginante de béisbol. Se corrobora la hemostasia y se deja una malla antiadherente sobre la incisión.

Figura 3 Imagen macroscópica de malformación arteriovenosa uterina. Pieza quirúrgica resecada y delimitada por ultrasonido Doppler transoperatorio, en la que se observan ovillos de vasos (O-AV) que protruyen el tejido miometrial.
El estudio histopatológico se hizo con tinciones de Masson y para fibras elásticas, que evidenciaron la malformación arteriovenosa uterina en el espesor del miometrio y cambios atróficos endometriales (Figuras 4 y 5).
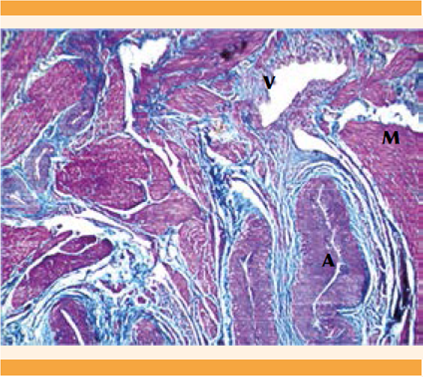
Figura 4 Corte histopatológico de malformación arteriovenosa. Tinción de Masson en la que se observa la pared muscular de las arterias (A) y venas (V) dentro del miometrio (M).

Figura 5 Malformación arteriovenosa uterina y endometrio atrófico. Tinción de Masson en la que se observa la arteria (A) y el endometrio atrófico por efecto del acetato de ulipristal (B).
El seguimiento de la paciente mostró regularización de ciclos menstruales en cantidad, frecuencia y eumenorrea.
DISCUSIÓN
Si bien una cicatriz de la pared uterina puede incrementar el riesgo obstétrico de un futuro embarazo, si no se dispone de otra opción de tratamiento de una malformación arteriovenosa uterina sintomática, esta técnica puede ser útil para el control de la hemorragia y preservar la fertilidad.
CONCLUSIÓN
La alternativa quirúrgica descrita es una técnica innovadora, al alcance de los hospitales de tercer nivel, que permite el tratamiento selectivo del área afectada por la malformación arteriovenosa uterina. La delimitación transoperatoria con flujometría Doppler en tiempo real permite la disección quirúrgica sin afectar el tejido miometrial sano. Es una opción cuando se desea preservar la fertilidad y, sobre todo, cuando la embolización no es factible.











 nueva página del texto (beta)
nueva página del texto (beta)


