ANTECEDENTES
La corioamnionitis explica 70% de los partos con ruptura prematura de membranas fetales o con trabajo de parto espontáneo y 13% de los nacimientos prematuros.1,2,3 Los agentes causales de corioamnionitis aislados con mayor frecuencia son bacterias grampositivas (Gardnerella vaginalis, Mycoplasma hominis), gramnegativas (Escherichia coli, Streptococcus agalactiae, Chlamydia trachomatis) y atípicas (Ureaplasma urealyticum).4-7 El proceso infeccioso activa la respuesta inmunológica innata del tejido epitelial, de macrófagos, monocitos, células NK y neutrófilos.8,9 El reconocimiento de las bacterias activa la secreción masiva de diversas citocinas quimiotácticas (IL-6 e IL-8) e inflamatorias (IL-1β, y el factor de necrosis tumoral tipo alfa; TNFα), que son las responsables de amplificar la respuesta inmunológica y la activación para la fagocitosis y de los linfocitos T.8-10 En este escenario de regulación de la respuesta inflamatoria-antinflamatoria se ha demostrado la participación de una clase particular de ARNs no codificantes, denominados microRNA (miRNAs) como moduladores de la respuesta inflamatoria que inhiben los factores encargados de la diferenciación y activación de las células inmunológicas o inhibición de diferentes tipos de ARN mensajeros.11-13 Si bien se conocen las moléculas inflamatorias y de fase aguda relacionadas con el proceso infeccioso en fase activa,14 en la actualidad no se cuenta con marcadores de diagnóstico temprano que logren identificar la corioamnionitis durante el embarazo.
El objetivo de este ensayo fue: determinar el perfil de expresión de los miRNA-21, -106, -126 y -146 y la cuantificación de IL-1β en el suero de pacientes embarazadas sanas, a término, con y sin trabajo de parto activo y en pacientes con evidencias clínicas de corioamnionitis.
MATERIALES Y MÉTODOS
Estudio analítico, longitudinal y prolectivo efectuado en pacientes que ingresaron para control, seguimiento obstétrico y terminación del embarazo al Instituto Nacional de Perinatología Isidro Espinosa de los Reyes de la Ciudad de México entre febrero de 2015 y agosto de 2016. Variables de estudio: pacientes embarazadas sanas con y sin trabajo de parto, embarazadas con evidencias clínicas de corioamnionitis, edad materna y semanas de embarazo al momento del nacimiento. A cada paciente se le tomaron 5 mL de sangre periférica que se centrifugó a 15,000 rpm; el suero recuperado se transfirió a un tubo Eppendorf estéril para obtener el ARN. El diagnóstico de corioamnionitis se basó en la coexistencia de dos o más de los siguientes signos clínicos: fiebre (temperatura corporal mayor de 38°C), taquicardia materna (más de 100 latidos por minuto), taquicardia fetal (más de160 latidos por minuto), líquido amniótico fétido o purulento, dolor o sensibilidad uterina; leucocitosis (más de 15 000/mm3), bandemia (más de 6%), concentraciones elevadas de proteína C reactiva (más de 2 mg/dL). Al momento de la obtención de las muestras las pacientes no mostraron evidencias clínicas de otras afecciones asociadas con la respuesta inflamatoria. La confirmación de la corioamnionitis se evaluó por histología de las membranas fetales, cordón umbilical y placenta. En todos los casos se obtuvo el consentimiento informado con base en los lineamientos aprobados por el comité de investigación y ética institucionales vigentes en el proyecto 212250-3210091.
Obtención del ARN
El ARN total de cada muestra se extrajo con el reactivo de TRIzol (InvitroGen; Carlsbad, CA) siguiendo las especificaciones de la casa comercial y de acuerdo como lo reportaron Montenegro y su grupo.15 A partir de 500 µL de plasma se adicionó el mismo volumen de TRIzol. La mezcla se agitó vigorosamente durante 15 segundos y se incubó por espacio de 15 minutos a 30°C. Enseguida, a cada muestra se le añadieron 100 µL de cloroformo y la mezcla se agitó durante 15 segundos y se incubó 3 minutos a 30°C. Al término, las muestras se centrifugaron a 4,000 rpm durante 15 minutos; la fase acuosa se transfirió a un tubo nuevo y se le agregó 1 µL de isopropanol. Las muestras se incubaron durante 1 hora a -20°C. Al término de ese tiempo se centrifugaron a 4,000 rpm durante 30 minutos. Al pellet se le agregó 1 mL de etanol al 100% y se agitó vigorosamente durante 15 segundos y de nuevo se centrifugó a 4,000 rpm durante 15 minutos. El procedimiento se repitió una vez más con etanol al 75%. El ARN se evaporó durante toda la noche a temperatura ambiente. El ARN se hidrató con 20 μL de dietilpirocarbonato y, posteriormente, se cuantificó por espectrofotometría mediante la relación de absorbancia 260-280.
Síntesis del cDNA mediante el ensayo de retrotranscripción
Para la obtención del cDNA se utilizó el equipo Access RT-PCR System (RT-PCR: cat A1250. Promega, Madison WI, USA) de acuerdo con las recomendaciones de la casa comercial. En tubos Eppendorf independientes se agregaron 2.5 μL (3 ng) del RNA de cada muestra y se añadieron 5 µL de amrtiguador AMV-Tfi (5X), 1 µL dNTP [10 mM], 2 µL MgSO4 [50 mM], 10 µL de agua libre de RNAsas, 1 µL de AMV RT y 1 µL [20 pmol] de cada iniciador específico (Cuadro 1). La síntesis del cDNA se realizó durante 45 minutos a temperatura de 45°C. Por último, la reacción se inactivó a 70°C. El cDNA obtenido se almacenó a 4°C.
Cuadro 1 Secuencia específica de los microRNA para la retrotranscripción
| microRNA | Secuencia (5´a 3´) |
|---|---|
| 21 | GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACT |
| 106 | GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCCATC |
| 126 | GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTACGC |
| 146 | GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAGCC |
Expresión de los miRNAs mediante PCR
Las condiciones de PCR se realizaron mediante lo previamente reportado por García-Gudiño y su grupo.16 A partir del cDNA obtenido se amplificaron los cuatro miRNAs mediante el ensayo de PCR a punto final. Para la amplificación de dichas secuencias se adicionaron 5 µL (5X) de amortiguador AMV-Tfi, 1 µL dNTP [10 mM], 2 µL MgCl2 [50 mM], 1 µL de Tfi, 1 µL [20 pmol] de iniciador específico de PCR para cada miRNAs (Cuadro 2) y 1 µL (2 unidades/mL) de Taq polimerasa, ajustando la reacción a 25 μL con agua libre de RNAsas para PCR. Como control interno de expresión de los miRNAs se utilizaron: tejido neural de rata (miR-21 y -106), células leucémicas (miR-126) y tejido cardiaco de rata (miR-146). Una porción de cada tejido se maceró con TRIzol y centrifugó a 12 000 rpm durante 10 minutos. La extracción y cuantificación del RNA se efectuó mediante el procedimiento antes descrito.
Cuadro 2 Secuencia específica de los miRNAs para la amplificación por PCR.
| miR | Secuencia 5´a 3´ | Tamaño (pb) |
|---|---|---|
| 21 | CCGGCCGATCGAATAG | 71 |
| 106 | CCGGCCGTTTTCACG | 70 |
| 126 | GCCGAGCATGGCTCTC | 72 |
| 146 | GTGCAGGGTCCGAGGT | 74 |
Los tubos de PCR se amplificaron en el termociclador Mastercycler gradient (Eppendorf; Hamburg, Germany) con las siguientes condiciones: 94°C para una elongación inicial durante un minuto y 40 ciclos (94°C durante 30 segundos, alineamiento 56, 58, y 60°C durante 30 segundos, 72°C durante 30 segundos) y una elongación final de 72°C por espacio de 10 minutos. Los amplificados se colocaron en geles de agarosa al 4% a voltaje constante durante 40 minutos y las bandas se visualizaron con luz ultravioleta y las imágenes se capturaron con el sistema fotodocumentador (Gel Doc 2000. Bio-Rad, USA). El nivel de expresión de las bandas se determinó mediante la densidad óptica y el programa ImageJ (NIH; USA).
Cuantificación de IL-1β
Para determinar la concentración de IL-1 (Duoset DY201, R&D Systems) en el plasma se utilizó el ensayo inmunoenzimático tipo emparedado (ELISA), de acuerdo con las recomendaciones de la casa comercial y con nuestro reporte previo.17) Para la curva estándar se incluyeron siete puntos con un rango de 250 a 3.90 pg/mL. Se determinó la densidad óptica a una longitud de 450 nm.
Análisis estadístico
Para las diferencias entre las variables maternas se usó el análisis t Student seguido de la prueba de Mann-Whitney. El análisis estadístico se efectuó mediante el programa SigmaStat (versión 3.0 Jandel Co, USA). Los valores se presentan con media ± desviación estándar y una p < 0.05 se consideró estadísticamente significativa.
RESULTADOS
Se estudiaron 45 pacientes embarazadas que se dividieron en tres grupos: 1) pacientes sanas a término, sin trabajo de parto activo (n = 15); 2) pacientes con trabajo de parto activo (n = 15); y 3) pacientes con evidencias clínicas de corioamnionitis (n = 15). Las características maternas se muestran en el Cuadro 3. La edad materna media de las pacientes sin trabajo de parto fue de 30.0 ± 6.5 y no se encontraron diferencias significativas con respecto al grupo de sin trabajo de parto y corioamnionitis (p = 0.6; Cuadro 3). La edad gestacional media al momento del nacimiento en el grupo de neonatos de madres con corioamnionitis fue de 27.9 ± 5.7 semanas, cifras con valor estadísticamente significativo con respecto al grupo sin y con trabajo de parto (p < 0.001; Cuadro 3).
Cuadro 3 Características generales de la población de estudio
| Pacientes sin corioamnionitis (n=30) | Pacientes con corioamnionitis (n=15) | ||
|---|---|---|---|
| STP (n=15) | CTP (n=15) | ||
| Edad materna (años) | 30 ± 6.5 | 27.3 ± 8.4 | 28.4 ± 8.1 |
| Edad gestacional (semanas) | 36.1 ± 4.5 | 37.9 ± 2.7 | 27.9 ± 5.7 |
Evidencias histológicas de las pacientes con corioamnionitis
La Figura 1 muestra las características morfológicas de las membranas fetales, cordón umbilical y de la placenta de pacientes con corioamnionitis (Figuras 1A-C) y de pacientes con trabajo de parto (Figuras 1D-F). En las muestras de las pacientes con corioamnionitis se observó el desprendimiento de la región del amnios y de la coriodecidua y el incremento en el infiltrado celular en las membranas fetales (Figura 1A), cordón umbilical (Figura 1B) y en la placenta (Figura 1C) con respecto al grupo con trabajo de parto (Figuras 1D-F).
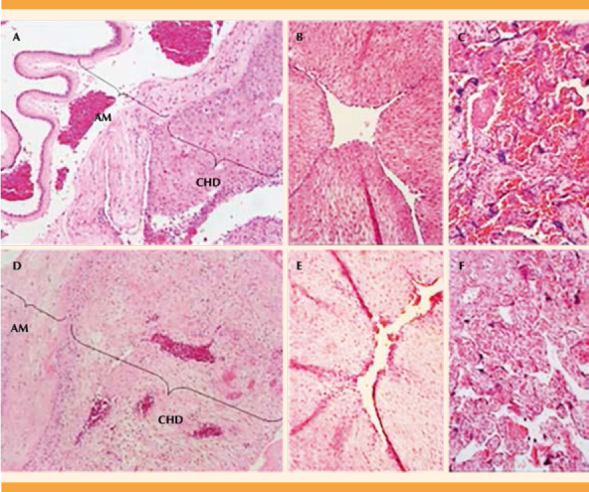
Figura 1 Corte histológico de corioamnionitis en diferentes tejidos gestacionales. Membranas fetales (A; 10X), cordón umbilical (B; 20X) y placenta (C; 20X) de pacientes con evidencias clínicas de corioamnionitis. Membranas fetales (D; 10X), cordón umbilical (E; 20X) y placenta (F; 20X) de pacientes sanas sin trabajo de parto. Epitelio amniótico (AM), y coriodecidua (CHD). La imagen es representativa de 6 cortes de muestras independientes.
Estandarización de las condiciones de RT-PCR
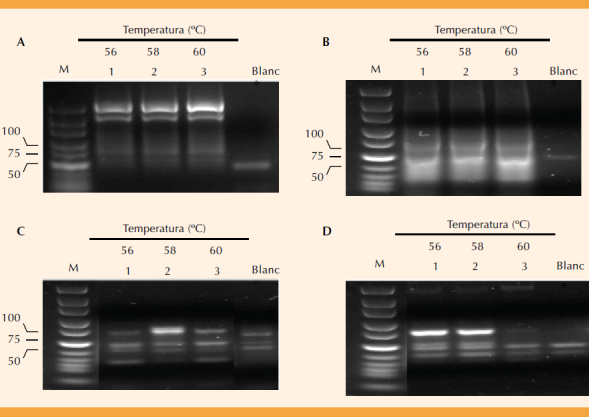
La Figura 2 muestra los amplificados de los miRNAs en cada una de las temperaturas de alineamiento; 58°C fue la temperatura óptima para los miR-21, -126 y -146; en tanto que para el microRNA-106 fue de 60°C. El peso molecular para cada uno de los miRNAs fue de 71, 70, 72 y 74 pares de bases (pb), respectivamente, y corresponde con el estimado por el análisis bioinformático. Estas condiciones de temperatura de amplificación se usaron para evaluar la expresión de los miRNAs de los tres grupos de estudio y en cada caso se incluyó como control positivo el cADN correspondiente.
Perfil de expresión de los miRNAs de los tres grupos de pacientes
Para evaluar el cambio en la expresión de los cuatro miRNAs de las pacientes con corioamnionitis se tomó como medida de referencia la identificada en el grupo de pacientes sin trabajo de parto porque no hay incremento las concentraciones de IL-1β. En todos los casos los geles de expresión mostraron bandas por arriba de las esperadas y representaron la forma inmadura de los miRNAs. Figura 2
La Figura 3 muestra la disminución significativa en la expresión del miR-21 en el grupo de pacientes con trabajo de parto y en el de corioamnionitis. La banda de expresión que corresponde al miRNA (71 pb) se cuantificó por densidad óptica (Figura 3B). En las pacientes con trabajo de parto la expresión del miR-21 disminuyó dos veces con respecto al grupo sin trabajo de parto (p ≤ 0.001, Figura 3B). La expresión del miR-21 en las pacientes con corioamnionitis disminuyó significativamente 1.3 veces con respecto al grupo sin trabajo de parto (p < 0.05; Figura 3B).
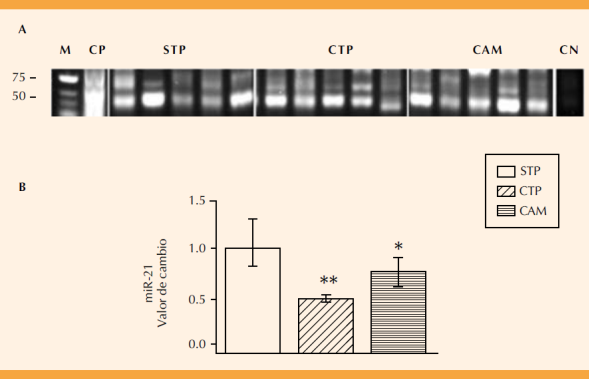
Figura 3 Expresión diferencial entre el grupo de pacientes sin trabajo de parto (STP), con trabajo de parto (CTP) y de corioamnionitis (corioamnionitis; A), marcador de talla molecular (M, Low Range DNA), pares de bases (pb), control positivo (CP; tejido neural de rata) y negativo (CN; sin cDNA). El valor de la banda de expresión se determinó mediante la densidad óptica y se ajustó con respecto al valor del grupo de STP. Diferencia estadísticamente significativa entre STP vs CTP (**p ≤0.001) y STP vs corioamnionitis (* p ≤0.05).
La Figura 4 muestra el perfil de expresión del miR-106 en las pacientes con trabajo de parto y de corioamnionitis. La banda de expresión que corresponde al miRNA (70 pb) se cuantificó por densidad óptica (Figura 4B). El perfil de expresión del miR-106 en las pacientes con trabajo de parto y con corioamnionitis aumentó 1.1 y 1.07 veces, respectivamente; sin embargo, no se observó una diferencia estadísticamente significativa con respecto al grupo sin trabajo de parto (p =0.6; Figura 4B).
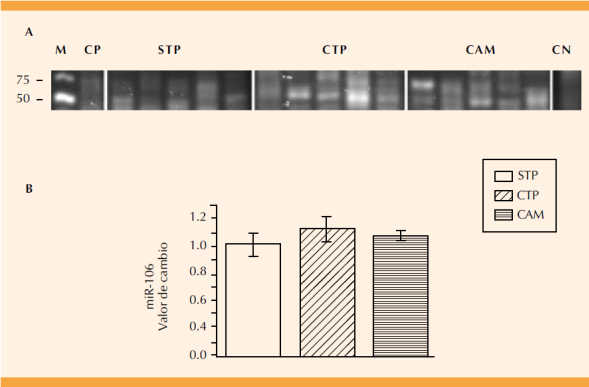
Figura 4 Expresión del miR-106. Se muestra la expresión diferencial entre el grupo de pacientes sin trabajo de parto (STP), con trabajo de parto (CTP) y de corioamnionitis (corioamnionitis; A), marcador de talla molecular (M, Low Range DNA), pares de bases (pb), control positivo (CP; tejido neural de rata) y negativo (CN; sin cDNA). El valor de la banda de expresión se determinó mediante la densidad óptica y se ajustó con respecto al valor del grupo de STP. Diferencia estadísticamente significativa p =0.06.
La Figura 5 muestra el perfil de expresión del miR-126 en las pacientes con trabajo de parto y de corioamnionitis. La banda de expresión que corresponde a este miRNA (72 pb) se cuantificó por densidad óptica (Figura 5B). El perfil de expresión del miR-126 aumentó significativamente 1.2 y 1.3 veces, respectivamente, en el grupo con trabajo de parto y en el grupo corioamnionitis con respecto al grupo sin trabajo de parto (p ≤0.001; Figura 5B).
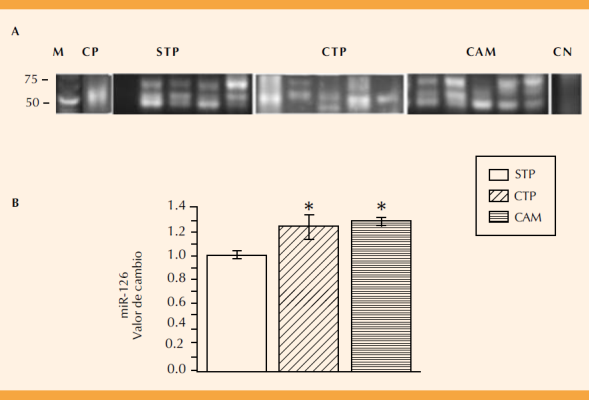
Figura 5 Expresión del microRNA-126 y la diferencial entre el grupo de pacientes sin trabajo de parto (STP), con trabajo de parto (CTP) y de corioamnionitis (corioamnionitis; A), marcador de talla molecular (M, Low Range DNA), control positivo (CP; tejido neural de rata) y negativo (CN; sin cDNA). El valor de la banda de expresión se determinó mediante la densidad óptica y se ajustó con respecto al valor del grupo de STP. Diferencia estadísticamente significativa entre STP vs CTP (* p ≤0.001) y STP vs corioamnionitis (* p ≤0.001).
La Figura 6 muestra el perfil de expresión del miR-146 en las pacientes con trabajo de parto y de corioamnionitis. La banda de expresión que corresponde a este miRNA (74 pb) se cuantificó por densidad óptica (Figura 6B). El perfil de expresión del miR-146 disminuyó para el grupo con trabajo de parto (p ≤ 0.001) y aumentó significativamente en las pacientes con corioamnionitis (p = 0.05).
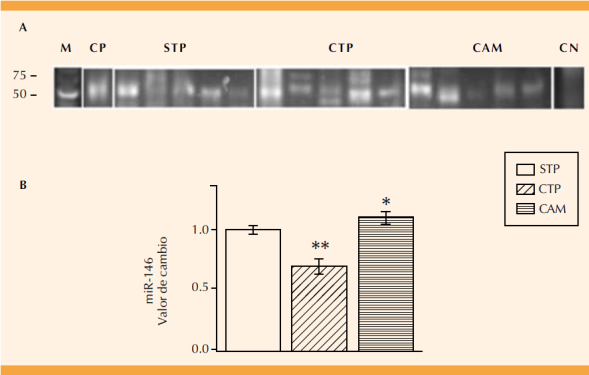
Figura 6 Expresión del miRNA-146. Expresión diferencial entre el grupo de pacientes con y sin trabajo de parto (CTP, STP) y de corioamnionitis (corioamnionitis; A), marcador de talla molecular (M, Low Range DNA), control positivo (CP; tejido neural de rata) y negativo (CN; sin cDNA). El valor de la banda de expresión se determinó mediante la densidad óptica y se ajustó con respecto al valor del grupo de STP. Diferencia estadísticamente significativa entre STP vs CTP (** p ≤0.001) y STP vs corioamnionitis (* p=0.05).
Cuantificación de IL-1β
La Figura 7 muestra la secreción de IL-1β en los tres grupos de estudio. Las pacientes con trabajo de parto y de corioamnionitis incrementaron, significativamente, 1.8 (p = 0.014) y 2.8 veces (p = 0.002), respectivamente, la secreción de IL-1β con respecto a las pacientes sin trabajo de parto (6.16 ± 2.6).
DISCUSIÓN
Los hallazgos de este estudio muestran que la corioamnionitis origina: 1) disminución del miR-21; 2) incremento en la expresión del miR-126 y -146; y 3) aumento de la secreción de la IL-1β. Este hallazgo es consistente con otros estudios que han reportado la detección de los cuatro miRNAs en suero y que se han asociado con la respuesta inflamatoria en diferentes enfermedades.15-17
Perry y colaboradores demostraron, en condiciones in vitro, que al estimular durante tres horas a las células alveolares tipo II con IL-1β (1 ng/mL) se incrementa significativamente la expresión del miR-146.21 Nuestros resultados indican que la corioamnionitis activa la respuesta inflamatoria mediada por la IL-1β y aumenta la expresión del miR-126 y -146 (Figura 6); sin embargo, en las pacientes con trabajo de parto activo la concentración de IL-1β es menor y solo se incrementa la expresión del miR-126. En las pacientes con trabajo de parto activo la IL-1β reduce la expresión del miR-21 pero no así en las pacientes con evidencias de corioamnionitis (Figura 3). Es probable que las proteínas implicadas en la regulación entre estos miRNAs y la respuesta inflamatoria estén modificadas en las pacientes de corioamnionitis, lo que deberá de demostrarse en condiciones in vitro.
Nuestros datos sugieren que las variaciones en el perfil de expresión entre el miR-21 y el miR-126, y miR-146 podrían considerarse marcadores moleculares de corioamnionitis; sin embargo, deben llevarse a cabo más ensayos que corroboren este patrón y evalúen su eficiencia. Esto puede contribuir a disminuir los efectos adversos en el desarrollo neurológico de los recién nacidos de madres con infección intrauterina.19,20
Nuestros resultados demuestran que en pacientes con evidencias clínicas de corioamnionitis en quienes se incrementó la concentración de IL-1β el aumento significativo en la expresión del microRNA-126 y el -146 con respecto a las pacientes sin trabajo de parto. Perry y colaboradores encontraron una reducción importante en la expresión del microRNA-146 inducida por el aumento en la IL-1β.18 La respuesta inflamatoria reduce la expresión del microRNA-21; sin embargo, al compararse con respecto al grupo con trabajo de parto se observa un incremento (Figura 3B). El microRNA-106 no cambia con respecto al proceso infeccioso.
Nuestros datos sugieren que el aumento en la expresión de los microRNA-126 y 146 y la disminución del microRNA-21 pueden utilizarse como marcadores de referencia en respuesta a un proceso infeccioso.
CONCLUSIÓN
En su conjunto, los resultados de este ensayo sugieren que el perfil de expresión entre miR-21, miR-126 y miR-146 podría considerarse marcador molecular de corioamnionitis. Para que esto pueda tomarse como patrón de referencia deberán emprenderse más ensayos que corroboren este patrón y evalúen su eficacia.











 nueva página del texto (beta)
nueva página del texto (beta)