ANTECEDENTES
El uso médico de los dermatoglifos (dermato: piel, glyph: escultura) está asociado al trabajo de Cummins H,1 que escribió: “Las interpretaciones de la dirección de las crestas se agrupan en dos clases: en una de ellas…, tal distribución se considera un foco primario de evolución. La segunda interpretación explica la dirección de las crestas, simplemente sobre la base de la respuesta a las fuerzas de crecimiento que operan durante el periodo fetal, de la diferenciación de las crestas”. Menciona, además, que las crestas epidérmicas de las manos y pies forman una variedad de configuraciones denominadas dermatoglifos. Según Moore KL, Persaud TVN,2 la piel tiene un doble origen: la capa superficial llamada epidermis y la capa profunda denominada dermis, que proviene del mesodermo subyacente. De esta última capa, denominada estrato germinativo, mana un flujo permanente de células neoformadas que migra hacia la periferia que, a su vez, forma pliegues y hundimientos ocupados por el mesodermo subyacente que finalmente se traducen en huellas en la superficie de la piel de los dedos, las palmas y las plantas; esto sucede en el periodo embriológico que corresponde a la decimoséptima semana posterior a la fertilización y que, según Herschel,3 se caracterizan por ser perennes, inmutables y diversiformes. Kucken4 considera que, desde el punto de vista mecánico, las huellas de los dedos se producen por la interacción de fuerzas elásticas no lineales entre la dermis y la epidermis. Okamoto K y colaboradores,5 Schöler HR(6) y Rosner MH y su grupo7 descubrieron, independientemente, un gene homeótico denominado Oct. 4 (6p21.33), que se expresa en el ectodermo embrionario. Stelnicki EJ y sus coautores8 mencionan que los genes MSX-1 (4p16.2), MSX-2 (5q35.2) y el MOX-1 (17q21.31) juegan un papel específico en el desarrollo de la piel. Stelnicki EJ y colaboradores9 identificaron los genes HOXA4 (7p14-p15), HOXA5 ( 7p14-p15), HOXA7 ( 7p14-p15), HOXB4 (7q21-q22), HOXB7 (17q21-q22) y HOXC4 (12q13) que se expresan de manera variable en la piel en desarrollo. Bokhari A y su grupo10 sugieren la participación de elementos ambientales en la formación de las crestas epidérmicas durante el desarrollo embrionario. Kömuves LG y su equipo11 indican que el gene HOXB13 (17q21.32) puede regular aspectos del desarrollo del tejido epidérmico. Mitsui K y sus coautores12 mencionan que el gene Nanog (siempre joven) (12p13.31) actúa en la diferenciación de las células madre y el ectodermo primitivo. Reed T y colaboradores13 incluyen las crestas epidérmicas como rasgos determinados genéticamente. Lugassy J su grupo14 informan que el gene KRT14 (17q11.2-21) juega un papel muy importante durante la ontogénesis de los dermatoglifos y las glándulas sudoríparas. Nousbeck J y su equipo15 concluyen que el gene SMARCAD 1 (4q22.3) está estrechamente implicado en la ontogénesis de los dermatoglifos y Nousbeck J y sus coautores16 informan que la mutación de este gene es causa de la adermatoglifia, que perturba la expresión de la diferenciación epidérmica. Garzón-Alvarado DA, Martínez Ramírez AM,17con la ayuda de un modelo Turing, teoría de la morfogénesis, denominado reacción-difusión, proponen una hipótesis bioquímica acerca de la formación de las huellas dactilares. Xu H y colaboradores18 mencionan que el gene EGF (4q25), cuya proteína actúa como un factor mitogénico potente, juega un papel importante en el crecimiento, proliferación y diferenciación de tipos celulares, tanto del ectodermo, como del mesodermo.
En trastornos cromosómicos y génicos, la configuración de las crestas puede estar alterada de manera característica y por este motivo su análisis detallado tiene valor diagnóstico como lo han descrito Cummins H19 para mongolismo; Uchida I y su grupo20 para trisomía 18 y trisomía D1; Forbes AP,21 Cam FS y colaboradores22 para síndrome de Klinefelter; Holt SB, Lindsten J23 para síndrome de Turner; Hodges RB, Simon JR24 para enfermedad de Wilson; Hirsch W25 para fenilcetonuria; Ptacek LJ y sus coautores,26 Cornelia de Lange y Atasu M27 para caries dentales; Rosa A y su grupo28 para psicosis del adulto; Jalali F, Hajian-Tilakik O29 para infarto de miocardio; Ana Tarcä EP30 para diabetes mellitus tipo 1; Mathew L y colaboradores31 para hendiduras orales en niños; Tikare S y sus coautores32 para marcador de maloclusión; Bhat PK y su grupo33 para caries dentales en niños; Raizada A y sus coautores34 para cáncer de mama; Boggula Rama MR y su equipo35 para oclusiones normales y anormales; Lederer D y sus coautores36 para síndrome de Kabuki; Lu H y su grupo37 para enfermedad de la arteria coronaria; Abbasi S y colaboradores38 para cáncer gastrointestinal; Kazemi M y su equipo39 para autismo; Sun L y sus coautores40 para asma. Respecto de la separación tardía de algunos cromosomas Weaver BA y colaboradores41 informan que las mutaciones del gene CENP-E permiten un aumento en la proporción de cromosomas atrasados en la anafase de células hepáticas en el ratón y en fibroblastos embrionarios y Gudinchuck N y su grupo42 mencionan la existencia de un sistema molecular para la contribución de la CENP-E, en la estabilidad de la unión entre el cinetocoro y las terminaciones dinámicas de los microtúbulos.
CASO CLÍNICO
Paciente de ocho años, nacido por cesárea a las 40 semanas de gestación. El embarazo trascurrió sin complicaciones; peso al nacimiento de 2500 g (percentil 50) y talla de 47 cm (por debajo del percentil 1). Acudió a consulta por recomendación del endocrinólogo a los 5 años, por talla baja (93 cm, por debajo del percentil 3) y 14 kg de peso (percentil 3). Al examen físico a los 8 años no se evidenció ninguna característica fenotípica sindromológica turneriana, excepto la talla baja 1.07 cm (por debajo del percentil 3), estado que se repitió a los 13 años de edad con 1.28 cm (por debajo del percentil 3). La laparoscopia exploradora efectuada a los 8 años de edad reportó: útero hipoplásico con trompas rudimentarias, cintillas ováricas hipoplásicas delgadas, anillos inguinales normales, sin evidencia de hernias. En la pelvis y el abdomen no se encontraron evidencias de tejido testicular, la vejiga estaba normal, lo mismo que el apéndice ciego y recto sigmoide.
Estudio citogenético, FISH, dactiloscopia y quiroscopia
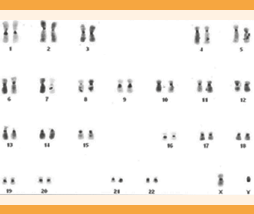
En el cultivo de sangre periférica, según la técnica de Moorhead OS y colaboradores,43 con medio de cultivo PB-MAX de 20 metafases analizadas, 18 tuvieron un número modal de 46 cromosomas, fórmula 46, XY y 2 metafases y número modal de 45 cromosomas, fórmula 45,X (Figuras 1, 2 y 3) con bandas “C”.44
Con la técnica de FISH, según Lichter P,45 y las sondas CEP 18/X/Y y LSI 13/21 para cromosoma Y,18 y 21 se analizaron 411 núcleos en interfase repartidos de la siguiente manera: 230(X),117(XY), y 64dic(Y), deduciéndose la siguiente fórmula cromosómica: 45,X/46,XY/46,X,dic(Y). Figura 4
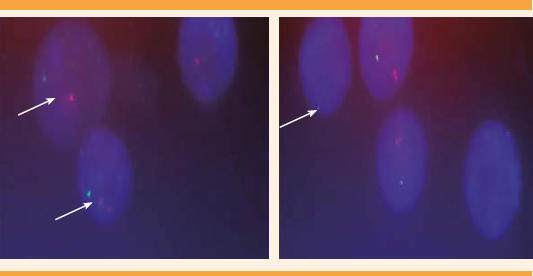
Figura 4 Núcleos en interfase según la técnica de FISH45 que muestran una señal verde (45,X); señal verde y roja (46, XY) y núcleo con una señal verde y dos rojas juntas (46,X,dic.Y).
Además, a la madre y el padre, que no tenían antecedentes patológicos, tóxicos, o farmacológicos importantes, se les realizaron estudios citogenéticos convencionales con fórmulas cromosómicas normales 46,XX y 46,XY, respectivamente. Se tomaron los dermatoglifos de acuerdo con las recomendaciones de Alter M.46
DISCUSIÓN
La talla baja es el hallazgo más frecuente (100%) de las pacientes con síndrome de Turner, de tal manera que desde el nacimiento ya tienen variación entre 2-3 cm por debajo de la estatura normal que, según Rey Vargas H,47 fluctúa entre 47-54 cm. De acuerdo con Collin JA48 esta característica se intensifica en la época de la pubertad al no suceder el crecimiento causado por las hormonas sexuales. Hjerrild BE y colaboradores49 indican que la talla final en pacientes sin terapia hormonal se estima en torno a 1.42 cm (percentil 50). Para nuestro caso era de 1.07 cm a los 8 años (por debajo del percentil 3), aunque también influye la talla media parental, sobre todo la materna (la de la madre de esta paciente, es de 1.54 cm) y el porcentaje de la línea monosómica 45,X.
La esencia del cromosoma Y puede observarse en pacientes con síndrome de Turner en forma total o parcial. Berta P y su grupo50 y Teixeira J y sus coautores51 informan que en mujeres con disgenesia gonadal aislada, pero normales en talla, el gene SRY (región determinante del sexo), cuyo locus se ubica en (Yp11.3), puede estar alterado en Yp, o puede estar mutado. Morava E y su equipo52 mencionan que en otras mujeres con síndrome de Turner el cariotipo suele ser anormal y con un mosaicismo frecuente 45,X/46.XY. En estos casos el fenotipo depende de la proporción en el cuerpo entre el (Y) positivo y la línea celular 45,X. Nuestros hallazgos se limitan a estudios en sangre periférica. Ravel C y Siffroid JP53 informan que los cromosomas (Y) son propensos a portar anormalidades estructurales que explican la inestabilidad mitótica, como por ejemplo la existencia de dos centrómeros. Según Shaw CJ y sus coautores54 y Davalillo CH,55 los cromosomas dicéntricos pueden producirse por translocaciones robertsonianas, recombinación dentro del bucle de una inversión paracéntrica, o translocaciones en tandem. Debido a la coexistencia de dos centrómeros, estos cromosomas suelen tener una inestabilidad alta. No obstante, cuando los dos centrómeros están muy próximos permanecen estables a lo largo de las divisiones celulares, debido a que se comportan como si tuvieran un centrómero único, pseudodicéntrico. Klebig C y su grupo56 aluden que el gene BUB1 tiene dos funciones diferentes durante la mitosis. Así, es esencial en la señalización del punto de control del uso y en el correcto alineamiento de los cromosomas en la placa ecuatorial. De Voer RM y colaboradores57 indican que las mutaciones en los genes BUB1 y BUB3 causan mosaicos aneuploídicos diversificados. Susuki A y sus colegas58 publicaron que las elongaciones intracinetocóricas propias se requieren para el funcionamiento normal del cinetocoro y dependen, críticamente, de las uniones mecánicas de la red asociada al centrómero constitutivo y al complejo NDc80 que, según Tooley S, Stukenberg PT,59 es una maquinaria proteica grande, ubicada en el corazón del cinetocoro, que seguramente secreta los cromosomas durante la división celular.
Al comparar los hallazgos de nuestro caso con los publicados en la bibliografía respecto de la dactiloscopia y quiroscopia encontramos que (Cuadro 1) claramente se muestra teniendo en cuenta los hallazgos dermatoglíficos en el síndrome de Turner publicados por primera vez por Penrose LS60 que desde el punto de vista de la dactiloscopia hay un predominio de verticilos, con cantidad de crestas mayor a la mencionada como normal (127 ± 0.8) y confirmados con los publicados en la bibliografía básica revisada para estos dos parámetros. Alter M,46 Bernal JM,61 Egozcue J y sus colegas62 concuerdan perfectamente con los observados en nuestra paciente. Relacionado con los resultados de la quiroscopia, donde los parámetros analizados fueron ángulo (atd) y número de crestas (a-b) y porcentual de “t”, mencionados en las publicaciones básicas revisadas, Penrose LS60 y Alter M,46 Armendares S,63 Bernal JM61 y Egozcue J y su grupo62 señalan que son coincidentes con los encontrados en nuestro caso. Esto indica un hallazgo adicional y es la existencia de arcos en la región hipotenar que, según Alter M,60 desde el punto de vista de valor normal, corresponden a 7%.
Cuadro 1 Bibliografía básica para la comparacion de hallazgos cualitativos y cuantitativos en los dermatoglifos (dactiloscopia y quiroscopia) del síndrome de Turner y nuestro caso
| Parámetros | Autores | Penrose LS 1963 (60) | Alter M 1966 (46) | Armendares S 1968 (63) | Bernal JM 1973 (61) | Egozcue J y col 1976 (62) | Caso reportado |
|---|---|---|---|---|---|---|---|
| Dactiloscopia | |||||||
| Verticilos Conteo de crestas mayor que el normal (127 ± 0.8) | Verticilos Conteo de crestas mayor que el normal (127 ± 0.8). | Verticilos Conteo de crestas mayor que el normal (127 ± 0.8) | Verticilos y presillas. Número dactilar total (169) | Verticilos Conteo de crestas mayor que el normal (169). | |||
| Presillas cubitales de ambos pulgares. Presilla radial índice | Presillas cubitales ambos pulgares | ||||||
| Quiroscopia | |||||||
| Ángulo ATD en t´ (45-56º). | Ángulo ATD aumentado. | Posición distal del trirradio axial en ambas palmas de 29.1 %, controles 19.6% | Ángulo ATD mayor de 67º | Ángulo ATD 10º más abierto. | Ángulo ATD 92º. | ||
| Número de crestas (a-b), aumentado | Número de crestas (a-b), aumentado | Figuras en forma de s en la región hipotenar. | Posición distal del trirradio axial en ambas palmas de 24.3%. | ||||
| Aumento del número de crestas (a-b) | Número de crestas (a-b) (86). | ||||||
| Arcos de la región hipotenar de ambas palmas |
Con base en la información anterior, y a pesar de la fórmula cromosómica de la paciente motivo de este reporte (45,X/46,XY/46,X,dicY), el fenotipo corresponde a un síndrome de Turner 45,X, sustentado en la proporcionalidad de la línea celular monosómica (X) de 56%, respecto de 28% (XY).(64 Si bien solo se estudió el cariotipo en sangre periférica, no existen rasgos clínicos de SRY en la paciente, lo que sugiere que el rearreglo dic(Y), además de ser inestable, perdió la región correspondiente a este gen.
Desde el punto de vista de los dermatoglifos se ratifican los hallazgos más frecuentes en el síndrome de Turner y se insiste en cómo en un cigoto (XY), que en su primera división mitósica, el núcleo de una de sus blastómeras pierde un cromosoma (Y), por un atraso anafásico, y origina a una línea celular monosómica (X) que se consolida como tal. En la segunda división mitósica de la blastómera (XY), originada en la primera división mitósica, en el núcleo de una de las dos, producto de otra división mitósica se consolida la línea celular (XY) y la blastómera (XY) que queda. Se presenta una blastómera (XY) y un re-arreglo estructural que da origen al cromosoma dic(Y). La proporcionalidad de la línea celular monosómica 45,X (230 = 56%) y las aberraciones de número y estructura de las líneas celulares con cromosoma (Y) (117 + 64 = 181 = 44%) juegan un papel relevante en la definición del fenotipo femenino turneriano y cómo el número total de las crestas de las yemas de los dedos, correlacionado con el aumento de presillas y verticilos y la pérdida en la línea celular principal, de un cromosoma (Y), concuerdan perfectamente con el síndrome motivo de esta publicación.











 nova página do texto(beta)
nova página do texto(beta)