ANTECEDENTES
La displasia mesenquimal de placenta es una anomalía placentaria de incidencia desconocida. Algunos autores la estiman en 0.02-0.03%1,2 y todos coinciden en que es posible la infravaloración debido a que solo se efectúan estudios histológicos de placentas en gestaciones con comorbilidades médicas o, bien, con alguna sospecha ecográfica o macroscópica de lesión. También contribuye a su escaso diagnóstico el que se trate de una anomalía poco conocida por los obstetras y patólogos.
La primera descripción data de 1982 asociada con síndrome de Beckwith-Wiedemann.3 En 1991 Moscoso y colaboradores4 propusieron el término de displasia mesenquimal de placenta junto con la descripción de dos casos de placentas con una anomalía vascular asociada con hiperplasia difusa de las vellosidades mesenquimatosas; sugirieron que quizá representara un nuevo cuadro clínico de una enfermedad.
Desde el punto de vista microscópico las placentas con displasia mesenquimal tienen vellosidades aumentadas e hidrópicas, con las cisternas centrales recubiertas por un estroma laxo, mixoide y rico en mucina ácida. Para poder establecer el diagnóstico es imprescindible la ausencia de proliferación trofoblástica o de inclusiones trofoblásticas en el estroma.5,6
La etiología de esta displasia también es incierta, aunque algunos han propuesto que se trata de una hipoxia e hipoperfusión de causa desconocida, que son las que favorecen los cambios fenotípicos en la placenta porque durante la hipoxia los fibroblastos estimulados producen fibras de tejido conjuntivo, con el consecuente aumento de producción del factor de crecimiento vascular endotelial por parte de las vellosidades, lo que induce la angiogénesis.7 Otra teoría para explicar el origen de la displasia mesenquimal es el mosaicismo androgenético-biparental confinado a la placenta. Esta hipótesis se apoya en la existencia de dos líneas celulares separadas en estas placentas, una androgenética y otra biparental.
Las células androgénicas anormales están confinadas a las membranas y vasos del mesodermo coriónico, sin afectar a las células trofoblásticas. Esta teoría también puede explicar el marcado predominio por el sexo femenino de la displasia mesenquimal de placenta. Puesto que la línea androgenética surge de la duplicación del genoma haploide paterno, se origina una línea celular 46XX, porque una línea celular de 46YY es incompatible con la vida.8 Ninguna de las dos teorías puede explicar la displasia en fetos masculinos, por lo que la displasia mesenquimal de placenta debe tener un origen multifactorial.
El diagnóstico se sospecha en la ecografía, y algunos autores9 sugieren a la resonancia magnética por su buen poder discriminatorio. El diagnóstico definitivo siempre será mediante el estudio histológico de la placenta.
Ante la sospecha ecográfica de displasia mesenquimal de placenta debe plantearse el diagnóstico diferencial con la mola hidatiforme parcial, embarazo gemelar con mola completa y los mosaicismos placentarios confinados. Una ecografía con hallazgos compatibles con gestación molar asociada con valores elevados de alfafetoproteína en suero materno y normales o discretamente elevados de beta-gonadotropina coriónica, junto con el estudio genético fetal normal, es sumamente sugerente de displasia mesenquimal de placenta.7
El objetivo de esta revisión es describir las características clínicas y las repercusiones perinatales de la displasia mesenquimal de placenta y reportar un caso clínico.
MÉTODO
Revisión sistemática mediante la búsqueda de artículos en las bases de datos: PubMed, EMBASE y Scopus, sin fecha de inicio hasta la actualidad (septiembre 2017). Criterios de inclusión: asociaciones de palabras clave: “placental mesenchymal displasi", “pseudopartial mole”. El término “displasia mesenquimal de placenta” carece de descriptor MeSH (Medical Subject Headings). Se revisó la bibliografía de todos los artículos encontrados en busca de nuevas citas bibliográficas. La búsqueda bibliográfica fue supervisada por un bibliotecario experto en investigación médica. Se incluyeron todos los idiomas. Criterios de exclusión: carencia de diagnóstico histológico de la placenta, no aportar al menos 75% (15 de 20) de los datos clínicos preestablecidos.
Dos revisores obstetras evaluaron, de forma independiente, los artículos completos. Se generó una alerta automática en los diferentes motores de búsqueda para la continua actualización de la base de publicaciones.
Los datos obtenidos de los artículos se enlistan en el Cuadro 1.
Cuadro 1 Datos obtenidos de las historias clínicas revisadas
| Publicación | Autor |
| Año de publicación | |
| Especialidad médica | |
| Datos maternos | Edad |
| Paridad | |
| Complicaciones durante la gestación | |
| Datos gestacionales | Gemelaridad |
| Alfafetoproteína (valor) | |
| HCG (valor) | |
| Amenorrea al diagnóstico | |
| Patrón ecográfico | |
| Amenorrea a la finalización | |
| Complicaciones gestacionales | Aborto |
| Rotura prematura de membranas | |
| Retraso del crecimiento intrauterino | |
| Características feto-recién nacido | Sexo |
| Cariotipo | |
| Peso al nacimiento | |
| Síndrome de Beckwith- Wiedemann | |
| Malformaciones asociadas | |
| Muerte fetal/neonatal | |
| Estudio de la placenta | Peso |
| Otras patologías placentarias |
Con los datos obtenidos de la revisión sistemática se elaboró y realizó el estudio estadístico mediante SPSS.15
Caso clínico
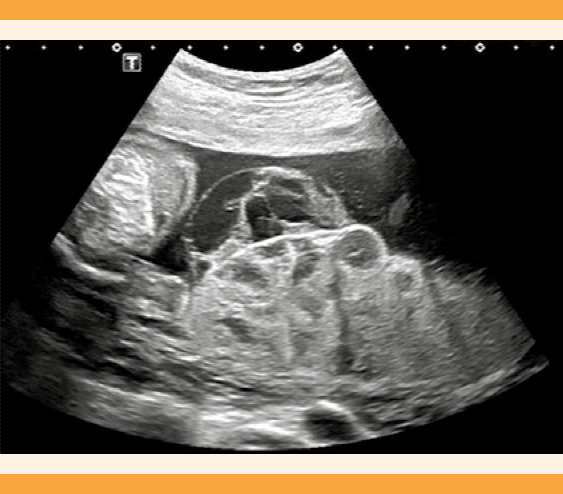
Paciente primigesta, de 38 años de edad, sin antecedentes personales ni familiares de interés. El cribado de cromosomopatías del primer trimestre se reportó de bajo riesgo. PAPP-A: 20 ng/mL (0.5 MoM) y β-hCG: 0.76 mUI/mL (0.24 MoM). Ecografía morfológica de la semana 20: sin hallazgos fetales patológicos. Se observó placentomegalia (grosor de 5 cm) heterogénea con múltiples quistes subamnióticos (Figuras 1 y 2). En la semana 22 se diagnosticó retraso en el crecimiento intrauterino tipo I y se programaron controles semanales con flujometría doppler. En la semana 26 la paciente inició con un cuadro de preeclampsia que se trató con 500 mg cada 8 horas de metildopa oral. El crecimiento fetal se mantuvo en un percentil 0, con fluxometría estable hasta la semana 29. En ese momento se observó la ausencia de diástole en ambas arterias umbilicales (retraso en el crecimiento intrauterino tipo II). Se decidió la maduración pulmonar con corticoesteroides.
En la semana 31 se finalizó la gestación debido al retraso en el crecimiento intrauterino tipo II, placentomegalia y preeclampsia.
El nacimiento fue por cesárea electiva de un feto femenino de 810 g (percentil 0) que ingresó a la unidad de cuidados intensivos neonatales con adecuada evolución posterior.
Placenta: en la observación macroscópica (Figura 3) se la encontró de coloración parduzca, con áreas blanquecinas extensas, de consistencia blanda con predominio en la cara fetal y peso de 530 g.
Al microscopio se encontraron extensas áreas de infarto placentario, proliferación fibroblástica intravellositaria, degeneración hidrópica focal y cambios vasculares de tipo corangiosis: hallazgos compatibles con displasia mesenquimal de placenta.
RESULTADOS
De la serie de casos clínicos (n = 104) analizados (1986-2017) 45.1% (n = 47) se reportaron en los últimos cinco años. En la revisión se encontró gran heterogeneidad de datos clínicos reportados; solo 9.6% (n = 10) de los casos aportaron todos los datos establecidos en el estudio. Esto se justifica, en parte, por la gran dispersión de especialidades médicas que comunican casos de displasia mesenquimal de placenta. Así, atendiendo a la especialidad del primer autor, se encontró que 54.8% eran ginecoobstetras, 19.2% anatomopatólogos, 9.6% pediatras, 5.7% radiólogos e, incluso, más de 10% eran de otras especialidades.
La edad media de las pacientes con el diagnóstico motivo de estudio fue de 29.6 ± 5.3 años (mínimo 18, máximo 41), con la distribución por quinquenios que se detalla en la Figura 4.
El 93.9% de los casos fue de gestaciones simples. En 6.0% correspondió a gestaciones gemelares, de ellas 5.0% se catalogaron como bicoriales y 1% monocoriales.
Se encontró que 52.7% de los casos se diagnosticaron como displasia mesenquimal de placenta durante la primera gestación, mientras que 47.2% eran multíparas.
El valor de la alfafetoproteína en sangre materna se encontró elevado en 71.4% de los casos; mientras que la hormona gonadotrofina coriónica sólo tuvo valores superiores a su límite en 3.8%.
En 89.4% de los casos hubo sospecha ecográfica de patología placentaria, mientras que en 10.5% fueron hallazgos fortuitos de desprendimiento prematuro de placenta en el estudio histológico por otras indicaciones.
La descripción de la alteración placentaria mediante sonografía se reportó entre las semanas 8 y 36; en la mayoría de los casos se detectó en el trascurso del segundo trimestre (83.8%). Sólo en 6.4% de la cohorte se sospechó la alteración placentaria durante el estudio ecográfico del primer trimestre.
Los diferentes autores describen, básicamente, dos tipos ecográficos de alteración placentaria relacionada con el desprendimiento prematuro de placenta:
Tipo 1: placentomegalia (placentas con grosor superior a 40 mm) con múltiples imágenes hipoecogénicas rodeadas por un halo hiperecogénico, con la clásica imagen en “copos de nieve” o “panal de abejas”.
Tipo 2: placenta con múltiples espacios lacunares y complejo retroplacentario muy vascularizado.
En nuestra revisión 55.9% de los autores describieron la placenta como tipo 1, mientras que 17.2% podrían incluirse en el tipo 2. En el resto de los casos la sospecha ecográfica coincidió con la descripción de corioangiomas o, bien, de patología fetal.
Del total de la cohorte estudiada 11.5% interrumpieron el embarazo. De ellas, 66.6% fueron interrupciones voluntarias después de conocer el diagnóstico y el informe de mal pronóstico fetal. Un tercio de los casos fueron abortos espontáneos. La tasa de aborto espontáneo fue de 3.8%, todos entre las semanas 14 y 16.
La amenorrea al parto estuvo entre 24 y 40 semanas, con una media de 32.8 ± 4.3 semanas. Solo 23.2% alcanzaron el término (amenorrea mayor a 37 semanas). Fueron fetos inmaduros (amenorrea menor a 32 semanas) 45.3% del total de la serie y prematuros (amenorrea menor a 37 semanas) 83.7%. En 62.7% de la serie la prematuridad fue de origen iatrogénico.
El 26.7% de los casos estudiados se asoció con rotura prematura de membranas.
En 32.2% de la serie los recién nacidos se diagnosticaron con síndrome de Beckwith-Wiedemann. La proporción entre sexos de los recién nacidos con síndrome de Beckwith-Wiedemann fue de 2.1/1 a favor del femenino. La tasa de mortalidad neonatal en el grupo afectado se incrementó 538.5 por mil; dos tercios correspondieron a mortalidad fetal.
El retraso en el crecimiento intrauterino, excluidos los fetos con síndrome de Beckwith-Wiedemann, alcanzó 52.6% de la muestra. Sólo la mitad tuvo peso adecuado para la edad gestacional. El retraso en el crecimiento intrauterino fue más frecuente en el sexo femenino, con una relación de 7.4:1 sin significación estadística en relación con el total de la cohorte (p = 0.42). La tasa de mortalidad neonatal en los casos de retraso del crecimiento intrauterino se cuantificó en 256.4 por mil, 70% ocurrieron en los casos intraútero. No se encontraron diferencias estadísticas al compararlos con el total de la serie (p = 0.6).
De los casos con displasia mesenquimal de placenta 18.8% de las gestaciones se complicaron con estados hipertensivos del embarazo: preeclampsia e hipertensión gestacional.
Los límites de peso de los recién nacidos fueron 610 y 3560 g, sólo 11.9% pesaron más de 2500 g.
El sexo femenino fue más frecuente, con 80.8%, con una relación mujer-hombre de 4.5 a 1.
Los cariotipos pre y postnatales se comunicaron normales en 96.6%, solo se identificaron 3 cariotipos patológicos (3.3%) que se correspondieron con: trisomía 21, trisomía 13 y síndrome de Klinefelter.
El 29.3% de los recién nacidos tuvo diagnóstico de alguna malformación congénita, la más frecuente fue el hamartoma de hígado o pulmón con una frecuencia de 29.6%; seguida por los hemangiomas, sobre todo de piel e hígado, con una frecuencia de 22.2%. En 18.5% de la cohorte se estableció el diagnóstico de onfalocele. El 7.6% de los recién nacidos tuvieron diagnóstico de anemia con trombocitopenia.
El 25.9% de la serie se complicó con muerte perinatal. Así, en el global de la cohorte la mortalidad perinatal ascendió a 321.4‰ (IC 95%: 215.6-427.2) sobre todo a expensas de la mortalidad fetal que representó 70.3% de los casos de muerte perinatal. En todos los casos de muerte perinatal los cariotipos fueron normales. En el total del estudio la tasa de mortalidad fetal fue de 182.7‰. La amenorrea a la muerte fetal estuvo entre 25 y 36±5 semanas. En 21.0% de las muertes intrauterinas se diagnosticaron hamartomas hepáticos y en 10.5% se observó hidrops fetal, quizá secundario al diagnóstico de anemia y trombopenia. El 50% de los recién nacidos fallecidos en el periodo neonatal tenía malformaciones.
La distribución por semanas de gestación de la mortalidad fetal se encuentra en la Figura 5.
Entre las semanas 31 y 34 ocurrieron 63% de las muertes fetales intraútero.
El riesgo prospectivo de muerte fetal se calculó según la amenorrea; así, antes de la semana 28 alcanzó 43.7%; en la semana 28 fue de 27.9%; a la semana 32 se estimó en 19.5% y en las gestaciones que alcanzaron la semana 36 el riesgo estimado de muerte fue de 6.9%. Figura 6
El estudio histológico de la placenta confirmó el diagnóstico de displasia mesenquimal (criterio esencial de inclusión), pero en 15.7% de los casos se observó la coexistencia con corioangiomas y corangiomatosis.
Solo en 3.8% del total de la serie se obtuvo un recién nacido sano, a término y con peso adecuado para la edad gestacional.
DISCUSIÓN
La amplia dispersión de los artículos estudiados respecto al año de publicación (40 años de intervalo)10-50 y al país de origen hace muy difícil comparar la edad materna o la paridad de nuestra cohorte con los datos de la población obstétrica en general (es bien sabido que la edad materna al parto o la paridad es una variable dependiente de factores socioeconómicos mundiales y también que la edad materna se ha incrementado con el paso del tiempo en los países con mayores recursos económicos). Nosotros calculamos que en más de 40% de la serie, la edad materna estuvo comprendida entre los límites de 26 a 30 años.
La tasa de gestaciones gemelares en nuestra cohorte parece incrementada respecto de los datos poblacionales publicados51 que la estiman en 1%.
Los abortos espontáneos del segundo trimestre alcanzaron 3.8%; es probable que las pacientes con esta patología tuvieran incrementada la tasa de abortos espontáneos, secundaria a los procesos de hipoxia-isquemia de la placenta.
Existe un claro predominio por el sexo femenino, se cree que se debe a que el gen D del factor de crecimiento endotelial (VEGF-D), o factor relacionado con la angiogénesis, está localizado en el cromosoma Xp22.31.52 En el total de la muestra estudiada la proporción mujer-hombre fue de 4.5/1. Esta proporción se incrementa en los casos con retraso en el crecimiento intrauterino que alcanzó 7.4/1; hallazgo no descrito en la bibliografía.
La alfafetoproteína sérica tuvo valores por encima del límite de la normalidad para amenorrea en más de 70% de la serie. Este dato es clásico; la mayoría de los autores lo incluyen como parámetro para la sospecha gestacional de displasia mesenquimal de placenta y para su diagnóstico diferencial con la mola parcial. El aumento del área de transferencia secundario a la placentomegalia y a sus alteraciones estructurales puede justificar mayor cesión de alfafetoproteína del feto a la embarazada.53
La sospecha prenatal de displasia mesenquimal de placenta fue mayor y a menor tiempo de amenorreamenores en los artículos de publicación más reciente. Es un dato lógico teniendo en cuenta el avance tecnológico de la sonografía y su generalización en el estudio de la población obstétrica. En la mayor parte de los artículos revisados la sospecha de displasia mesenquimal de placenta se detectó durante el estudio morfológico fetal (alrededor de la semana 20). Nayeri y colaboradores,2 después de revisar 44 artículos que incluían obligatoriamente la descripción ecográfica de la placenta, encontraron que 80% de los autores describieron la imagen ecográfica de la placenta como “quística con áreas hipoecogénicas” y 50% refirieron una placenta aumentada en tamaño o grosor o 16% la existencia de vasos coriónicos dilatados. Estos hallazgos ecográficos deben plantear el diagnóstico diferencial con la mola parcial, cuya descripción ecográfica es similar.95 El diagnóstico diferencial entre ambos cuadros clínicos es fundamental porque la mola parcial se asocia con triploidía fetal, mientras que la incidencia de cromosomopatías en displasia mesenquimal de placenta es similar al resto de la población. El estudio del cariotipo fetal mediante biopsia corial o amniocentesis aporta un dato imprescindible para el consejo genético y el pronóstico, que siempre debe ofrecerse a los padres.
La tasa de prematurez superó 80% de los casos, mayor que la descrita por otros autores. Nayeri y su grupo,2 en su metanálisis, la cuantifican en 52%, mientras que Ishikawa y sus coautores,50 en una cohorte de 109 casos con diagnóstico de displasia mesenquimal de placenta estimaron que la tasa de prematurez fue de 67.5%. Es posible que la dispersión en estos resultados sea secundaria a la propia definición de prematurez. Los diferentes autores2,50 coinciden con nuestros datos en que en más de 50% de los casos la prematurez es iatrogénica, secundaria al incremento en la tasa de rotura prematura de membranas y alteraciones del bienestar fetal (sobre todo secundaria al retraso en el crecimiento intrauterino), que determinan la finalización prematura del embarazo.
Una revisión de la bibliografía54-83 indica que, aproximadamente, 25% de los casos de displasia mesenquimal de placenta se asocian con síndrome de Beckwith-Wiedemann, un padecimiento que se caracteriza por macrosomía, onfalocele, macroglosia, onfalocele, visceromegalia interna, hiperglucemia neonatal, placentomegalia y aumento de la susceptibilidad a tumores infantiles. La patogénesis del síndrome de Beckwith-Wiedemann y la displasia mesenquimal de placenta pueden tener un origen común, con la evidencia más fuerte que apunta hacia anomalías de impresión epigenética que implica a los genes del cromosoma 11p15.5. Las alteraciones genéticas encontradas en el síndrome de Beckwith-Wiedemann e implicadas en la displasia mesenquimal de placenta pueden ser parte de un espectro, con aberraciones de genes solo encontradas en el feto (síndrome de Beckwith-Wiedemann), localizadas solo en la placenta (displasia mesenquimal de placenta), o ambas (displasia mesenquimal de placenta más síndrome de Beckwith-Wiedemann).10 Los genes que con más frecuencia participan son CDKNIC, H19, IGF-II, y KVLQT.68 No se han efectuado grandes análisis de la frecuencia de estas alteraciones moleculares en la displasia mesenquimal de placenta.
En la bibliografía existen múltiples casos con diagnóstico de síndrome de Beckwith-Wiedemann en ausencia de displasia mesenquimal de placenta. En esta situación los fetos no se asocian con retraso del crecimiento intrauterino sino, más bien, con un crecimiento excesivo, y no se ha descrito un aumento de la mortalidad neonatal. Por el contrario, ante una displasia mesenquimal de placenta, las tasas de retraso del crecimiento intrauterino y muerte perinatal son altas y bastante similares en fetos con y sin síndrome de Beckwith-Wiedemann, lo que refleja que es la displasia mesenquimal de placenta pero no este síndrome el factor principal que influye en el resultado de la gestación.2
Los fetos que no se diagnostican con síndrome de Beckwith-Wiedemann tienen, con frecuencia, restricción del crecimiento intrauterino; en nuestra revisión fue mayor a 50%. Pham y su grupo,83 en su metanálisis, encontraron un valor similar. Estos autores proponen que el retraso en el crecimiento intrauterino y el incremento de la mortalidad intraútero observado en estas pacientes puede explicarse por una hipoxia potencialmente crónica, secundaria a la obstrucción vascular fetal por trombosis, que provoca la disminución del intercambio materno-fetal como resultado de un número insuficiente de vellosidades coriónicas normales y la derivación de sangre de la superficie de intercambio a las vellosidades displásicas. Sander y sus colegas84 propusieron que el retraso en el crecimiento puede deberse a la desviación de sangre fetal dentro del complejo de malformación vascular desde el espacio intervelloso materno. La anemia o trombocitopenia podría deberse a un proceso microangiopático relacionado con trombosis dentro los vasos malformados. Hojberg y colaboradores73 atribuyen el bajo peso al nacer, retraso en el crecimiento intrauterino, anemia y elevación de la alfa feto proteína en suero materno a la insuficiencia placentaria y fuga vascular.
La combinación de displasia mesenquimal de placenta con hamartomas fetales, corioangioma y corangiomatosis se considera una forma mixta de malformación congénita del mesodermo fetal.11,60 Los corioangiomas y la corangiomatosis son lesiones relacionadas con el desarrollo vascular fetal de la placenta. La corangiomatosis es una lesión multifocal que se caracteriza por incremento del número de capilares que se asientan en los troncos vellositarios principales, sin afectación de las vellosidades terciarias.85 Hasta en 15% de nuestra cohorte el estudio histológico de la placenta reveló la asociación entre displasia mesenquimal de placenta con coriangiomas-corangiomatosis. Los hamartomas fetales fueron la malformación fetal reportada con más frecuencia en la serie de casos, sobre todo los de localización hepática o pulmonar.
Se observó una alta frecuencia de asociación con anemia-trombocitopenia neonatal e, incluso, varios casos de hidrops fetal que parece lógico pensar son la manifestación intrauterina de la anemia fetal. Varios autores51-54 asocian las manifestaciones hematológicas con la existencia del fenómeno de Kasabach-Merritt, que se caracteriza por trombocitopenia, coagulopatía de consumo y anemia hemolítica microangiopática secundaria a una lesión vascular. Estas características patogenéticas sugieren que las alteraciones hematológicas fetales se asocian, principalmente, con el grado de vascularidad en la displasia mesenquimal de placenta, más que con el grado de placentomegalia.
El pronóstico materno suele ser bueno; en la bibliografía solo se encontró asociación con los estados hipertensivos del embarazo18,30,34,39,51,67,72,74,76,85 y síndrome en espejo materno.49 En nuestra serie la incidencia de estados hipertensivos del embarazo alcanzó casi 19% de la muestra, porcentaje muy elevado respecto de la población obstétrica en general. El aumento en la frecuencia de la hipertensión asociada puede explicarse por las alteraciones vasculares características de ese estado patológico. En la actualidad, en el seguimiento y monitorización de las gestaciones con disfunción placentaria, se están utilizando los biomarcadores solubles en suero relacionados con la angiogénesis, tirosina cinasa 1 (sFlt-1) y el factor de crecimiento placentario (PIGF).86 Herraiz y su grupo49 publicaron su experiencia con casos clínicos donde dichos marcadores pueden ser útiles para predecir las complicaciones derivadas de la insuficiencia placentaria. La bibliografía relacionada con su aplicación es muy limitada.
De acuerdo con los datos publicados por la Organización Mundial de la Salud,87 después de estudiar más de un millón de muertes neonatales procedentes de 194 países de diferentes áreas geográficas y con amplias variaciones socioeconómicas, la mortalidad neonatal a nivel mundial varía entre 5 y 30 por cada mil. En nuestra serie la mortalidad neonatal se multiplicó entre 11 y 65 veces, sobre todo a expensas de la mortalidad fetal. En nuestro estudio 26% fueron casos de muerte perinatal, dato similar al publicado por Ishikawa y sus coautores50 que estiman un porcentaje de 29.4%. Pham y colaboradores83 proponen que tanto la mortalidad fetal como la restricción del crecimiento intrauterino pueden ocurrir como consecuencia de la trombosis obstructiva de los vasos de la placenta, con la subsiguiente disminución del intercambio materno-fetal.
En nuestro estudio, 63% de las muertes fetales ocurrieron entre las semanas 31 y 34, independientemente de la asociación con la restricción del crecimiento intrauterino. Este hallazgo obliga a la necesidad del seguimiento intensivo de la gestación mediante estudio Doppler seriado, capaz de reducir la tasa de mortalidad fetal.
Para un mejor asesoramiento de la embarazada es importante conocer la probabilidad de muerte neonatal; así, en la semana 28 pudo calcularse que alcanza 27.9%. En amenorreas superiores a 36 semanas ésta permanece elevada, cercana a 6.9%. Otros autores50 estiman el riesgo potencial de muerte a la semana 36 en 13%.
Un porcentaje de pacientes con diagnóstico de displasia mesenquimal de placenta cursan con gestaciones normales, sin morbilidad materna y los recién nacidos son sanos, a término, y con peso adecuado.
Limitaciones del estudio
Es probable que nuestra revisión sistemática esté limitada por el sesgo de las publicaciones, porque es más frecuente publicar casos con mal resultado neonatal que casos que cursaron sin incidencias materno-fetales. Otro posible sesgo del estudio es que habitualmente sólo se realiza estudio histológico de las placentas cuando existe una sospecha ecográfica o macroscópica de patología. Es posible que las placentas con lesiones parciales de displasia mesenquimal no se estudien debidamente. Como consecuencia de los puntos anteriores es posible que las complicaciones perinatales y la tasa de mortalidad estén sobrevaloradas.
CONCLUSIONES
La displasia mesenquimal de placenta es una anomalía poco conocida en Obstetricia; por ello infradiagnosticada y poco publicada. Gracias al avance tecnológico en ecografía obstétrica y la generalización del estudio fetal, cada vez es más frecuente la sospecha diagnóstica de displasia mesenquimal de placenta durante la gestación. Desde el punto de vista ecográfico la displasia mesenquimal de placenta simula una mola parcial, que casi siempre tiene un cariotipo fetal diploide y concentraciones elevadas de alfafetoproteína. Esta displasia se asocia, frecuentemente, con prematurez, rotura prematura de membranas, retraso en el crecimiento intrauterino, síndrome de Beckwith-Wiedemann y muerte perinatal.











 nova página do texto(beta)
nova página do texto(beta)