ANTECEDENTES
Los teratomas quísticos maduros son los tumores de células germinales de ovario más comunes y la principal neoplasia en mujeres menores de 20 años; representan, aproximadamente, 20 a 25% de las lesiones benignas1 y aparecen bilateralmente en 10 a 17% de los casos. La incidencia se estima en 1.2 a 14.2 casos por cada 100,000 personas año.2 Las células germinales primordiales están constituidas por múltiples tipos, derivados de una o más de las tres capas germinales (ectodermo, mesodermo y endodermo).
Los teratomas quísticos maduros suelen permanecer asintomáticos o causar síntomas mínimos. Los signos y síntomas más comunes incluyen: aumento de la circunferencia abdominal, dolor abdominal o distensión y masa abdominal o pélvica palpable. En caso de invasión a las estructuras adyacentes pueden desencadenarse síntomas gastrointestinales o urinarios.3 Rara vez se manifiesta con menorragia, fiebre o caquexia.
Sus complicaciones asociadas más frecuentes son: torsión (6%), degeneración maligna (0.17 a 3%),4 ruptura ovárica (1 a 2%) e infección (1%). Una de las teorías de la degeneración maligna se basa en la permanencia a largo plazo de un teratoma maduro en la cavidad pélvica expuesto a diferentes factores hormonales, ambientales y carcinógenos potenciales.5,6
Durante su transformación los componentes malignos pueden evolucionar desde cualquiera de las tres capas germinales, lo que resulta en diferentes tipos de tumores histológicos. Más de 80% son carcinomas de células escamosas (derivados del ectodermo), tumores de tipo cutáneo (carcinomas basocelulares, tumores sebáceos, melanomas malignos o tumores neuroendodérmicos).7,8
La histogénesis del carcinoma epidermoide, originado en teratoma maduro, deriva de la asociación con displasia y carcinoma epidermoide in situ en el epitelio de la epidermis, que delimita el quiste dermoide o teratoma maduro.9 La mayor parte de los teratomas quísticos maduros se detectan 15-20 años antes de transformarse en malignos secundarios.10
El diagnóstico de la transformación maligna del teratoma quístico maduro no es fácil y debe sospecharse ante la aparición de un tumor mayor de 10 cm en una paciente posmenopáusica (entre la quinta y sexta décadas de la vida), con adherencias y, en muchas ocasiones, ruptura de la cápsula. Estos tumores muestran, en gran medida, crecimientos nodulares, papilíferos o de coliflor que sobresalen en las cavidades del quiste.10
Los marcadores tumorales séricos, como el antígeno de carcinoma de células escamosas, CA-125, CA-19.9 y el antígeno carcinoembrionario (CEA) son útiles para distinguir el teratoma quístico maduro de la transformación maligna. El antígeno del polipéptido tisular y el factor estimulante de las colonias de macrófagos también pueden ayudar a predecir la transformación maligna en este tumor.11
La eliminación completa del tumor, de acuerdo con principios del tratamiento oncoquirúrgico, es decisiva (citorreducción completa). Está suficientemente demostrado que el cisplatino es activo contra el antígeno de carcinoma de células escamosas ginecológico y es el más estudiado entre los agentes alquilantes. La radioterapia puede favorecer mayor morbilidad por lo que solo se recomienda en enfermedad limitada a la pelvis.12,13
CASO CLÍNICO
Paciente de 59 años de edad, menarquia a los 13 años, inicio de vida sexual activa a los 30 años, una pareja sexual, un año de consumo de anticonceptivos, tres embarazos, tres cesáreas, un aborto; última menstruación a los 47 años. Su padre falleció por cáncer de pulmón, alérgica a la penicilina y a las sulfas.
Al examen físico tuvo ECOG: 1, Karnofsky: 90, sin inestabilidad hemodinámica. Abdomen: semigloboso por panículo adiposo, cicatriz quirúrgica en buen estado, levemente doloroso a la palpación, superficial, sin datos de irritación peritoneal.
En la especuloscopia se observaron: cuello uterino atrófico, aparentemente sano, sin tumor visible; la exploración bimanual no fue posible debido a cirugía reciente.
Reporte de patología: carcinoma epidermoide invasor, moderadamente diferenciado, queratinizante, originado en un teratoma quístico maduro, monodérmico, de ovario. La neoplasia tenía afectación y ruptura capsular focal, con permeación linfovascular, sin invasión perineural. La lesión midió: 10.1 x 99.9 cm (Figuras 1, 2 y 3). La salpinge estaba congestionada y edematosa, sin evidencia de infiltración por la neoplasia.

Figura 2 Hallazgo macroscópico de la transformación maligna hacia un carcinoma de células escamosas.
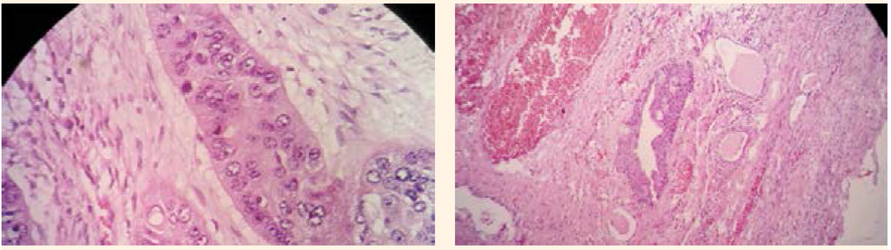
Figura 3 Hallazgo microscópico de una lesión quística revestida por un epitelio plano estratificado queratinizado, a partir de que se origina una neoplasia maligna constituida por proliferación de células escamosas, de tamaño grande, con citoplasma irregular, núcleos pleomórficos y nucleolos rominentes. Las células se agrupan formando nidos sólidos, entre los que se observan focos de queratinización.
La revisión de las laminillas y bloques de parafina confirmó el hallazgo de CA-125 de 47.3 U/mL. Para completar la estadificación se operó y consiguió una citorreducción óptima, y se determinó que el tumor correspondía a etapa IC3.
La paciente recibió tres ciclos de quimioterapia con cisplatino, etopósido y bleomicina. Durante la vigilancia tuvo elevación del CA-125 a 71.4 U/mL, datos de trombosis venosa profunda en el miembro inferior izquierdo. La tomografía axial computada abdominal reportó: hidronefrosis izquierda y masa pélvica en la fosa obturatriz, con afectación vascular y nerviosa. Se inició la quimioterapia paliativa con posterior fallecimiento de la paciente en abril del 2017, como consecuencia del tromboembolismo pulmonar.
DISCUSIÓN
La edad de las pacientes a la aparición del teratoma quístico es entre los 30 y 69 años, con una media de 52 años.14,15 Los síntomas que motivan la búsqueda de la valoración médica son, predominantemente, dolor y distensión abdominal, gastrointestinales y urinarios.
El estudio de imagen más utilizado para la evaluación de la masa anexial es el ultrasonido pélvico, la tomografía axial computada abdómino-pélvica y la resonancia magnética nuclear.
El marcador tumoral más utilizado es el CA-125, seguido del CA-19.9, antígeno se carcinoma de células escamosas y CEA. La medición de las concentraciones de AFP y B-HCG no suele reportarse alterada. Si bien no se han descrito correlaciones significativas entre las concentraciones de estos marcadores tumorales y la etapa clínica FIGO, evidenciar concentraciones elevadas es predictivo de mal pronóstico de supervivencia.16
El procedimiento quirúrgico de inicio más utilizado es la salpingooforectomía unilateral por laparotomía, seguido por la cirugía estadificadora-citorredutora, histerectomía con salpingooforectomía bilateral por laparotomía, acompañada en algunas ocasiones, por omentectomía. Si bien no existe unanimidad de criterios, el tratamiento quirúrgico es el que ofrece a las pacientes con cáncer epitelial de ovario la citorreducción, en búsqueda de la ausencia macroscópica de la enfermedad. Para realizarla de primera intención durante la evaluación del estudio por congelación debe orientarse al patólogo hacia la búsqueda de este carcinoma.17,18
El volumen promedio de los tumores anexiales tiene una media de 16.85 cm.
De los 23 casos reportados 33% (n = 7) tuvieron ruptura del tumor como hallazgo en el momento de la cirugía, dos análisis no ofrecían información al respecto. El 55% de los tumores se reportó en el ovario izquierdo y 45% en el derecho.
Tres lavados peritoneales (27.2%) resultaron positivos para células malignas, 72.7% negativos; en 12 casos no lo realizaron o no lo reportaron.
El 82% (n = 19) de las pacientes tuvo como transformación maligna del teratoma quístico maduro un carcinoma de células escamosas. Los demás casos fueron: adenocarcinoma mucinoso, melanoma maligno (n = 19), un carcinoma papilar de tiroides y un adenocarcinoma sebáceo.21
Posterior al estudio definitivo de patología se efectuó la cirugía, que se completó con histerectomía y salpingooforectomías. La linfadenectomía pélvica y paraaórtica se efectuó en cinco casos, omentectomía en tres y una apendicectomía. Una de las cirugías se denominó debulking sin especificar cada procedimiento.20
Se reportaron, además, según la clasificación FIGO, 15 estadios clínicos; 46.6% correspondieron a etapa I, 13.3% a etapa II y 40% a etapa III.
De acuerdo con el reporte, 14 pacientes recibieron quimioterapia coadyuvante. Los agentes citotóxicos predominantes fueron los derivados del platino en 11 casos (78.5%), en 50% fue cisplatino y en el resto carboplatino (un reporte no especificaba el tipo de platino). El paclitaxel se indicó en 50% de las pacientes y la bleomicina en 21.4%. Recibieron vincristina dos pacientes, mitomicina C otras dos pacientes, etopósido y 5 fluorouracilo en un caso, respectivamente. En ningún caso se documentó la utilización de terapia blanco.
En cinco pacientes se documentó recurrencia entre los tres y cuatro meses seguidos a la cirugía. Se utilizaron como agentes quimioterapéuticos los platinos como primera elección en tres casos,2,16 asociados o no con paclitaxel, docetaxel, ifosfamida o gemcitabina.
La supervivencia global, sin tener en cuenta el estadio clínico FIGO, y calculada hasta la fecha de los reportes o el fallecimiento de las pacientes, se estimó en una media de 34.5 meses, en general, promedio mayor que el evidenciado en otros análisis donde fue inferior a 12 meses.19
CONCLUSIONES
La transformación maligna de un teratoma quístico es rara y su diagnóstico debe sospecharse cuando haya tumoraciones de rápido crecimiento en pacientes entre 50 y 60 años de edad y con estudios de imagen que orienten hacia un quiste dermoide. La elevación anormal del antígeno para carcinoma de células escamosas puede hacer sospechar el tumor, al igual que la elevación del CA-125, CA-19.9 y CAE. La cirugía siempre será el pilar fundamental para el tratamiento asociado con agentes citotóxicos con platinos. Deben efectuarse estudios con radioterapia única o concomitante con la quimioterapia, junto con agentes para terapia blanco.











 text new page (beta)
text new page (beta)



