ANTECEDENTES
Los marcadores bioquímicos,1,2 junto con la ecografía de la translucencia nucal, crearon la prueba combinada del primer trimestre del embarazo,3-5 con mejor desempeño como tamiz prenatal de aneuploidias y posible predicción temprana de preeclampsia, entre otros desenlaces perinatales adversos.6-14
La determinación de estos marcadores bioquímicos se inició y difundió en México con el ensayo de quimioluminiscencia (Siemens, Immulite ® , Diagnostic Products Corp., Los Angeles, CA, USA) que ha demostrado un desempeño menor al esperado debido a un coeficiente de variación inaceptablemente alto y un sesgo en los múltiplos de la mediana de embarazos afectados con fetos trisómicos.15 Para The Fetal Medicine Foundation esta metodología no es aceptable para el tamiz prenatal combinado del primer trimestre y no se incluye en el módulo astraia ® (Alemania, en lo siguiente, astraia), programa de cómputo preferido por más de mil profesionales de la salud en México (https://fetalmedicine.org/education/the-11-13-weeks-scan).
Con el propósito de ofrecer marcadores bioquímicos prenatales de calidad, adecuados a nuestra población y la visión de ser referente en el tamiz de aneupliodias y la predicción de pre-eclampsia, se fundó un laboratorio especializado en bioquímica prenatal con la participación de uno de los autores de este artículo. La implementación de los marcadores bioquímicos del primer trimestre requiere establecer con precisión las semanas de embarazo y corregir los múltiplos de la mediana al método de concepción, la corionicidad en embarazos dobles, el hábito tabáquico, el tipo de diabetes, la paridad, el peso materno y la etnia.16-23 El factor etnia puede corregirse mediante la construcción de medianas en cada población o aplicando un factor de ajuste en las curvas de referencia, casi siempre preinstaladas, por defecto, en los programas de cómputo. Al momento de fundar el laboratorio sólo se encontraron publicaciones acerca del efecto de la etnia hispana en los marcadores bioquímicos del segundo trimestre24,25 y ninguna de la distribución de marcadores bioquímicos del primer o segundo trimestres en población mexicana.
A partir del inicio se reconoció que la población mexicana no es una etnia en sí, sino un mosaico de etnias; algunas hispanoamericanas o hispanas europeas, otras indígenas, de origen africano o caribeño. Hay mestizas diversas y migrantes de diferentes regiones. México es un país conformado por una población mixta. La búsqueda inicial en PubMed con los términos MeSH Chorionic Gonadotropin, beta Subunit, Human[Mesh]) y Pregnancy-Associated Plasma Protein-A[Mesh]) AND Mexico[Mesh] no arrojó resultados y sólo se contaba con las medianas predefinidas por el programa astraia para población hispana europea.
El objetivo de este estudio es: determinar si la distribución de los marcadores séricos del primer trimestre en una muestra de población mexicana difiere del modelo de riesgos de la Fetal Medicine Foundation, basado en población caucásica e hispana europea, para calcular los factores de corrección necesarios que mejoren el desempeño de la prueba.
MATERIALES Y MÉTODOS
Estudio descriptivo y transversal inserto en una cohorte prospectiva de embarazadas que ingresaron, consecutivamente, a un tamiz prenatal combinado de aneupliodias y de riesgos perinatales en el primer trimestre,26 según la metodología de la Fetal Medicine Foundation.27
Determinar en suero los marcadores bioquímicos del primer trimestre: fracción beta libre de gonadotrofina coriónica humana (beta-hCG-libre) y la proteína plasmática A del embarazo mediante electroquimioluminiscencia. Esta metodología cuenta con la aprobación de la Fetal Medicine Foundation, que utiliza un equipo Cobas e411 (Roche®, Suiza). Para fines de este estudio se siguieron las normas de operación del fabricante y el lineamiento de la Fetal Medicine Foundation.28 La calibración del analizador se efectúa periódicamente y con cada lote nuevo de reactivos. Los sueros control se procesan con cada corrida y existen tres niveles. El mismo equipo calcula, automáticamente, el coeficiente de variación y sólo se procede a analizar muestras si éste es menor de 6%.
Los materiales y métodos de los criterios de inclusión, recolección y captura de datos, toma o recepción de muestras, almacenamiento de sueros, procesamiento, reporte de marcadores bioquímicos por el analizador, conversión de unidades para captura en el programa de cómputo, secuencia para la inclusión de marcadores ecográficos y bioquímicos, su interpretación para aneuploidías, entrega de resultados y obtención de cariotipos, ya están descritos para esta cohorte.26
Con fines informativos se describe la distribución que tuvieron las variables de corrección que utiliza astraia en su algoritmo de riesgo:16-23 etnia, peso materno, hábito tabáquico, método de concepción, tipo de diabetes, semanas de embarazo al momento de la muestra y corionicidad en gestaciones dobles. La descripción de la estatura materna y el índice de masa corporal son complementarias.
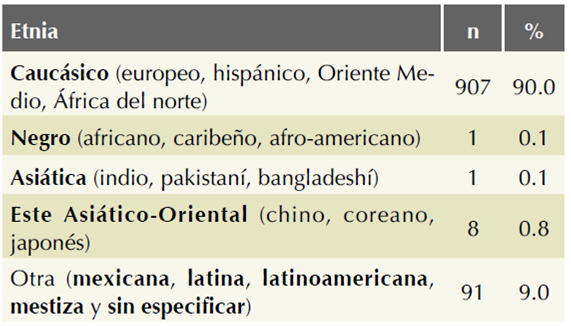
Puesto que la población mexicana no es una etnia en sí misma, sino un mosaico étnico (v. supra) cuya composición varía según la región geográfica y accesibilidad a los servicios de salud, se recomienda categorizar y describir la composición de cada muestra poblacional que sea motivo de cualquier estudio en México. En nuestra cohorte, cada paciente embarazada asignó su etnia,26 siguiendo la metodología de la Fetal Medicine Foundation23 y porque se confía en que nadie mejor puede conocer el origen de sus ancestros (el objetivo del estudio no es investigar el aspecto ancestral de la muestra poblacional). Para categorizar la etnia de la embarazada, en el cuestionario inicial la pregunta “¿De qué origen étnico se considera la embarazada?” ofrece las opciones del programa astraia, basadas en la clasificación de la Fetal Medicine Foundation23 (caucásico, europeo, hispánico, Oriente Medio, África del Norte), negro (africano, caribeño, afro-americano), asiático (indio, pakistaní, bangladesí), este asiático-oriental (chino, coreano, japonés), mixta u otra: (especificar).
Las semanas de embarazo se establecieron con base en la longitud corona-cauda (LCC)29,30 fetal que va de 45 a 84 mm. Las muestras bioquímicas se consideran válidas cuando se toman entre los 57 y 99 días de gestación.
Las concentraciones absolutas de los marcadores bioquímicos se expresan en unidades internacionales por litro (UI/L); se describen mínimos, máximos y se grafican junto con la mediana de referencia en el modelo de la Fetal Medicine Foundation de riesgos (astraia), con fines de inspección visual. Debido a que este referente proviene de población caucásica e hispana europea, se asume que nuestra muestra poblacional se compara con ella. Los valores absolutos de cada marcador se convirtieron en múltiplos de la mediana ajustados a las semanas de embarazo, el peso materno y las características relevantes del embarazo.16-23 Estos múltiplos de la mediana corregidos se transformaron en su logaritmo base 10, log10 (MoM) en lo sucesivo, para asegurar el supuesto de normalidad gaussiana requerido por las pruebas inferenciales del diseño del estudio.
Se utilizan media y desviación estándar de los valores log10 (MoM) para describir la distribución de cada marcador en la muestra poblacional y aplicar la prueba estadística de t para una media, con el valor 0.000 como el ideal y una p significativa menor de 0.05. Con fines de representación visual de lo anterior el histograma de frecuencias para los log10 (MoM) de cada marcador se grafica junto con la curva esperada para una población similar a la hispana europea.
Se calculó un tamaño de muestra global para todas las semanas de gestación, porque la transformación MoM ajusta este factor y así ya no se requiere calcular el tamaño de muestra para cada semana de gestación.
Con base en los datos descritos para la cohorte26 se estimó un log10 (MoM) esperado para beta-hCG-libre = -0.127 (IC95%: -0.145; -0.109) ± 0.2712 desviación estandar y un log10 (MoM) esperado para la proteína plasmática A del embarazo = -0.056 (IC95 -0.071; -0.041) ± 0.2374 DE. Para la media esperada en el cálculo de muestra se prefirió utilizar el límite superior de cada IC95% estimado, junto con la desviación estándar respectiva, 0.000 como la media conocida, α = 0.001 y β = 0.20 se obtiene una n = 105 para beta-hCG-libre y n = 585 para proteína plasmática A del embarazo; se consideró la mayor (n = 585) como el tamaño de muestra mínimo para el estudio. Debido a que el lineamiento de la Fetal Medicine Foundation y la configuración del programa astraia demanda, al menos, n = 1000 sueros para habilitar los ajustes de medianas28 y sobrepasa el tamaño de muestra mínimo requerido, se prefirió hacer el análisis estadístico con este número de observaciones.
Con fines informativos también se describe la distribución de los MoM para cada marcador según el percentil de interés, las semanas de gestación, las características relevantes del embarazo16-23 y por lote de reactivo;31 por diseño, no se puede hacer análisis inferencial de estos datos.
El análisis estadístico de los marcadores bioquímicos, los resultados y gráficas se obtuvieron principalmente desde la aplicación “auditoría del primer trimestre” del programa astraia y directamente de la base de datos de la cohorte. El factor de corrección para cada marcador se calculó e hizo efectivo sobre el algoritmo de riesgos mediante la aplicación “ajuste de los valores log10” incluido en el programa; los análisis adicionales se realizaron con Excel® Microsoft (EUA) y con SPSS® IBM (EUA).
RESULTADOS
Al momento del corte transversal (26 de junio del 2014) se habían reunido 1176 embarazadas ingresadas a la cohorte. Los marcadores bioquímicos solo se midieron en 1008 embarazadas de 16 a 52 años de edad, 400 (39.7%) de 35 años o más. La mayor edad a la que se consiguió el embarazo espontáneo fue a los 47 años; las de mayor edad lo consiguieron mediante donación de ovocitos. Se asignaron 907 mujeres a la etnia caucásica hispana y 91 a “otra” etnia, ya sea sin especificar o especificando “mexicana”, “latina”, “latinoamericana” o “mestiza”; no hubo indígenas (Cuadro 1).
Los pesos de las madres se registraron entre 41 y 106 kg, con mediana de 61.5 kg. La mediana de la estatura fue de 159 cm y el IMC 24.2, con 188 (18.7%) obesas (IMC ≥ 28). Sólo 44 (4.4%) pacientes reportaron que fumaban al inicio del embarazo, el resto refirió haberlo suspendido cuando ingresaron al estudio.
Se contaron 373 (37.3%) pacientes con paridad previa y 140 (13.9%) embarazadas mediante reproducción asistida: 119 (11.8%) por fertilización in vitro (FIV) y 21 (2.1%) con inductores de la ovulación sin FIV. Ninguna diabética.
El tiempo de embarazo al momento de la toma de la muestra fue de 61 (8 semanas, 5 días) a 99 días (14 semanas, 1 día). Sólo se contaron 99 (9.8%) embarazos dobles, 16 monocoriales y 83 bicoriales.
Los valores absolutos de beta-hCG-libre fueron de 2.7 a 348.6 UI/L; 90% de las mediciones se reportaron entre 10.2 y 98.3 UI/L. Su distribución por semanas de embarazo se grafica en la Figura 1 junto con el trazo de la mediana de referencia en el modelo Fetal Medicine Foundation de riesgos (astraia, población caucásica e hispana europea). Las mediciones mayores de 150 UI/L se graficaron sobre este límite. Los valores absolutos de proteína plasmática A del embarazo se encontraron entre 0.230 y 49.500 UI/L; 90% de las mediciones se reportaron entre 1.023 y 12.213 UI/L, su distribución por edad de la gestación se grafica en la Figura 2 junto con el trazo de la mediana de referencia en el modelo de la Fetal Medicine Foundation de riesgos (astraia, población caucásica e hispana europea). Las mediciones mayores de 8000 UI/L se graficaron sobre este límite. El coeficiente de variación medio reportado por el analizador para beta-hCG-libre fue de 3.4% (mínimo 1.7%, máximo 5.2%) y para proteína plasmática A del embarazo de 3.7% (mínimo 2.0%, máximo 5.1%), siempre menor al 6% requerido.
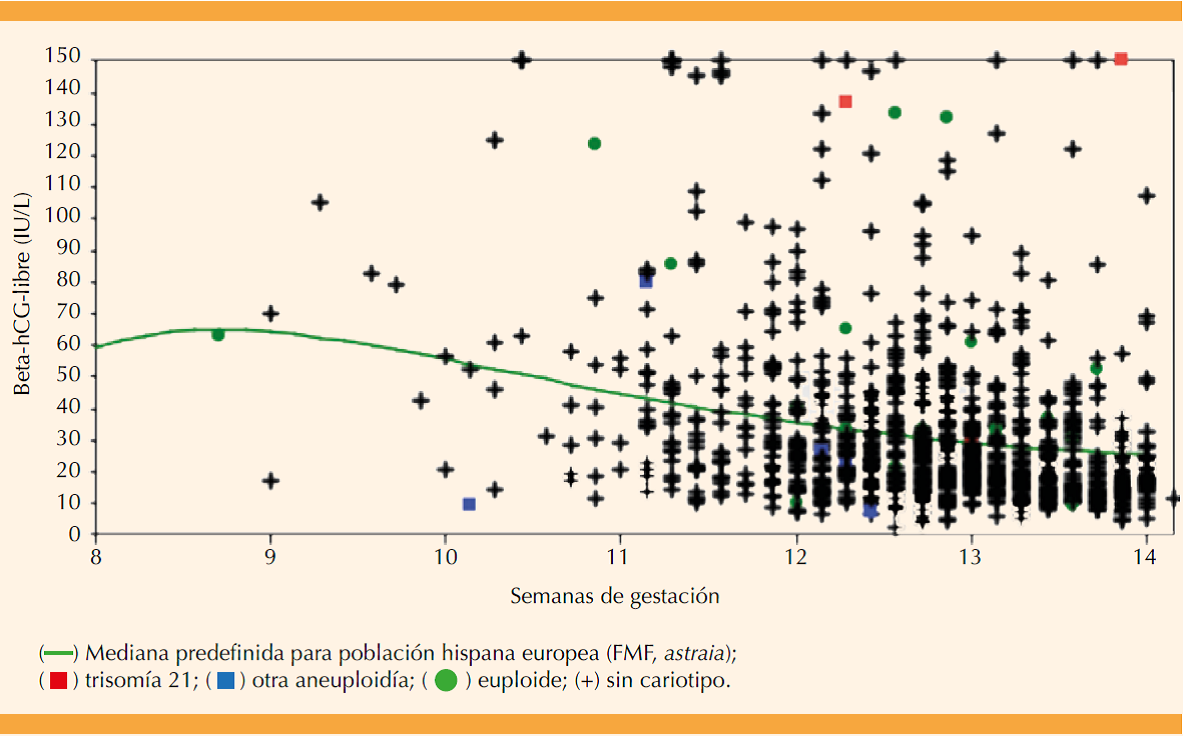
Figura 1 Distribución de beta-hCG-libre (UI/L) en el primer trimestre para la muestra poblacional mexicana en estudio (n = 1008 muestras de sueros).
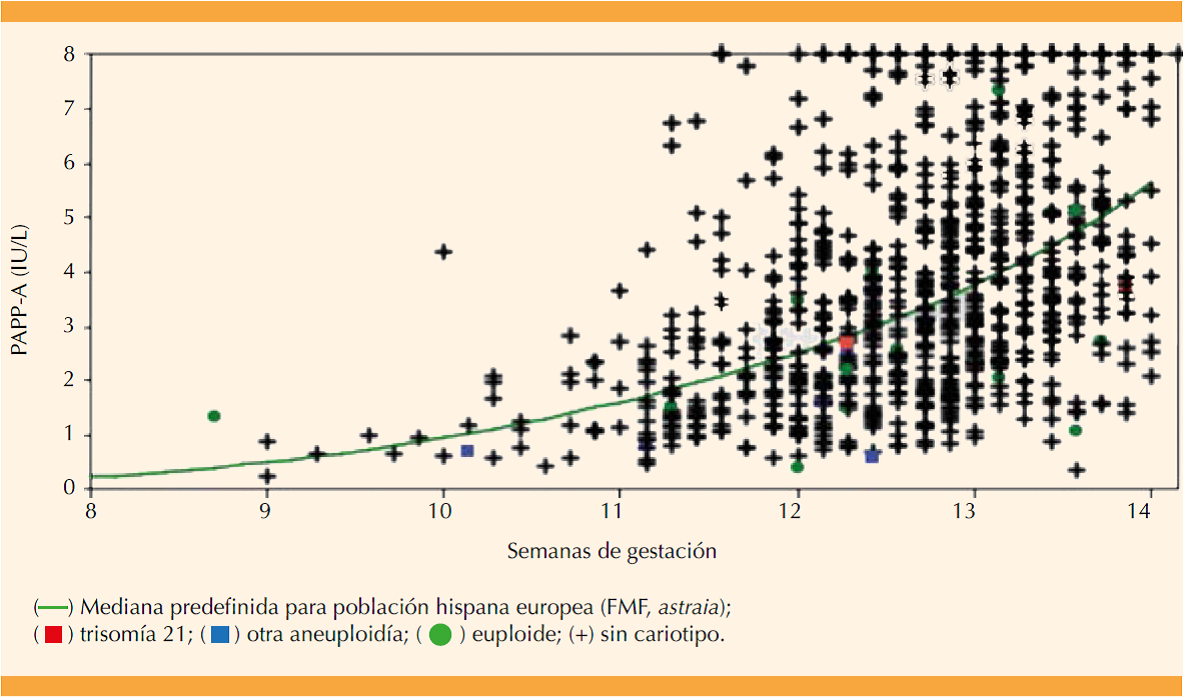
Figura 2 Distribución de PAPP-A (UI/L) en el primer trimestre para la muestra poblacional mexicana en estudio (n = 1008 muestras de sueros).
Los valores log10 corregidos para beta-hCG-libre resultaron desde 0.086 hasta 8.712 MoM, con un valor medio de 0.756 MoM (IC95%: 0.728-0.787, Cuadro 2), equivalente a un valor log10 (beta-hCG-libre MoM) = -0.121 (DE = 0.2706). (Figura 3) La diferencia entre la mediana hipotética ideal y la real es -0.121 (IC95: -0.138; -0.104), el valor t = 14.1967 con 1007 grados de libertad resulta en una diferencia estadísticamente significativa (p < 0.001) por la prueba de t para una media.
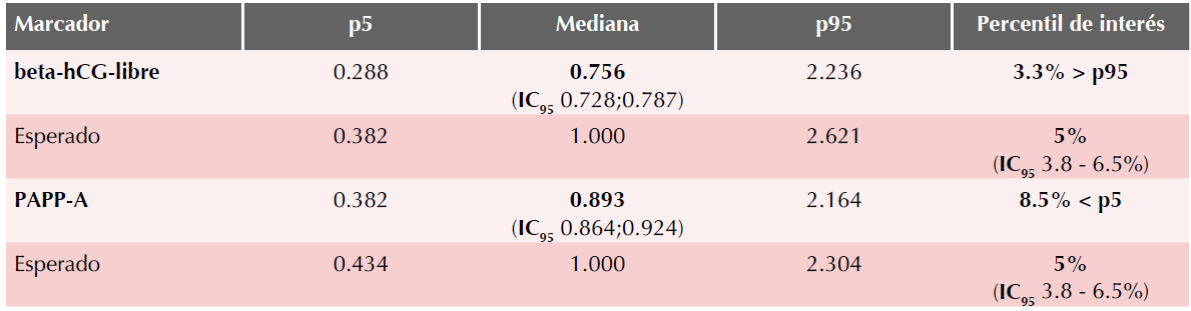
Cuadro 2 Distribución de los múltiplos de la mediana para marcadores bioquímicos en la población mexicana versus los valores esperados para una población similar a la hispana europea (n = 1008 muestras de sueros)
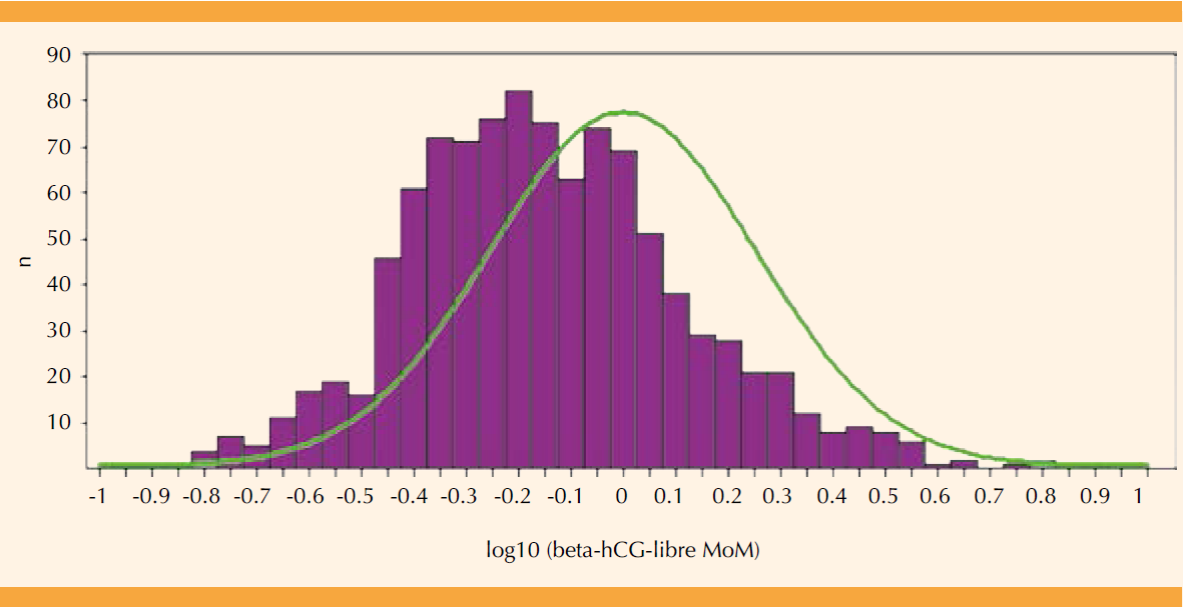
Figura 3 Distribución de log10 (beta-hCG-libre MoM) en el primer trimestre para población mexicana (n = 1008 muestras de sueros, histograma de barras) y la curva de dispersión esperada (—) para la mediana ideal (FMF, astraia); media = -0.121 (DE = 0.2706).
Los valores log10 corregidos para proteína plasmática A del embarazo resultaron desde 0.058 hasta 8.125 MoM, con un valor medio de 0.893 MoM (IC95%: 0.864-0.924; Cuadro 2), equivalente a un valor log10 (PAPP-A MoM) = -0.049 (DE = 0.2372). (Figura 4) La diferencia entre la mediana hipotética ideal y la real es -0.049 (IC95 = -0.064; -0.034), el valor t = 6.5586 con 1007 grados de libertad resulta en una diferencia estadísticamente significativa (p < 0.001) por la prueba de t para una media.
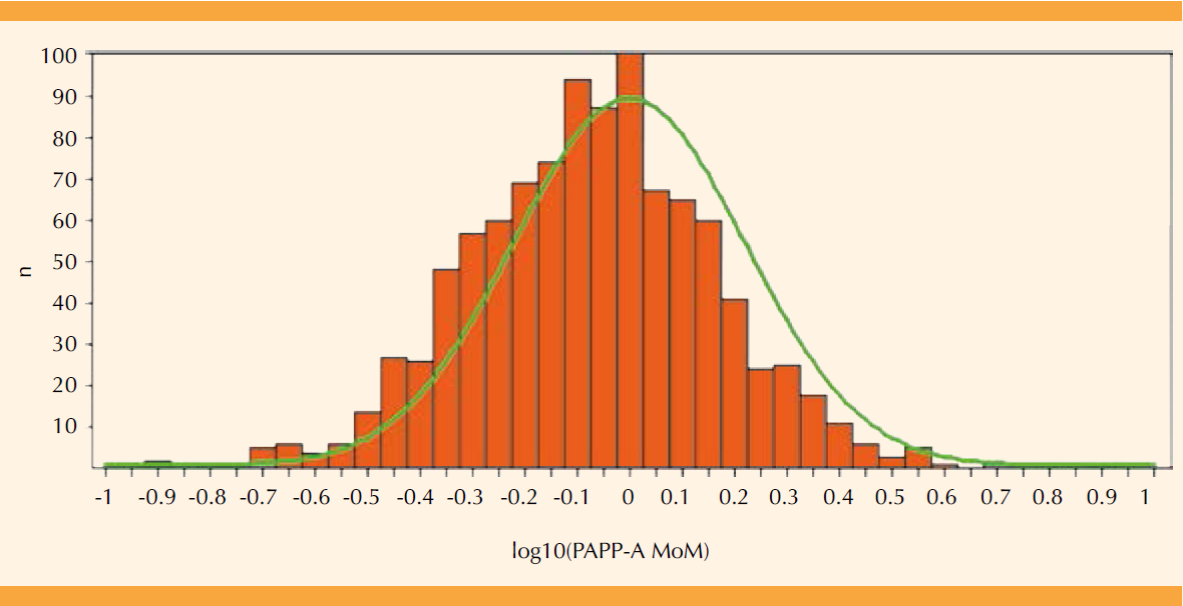
Figura 4 Distribución de log10(PAPP-A MoM) en el primer trimestre para población mexicana (n = 1008 muestras de sueros, histograma de barras) y la curva de dispersión esperada (—) para la mediana predefinida (FMF, astraia); media = -0.049 (DE = 0.2372).
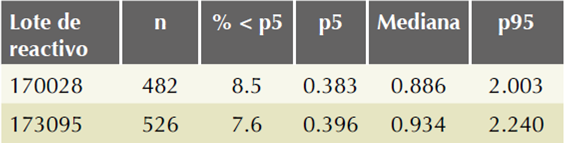
Con fines informativos se describe para los valores log10 de cada marcador: la distribución por semanas cumplidas de gestación y por grupos de peso materno en las Figuras 5 y 6; la distribución para cada característica relevante del embarazo en el Cuadro 3; la distribución por lote de reactivo para beta-hCG-libre en el Cuadro 4 y la distribución por lote de reactivo para proteína plasmática A del embarazo en el Cuadro 5; la variación entre lotes para beta-hCG-libre fue del 3.4% y del 4.8% para proteína plasmática A del embarazo.

Cuadro 3 Factores de corrección para los múltiplos de la mediana de beta-hCG-libre y PAPP-A en población mexicana (n = 1008 sueros)

Cuadro 4 Distribución de los múltiplos de la mediana para beta-hCG-libre por lote de reactivo (n = 1008 muestras de sueros)
DISCUSIÓN
Las características maternas y gestacionales de esta muestra poblacional son similares a lo previamente descrito para esta cohorte,26 la distribución global de cada marcador cae dentro del intervalo de confianza estimado pero difieren del modelo de riesgos de la Fetal Medicine Foundation, por lo que se tiene evidencia suficiente para inferir que nuestra cohorte mexicana es bioquímicamente diferente de la población europea.
En programas de tamiz prenatal, con marcadores bioquímicos, se esperan diferencias entre centros y laboratorios que pueden atribuirse a factores poblacionales (etnia y otras características del embarazo)16-23 o a variables específicas del laboratorio (el ensayo bioquímico,15,28 el lote de reactivo31 y diversos procesos internos) que requieren ajustes locales y periódicos para cada centro o laboratorio. No hay otra información publicada acerca de marcadores bioquímicos del primer trimestre en población mexicana, además de lo ya conocido de nuestra cohorte;26 este es el primer estudio formal al respecto.
Limitaciones del estudio: por el diseño transversal y sin resultados perinatales no pueden hacerse ciertas inferencias. Por diseño y número de observaciones, tampoco se puede hacer un análisis estratificado. Por las variaciones seculares esperadas de la población y otras variaciones inherentes al proceso, como los lotes de reactivos, tampoco se puede asegurar que estos factores de corrección se van a mantener constantes a lo largo del tiempo, aún para el propio laboratorio. Los factores de corrección aquí expuestos pueden aplicarse a poblaciones mexicanas similares utilizando el mismo modelo de riesgos (Fetal Medicine Foundation, astraia), pero el centro o laboratorio que los utilice deberá realizar ajustes adicionales y periódicos con su propia población.
Fortalezas del estudio: el estudio está inserto en una cohorte con procesos estandarizados y registrado en una base de datos periódicamente auditada, por lo que es sólida y confiable; se siguieron los lineamientos de la Fetal Medicine Foundation para el análisis de los marcadores bioquímicos y para el ajuste de medianas, que son procesos estandarizados y reconocidos a nivel internacional. El tamaño de muestra es considerablemente mayor al requerido para conseguir poder estadístico de las inferencias diana. Por todo lo anterior puede decirse que los factores de corrección aquí obtenidos pueden aplicarse, de primera intención, en poblaciones mexicanas de características similares, tratadas de manera estandarizada y utilizando el mismo algoritmo de riesgos.
CONCLUSIONES
Los marcadores bioquímicos del primer trimestre (beta-hCG-libre y proteína plasmática A del embarazo) en esta muestra poblacional mexicana tienen una distribución significativamente diferente a la de la población hispana europea, referente del modelo de riesgos de la Fetal Medicine Foundation del programa astraia. Se sugiere realizar más estudios en la población mexicana, con la finalidad de considerar factores de corrección para las medianas bioquímicas preinstaladas en el programa astraia y, posteriormente, establecer medianas específicas para cada población. Además, cada centro o laboratorio deberá realizar ajustes locales y periódicos.











 nova página do texto(beta)
nova página do texto(beta)