ANTECEDENTES
Los casos de embriones que se dividen para formar dos embriones idénticos representan una preocupación para los médicos y las pacientes que reciben tratamientos de reproducción asistida. Si bien es un fenómeno poco frecuente en las concepciones naturales, en 0.4% de los nacimientos1,2 se ha descrito un aumento de estos casos en los tratamientos de reproducción asistida, especialmente en la transferencia en estadio de blastocisto.3 Es importante considerar esta situación al transferir un embrión, decisión que habrá de tomarse en cuenta para evitar un posible embarazo gemelar, incluso si se transfieren dos embriones, en cuyo caso puede ocurrir un embarazo triple, con las complicaciones que ello implica.
Algunos autores asocian el riesgo de gemelos monocigotos con daños en la zona pelúcida,4 aplicación de la inyección intracitoplasmátic5,6 de espermatozoides (ICSI), eclosión (hatching) asistida, cultivo prolongado a blastocist4-6 e hiperestimulación ovárica. Incluso sugieren riesgo elevado en mujeres mayores de 35 años de edad o en quienes reciben ovodonación. Otras revisiones muestran que no existe relación entre los embriones sometidos a eclosión (hatching) y la incidencia de estos embarazos.7,8
Cervantes y sus colaboradores publicaron una serie de 5 casos en estadio de blastocisto y señalan que la bipartición temprana puede originarse por una masa celular interna con diferentes propiedades, predisposición genética del embrión, alteración de la zona pelúcida o algún proceso fisiológico ajeno a la reproducción asistida.9
La condición de los medios de cultivo también puede afectar el metabolismo embrionario y favorecer la división de la masa celular interna antes o durante la eclosión (hatching).10
Aunque se ha demostrado que cuando el embrión se divide en los primeros 3 días de la fecundación se logra una gestación bicorial biamniótica, cuando se divide del cuarto al octavo día ocurre un embarazo monocorial biamniótico y después del octavo día sucede un embarazo monocoarial monoamniótico,11 diversos autores han descrito divisiones embrionarias después del día 5 con embarazos bicoriales biamnióticos,12 incluso reportan ausencia de divisiones embrionarias en el laboratorio, a pesar de años de experiencia trabajando con embriones. Sin embargo, en nuestro centro hemos reportado una gestación tricorial triamniótica después de la transferencia embrionaria de 2 blastos.13
CASOS CLÍNICOS
Se describe una serie de nueve casos de pacientes a quienes se transfirió un embrión y se visualizaron dos sacos, o en las que se transferencia 2 embriones y se visualizaron 3 sacos (Cuadro 1).
Cuadro 1 Descripción del tratamiento de reproducción asistida
Embcp: embroscopia; ET: embriotransferencia; F: femenino; M: masculino. Asteno: astenozoospermia.
Entre 2014 y 2016 se transfirieron 3737 embriones: 1470 en fresco (506 transferencias de embrión único, 952 transferencias de dos embriones y 12 transferencias de tres embriones) y 827 desvitrificados (373 transferencias de embrión único, 444 transferencias de dos embriones y 10 transferencias de tres embriones). Nueve de 1470 transferencias suponen 0.61% de los procedimientos en fresco y ningún caso de los 827 de las transferencias de embriones desvitrificados. Además, observamos una bipartición temprana en 0.39% del total de las transferencias embrionarias y 0.86% del total de las gestaciones. Incluso puede haber casos no descritos, pues en los que se transfirieron 2 embriones y se visualizaron 2 sacos mediante ecografía, quizá se trató de un embrión que no se implantó y otro que se dividió. Estos casos son difíciles de identificar y para ello se requieren estudios genéticos posteriores de los recién nacidos.
Se buscaron variables comunes en estos casos, con la finalidad de predecir los que suponen mayor riesgo. De los 9 casos observados, en 5 se trasfirió 1 embrión y en 4 se transfirieron 2 embriones. Todas las transferencias fueron en fresco, de ciclos con ovocitos donados frescos (donantes entre 19 y 31 años de edad; número de ovocitos recuperados 15 a 40). Además de 2 pacientes en quienes se utilizó semen de donante.
De los 13 embriones transferidos, 11 fueron blastos, 8 de calidad 5AA, 1 de 4AA, 1 de 4 BB y 1 de 5BB. Los 2 embriones transferidos el día +3 fueron de calidad A.
De los casos con transferencia de embrión único (n = 5), que en la primera ecografía se visualizaron 2 sacos con 2 embriones: 1 resultó en aborto de ambos embriones, 2 tuvieron 2 recién nacidos idénticos, en 1 evolucionó solo uno de los dos embriones (embarazo en curso) y en el último se visualizaron 2 sacos (embarazo en curso).
Respecto de las pacientes con transferencia de dos embriones (n = 4): 2 tuvieron 3 recién nacidos vivos, 1 procedente de una gestación en curso de tres fetos y en la otra solo evolucionó 1 de los 3 embriones, quien tuvo recién nacido vivo.
Caso 1
Noviembre de 2016. Paciente de 42 años de edad, con esterilidad secundaria, antecedente de un hijo nacido en 2013, procedente de un embarazo espontáneo normal, con recién nacido sano. La paciente recibió tratamiento previo en otro centro de reproducción asistida. Recibió inseminación artificial en 2016 con resultado negativo y posteriormente recibió tres tratamientos de FIV/ICSI durante el mismo año, también con resultados negativos.
En el último tratamiento recibió un ciclo de ovodonación (edad de la donante: 22 años), con semen de su pareja (edad del varón: 43 años), del que se obtuvieron 6 blastos y se transfirió 1 blastocisto 5AA (Clasificación de Gardner, 1990). La ecografía de la semana 5+2 evidenció un saco intrauterino y en la semana 6+1 se escuchó el latido cardiaco. En la semana 8+1 se comprobó una gestación gemelar monoamniótica. Después de 9 semanas aconteció un aborto espontáneo.
Caso 2
Diciembre de 2015. Paciente de 44 años de edad, con antecedente de dos embarazos y dos abortos espontáneos en 2012 y 2015, respectivamente. Antecedente de laparoscopia por endometriosis grado IV, histeroscopia y metroplasia por septo. Se realizaron dos ciclos previos de FIV-ICSI en otro centro de reproducción asistida, con baja reserva ovárica, donde se transfirió un embrión único que resultó negativo.
Se aplicó un ciclo de ovodonación (edad de la donante: 27 años), con semen de su pareja (edad del varón: 42 años), del que obtuvieron 6 blastos y se transfirieron 2 blastocistos 5AA (Clasificación de Gardner, 1990). En la semana 5+6 se efectuó la primera ecografía del embarazo, en la que se visualizaron tres sacos intrauterinos, pero solo uno tenía latido cardiaco y en la semana 6+6 se observaron los tres sacos gestacionales con latido cardiaco. El embarazo transcurrió sin incidencias. En la semana 34 se realizó cesárea, de la que nacieron dos mujeres de 1340 y 1590 g, respectivamente, y un varón de 1770 g, todos sanos.
Caso 3
Noviembre de 2016. Paciente de 40 años de edad, con antecedente de un embarazo logrado por inseminación artificial homóloga que terminó en aborto (septiembre de 2011) y ocho ciclos de FIV-ICSI (2011-2012) negativos. El primer tratamiento realizado en nuestro centro se llevó a cabo con ovocitos donados y semen de su pareja, que se canceló porque ningún embrión fue apto para la transferencia. El segundo ciclo consistió en recepción ovocitaria, con semen de donante, del que se transfirieron dos embriones el día +3 (diciembre de 2014) y se vitrificó un embrión el día +5. Con este ciclo se logró un embarazo que finalizó en cesárea urgente en la semana 31 por gestosis grave; se obtuvo un varón sano de 1400 g. Posteriormente se transfirió un embrión desvitrificado sin lograr el embarazo. Se realizó un tercer ciclo de recepción ovocitaria, con semen de donante, del que se obtuvieron 5 blastos, con transferencia de 2 blastocistos (4BB, 5BB). La ecografía de la semana 7 del embarazo reportó tres embriones, dos de ellos compartiendo el corion, con latido cardiaco (+). En la semana 13+1 se efectuó fetorreducción de ambos fetos monocoriales. El embarazo se mantiene en curso, con un feto en evolución normal.
Caso 4
Septiembre de 2014. Paciente de 41 años de edad, con esterilidad primaria de 10 años de evolución. Antecedente de cuatro inseminaciones artificiales homólogas y cuatro ICSI, además de un aborto en otro centro de reproducción asistida.
Se efectuó un ciclo de ovodonación (edad de la donante: 19 años), con semen de su pareja (edad del varón: 41 años), del que se obtuvieron 5 blastos y se transfirieron 2 blastocistos 5AA y 4AA (Clasificación de Gardner, 1990). En la primera ecografía, realizada en la semana 6+1, se identificaron tres sacos gestacionales con tres embriones, todos con latido cardiaco. En la semana 32 del embarazo de efectuó la cesárea y nacieron: una mujer de 1500 g y dos varones de 1001 y 1008 g, respectivamente.
Caso 5
Agosto de 2016. Paciente de 33 años de edad, con esterilidad primaria de dos años de evolución, con diagnóstico de insuficiencia ovárica precoz. La paciente no había recibido ningún tipo de tratamiento de reproducción asistida.
Se llevó a cabo un ciclo de ovodonación (edad de la donante: 19 años), con semen de su pareja (edad del varón: 34 años), del que se desarrollaron 6 blastos y se transfirieron 2 blastocistos de calidad 5AA (Clasificación de Gardner, 1990). En la ecografía se visualizaron dos sacos con tres embriones y latido cardiaco. En la semana 12 del embarazo se estableció el diagnóstico de feto acráneo, procedente de uno de los fetos monocoriales, por lo que se decidió la fetorredución de ambos fetos. El embarazo del feto sobreviviente llegó a término y nació un varón sano por vía vaginal.
Caso 6
Abril de 2015. Paciente de 39 años de edad, con antecedentes de esterilidad primaria y pareja previa. Acudió al centro de reproducción asistida sin su pareja, con muy baja reserva ovárica. Se le planteó la opción de un ciclo con ovocitos propios y tasas de embarazo vs tratamiento con ovocitos donados.
Se realizó un ciclo de ovodonación (edad de la donante: 23 años), con semen de donante, del que se obtuvieron 3 blastos y transfirió un blastocisto de calidad 5AA (Clasificación de Gardner, 1990). La ecografía efectuada en la semana 7+2 evidenció un saco intrauterino con dos embriones, ambos con latido cardiaco. En la semana 8+1 se confirmó la gestación gemelar monocorial monoamniótica. El embarazo finalizó por vía vaginal a las 35 semanas, del que nacieron dos mujeres de 1900 y 2100 g, respectivamente.
Caso 7
Diciembre de 2016. Paciente de 45 años de edad, con esterilidad secundaria, antecedente de una hija nacida de un ciclo de FIV-ICSI a los 42 años de edad. El embarazo y parto trascurrieron sin incidencias con el nacimiento de un niño sano. En nuestro centro se le realizó un segundo ciclo de FIV-ICSI, a los 44 años de edad, con resultado negativo.
Posteriormente se efectuó un ciclo de ovodonación (edad de la donante: 31 años), con semen de su pareja (edad del varón: 45 años), del que se obtuvieron 5 blastos y se transfirió solo un blastocisto de calidad 5AA (Clasificación de Gardner, 1990). En la semana 6+4 se visualizó el saco gestacional intrauterino con embrión y latido cardiaco. En la semana 7+4 se diagnosticó un embarazo monocorial biamniótico (primer embrión con CRL 12 mm y latido cardiaco, y el segundo embrión con CRL 7 mm sin latido cardiaco). En la semana 8+4 se confirmó la evolución de uno de los embriones. Actualmente la gestación permanece en curso.
Caso 8
Febrero de 2017. Paciente de 44 años de edad, con esterilidad primaria, antecedente de tres tratamientos de FIV-ICSI en otro centro reproducción asistida, sin llegar a transferencia embrionaria.
Se realizó un ciclo de ovodonación (edad de la donante: 30 años), con semen de su pareja (edad del varón: 53 años), del que se obtuvieron dos embriones y se transfirió solo uno en el día +3, de calidad A (Clasificación de ASEBIR). En la semana 5+5 se efectuó la primea ecografía, que reportó un saco intrauterino con dos vv. En la semana 7+3 se confirmó la coexistencia de ambos embriones y latido cardiaco. El embarazo se encuentra en curso.
Caso 9
Junio de 2015. Paciente de 39 años de edad, con esterilidad secundaria y antecedentes obstétricos de un embarazo sin complicaciones y un aborto.
Se llevó a cabo un ciclo de ovodonación (edad de la donante: 21 años), con semen de su pareja (edad del varón: 34 años), del que se obtuvieron cuatro embriones en el día +3 y se trasfirió solo uno en el mismo día, con calidad A (clasificación de ASEBIR). En la semana 31 del embarazo se efectuó la cesárea, de la que nacieron dos varones sanos de 1825 y 1825 g, respectivamente.
DISCUSIÓN
El mecanismo de división embrionaria es poco conocido. Los gemelos monocigotos resultan de la división de un embrión formado por un óvulo fecundado en los estadios iniciales del desarrollo. Algunos estudios14 señalan que cuando la masa celular embrionaria se divide en las primeras 72 horas de la fertilización se obtienen gemelos biamnióticos bicoriónicos; por su parte, cuando la masa se divide entre el día 4 y 8 se obtienen gemelos monocoriónicos biamnióticos y cuando se produce después del día 8 del desarrollo se logra una gestación gemelar monocorial monoamniótica. El proceso puede iniciar con la protrusión del trofoectodermo a través de un pequeño agujero en la zona pelúcida. Sin embargo, otros autores describen divisiones embrionarias después del día 5 con embarazos bicoriales biamnióticos.12
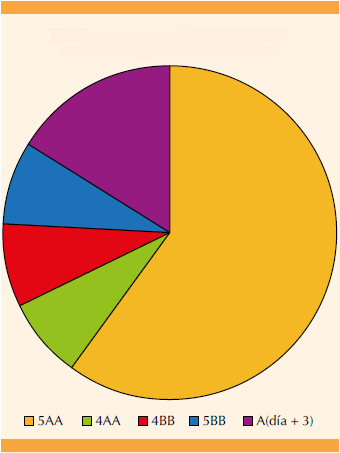
Los 9 casos son procedentes de ciclos de ovodonación y transferencia en fresco
Figura 1 Calidad embrionaria.
La incidencia de gemelos monocigóticos en la población general es de 0.4-0.45% del total de las gestaciones,15,16 mientras que en casos de reproducción asistida se estima en alrededor de 1.2%.14
En nuestra experiencia, la incidencia estimada de gemelos monocigotos es de 0.39% del total de las transferencias embrionarias realizadas y 0.86% del total de los embarazos, lo que supone un aumento respecto de la población general, diferente a lo descrito en estudios previos;14 sin embargo, se requieren estudios adicionales para confirmar este dato.
Es posible la coexistencia de casos no descritos en la bibliografía, pues en los que se transfirieron dos embriones y se visualizaron dos sacos gestacionales en la ecografía puede tratarse de un embrión que no se implantó y otro que se dividió, lo que resulta imposible de identificar hasta efectuar estudios genéticos a los fetos o recién nacidos.
Aún se desconoce el motivo por el que se dividen los embriones, incluso se ha relacionado la bipartición temprana con daños en la zona pelúcida,4 aplicación de inyección intracitoplasmática5,6 de espermatozoides (ICSI), eclosión (hatching) asistida, cultivo prolongado del blastocisto4-6 e hiperestimulación ovárica. Algunos autores señalan mayor riesgo en mujeres de 35 años o más, mientras que otros sugieren la participación de tratamientos de ovodonación. La condición de los cultivos implica otro factor que afecta el metabolismo embrionario, lo que favorece la división de la masa celular interna antes o durante la eclosión (hatching).10 Otros estudios no demuestran relación entre los embriones sometidos a hatching con la incidencia de estos embarazos.7,8 La predisposición genética del embrión a la alteración de la zona pelúcida o un proceso fisiológico ajeno a la reproducción asistida9 puede suponer esta causa.
La mayoría de los autores coincide en efectuar la transferencia de embrión único para minimizar los embarazos múltiples y sus complicaciones.
Diversos estudios señalan resultados perinatales poco satisfactorios después de un aborto espontáneo selectivo de un gemelo en los tratamientos de reproducción asistida versus gestaciones espontáneas,15 lo que supone que la transferencia de dos embriones puede afectar la posibilidad de obtener un embrión de mejor calidad.
Es importante asumir, en los tratamientos de reproducción asistida, la necesidad de una mejor selección embrionaria, para de esta manera transferir un solo embrión con alto potencial de implantación. Para ello se requiere el cultivo del blastocisto, utilizar incubadoras time lapse y establecer el diagnóstico genético preimplantacional.16
La transferencia de embrión único no puede implementarse sin antes planear un buen programa de vitrificación,17,18 que garantice una tasa de embarazo elevada y resultados positivos.
La posibilidad de un embarazo monocigótico no representa una ventaja para recomendar la transferencia de embrión único. Se ha reportado un aumento en los recién nacidos pretérmino después de un aborto selectivo espontáneo de alguno de los gemelos.19
Las instituciones de salud pública y privada hacen que las tasas de gestación múltiple, después de algún tratamiento de reproducción asistida, varíen de un centro a otro; por tanto, es necesario estandarizar los criterios de selección, con la finalidad de indicar la transferencia de embrión único en las pacientes con mejor pronóstico y de esta manera disminuir el riesgo de gestación múltiple.20
Aunque algunos autores describen 0% de gestación múltiple en las pacientes con embrión único,21 es importante recordar e informar a las pacientes que las gestaciones gemelares no pueden evitarse por completo, debido a la posibilidad de bipartición espontánea embrionaria.17
En las pacientes receptoras de ovocitos (ovocitos donados) se requiere efectuar la transferencia de embrión único, debido al aumento del riesgo de hipertensión gestacional, preeclampsia22 y hemorragia posparto23
CONCLUSIÓN
Este estudio demostró que no existe relación entre el riesgo de división embrionaria, eclosión asistida (hatching), edad avanzada ovocitaria (todas las pacientes tuvieron ovocitos procedentes de mujeres menores de 31 años) y edad paterna. En todos los casos se transfirieron embriones de muy buena calidad, fecundados mediante ICSI, transferencia en fresco y ovocitos donados.
En nuestro centro, la tasa de división embrionaria en ciclos de reproducción asistida mediante ICSI fue de 0.39% del total de las transferencias y de 0.86% del total de los embarazos. Por su parte, la división embrionaria en gestaciones espontáneas fue de 0.4% de los embarazos; por tanto, consideramos que los tratamientos de reproducción asistida aumentan el riesgo de bipartición embrionaria respecto de las gestaciones espontáneas.
Se requieren estudios adicionales para evaluar el uso dispositivos time lapse y conocer la relación entre la morfocinética y el riesgo de división embrionaria.
Puesto que en nuestra experiencia todos los casos fueron de transferencia de embriones de muy buena calidad, en fresco, procedentes de ovocitos de pacientes jóvenes, se recomienda la transferencia de embrión único (recepción ovocitaria) en mujeres menores de 35 años de edad, con la finalidad de evitar un embarazo triple y minimizar el riesgo de gemelaridad.











 nueva página del texto (beta)
nueva página del texto (beta)


