ANTECEDENTES
En la actualidad, en el campo de la reproducción asistida, la estimulación ovárica controlada es el principal procedimiento integrado en los diferentes tratamientos. La estimulación ovárica controlada se realiza mediante la administración exógena de gonadotropinas para incrementar el reclutamiento y la maduración folicular. En el momento actual existen varios preparados de hormona folículo estimulante (FSH) disponibles para estimulación ovárica controlada. De todos estos productos, los más comúnmente utilizados son la FSH urinaria humana (FSHu) y la FSH recombinante (FSHr). La FSH urinaria humana contiene una porción de isoformas ácidas mayor que la recombinante, mientras que FSHr contiene mayor proporción de isoformas menos ácidas.1 En cuanto a características biofísicas, las isoformas menos ácidas tienen mayor bioactividad in vitro, pero una semivida plasmática menor que las isoformas ácidas.2 Por tanto, las isoformas de FSH juegan un papel esencial en el ciclo natural y en los protocolos de estimulación. Si nos basamos en lo ocurrido en el ciclo natural se podrá diferenciar que las formas ácidas de FSH se producen durante la fase folicular temprana, cuando las concentraciones de estradiol son bajas, y las isoformas menos ácidas se producen durante la segunda mitad del ciclo, con concentraciones de estradiol mayores. Este cambio de acidificación es importante en cuanto a la regulación de la intensidad del estímulo de FSH durante los últimos pasos de la maduración folicular preovulatoria.3,4
Al extrapolar lo anterior a las terapias en reproducción asistida será interesante comparar diferentes protocolos de estimulación variando el patrón de glicosilación según la secuencia de administración de gonadotropinas: FSHr durante toda la estimulación (isoformas menos ácidas), FSHhp durante toda la estimulación (isoformas más ácidas) o inicio con FSHhp en la fase folicular inicial para continuar con FSHr cuando las concentraciones de estrógeno aumenten (simulando un ciclo natural).
No existe evidencia científica clara acerca de cuál es el que ofrece mejores resultados, por lo que hemos evaluado una comparación entre el protocolo secuencial, frente a otros dos protocolos de estimulación con FSH para pacientes susceptibles de tratamiento de inseminación artificial.
El objetivo principal de este ensayo es demostrar la efectividad en tasas de gestación del tratamiento de estimulación ovárica con protocolo secuencial de gonadotropinas FSHu + FSHr para inseminación artificial en comparación con otros esquemas tradicionales de estimulación ovárica con FSHr o FSHu solas. Además, comparar las tres estrategias en cuanto a dosis de gonadotropinas necesarias empleadas, seguridad para la paciente y un análisis de costo-efectividad de cada brazo terapéutico.
MATERIALES Y MÉTODOS
Estudio de cohortes, histórico, de parejas con diagnóstico de infertilidad que acudieron a la Unidad de Reproducción del Hospital Universitario La Zarzuela, en Madrid, España, entre mayo 2012 y mayo 2015. Se seleccionaron las pacientes con diagnóstico de infertilidad en quienes se efectuaron ciclos de estimulación ovárica seguidos de inseminación artificial.
Las pacientes se ingresaron a un protocolo de estimulación ovárica con gonadotropinas que se estructura en tres grupos diferentes, de acuerdo con el tipo de FSH utilizada en la estimulación o según su secuencia de utilización:
Grupo FSHr: 75 UI al día de FSH recombinante (Gonal®) a partir del segundo al tercer día del ciclo hasta conseguir, al menos, un folículo de 18 mm.
Grupo FSHhp: se administraron 75 UI al día de FHS urinaria altamente purificada (Fostipur®) a partir del segundo al tercer día del ciclo hasta conseguir la madurez folicular.
Grupo secuencial: los primeros cinco días de estimulación se pautaron 75 UI FSHhp (Fostipur®) y la estimulación se continuó con 75 UI FSHr (Gonal®).
La Figura 1 muestra, en un diagrama de flujo, los tres grupos participantes. Todas las pacientes cumplieron criterios de inclusión y exclusión que se resumen en los siguientes puntos:
Criterios de inclusión
Edad entre 18 y 40 años al momento del tratamiento que consultan por un problema de esterilidad y cuyo tratamiento indicado es la inseminación artificial.
IMC menor de 35 kg/m2.
Parejas con información completa que reconocieron en un documento firmado de consentimiento informado para inseminación artificial.
Ausencia de evidencia de mala reserva ovárica (FSH > 10 UI/mL en el terecr día del ciclo).
Permeabilidad tubárica conservada, demostrada por histerosalpingografía (HSG).
Ausencia de factor masculino severo (más de 3 × 106 espermatozoides móviles por mililitro después de la capacitación espermática mediante técnica de swim-up). Si el primer seminograma está alterado, se solicita el segundo para comparar.
Ausencia de contraindicación médica para recibir tratamiento o embarazo.
Aceptación de los riesgos y complicaciones de las técnicas de reproducción asistida por parte de la pareja.
No más de tres ciclos previos de inseminación artificial
Criterios de exclusión
Enfermedad sistémica endocrino-metabólica con afectación de: hipófisis, tiroides, suprarrenales, páncreas, hígado o riñón, que contraindiquen el tratamiento o el embarazo.
Medicación concomitante que pueda interferir con la medicación del estudio.
Abuso de alcohol o drogas.
Hemorragia vaginal de causa no determinada.
Tumores de ovario, mama, suprarrenales o hipotálamo hipofisarios.
Antecedentes de quimioterapia o radioterapia.
Malformaciones de los órganos sexuales incompatibles con el embarazo.
Factores relacionados con la técnica de inseminación artificial (obstrucción tubárica bilateral u otras afecciones ginecológicas determinantes, factor masculino severo).
Alergias conocidas a preparados de gonadotropinas.
Alguna de las contraindicaciones que constan en la ficha técnica de Gonal®, Fostipur®, Ovitrelle® o Progeffik®.
No aceptación del consentimiento informado para el tratamiento.
Ausencia de respuesta al tratamiento de estimulación luego de 15 días de tratamiento.
Algún acontecimiento adverso de toxicidad grado 3 o 4 según la escala de toxicidad de la Oganización Mundial de la Salud (OMS).
Respuesta ovárica excesiva que indique un riesgo elevado de síndrome de hiperestimulación ovárica.
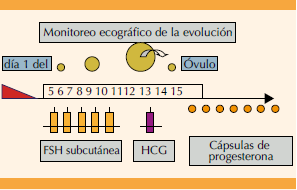
Todas las pacientes reunidas en el estudio, siguieron un protocolo de estimulación ovárica con gonadotropinas: FSH a dosis de 75 UI/día desde el segundo-tercer día de un ciclo espontáneo. Los ajustes de dosis se realizaban tras los controles ecográficos; el primer control se realizó al cuarto o quinto día de estimulación y, posteriormente, se realizan reevaluaciones ecográficas cada 48-72 h hasta conseguir al menos un folículo ovárico mayor de18 mm de diámetro mayor y endometrio de características periovulatorias, tipo trilaminar con más de 6-7 mm. En ese momento se solicita una determinación de estradiol en sangre periférica como marcador de madurez folicular (valores entre 200 y 500 pg/mL) y se induce la ovulación mediante la administración de 250 µg de hCGr, (gonadotropina coriónica humana recombinante) realizándose inseminación artificial intrauterina (IA) con semen de pareja 36 horas después. La Figura 2 muestra el protocolo de estimulación ovárica.
Si no se cumplen ninguno de los criterios anteriores mencionados tras 15 a 20 días de tratamiento estimulación ovárica controlada se cancela por baja respuesta; si se encuentran más de 3 folículos y concentraciones de estradiol mayores de 500 pg/mL el ciclo se cancela por riesgo de hiperestimulación y gestación múltiple.
En todos los casos se realiza apoyo de fase lútea con progesterona natural micronizada 200 mg/12 horas, vía vaginal, desde el día de inseminación artificial hasta la confirmación de gestación.
Se indica la determinación de β-HCG en sangre periférica a los 15 días de la inseminación artificial. Para determinar si existe o no embarazo clínico se realiza ecografía transvaginal entre la sexta a séptima semana para visualizar saco gestacional.
Se reúnen los datos de cada paciente relativos a edad (años), origen de esterilidad, antecedentes obstétricos (aborto previo o parto previo), concentración de FSH basal y Estradiol basal, test de recuperación espermática basal y número de ciclo de inseminación.
Las variables de respuesta primarias fueron:
Número de folículos maduros (folículos mayores de 17mm bajo control ecográfico)
Tamaño del folículo mayor
Tasa de gestación química por ciclo iniciado (β-HCG positiva a los 15 días post inseminación), así como por ciclo inseminado
Tasa de gestación clínica (embarazo evolutivo) así como los que finalmente evolucionan hasta parto
Las variables de respuesta secundarias fueron:
Número de días de estimulación (desde el primer día de administración de FSH hasta el día de inducción de ovulación)
Dosis total de gonadotropinas (medida en UI)
Costo por ciclo (costo de cada UI por UI usadas por cada ciclo)
Concentraciones de estradiol en día de administración de HCGr
Tasa de abortos
Tasa de cancelación (estimulaciones que no llegan a seguirse de inseminación artificial)
Tasa de embarazo múltiple
Número de síndromes de hiperestimulación ovárica
Para el análisis costo-efectividad se realizó un estudio en el que se calcularon los siguientes parámetros:
Número de unidades por ciclo: cantidad de gonadotropina, medida en UI empleadas en cada ciclo de estimulación
Costo por ciclo: precio de la unidad de gonadotropina multiplicado por el número de unidades utilizadas por ciclo
Tasa costo efectividad: costo por ciclo entre la tasa de gestación y entre la de recién nacido.
Los resultados se analizaron estadísticamente con χ2, ANOVA o test Mann-Whitney, para variables no cuantitativas. Las comparaciones entre grupos de tratamiento se efectuaron corrigiendo el nivel de significación estadística. El análisis estadístico se realizó con el paquete estadístico Stata 13.
RESULTADOS
Se analizaron 299 ciclos de estimulación ovárica controlada efectuados en 178 pacientes. La estimulación ovárica controlada acabó en inseminación artificial en 282 casos; se cancelaron 17 ciclos, en 5 pacientes.
Las características demográficas se señalan en el Cuadro 1 y no se encontraron diferencias estadísticamente significativas respecto de la edad, el tiempo de esterilidad, las casusas de esterilidad o los antecedentes obstétricos.
Con respecto al número de ciclo al que se somete la paciente, la comparación entre grupos reflejó diferencias estadísticamente significativas (p = 0.001), mayor número de primeros ciclos en FSHu, respecto de la secuencial y FSHr y mayor número de segundos y terceros ciclos en terapia secuencial. Cuadro 2
En los datos previos a la estimulación ovárica no se encontraron diferencias entre los grupos en el valor de estradiol basal, hormona folículo estimulante (FSH) o el recuento de folículos antrales.
El Cuadro 3 muestra las características objetivo del estudio, donde se observa que con el tratamiento con protocolo secuencial se obtuvo mayor número de folículos con concentraciones de estradiol mayores en comparación con las obtenidas en los otros grupos. La obtención de un folículo necesitó menor dosis y menor número de días de estimulación en el protocolo secuencial en comparación con el resto, aunque en ningún caso las diferencias fueron signficativas.
En cuanto a la estimulación ovárica controlada se observó que con FSHr se incrementó 10% el número de días de estimulación ovárica controlada en comparación con lo ocurrido en el tratamiento secuencial. La magnitud del efecto permaneció ajustada por edad y número de ciclos. No hubo diferencias entre el tratamiento por FSHu y secuencial. A propósito de la dosis total necesaria para estimulación ovárica controlada se observó que el efecto ajustado y sin ajustar, el empleo de FSHr aumenta en 26 unidades la dosis total versus la secuencial. Cuadro 4.
Las diferencias en efectividad de los esquemas de tratamiento del total de los ciclos estimulados se presentan en el Cuadro 5. No se encontraron diferencias estadísticamente significativas entre los distintos esquemas, aunque ambas tasas son mayores en FSHu y secuencial frente a FSHr.
En el análisis costo-efectividad de los distintos tratamientos se observó menor costo-efectividad en el esquema secuencial en comparación con los otros dos esquemas. (Cuadro 6) Quedó de manifiesto que con el protocolo secuencial se obtienen resultados positivos con menor costo del tratamiento. Así, se verificó que el protocolo secuencial tiene un costo-efectividad mejor que los otros dos protocolos.
En el segundo análisis los tres grupos se analizaron de acuerdo con su última intervención: se compararon pacientes con inseminación artificial previas y pacientes sin inseminación artificial anterior. Se analizaron 173 pacientes que se dividieron en dos grupos: las que tenían intentos previos de inseminación artificial y las de primer intento. En el grupo de pacientes sin intentos previos la razón de momios (RM) se estimó del esquema FSHr y FSHu en relación con la secuencial sin ajustar y ajustando por edad, embarazo previo y estradiol. No se encontraron efectos relevantes en los modelos sin ajustar, ni en los modelos ajustados.
Sin embargo, en el grupo con intentos previos la probabilidad de β-HCG y gestación y de recién nacido disminuye en el esquema FSHr frente al secuencial con RM = 0.24 (IC95%: 0.06-0.92, p = 0.038) y RM = 0.15 (IC95%: 0.03-0.74, p = 0.019) y una RM 0.22 con IC95%: 0.02-3.2 y p = 0.089, respectivamente. Ambas comparaciones con significación estadística.
Se encontraron efectos de la misma magnitud en los modelos ajustados estadísticamente en tasa de gestación. De acuerdo con estos datos parece que la FSHr disminuye la probabilidad de β-HCG frente a la secuencial de manera estadísticamente significativa, p = 0.038. Cuadro 7
DISCUSIÓN
En el campo de la reproducción asistida el objetivo final, independientemente de la técnica que se aplique en cada pareja, es conseguir un embarazo y un recién nacido sano a término. Estos deben ser los criterios para demostrar qué tratamiento es más eficaz. De igual manera, deben intentarse tratamientos de alta seguridad e, incluso, con máxima efectividad y con un costo-efectividad lo menor posible. La tendencia actual en las estrategias de estimulación ovárica controlada es mejorar el éxito de la técnica y la seguridad del tratamiento, y minimizar las molestias ocasionadas.5,6
En las últimas décadas el tratamiento con FSH ha adquirido un papel principal en los protocolos de estimulación ovárica controlada en mujeres infértiles o subfértiles de diferente condición.7Así, en la actualidad, la gonadotropina más indicada en la estimulación es FSH que, a su vez, puede diferenciarse en FSHu y FSHr. Ambas tienen distintas isoformas que confieren propiedades químicas y biológicas distintas. El alto costo médico de los productos recombinantes ha motivado la realización de estudios que exploren la efectividad y el costo-efectividad de tratamientos alternativos para estimulación ovárica controlada.
Un punto decisivo para diseñar un protocolo de estimulación ovárica controlada en una paciente determinada fue comparar diferentes protocolos de estimulación ovárica controlada variando el patrón de glicosilación según la secuencia de administración de gonadotropinas. Los distintos protocolos utilizados durante muchos años consisten en FSHr (isoformas menos ácidas) o FSHhp durante todo el ciclo (isoformas más ácidas). Con base en los cambios de acidez de FSH durante la fase folicular hay estudios que diseñan protocolos de estimulación ovárica controlada siguiendo una secuencia de administración de la FSH ácida (menos ácida que imita el ciclo natural). El protocolo de estimulación propuesto en este estudio consiste en iniciar con FSHhp en la fase folicular inicial para continuar con FSHr cuando las concentraciones de estrógeno aumentan (simulando el ciclo natural).8
CONCLUSIONES
En este estudio se planteó la estimulación ovárica controlada con protocolo secuencial en pacientes que recibirían inseminación artificial y, aunque no se encontraron diferencias significativas, sí se observó una tendencia en la que tanto la dosis como los días de estimulación requerida son menores con este protocolo que con los clásicos con FSHr o FSHu, exclusivamente. Esto sugiere que el protocolo secuencial podría ser benéfico porque utilizar menos dosis, en unidades y en días, implicaría provocar menos efectos indeseables, mayor comodidad y, además, un tratamiento más económico. No obstante, el objetivo final fue conseguir la gestación después de la inseminación artificial. En nuestro estudio obtuvimos una tasa de gestación bioquímica y clínica mayor con protocolo secuencial, 20%, que con cualquiera de los otros dos: 12% con FSHr y 18% con FSHu.
Por tanto, al parecer un protocolo de estimulación ovárica controlada que simule ciclo natural en la práctica clínica sugiere mejores resultados en tasas de gestación. Por ello, aún sin diferencias significativas, se observó una tendencia a requerir menos días de estimulación ovárica controlada y menos dosis de gonadotropinas utilizando protocolo secuencial en comparación con los otros dos, para la obtención de un folículo maduro y mayores concentraciones de estradiol sérico. El protocolo secuencial no solo es más barato por el precio inicial de FSHu, sino que además la dosis utilizada en este protocolo fue menor y con menos días de estimulación ovárica controlada, por lo que resultó en tasas de gestación algo mayores.
Las pacientes que previamente recibieron ciclos de inseminación artificial tuvieron mayor tasa de embarazo con protocolo secuencial y con FSHu, respecto de las pacientes estimuladas con FSHr. De la misma manera, se observó que en la serie sin intentos previos no hubo diferencias ni en la β-HCG ni en la tasa de gestación o tasa de recién nacido. Así, pues, puede deducirse que es menos probable tener un recién nacido si la inseminación artificial se efectúa con estimulación ovárica controlada previa con FSHr o FSHu que si se trata con secuencial, a pesar de que las diferencias no fueron significativas.
En cambio, en la serie con intentos previos sí se encontraron diferencias estadísticamente significativas en la β-HCG y tasa de gestación clínica al comparar FSHr con la secuencial. Por el contrario, FSHu se comporta similar a la secuencial.
Una de las mayores limitaciones de este estudio preliminar fue no contar con una muestra más numerosa para establecer diferencias entre los grupos; aun así, las diferencias en tasa de embarazo encontrada para el esquema secuencial versus el tratamiento de FSHr fueron de 7.8% (IC95%: -2.7 a 18.32%), intervalo compatible con la hipótesis planteada para determinar el tamaño de la muestra.9 No fue así para las diferencias encontradas entre la tasa de embarazo para el esquema secuencial versus el tratamiento de FSHu -0.8% (IC95%: -12.2 a 10.67%). Quizá los estudios futuros deberían plantear diferencias mayores entre ambas estrategias, secuenciales versus FSHu.











 nueva página del texto (beta)
nueva página del texto (beta)