ANTECEDENTES
Las alteraciones cromosómicas se encuentran en 50% de los embriones logrados mediante fertilización in vitro.1 Estas alteraciones se deben a una inestabilidad cromosómica que se caracteriza por la ganancia o pérdida de cromosomas completos [aneuploidias numéricas (monosomías y trisomías)] o de segmentos cromosómicos (aneuploidias segmentarias), como pérdidas o duplicaciones. Las aneuploidias segmentarias pueden aparecer en cada ciclo celular debido a que se generan de novo durante la meiosis cuando se lleva a cabo la gametogénesis y durante la mitosis en el desarrollo embrionario; además, pueden heredarse de individuos con alteraciones estructurales balanceadas, que dan lugar a una variabilidad de célula a célula.2
Para el estudio de las alteraciones cromosómicas, el análisis mediante hibridación fluorescente (FISH) de gametos y embriones sujetos a diagnóstico genético preimplantacional (PGD), ha demostrado que las alteraciones cromosómicas originadas en meiosis I y II, así como las alteraciones mitóticas posfecundación son muy frecuentes. Esto genera arresto del desarrollo embrionario, falla en la implantación o aborto espontáneo en el primer trimestre de la gestacion.3,4 A su vez, el estudio molecular detallado con base en microarreglos de ADN de embriones en división ha permitido la identificación y estudio de pérdidas o duplicaciones y otras alteraciones indicativas de inestabilidad inherente de los cromosomas en embriones humanos,5,6,7 que aunado a la alta frecuencia de reordenamientos cromosómicos pueden resultar en alteraciones genéticas y afectar la supervivencia de los embriones.7
Las pérdidas o duplicaciones en el área de la reproducción asistida humana son una nueva clase y existen muy pocos estudios en los que se haya reportado una variación en la incidencia que va de 3.9 a 70%.7-12 También se ha visto que la cantidad de embriones afectados por estas aneuploidias depende del estadio en que se encuentran, tal como lo observaron Babariya y colaborores13, quienes reportaron mayor incidencia de aneuploidias segmentarias en embriones de día 3 (blastómeras) (24.2%) en comparación con las de día 5 (blastocistos) (15.5%), similar a lo reportado por Fragouli y su grupo,10 quienes observaron pérdidas o duplicaciones en blastómeras (15%) y blastocistos (7%).
El tamizaje genético preimplantacional (PGS) durante un ciclo de fecundación in vitro (FIV) ha aumentado en los últimos cinco años y en diferentes estudios con asignación al azar se ha demostrado una clara ventaja en los resultados.14-17 Para muchas pacientes que recibirán fecundación in vitro es de gran interés poder transferir al útero el embrión con mayor potencial reproductivo, lo que minimiza la frecuencia de abortos y evita los embarazos múltiples y consigue el éxito del tratamiento en el primer ciclo.
A pesar de los grandes avances en fecundación in vitro un número considerable de embriones euploides, morfológicamente normales, no logran el nacimiento de un niño saludable. Esto se ha relacionado con posibles alteraciones originadas en el embrión, endometrio y factores epigenéticos. Son muchos los estudios que sugieren que las alteraciones subcromosómicas, las pérdidas o duplicaciones o el mosaicismo embrionario son la posible explicación del subgrupo de embriones euploides transferidos que no resultan en el nacimiento de un niño sano.
El objetivo de esta investiagación fue: conocer la frecuencia de aneuploidias cromosómicas segmentarias en biopsias de trofoectodermo durante un ciclo de fertilización in vitro y su relación con la edad materna.
MATERIALES Y MÉTODOS
Estudio retrospectivo efectuado en un centro privado de reproducción asistida de México. Se incluyeron los ciclos de pacientes atendidas entre 2015 y 2016 de los que se obtuvieron embriones en estadio de blastocisto (día 5 y 6), que se analizaron mediante tamizaje genético preimplantacional y realizó biopsia de células del trofoectodermo.
Para el análisis de las células del trofoectodermo se recurrió al tamizaje genético preimplantacional en su variante de microarreglos de polimorfismo de nucleótido único (SNP microarrays). El análisis de resultados se efectuó con base en el algoritmo “Parental Support” (Natera inc., USA), que permite evaluar la ploidía de los 23 pares de cromosomas y compararla con el genotipo de los padres.
Los resultados obtenidos del tamizaje genético preimplantacional se dividieron en cuatro límites de edad, dependiendo de la edad materna: menores de 35, entre 35 y 37, entre 38 y 40 y más menos mayores de 41 años, incluidos blastocistos euploides y aneuploides.
Todas las pacientes firmaron un consentimiento informado para la realización de los protocolos de estimulación ovárica y estudio genético de los embriones, en donde se les explicaron las ventajas, alcances y limitantes del tamizaje genético preimplantacional.
Cultivo embrionario
Los embriones obtenidos por FIV-ICSI se cultivaron en medios G-Series (Vitrolife) desde el día de la fecundación del ovocito hasta el estadio de blastocisto (día 5 o 6 de desarrollo).
Biopsia embrionaria para el tamizaje genético preimplantacional
Se evaluaron el grado de expansión, características de la masa celular interna (MCI) y células de trofoectodermo, para determinar el día de la biopsia. Se utilizó una aguja “Biopsy” MBB-BP-30 de la marca Origio Inc. (Charlottesville, VA USA) y para sujetar los embriones se utilizó una aguja “Holding” MPH-SM-30 de la marca Origio Inc. (Charlottesville, VA USA), con ayuda del micromanipulador se tomaron de 4-6 células del trofoectodermo, desprendiéndolas del blastocisto con ayuda del láser (Zilos Tk, Hamilton Thorne Biosciences), incidiendo sobre la superficie de la zona colapsada y con pulsos de 400 microsegundos de intensidad cada uno, al 100% de potencia. Enseguida, las células biopsiadas se mantuvieron en congelación a -78°C (hielo seco) para enviarlas al laboratorio de Natera, en donde se llevó a cabo el tamizaje genético preimplantacional.
Tamizaje genético preimplantacional basado en microarreglos de polimorfismo de nucleótido único (SNP)
En Natera (laboratorio de genética), las muestras biopsiadas (células) de los blastocistos se analizaron y genotipificaron con Illumina HumanCyto-12 DNA BeadChips y evaluaron según el algoritmo informático “Parental Support”, que analiza los microarreglos de polimorfismo de nucleótido único de los padres y de los blastocistos, y permite la comparación de las copias de ADN que presentan los blastocistos con el de los padres. Así se identifican las aneuploidias [numéricas (nulisomías, monosomías o trisomías) o segmentarias pérdidas o duplicaciones, mínimo 15% del cromosoma afectado), y las disomías uniparentales (DUP)] y el origen parental (materno, paterno o mixto).
Análisis de resultados y estadístico
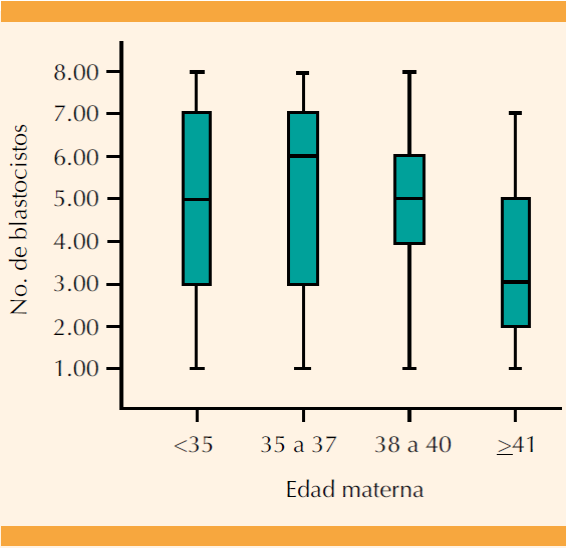
Se analizó el porcentaje de blastocistos obtenidos por ciclo de estimulación ovárica en cada uno de los diferentes límites de edad mencionados, con diagramas de caja y bigotes (BOX PLOT), y el paquete estadístico SSPS en su versión 22.0.0.0.
Se tomaron en cuenta los resultados de blastocistos aneuploides por límite de edad, para evaluar: a) la proporción de blastocistos con aneuploidias numéricas, pérdidas o duplicaciones y aneuploidias numéricas junto con pérdidas o duplicaciones del total de embriones analizados con tamizaje genético preimplantacional y b) proporción de blastocistos con aneuploidias numéricas, Del/DUP y aneuploidias numéricas junto con aneuploidias pérdidas o duplicaciones del total de embriones aneuploides. La tendencia de los datos se evaluó con un análisis de regresión lineal y no lineal, para medir la fuerza de correlación (R2) en Excel (Office 2016).
Criterios de inclusión
Blastocistos de día 5 y 6.
Resultados obtenidos de biopsias de trofoectodermo (4 a 6 células).
Pacientes con pérdida gestacional recurrente (más de 2 abortos).
Falla repetida en la implantación.
Pacientes con edad materna más o menos mayor de 35 años de edad.
Antecedentes de alteraciones cromosómicas en ciclos previos.
Antecedentes de familiares con algún síndrome o enfermedad por alteraciones cromosómicas.
Factor masculino severo.
RESULTADOS
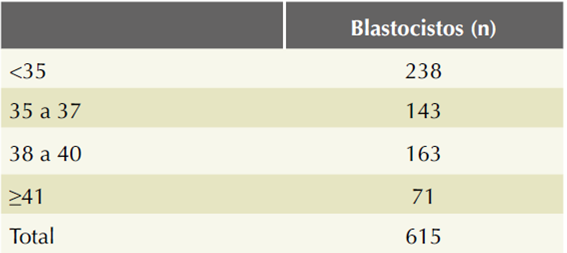
Se analizaron 615 biopsias de trofoectodermo de las que se tomaron de 4 a 6 células que se enviaron al laboratorio de Natera en Estados Unidos para analizarlas con tamizaje genético preimplantacional. Los resultados se dividieron por límites de edad de la madre. Cuadro 1
En la Figura 1 se encuentra la cantidad de blastocistos obtenidos por ciclo y evaluados con tamizaje genético preimplantacional. En el límite de edad de más menos 41 años hubo menos blastocistos que en los límites de edad de menores de 35 años, 35 a 37 y 38 a 40 años. En la misma Figura 1 puede observarse que en el límite de edad de 35 a 37 años se obtuvo la mayor cantidad de blastocistos por ciclo que en los grupos de menores de 35 años, entre 38 y 40 y más de 41 años. Además, en el rango de menores de 35 años se obtuvo menor número de blastocistos por ciclo en comparación con los grupos de edad de 35 a 37 y 38 a 40 años.
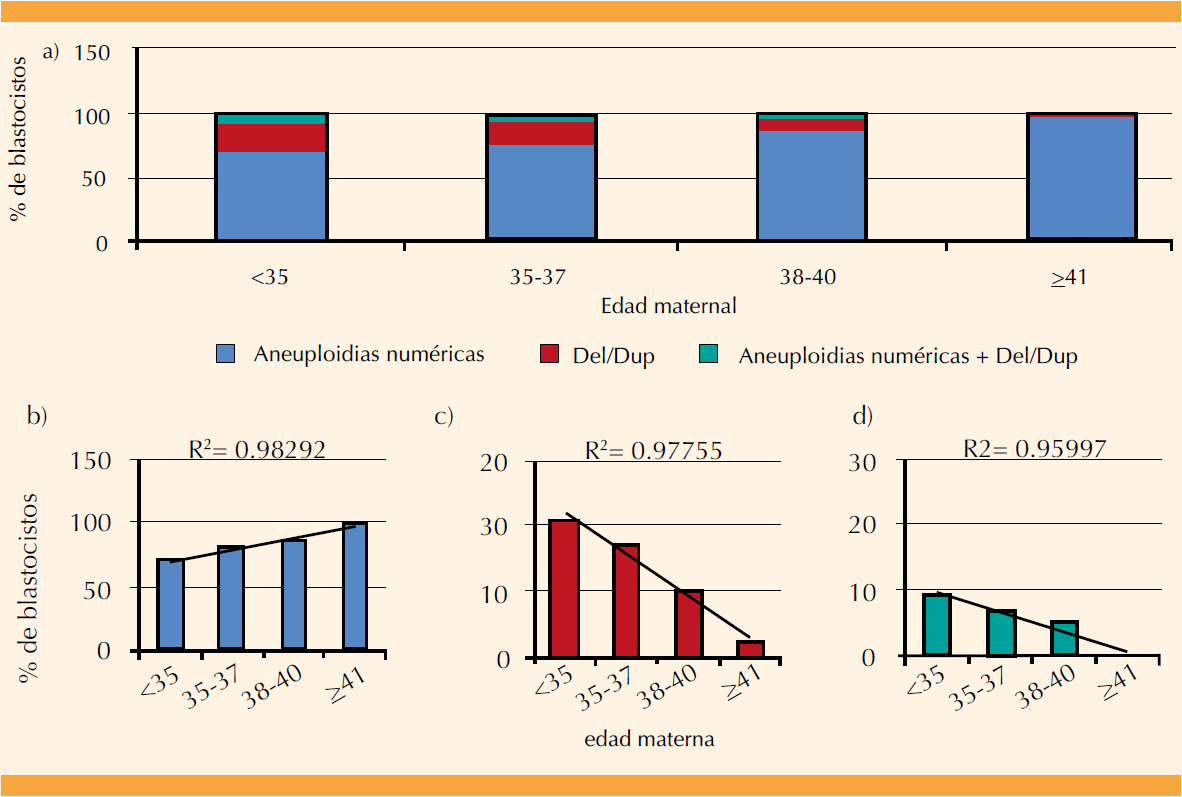
De los 615 blastocistos analizados con tamizaje genético preimplantacional, 309 (50.2%) resultaron aneuploides, con aumento directamente proporcional a la edad materna (Figura 2A). De estos 615 blastocistos, 246 (40%) tuvieron aneuploidias numéricas, 42 (6.8%) pérdidas o duplicaciones y 21 (3.4%) una combinación de aneuploidias numéricas y pérdidas o duplicaciones.

Figura 2 Porcentajes de los tipos de aneuploidias del total de blastocistos analizados con PGS, en diferentes rangos de edad materna (A): B) Aneuploidias numéricas, C) Pérdidas o duplicaciones y D) Blastocistos con una combinación de aneuploidias numéricas con pérdidas o duplicaciones.
El análisis de los resultados muestra que los blastocistos con aneuploidias numéricas aumentaron conforme mayor fue la edad materna, con una fuerte relación lineal (R2=0.98) (Figura 2 A y 2B), mientras que los blastocistos con pérdidas o duplicaciones tuvieron una tendencia a disminuir con el aumento de la edad materna, con una relación lineal de R2=0.87 (Figura 2 A y 2C). Además, cuando los blastocistos tuvieron aneuploidias numéricas junto con pérdidas o duplicaciones, éstas mostraron un tendencia a disminuir con el aumento de la edad materna; con una relación lineal débil (R2=0.59) (Figura 2 A y 2D).
En total 309 blastocistos resultaron aneuploides, de los que 246 (79.6%) tuvieron aneuploidias numéricas, 42 (13.5%) aneuploidias segmentarias y 21 (6.7%) una combinación de aneuploidias numéricas y segmentarias. Del total de aneuploidias, los embriones con la variedad numérica aumentaron conforme mayor fue la edad de la madre, con una estrecha relación lineal (R2=0.98) (Figura 3 A y 3B). Con el aumento de la edad materna los blastocistos con pérdidas o duplicaciones tuvieron una tendencia a disminuir, con una fuerte relación lineal (R2=0.97) (Figura 3 A y 3C). Cuando los blastocistos tuvieron aneuploidias numéricas y pérdidas o duplicaciones éstas mostraron una tendencia a disminuir con el aumento de la edad materna, con una fuerte relación lineal (R2=0.96) (Figura 3 A y 3D).
DISCUSIÓN
Los resultados de este estudio demuestran que las aneuploidias segmentarias se encontraron en las biopsias de trofoectodermo de embriones humanos logrados mediante fertilización in vitro.
Las ventajas del tamizaje genético preimplantacional mediante SNP microarray según el algoritmo “Parental Support”, son que identifica paralelamente las aneuploidias numéricas y las pérdidas o duplicaciones.18
Puesto que las pérdidas o duplicaciones suelen afectar un pequeño fragmento del cromosoma, no pueden identificarse mediante métodos que utilizan un solo marcador para cada cromosoma, como es el FISH u otras metodologías de microarreglos de ADN. Esto es particularmente importante porque, presumiblemente, son menos probables que resulten en un aborto como suele suceder con las aneuploidias numéricas, que pueden resultar en el nacimiento de un niño gravemente discapacitado con algún síndrome, como los de Prader Willi, Williams, duplicación de Xq27.3-q28, entre otros.19-21
Las pérdidas o duplicaciones se han reportado en el orden de 5.3 a 6% en abortos analizados con aCGH y NGS,22,23 así como en 5 de cada 10,000 nacimientos.24 Estas cifras de abortos coinciden con las aneuploidias segmentarias reportadas en blastocistos (5.8 al 15%),10,12,13 que sugieren que este tipo de alteraciones cromosómicas deben considerarse en la práctica clínica.
Nuestros resultados mostraron una tasa de pérdidas o duplicaciones de 10% del total de blastocistos analizados, similares a las publicadas por Johnson y colaboradores12 y Fragouli y su grupo.10 Además, en este estudio se evaluó la tasa de pérdidas o duplicaciones del total de embriones aneuploides, donde se observó un valor de 20%.
Faulkner y sus coautores25 observaron aneuploidias segmentarias en blastocitos en porcentajes de 5 a 42%, con una relación inversa con la edad materna, lo que coincide con nuestros datos, que con el aumento de la edad materna las pérdidas o duplicaciones en blastocistos disminuyeron. (Figuras 2 y 3) Un estudio efectuado en embriones de día 3 (blastómeros) por Rabinowitz y colaboradores11 no mostró diferencia en la tasa de aneuploidias segmentarias, al comparar dos grupos de edad materna (menores de 36 y mayores de esta edad).
Los blastocistos con solo pérdidas o duplicaciones tuvieron mayor incidencia en este trabajo, en comparación con los de pérdidas o duplicaciones o aneuploidias numéricas (Figura 2 y 3), diferente a Ravinowitz y sus colegas,11 que reportaron mayor tasa de embriones de día 3 con pérdidas o duplicaciones, asociados con otros tipos de aneuploidias. Fragouli y su grupo10 informaron que la mayor parte de las aneuploidias segmentarias suelen estar en forma de mosaico, lo que indica mayor número de embriones con aneuploidias segmentarias y numéricas.
El reciente interés en la posibilidad de identificar aneuploidias segmentarias en los embriones humanos surge de la gran cantidad de datos obtenidos mediante las nuevas tecnologías de tamizaje genético preimplantacional.26-28 La relevancia de estas alteraciones durante el desarrollo de embriones humanos sigue siendo cuestionable en los programas de tamizaje genético preimplantacional, por lo que estas alteraciones cromosómicas representan una importante área de investigación, sobre todo cuando se trata de identificar la causa de la falla en la implantación, abortos espontáneos y embriones con alguna enfermedad o síndrome, al momento de transferir embriones considerados euploides.
La debilidad de este estudio radica en que los datos obtenidos representan una pequeña población. Sin embargo, nuestros resultados describen una tendencia que motiva a ampliar el estudio y conocer la relevancia clínica de estas alteraciones cromosómicas durante un ciclo de fertilización in vitro con tamizaje genético preimplantacional.
CONCLUSIONES
Las pérdidas o duplicaciones son comunes y suceden en gran porcentaje de embriones en estadio de blastocisto; son inversamente proporcionales a la edad materna. La alta frecuencia de estas alteraciones cromosómicas destaca su importancia en un ciclo de FIV, que representa un área de investigación para conocer su relevancia clínica e integrarlo a la asesoría genética de los pacientes, antes y después del tamizaje genético preimplantacional.











 nueva página del texto (beta)
nueva página del texto (beta)