ANTECEDENTES
Con el mejoramiento de las técnicas de reproducción asistida y de la criopreservación en la última década, se han incrementado los ciclos de transferencia de embriones congelados-descongelados. En 1983 Trouson y Mohr, en Australia, realizaron la primera transferencia de un embrión humano descongelado y el primer nacido vivo por esta técnica se informó en los Países Bajos en 1984. Esta técnica de reproducción asistida ha venido aumentando, considerablemente, y con ello la tasa de nacidos vivos.1
La transferencia embrionaria se efectuó, en un inicio, como complemento de las trasferencias de embriones en fresco, cuando éstas se cancelaban por algún padecimiento, como el síndrome de hiperestimulación ovárica, elevación prematura de progesterona, cuando había necesidad de un diagnóstico genético preimplantación o debido a la falta de sincronía entre el desarrollo endometrial y embrionario.2 El fundamento de esta técnica era lograr mayor tasa de nacidos vivos y disminuir el síndrome de hiperestimulación ovárica. En la actualidad existe la modalidad de tratamiento denominada Freeze-all policy, que consiste en congelar todos los embriones y seleccionar los de mejor calidad para, posteriormente, transferirlos selectivamente en un ciclo natural o artificial de preparación endometrial. Esta modalidad terapéutica ha mejorado los resultados de los ciclos de fertilización in vitro y entre sus ventajas están: reducir el riesgo de síndrome de hiperestimulación ovárica, mejorar los resultados del ciclo en caso de luteinización prematura u otra complicación, criopreservar toda la cohorte de embriones para, posteriormente, transferirlos en ciclos con preparación endometrial para transferencia embrionaria, realizar transferencia selectiva del embrión de mejor calidad. Todo esto ha favorecido el incremento de las tasas de embarazo y de nacidos vivos.3,6
La creciente evidencia en la bibliografía médica muestra que la estimulación ovárica controlada en los ciclos de transferencia embrionaria en fresco produce concentraciones suprafisiológicas de estrógeno y progesterona que, a su vez, alteran la expresión de receptores de progesterona en el endometrio, que influyen, aparentemente, de forma negativa en la receptividad e implantación embrionaria.
En los ciclos de transferencia embrionaria, a través de la preparación endometrial y sin las concentraciones hormonales suprafisiológicas de un tratamiento de estimulación ovárica controlada; el crecimiento endometrial ocurre de manera más fisiológica y el éxito del proceso de implantación dependerá de factores, como: la calidad del embrión, la interacción endometrio-embrión y la receptividad endometrial.
El primer embarazo reportado por criopreservación, a través de la congelación lenta con un crioprotector, ocurrió en 1986; sin embargo, con el tiempo, esta técnica ofreció bajas tasas de supervivencia de los embriones, ovocitos y de embarazo.
La idea de vitrificar se describió, inicialmente, en 1860 y fue retomada por Luyet, en 1937; 50 años más tarde (1985) Rall y Fahy describieron una alternativa potencial a la vitrificación, que fue la congelación lenta, que consiste en solidificar una sustancia por enfriamiento hasta formar un estado vidrioso por elevación extrema de su viscosidad.
La técnica actual de vitrificación implica la exposición de la célula a un volumen reducido de crioprotectores a elevadas concentraciones, seguido de congelación rápida en nitrógeno líquido, con lo que se solidifica y el agua intracelular no tiene tiempo para formar cristales. Así, su principal ventaja es evitar la formación de hielo en la blastómera y, con ello, la destrucción del embrión.4
Otro factor determinante para la supervivencia de los embriones es el medio de soporte, que es diferente al medio de cultivo, donde técnicamente se realiza la vitrificación. En la Unidad de Reproducción Asistida, donde se efectuó esta investigación, el que se utilizó fue Cryotop (Criotech® Lab), que usa como medio de soporte una lámina fina que contendrá al embrión durante el proceso de congelación y descongelación, protege a las células del daño físico y de la contaminación durante su almacenamiento en nitrógeno líquido. Este método ha demostrado, incluso, 99% de supervivencia del embrión y ha permitido la vitrificación en diferentes días de desarrollo embrionario (día 3, 4 y 5), seleccionar los embriones de mejor calidad, transferencia selectiva de un solo embrión y criopreservar para futuros ciclos de transferencia embrionaria. La vitrificación se ha convertido en una técnica de rutina en los laboratorios de fertilización in vitro.5
Con el mejoramiento de la técnica de criopreservación a través de la vitrificación, se han reportado pocos o ningún defecto en el embrión ni consecuencias a la descendencia.6
La transferencia embrionaria puede llevarse a cabo en un ciclo natural (idealmente en las pacientes con ciclos menstruales regulares de 28 a 32 días) o en un ciclo de preparación endometrial, con suplemento farmacológico de estrógenos y progesterona, incluidos los agonistas de GnRH para prevenir el pico prematuro de LH y ayudar a la sincronización del crecimiento endometrial.7
En un ciclo natural, la preparación endometrial depende de la producción de esteroides sexuales endógenos que produce el folículo en desarrollo, cuyo crecimiento se monitorea por ultrasonido y el pico de LH (hormona luteinizante) a través de cintas urinarias reactivas para LH o a través de la determinación sérica. La transferencia embrionaria puede cancelarse si hay un desarrollo ineficiente del folículo que sintetizará los esteroides sexuales endógenos o si el endometrio tiene un desarrollo insuficiente; se estima que un endometrio trilaminar ≥ 7 mm es ideal para la transferencia embrionaria.8
En los ciclos con preparación endometrial puede recurrirse a la complementación con estrógenos y progesterona, con o sin agonistas de GnRH. La complementación con estrógenos en ciclos con transferencia embrionaria tiene como uno de los principales objetivos: bloquear el eje hipotálamo hipófisis ovario y, con ello, evitar el reclutamiento, el desarrollo folicular y la ovulación; además de ayudar al crecimiento del endometrio. Una dosis inicial de 4 mg/día con el posterior incremento de ésta, en la mayoría de los casos es suficiente para lograr este efecto. Durante la fase lútea el estradiol no genera mayor incremento del grosor endometrial; sin embargo, tiene la vital función de inducir la síntesis de receptores de progesterona.9
La complementación de la fase lútea con progesterona es decisiva para la implantación y como apoyo durante parte del primer trimestre del embarazo.
Con los agonistas de GnRH hay supresión hipofisaria, que puede extenderse hasta dos semanas posteriores a la última aplicación; esto implica la producción inadecuada de LH y, subsecuentemente, una síntesis insuficiente de progesterona que se traduce en un endometrio con baja o nula receptividad embrionaria; de ahí la necesidad de suplementar los ciclos de transferencia embrionaria con progesterona. El efecto fisiológico de la progesterona en el endometrio consiste en modificar histológica, morfológica y funcionalmente el endometrio de proliferativo a endometrio secretor, con ello se crea un ambiente anatómico y bioquímico idóneo para la interacción embrión-endometrio. A este periodo se le conoce como ventana de implantación, que sucede entre los días 22 y 24 de un ciclo ideal de 28 días.10
Para la complementación de la fase lútea existen preparaciones orales, parenterales y vaginales de progesterona, estas últimas son tan eficaces como la vía parenteral, es de rápida absorción y la vía mejor tolerada por la paciente. Se recomienda una dosis promedio de 200 mg cada 8 horas, aunque la dosis ideal aún no está establecida.11
Entre los efectos secundarios indeseados se han reportado: cefalea, fatiga, irritación, descarga vaginal y dispareunia.
Aparte de la complementación de la fase lútea, existen otras variables que influyen en el éxito de la transferencia embrionaria como: la calidad embrionaria, la receptividad endometrial, el número de embriones transferidos, el IMC y, por supuesto, el protocolo de preparación endometrial descrito.
Por lo que se refiere a la calidad embrionaria, los embriones con buena calidad antes de la congelación o vitrificación tienen mayor supervivencia al ser descongelados y mejores posibilidades de implantación. Existen varias clasificaciones para determinar la calidad embrionaria; una de las más usadas y la que se sigue en el laboratorio de embriología de la Unidad de Reproducción Asistida, donde se efectuó esta investigación, es la clasificación de Lucinda Veeck, que clasifica en cinco grados la calidad embrionaria.12
En una reciente revisión sistemática, donde compararon las tasas de implantación y de embarazos clínicos en ciclos en fresco versus ciclos con transferencia embrionaria, se encontró mayor tasa de implantación y de embarazo clínico en estos últimos. Estos resultados se explican por la mayor sincronía entre el desarrollo embrionario y el endometrial.13
Entre las ventajas de los ciclos de transferencia embrionaria están los mejores resultados obstétricos y perinatales, en comparación con la transferencia de embriones en fresco, así como reducción del síndrome de hiperestimulación ovárica, de la tasa de embarazos múltiples, los ingresos a las unidades de terapia intensiva neonatal y reducción de la morbilidad y mortalidad materna y perinatal. Estos resultados se asemejan a los logrados en embarazos concebidos de forma natural.14
En este estudio se hace una descripción detallada de los últimos seis años de experiencia institucional con los ciclos de transferencia de embriones y ovocitos desvitrificados, con insistencia en el análisis de las tasas de embarazo, el tipo de preparación endometrial, el grosor endometrial alcanzado, la dosis de estradiol, los días de complementación y la calidad embrionaria.
MATERIALES Y MÉTODOS
Se trata de un estudio restrospectivo, observacional, descriptivo, efectuado en pacientes del servicio de Reproducción Asistida del Instituto Nacional de Perinatología Isidro Espinosa de los Reyes, entre enero 2010 y diciembre de 2015, a quienes se efectuaron ciclos de transferencia de embriones desvitrificados. Las pacientes tenían embriones en reserva, resultado de un ciclo previo de estimulación ovárica controlada, cuya transferencia fue cancelada por riesgo de síndrome de hiperestimulación ovárica, con elevación de la progesterona sérica mayor a 2.0 ng/dL el día de la aplicación de la HCG, pacientes con el hallazgo de líquido en la cavidad endometrial al final de la preparación endometrial y con alteraciones en la cavidad endometrial, como pólipos o miomas submucosos.
Las pacientes incluidas cumplieron con el siguiente protocolo de estudio: cavidad uterina normal documentada por histeroscopia o sonohisterografía en los últimos 12 meses previos a la transferencia embrionaria, panel viral que incluía estudios para TORCH, VIH, sífilis, hepatitis B y C y VDRL, exudado cervicovaginal y cultivos especiales para Chlamydia, Mycoplasma y Ureaplasma urealyticum que se reportaron negativos en los últimos seis meses.
Se excluyeron del análisis las pacientes que no llegaron a la transferencia por desarrollo endometrial inadecuado (menos de 7 mm), a pesar de la preparación endometrial farmacológica.
La criopreservación de embriones se efectuó mediante la técnica de vitrificación, con medio de soporte Cryotop (Criotech® Lab). La calidad embrionaria al momento de la transferencia se evaluó con la escala de Lucinda Veek12 que clasifica al embrión del I al V, dependiendo de la estructura y simetría de la blastómera y el grado de fragmentación.
Como coadyuvante de la preparación endometrial, la mayoría de las pacientes recibieron un análogo de GnRH: acetato de leuprolide (Lucrin Kit®, Abbott de México) en esquema largo y al resto se le indicó un esquema modificado, sin análogo de GnRH. El agonista de GnRH se administró a partir del día 21 del ciclo menstrual, previo a una dosis de 1 mg por vía subcutánea, cada 24 horas, hasta que se comprobó la desensibilización hipofisaria (concentraciones de FSH y LH menor a 5 UI/mL); posteriormente, se redujo la dosis a 0.5 mg, casi siempre a partir del primer día de menstruación y se continuó hasta el inicio de la complementación con progesterona.
Por lo que se refiere al protocolo de preparación endometrial, las pacientes se trataron con 17 β estradiol por vía oral (Primogyn®, Schering) en un esquema con aumento progresivo de la dosis a partir del día 1 del ciclo menstrual; en la mayoría se indicó el siguiente esquema: del día 1 al 4 del ciclo se administraron 4 mg al día por vía oral; del día 5 al 8 del ciclo 6 mg y, a partir del día 9, la dosis se incrementó a 8 mg/día hasta, aproximadamente, el día 12 en que se suspendió el agonista de GnRH y se bajó la dosis a 6 mg/día o se continuó con los 8 mg/día hasta que se realizó la prueba de embarazo.
El resto de las pacientes inició el esquema con 2 mg con incremento hasta alcanzar 6 mg/día.
En el caso de las pacientes que no alcanzaron en el día 10 del ciclo un grosor endometrial mínimo de 7 mm, se agregó estradiol en parches transdérmicos de 50 µg (Evorel®, Janseen Cilag), cada 72 horas hasta la prueba de embarazo, en la mayoría de los casos.
El soporte de fase lútea se hizo con progesterona micronizada (Geslutin®, Asofarma) por vía vaginal a razón de 200 mg cada 8 horas, a partir del día 12 del ciclo en que se suspendió el agonista; se siguió administrando la dosis de 17 β estradiol (Primogyn®) de 6 u 8 mg/día, según el esquema descrito; ambos tratamientos se continuaron, incluso, hasta completar el primer trimestre del embarazo.
Los criterios del laboratorio de embriología de la Unidad de Reproducción Asistida para la selección del día de vitrificación según el desarrollo embrionario (día 3 o día 5) dependen de la edad de la paciente, el número embriones y la calidad embrionaria.
No se tuvieron criterios de selección en cuanto al día en que se transfirieron los embriones desvitrificados; la transferencia se efectuó en los mismos días 3 o 5, dependiendo del día de desarrollo embrionario en que los embriones fueron vitrificados.
En cuanto a la complementación con progesterona, se indicaron de 4 a 5 días de complementación previos a la transferencia embrionaria cuando los embriones se encontraban en su tercer día de desarrollo y, en los casos en que los embriones habían sido vitrificados en el día cinco de desarrollo (blastocisto); se administraron siempre 5 días de complementación con progesterona previos a la transferencia, que se efectuó mediante guía por ultrasonido endovaginal.
Seguimiento
La fracción β hCG se cuantificó 14 días después de la transferencia embrionaria, cuando la prueba fue positiva se continuó con la complementación de estradiol y progesterona, hasta evidenciar el saco gestacional con embrión con latido cardiaco en su interior, o sea, un embarazo clínico intrauterino.
Se consideró embarazo viable al que superó las 28 semanas de gestación.
La tasa de implantación se calculó con la relación del número de sacos gestacionales observados por ultrasonido entre el número de embriones transferidos.
La tasa de embarazo clínico se definió como el porcentaje de pacientes a quienes se les comprobó saco gestacional intrauterino y embrión con latido cardiaco en su interior, confirmado por ultrasonido entre el número de pacientes a quienes se les realizó transferencia embrionaria.
La tasa de nacidos vivos se calculó con la relación del número de pacientes que tuvieron un recién nacido vivo viable (28 semanas de gestación) entre el número de pacientes a quienes se les realizó transferencia embrionaria.
La tasa de aborto espontáneo se obtuvo con la relación del número de embarazos intrauterinos perdidos hasta la semana 20 de gestación entre el número de pacientes a quienes se les realizó transferencia embrionaria.
RESULTADOS
Se analizaron 213 ciclos de pacientes con embriones vitrificados. El promedio de edad de las pacientes fue de 33.4 ± 3.5 años; 46.5% de ellas tenían entre 30 y 35 años de edad y 42.5% más de 35 años. La edad de la pareja tuvo una media de 36.3 ± 5.1 años.
El 53.3% de las pacientes tuvo IMC de 25.4 ± 0.66 kg/m2, seguido de 36.6% con sobrepeso. El tiempo de infertilidad fue de 6.2 ± 3.8 años en 59.2% de las pacientes y 52.1% de ellas tenía infertilidad secundaria. La principal causa de infertilidad se debió a factor tuboperitoneal en 38.5% de las pacientes, seguido por las de etiología mixta en 36.5% de ellas. Cuadro 1
En lo que al esquema de preparación endometrial se refiere, 82.6% (n= 176) recibió más de 12 días de complementación de 17 β-estradiol previo a la transferencia embrionaria, utilizando el 93.9% (n= 200) de las pacientes solo la vía oral y el resto la combinación de vía oral y transdérmica.
En cuanto a la dosis de complementación de 17 β estradiol, 97.2% (n=207) ocupó una dosis de 72 mg (en esquema ascendente de 4/6/8 mg) para la preparación endometrial. El 98.1% (209 ciclos) ingresó a un protocolo largo de agonista de GnRH. Respecto a la complementación con progesterona 100% (213 ciclos) recibieron una dosis de 600 mg/día.
El 74.6% (159 ciclos) recibieron ≤ 4 días de complementación con progesterona previo a la transferencia embrionaria y el 25.4% (54 ciclos) recibió más de 4 días de complementación con progesterona. (Figura 1)
A todas las pacientes se les realizó cuantificación del nivel de estradiol durante la fase de complementación previa a la transferencia embrionaria, siendo la media de éste entre el día 5 a 7 del ciclo de 295.1 ± 141.9 pg/dL, en el día 9 de 383.8 ± 219.6 pg/dL y en el día 12 de 507.3 ± 216.2 pg/dL. Cuadro 2
El 70.4% (n=150) de las transferencia embrionaria se realizaron entre el día 15 y 16 del ciclo de preparación endometrial y el 29.6% (n=63) se realizó a partir del día 17.
En cuanto al número de embriones transferidos, en 127 ciclos (59.6%) se transfirieron 2 embriones, seguido de 71 ciclos (33.3%) donde se transfirieron 3 embriones. Respecto a la calidad embrionaria, de los embriones transferidos, en el 64.8% de los ciclos (n=138) fueron embriones calidad tipo II y en el 17.4% (n=37) calidad tipo III. Al momento de ser transferidos los embriones, el 86.4% (n=184) de éstos estaban en día 3 de desarrollo embrionario. (Cuadro 3)
La fracción β hCG fue positiva en el 16% de los ciclos transferidos. La tasa de implantación fue de 19.7% y la de embarazo clínico de 12.2%. El embarazo viable se alcanzó en el 10.3% y la tasa de aborto fue 3.4%.
En cuanto a la tasa de embarazo clínico de acuerdo al esquema de complementación de 17 β-estradiol, ésta fue de 16.6 y 12% respectivamente en el esquema de 72 mg (en esquema de 4, 6, 8 mg/día) y 48 mg (en esquema de 2, 4, 8 mg/día), p = 0.73
En lo que respecta a la vía de administración del 17 β estradiol; la tasa de embarazo clínico en las pacientes que recibieron sólo vía oral y las que recibieron vía oral y transdérmica fueron de 12 y 15.3% respectivamente, p = 0.71.
Aquellas pacientes que usaron complementación de progesterona más de 4 días previo a la transferencia embrionaria, alcanzaron una tasa de embarazo clínico de 13.5% mientras que la tasa de embarazo en las pacientes que usaron menos de 4 días de complementación fue de 7.8, p = 0.27.
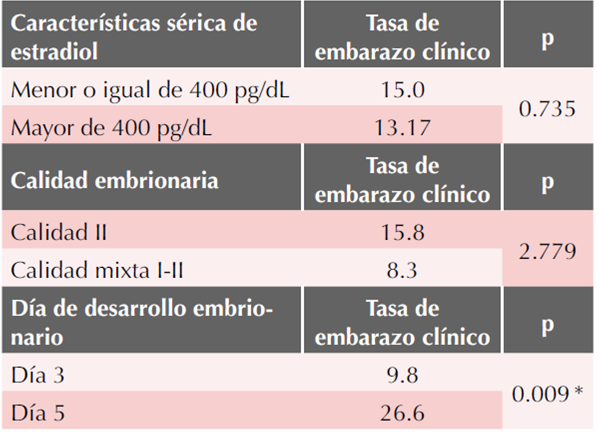
Durante el día 12 de preparación endometrial se cuantifico el nivel sérico de estradiol, en aquellas pacientes que alcanzaron un nivel mayor de 400 pg/dL alcanzaron una tasa de embarazo clínico del 13.17%, p = 0.73.
De acuerdo al grosor endometrial el día de inicio de la complementación con progesterona, la tasa de embarazo clínico fue de 12.1 vs 12.5% en las pacientes con grosor ≥ 7 mm vs menor de 7 mm, p = 0.96.
Por lo que se refiere a la calidad embrionaria, las mejores tasas de embarazo clínico se lograron con la transferencia de embriones calidad II (15.8%) y con la transferencia de embriones mixtos calidad I y II (8.3%). Cuadro 4
Finalmente, respecto al día de desarrollo embrionario, con la transferencia de embriones en día 5 de desarrollo (blastocisto) se logró una tasa de embarazo clínico de 26.6 vs 9.8% con la transferencia de embriones en día 3 de desarrollo, se consiguió significación estadística (p=0.009).
DISCUSIÓN
En este estudio se analizó la experiencia en el Instituto Nacional de Perinatología Isidro Espinosa de los Reyes con transferencias de embriones desvitrificados. Se incluyeron 213 ciclos con embriones desvitrificados. De estos ciclos, 96.4% fueron producto de embriones destinados a vitrificarse porque quedaron como excedentes de un ciclo de transferencia embrionaria en fresco. Por lo general se transfieren dos embriones y si la paciente tuvo mayor número de embriones que lograron progresar, éstos se vitrifican y se almacenan en sus respectivos tanques; 4.6% de los ciclos correspondieron a las pacientes que ingresaron a FIV y los embriones no se pudieron transferir en fresco por diversas condiciones médicas: síndrome de hiperestimulación ovárica, elevación sérica de progesterona el día del disparo (≥ 2 ng/dL) o alteraciones en la calidad endometrial, como líquido en la cavidad endometrial o distorsiones de la misma por miomas o pólipos.
Lo antes expuesto tiene como propósito aclarar que esta experiencia institucional dista mucho de lo que se hace en la actualidad en diversos centros de reproducción asistida conocido como “congelar todo”. Esta técnica consiste en realizar una estimulación ovárica controlada, individualizando el protocolo para cada paciente. Una vez efectuada la captura ovular, se hace la fertilización in vitro y se congelan todos los embriones para ser transferidos en un futuro ciclo de preparación endometrial y de forma selectiva, es decir, se puede transferir un solo embrión: el de mejor calidad. Esta técnica tiene como objetivo transferir embriones en un microambiente libre del efecto nocivo de las altas concentraciones de estradiol que se producen en los ciclos en fresco y que pueden alterar la ventana de implantación, entre otros.
De las técnicas de criopreservación, la vitrificación ha venido a revolucionar los resultados de los ciclos con transferencia de embriones congelados. Consiste en solidificar una sustancia por enfriamiento rápido, eso hace pasar de un estado líquido a un estado vidrioso por elevación extrema de su viscosidad (de ahí su nombre de vitrificación). Este proceso ocurre de forma rápida, evita la formación de cristales dentro de la blastómera, garantiza menor daño al embrión y mejora la supervivencia al ser descongelados. Con la transferencia de embriones desvitrificados se obtienen otras ventajas: disminuyen las posibilidades de síndrome de hiperestimulación ovárica, se reducen los embarazos múltiples, es posible la transferencia en otro ciclo de preparación endometrial cuando en un ciclo en fresco se obtuvo una mala repuesta endometrial (sangrado, pólipos, miomas). Esto aumenta las tasas de embarazos y reduce los costos.15
Los análogos de GnRH son fármacos decisivos en el protocolo de preparación endometrial para transferencia embrionaria, se indican para producir desensibilización hipofisaria y evitar la luteinización prematura; muchos autores recurren a ellos, como se hizo en este estudio, en el que se administraron desde el día 21 de un ciclo menstrual previo a la preparación endometrial.16
Para llevar a cabo la transferencia embrionaria en los ciclos descritos, en todas las pacientes se observó un protocolo de preparación endometrial: se utilizó valerato de estradiol (Primogyn) y el esquema que predominó en la mayoría de los ciclos fue con una dosis de 72 mg (esquema ascendente de 4/6/8 md/día). Este esquema ha sido ampliamente utilizado por otros autores para la preparación endometrial.15
La complementación de fase lútea es un paso fundamental previo a la transferencia embrionaria, en nuestro estudio se administraron más de cuatro días de complementación con progesterona micronizada antes de la transferencia embrionaria, con una dosis de 600 mg al día de forma similar al ensayo clínico realizado por Ferrer Molina.17
La concentración sérica de estradiol que se cuantifica durante el protocolo de preparación endometrial juega un papel importante, es uno de los factores determinantes del desarrollo del grosor endometrial y de la implantación embrionaria; algunos autores consideran que una concentración de estradiol superior a 200 pg/mL antes de la transferencia embrionaria se asocia con mayor tasa de embarazo clínico.19
De acuerdo con lo publicado por varios autores, el grosor endometrial es uno de los factores determinantes para la implantación; el grosor endometrial mínimo de 7 mm es favorable para la implantación en pacientes con preparación endometrial para transferencia embrionaria. En nuestro estudio el grosor endometrial no obtuvo significación estadística; sin embargo, esta característica sigue siendo un tema de controversia.17,18
La calidad embrionaria es un factor determinante para el éxito de la transferencia de embriones desvitrificados, en nuestro estudio predominó la transferencia de embriones calidad II, Gutiérrez Frusch y su grupo transfirieron embriones de buena calidad, y obtuvieron tasas más elevadas de embarazos clínicos.20
Sin duda alguna, el día de desarrollo embrionario es otra característica fundamental para aumentar las tasas de embarazos clínicos; en nuestro estudio esta variable fue estadísticamente significativa; esta característica resultó igual de significativa en el estudio de González y colaboradores.21
CONCLUSIONES
Se describió la experiencia en la transferencia de embriones desvitrificados durante los últimos seis años; al parecer, existen al menos tres factores determinantes para alcanzar el éxito con esta técnica de reproducción asistida: calidad embrionaria, día de desarrollo embrionario y grosor endometrial. Hace falta mayor cantidad de ciclos para poder determinar la significación estadística de los factores predictores para incrementar la tasa de nacidos vivos.











 nueva página del texto (beta)
nueva página del texto (beta)