ANTECEDENTES
La opción más utilizada para evaluar la infertilidad masculina es el análisis seminal, que aporta información de la calidad de la espermatogénesis. En la actualidad se dispone de un método internacional para evaluar los parámetros seminales, descrito en la quinta edición del Manual de la OMS.1 Los límites inferiores acordados en esa edición son: volumen seminal ≥ 1.5 mL, concentración espermática ≥ 15 millones/mL, movilidad progresiva ≥ 32%, vitalidad ≥ 58%, morfología espermática normal ≥ 4% y menos de un millón de leucocitos por mL. La desviación de uno o más parámetros seminales (por ejemplo, un recuento espermático bajo, movilidad escasa o abundantes formas anormales) es indicativa de probable infertilidad en la pareja con factor masculino.2
Durante las últimas décadas, el análisis seminal convencional ha recibido muchas críticas e, incluso, algunos autores lo han catalogado como obsoleto, sobre todo después de la introducción de técnicas como la inyección intracitoplásmica de espermatozoides (ICSI). No obstante, la mayoría de expertos en el campo de la andrología coincide en que el análisis básico del semen es, y seguirá siendo, el estudio principal y decisivo en la evaluación de la infertilidad masculina.
Se estima que alrededor de 15% de los hombres con un perfil seminal normal contribuye a la infertilidad de la pareja.3-6 Esto podría atribuirse a la incapacidad del análisis seminal convencional de revelar la causa de la infertilidad masculina. Por esto es necesario efectuar análisis más especializados que permitan investigar a nivel molecular la integridad funcional del espermatozoide.
Hace poco se demostró que el daño en el ADN espermático se relaciona con resultados adversos en las técnicas de reproducción asistida. Diversos estudios asocian fragmentaciones elevadas del ADN espermático con bajas tasas de fertilización,7,8,9 de desarrollo embrionario,10,11 de implantación,4,12,13,14 bajas tasas de embarazo6,8,13 y elevadas tasas de abortos y anomalías congénitas.4,6,12,15 Existen varias pruebas que permiten analizar la cromatina espermática y, aunque la metodología para cuantificar el daño en el ADN espermático difiere entre ellas, los estudios comparativos han demostrado resultados de fragmentación parecidos con las pruebas más comúnmente utilizadas, como: TUNEL, COMETA, SCSA (Sperm Chromatin Structure Assay) y el test SCD (Sperm Chromatin Dispersion).4,6,13,16 Sin embargo, los estudios efectuados hasta la fecha, que correlacionan los parámetros seminales con la fragmentación del ADN espermático, han mostrado resultados muy controvertidos.5,17-22 Esto se podría atribuir a la variabilidad en el método utilizado y a los diferentes valores de normalidad considerados en las distintas ediciones del Manual de la OMS.
En la mayor parte de los estudios publicados, la fragmentación del ADN espermático se ha relacionado con la calidad espermática, con base en los tres parámetros clásicos de calidad seminal: concentración, movilidad y morfología. Sin embargo, todo indica que no existe un estudio que haya tenido en cuenta el total de alteraciones seminales encontradas en el seminograma.
El principal objetivo de este estudio consiste en analizar la relación entre los parámetros obtenidos del análisis seminal (volumen, concentración, movilidad, leucocitos, vitalidad y morfología) y el resultado del análisis de la fragmentación del ADN. El objetivo secundario: valorar el uso del seminograma como predictor de fragmentación espermática.
MATERIALES Y MÉTODOS
Estudio retrospectivo y observacional efectuado en los hombres que acudieron, entre febrero de 2012 y abril de 2016, al Instituto de Ciencias en Reproducción Humana Vida debido a problemas de fertilidad. A todos se les realizó el análisis seminal conforme a lo señalado en la quinta edición del Manual de la OMS y el test de dispersión de la cromatina espermática, con un equipo Halosperm® (Halotech DNA SL). Todas las muestras se obtuvieron por masturbación después de 2 a 7 días de abstinencia sexual. Cada muestra se recolectó en un recipiente de plástico, estéril, de boca ancha y almacenada en una incubadora a 35ºC durante máximo 30 minutos para permitir la licuefacción. Enseguida se procedió a realizar el seminograma y la valoración del grado de fragmentación del ADN espermático de la muestra seminal mediante el equipo de Halosperm® siguiendo las instrucciones especificadas por el fabricante. El Halosperm® es un test que permite valorar la fragmentación del ADN con base en la capacidad de desnaturalización y dispersión de la cromatina del espermatozoide. La cantidad de dispersión es inversamente proporcional al nivel de daño al ADN.
A grandes rasgos, las muestras se mezclaron con agarosa líquida y se fijaron en portaobjetos pretratados. Después se refrigeraron y se colocaron en una solución desnaturalizante y de lisis. A continuación, las muestras se tiñeron con el colorante Wright y se valoraron contando 500 espermatozoides por muestra, siguiendo los criterios de Fernández y colaboradores.23 Cada uno de los 500 espermatozoides se clasificó en espermatozoide con ADN fragmentado (con halo pequeño, sin halo o degenerados) y no fragmentado (espermatozoide con halo mediano o grande). El índice de fragmentación del ADN (DFI) se calculó de la siguiente manera: número de espermatozoides fragmentados x 100 divididos entre 500. Por último, los resultados del Halosperm® se reportaron como fragmentación del ADN espermático normal en los casos de un índice de fragmentación menor de 15%, fragmentación moderada cuando el índice de fragmentación del ADN fue de 15 a 30% y fragmentación crítica cuando el índice de fragmentación fue mayor de 30%.24-27
El total de parámetros alterados en el análisis seminal se numeró a partir de 0, en el caso de los seminogramas sin ninguna alteración (normozoospermia) hasta 6 en el caso de tener todos los parámetros alterados (hipo-hiperespermia, oligozoospermia, astenozoospermia, leucocitospermia, necrozoospermia y teratozoospermia).
Para el análisis estadístico se utilizó el programa SPSS (Statistical Package for the Social Sciences) versión 17.0. Se analizaron las distribuciones de las variables y, en los casos en que fue necesario, se normalizaron mediante transformación logarítmica. Las diferencias entre grupos se analizaron con análisis de varianza ANOVA y el análisis post-hoc de Bonferroni. Las relaciones entre las variables se estudiaron con la correlación de Pearson y se obtuvieron las estimaciones del riesgo (OR) mediante la realización de tablas de contingencia. Las correlaciones y las diferencias entre medias se consideraron significativas cuando fueron menores de 0.05.
RESULTADOS
Se incluyeron 206 hombres con edad media de 37.8 ± 7.5 años y media de 4.2 ± 1.2 días de abstinencia en el momento de depositar el eyaculado. Las muestras seminales tuvieron un volumen medio de 3.0 ± 1.6 mL, pH medio de 7.6 ± 0.2, leucocitos de 1.3 ± 0.4 x 106/mL, concentración espermática de 43.6 ± 38.3 x 106/mL, movilidad progresiva del 48.8 ± 23.3%, vitalidad de 69.7 ± 19.5% y media de 3.9 ± 2.5% de espermatozoides morfológicamente normales. La media de parámetros seminales alterados fue de 1.6 ± 1.3 con un mínimo de 0 alteraciones a un máximo de 5. No se observó ningún individuo con todos los parámetros seminales alterados. La media del índice de fragmentación del ADN del grupo de estudio fue de 17 ± 15.7%; la fragmentación mínima fue 2.4% y y la máxima de 94%. Cuadro 1
Los pacientes de este estudio acudieron a la clínica de reproducción por problemas de fertilidad con su pareja. De los 206 pacientes incluidos y a quienes se realizó el seminograma y el test de fragmentación del ADN, 43 (20.9%) fueron normozoospérmicos y 163 (79.1%) tuvieron algún parámetro seminal alterado. Entre los pacientes normozoospérmicos, 35 (81.4%) resultaron con fragmentación del ADN espermático normal, 8 (18.6%) con fragmentación moderada y ninguno mostró fragmentación crítica. De los 163 pacientes con al menos un parámetro del seminograma alterado, 92 (56.4%) tuvieron una fragmentación del ADN normal, 49 (30.1%) fragmentación moderada y 22 (13.5%) resultaron con fragmentación crítica. En los seis pacientes con cinco parámetros alterados en el seminograma, tres mostraron una fragmentación moderada y tres una fragmentación crítica. No hubo ningún paciente con cinco alteraciones seminales con fragmentación normal.
Mediante el análisis de varianza ANOVA se observaron diferencias significativas entre los grupos de fragmentación normal, moderada y crítica en los días de abstinencia sexual (p = 0.043), en la concentración espermática (p = 0.003), en los porcentajes de espermatozoides progresivos (p < 0.0001), espermatozoides viables (p < 0.0001), espermatozoides morfológicamente normales (p = 0.013) y en el total de alteraciones seminales (p < 0.0001). No se observaron diferencias significativas entre los grupos de fragmentación en cuanto al volumen del eyaculado y la existencia de leucocitos (p = 0.781 y p = 0.061, respectivamente). Cuadro 2
Cuadro 2 Medias obtenidas de los diferentes parámetros seminales en función de los grupos de fragmentación del ADN espermático

Mediante el análisis post-hoc de Bonferroni solo la concentración de espermatozoides, los porcentajes de progresivos, de viables y del número total de alteraciones seminales, tuvieron medias significativamente diferentes cuando se compararon entre sí cada uno de los tres grupos de fragmentación.
Para evaluar la fuerza y dirección de cada una de las variables obtenidas del análisis seminal se realizó el análisis de correlación con el índice de fragmentación del ADN. Mediante este análisis se obtuvieron los siguientes resultados: correlación estrecha entre el índice de fragmentación del ADN y el porcentaje de espermatozoides progresivos (r = -0.613, p < 0.0001; Figura 1A), y en el porcentaje de espermatozoides viables (r=-0.702, P<0.0001; Figura 1B), ambos relacionados negativamente con el índice de fragmentación del ADN. También se observó una correlación negativa e igualmente significativa con la concentración de espermatozoides, aunque en este caso la r de Pearson mostró una relación más débil entre estas dos variables (r = -0.248, p < 0.0001; Figura 1C). También se analizaron los resultados del índice de fragmentación del ADN cuando los pacientes no tuvieron ninguna alteración en el seminograma; es decir, pacientes con esperma normal, cuando tuvieron un parámetro alterado en el seminograma, cuando reportaron 2, 3, 4 y hasta 5 parámetros seminales alterados. Conforme los pacientes tuvieron mayor número de alteraciones en el seminograma, el índice de fragmentación del ADN se incrementó (Figura 1D). Concretamente, las medias de fragmentación de los pacientes con 0, 1, 2, 3, 4 y 5 alteraciones seminales totales fueron del 10.0 ± 4.9%, 13.0 ± 7.7%, 16.2 ± 12.3%, 23.1 ± 21.5%, 32.7 ± 22.8% y 50.2 ± 31.8%, respectivamente.
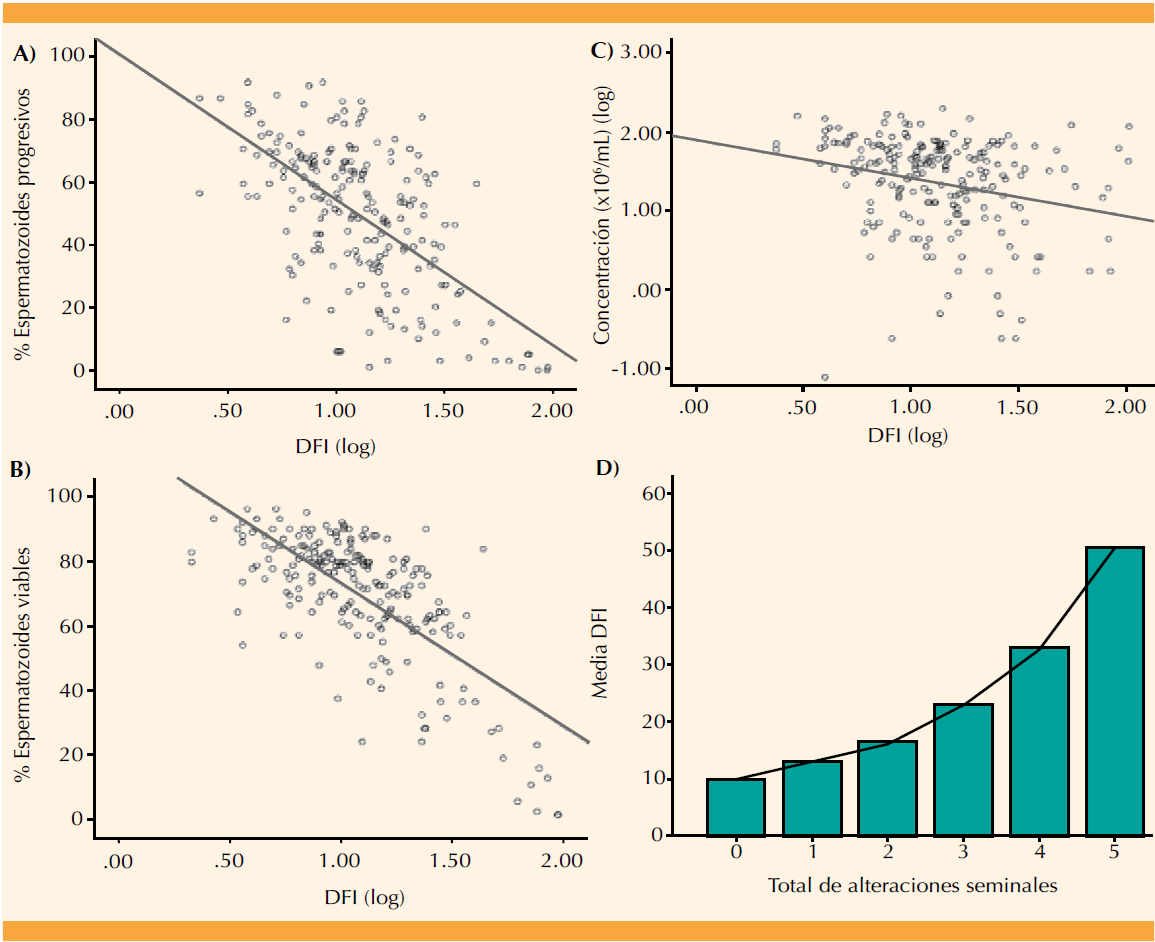
Figura 1 Correlación del DFI (log) con el porcentaje de espermatozoides progresivos (A), con el porcentaje de espermatozoides viables (B) y con la concentración espermática (log) (C). Medias del DFI por cada grupo de alteraciones seminales (D).
Para poder calcular la estimación de riesgo (OR) de las variables relacionadas con la fragmentación del ADN, cada una se transformó a variable dicotómica: fragmentación del ADN (si el índice de fragmentación del ADN es ≥ 15%, no: índice de fragmentación del ADN es menor de 15%), fragmentación crítica del ADN (si el índice de fragmentación del ADN es ≥ 30%, no: si el índice de fragmentación del ADN es menor de 30%), concentración (muestra con oligozoospermia o sin oligozoospermia), progresivos (muestra con astenozoospermia o sin astenozoospermia), viables (muestra con necrozoospermia o sin necrozoospermia) y número total de alteraciones seminales (menos de tres alteraciones seminales, tres o más alteraciones seminales). Los resultados obtenidos se muestran en el Cuadro 3.
La probabilidad de encontrar fragmentación en los pacientes con oligozoospermia es más del doble (OR= 2.2) comparada con los pacientes sin oligozoospermia y justo el doble (OR=2.0) en el caso de la fragmentación crítica. La probabilidad de encontrar fragmentación en los pacientes con astenozoospermia es 8 veces mayor (OR=8.0) que en los pacientes sin astenozoospermia y 26 veces mayor cuando hay fragmentación crítica (OR=26.2). La probabilidad de encontrar fragmentación en los pacientes con necrozoospermia es 10 veces superior (OR=10.5) comparada con los pacientes sin necrozoospermia y casi 20 veces superior en la fragmentación crítica (OR=19.8). Por último, la probabilidad de encontrar fragmentación en los pacientes con tres o más parámetros seminales alterados es 4.6 veces superior (OR=4.6) comparada con los pacientes con sólo 1, 2 o ninguna alteración en el seminograma y 14 veces mayor en el caso de la fragmentación crítica (OR=14.2).
DISCUSIÓN
Sin ninguna duda, la introducción de las técnicas de reproducción asistida ha revolucionado la atención médica de las parejas infértiles por un factor masculino. Sin embargo, en este tipo de técnicas, como el ICSI, existe el riesgo de inyectar espermatozoides con el ADN dañado y que los óvulos sean eficientemente fertilizados.28 La fertilización de un ovocito en metafase II por un espermatozoide con ADN fragmentado puede provocar defectos en el desarrollo embrionario, fallas en la implantación o incremento de las tasas de aborto.16 Por esto es decisivo identificar y diagnosticar a los pacientes con niveles elevados de fragmentación del ADN espermático para tratarlos adecuadamente antes de los procedimientos de reproducción asistida. Existe un número relativamente alto de mujeres que no pueden lograr el embarazo o que éste no llega a término a pesar de que, aparentemente, no exista algún factor femenino o masculino que pueda causar la infertilidad. En algunos de estos casos la fragmentación del ADN espermático pudiera provocar la infertilidad, que es indetectable en el análisis seminal básico.
Si bien el patrón de referencia para la detección de la fragmentación del ADN en muestras seminales es el TUNEL, el test de dispersión de la cromatina espermática es una técnica mucho más accesible para la mayor parte de los laboratorios de fertilización in vitro con una elevada sensibilidad y reproducibilidad que ha mostrado resultados similares a la técnica del TUNEL.29
Los resultados de este estudio muestran una importante relación entre algunos parámetros seminales y la fragmentación del ADN obtenida mediante el test de dispersión de la cromatina espermática. El resultado global del seminograma puede predecir el estado en que se encuentra el ADN espermático. Desde un punto de vista general, del total de pacientes que asistieron a nuestra clínica por problemas de fertilidad y que se incluyeron en este estudio, 20.9% resultaron ser normozoospérmicos y 79.1% tuvieron, al menos, un parámetro seminal alterado. Este último valor es mucho mayor al obtenido en el estudio de Godoy y colaboradores,30 en el que el porcentaje de muestras seminales con al menos un parámetro alterado de pacientes que acudieron a la evaluación inicial de la pareja infértil fue de 51%. Sin embargo, en nuestro estudio no se tuvo en cuenta la leucocitospermia ni la hiperespermia.
Con el test de dispersión de la cromatina espermática para determinar la capacidad de dispersión del ADN se observó que los pacientes normozoospérmicos tuvieron, significativamente, menos fragmentación de la cromatina que quienes resultaron con alguna alteración en el análisis seminal (10 ± 4.9% vs 27.1 ± 19.2%, respectivamente). Aunque el porcentaje de pacientes normozoospérmicos con fragmentación del ADN no fue despreciable (18.6%), no es extraño encontrar cierto número de espermatozoides fragmentados en individuos normozoospérmicos porque los mecanismos de reparación del ADN de los espermatozoides son escasos; por lo tanto, es frecuente encontrar daño en el ADN de los espermatozoides humanos, incluso en la población fértil.31 No obstante, un número elevado de espermatozoides con fragmentación en una muestra de semen es un factor que puede tener consecuencias importantes en los resultados reproductivos in vivo e in vitro. Por ello existen puntos de corte que permiten discriminar cuáles muestras seminales pueden tener un efecto adverso en los resultados del tratamiento. En este caso, en el grupo de pacientes normozoospérmicos, 18.6% mostró fragmentación moderada; es decir, por debajo de 30% y no hubo ningún paciente con fragmentación crítica o por encima de 30%. Este 18.6% de hombres con un perfil seminal normal podría contribuir a la infertilidad de la pareja debido al hallazgo de fragmentación del ADN espermático. Si, por el contrario, no se hubiera realizado la prueba de fragmentación, no se habría tenido en cuenta el hombre como fuente de infertilidad en la pareja.
Existen varios estudios que han evaluado la relación entre los parámetros seminales obtenidos del análisis básico del semen con los resultados de la fragmentación del ADN espermático con la aplicación de diferentes métodos. Sin embargo, la mayor parte sólo tienen en cuenta tres parámetros: concentración, movilidad y morfología.32-36 En el seminograma de este estudio se evaluaron todos los parámetros, como reflejo global de la calidad espermática, sin limitación a los tradicionales parámetros comúnmente utilizados. Fue así como se encontró la posible relación de éstos con los resultados de la prueba de fragmentación del ADN espermático.
En nuestro estudio se obtuvieron diferencias significativas entre los tres grupos de fragmentación (normal, moderada y crítica) en los días de abstinencia sexual (p = 0.043): en la concentración espermática (p = 0.003), en el porcentaje de espermatozoides viables (p < 0.0001), en el porcentaje de espermatozoides progresivos (p < 0.0001), en el porcentaje de espermatozoides morfológicamente normales (p = 0.013) y en el total de alteraciones seminales (p < 0.0001). No se observaron diferencias significativas en el volumen del eyaculado (p = 0.781) y leucocitos (p = 0.061). En estudios previos, el volumen tampoco se asoció con la fragmentación34,37 y, aunque la existencia de leucocitos en el eyaculado podría ser un factor determinante en la producción de especies reactivas de oxígeno y, consecuentemente, en la generación de daño en el ADN,38,39,40 nosotros no encontramos una relación entre los leucocitos y la fragmentación.
Mediante la aplicación del análisis post-hoc para determinar qué medias diferían entre si, los únicos parámetros que mantuvieron su significación estadística entre los diferentes grupos de fragmentación fueron: la concentración espermática, la movilidad, la vitalidad y el número total de alteraciones observadas en el seminograma. Sorprendentemente, en nuestra población de estudio no se observó ninguna relación entre la morfología y la fragmentación espermática, aunque siempre ha sido un tema muy controvertido en la bibliografía. Existen estudios en los que se ha encontrado una correlación negativa entre el número de espermatozoides morfológicamente normales y el grado de fragmentación del ADN espermático.32,35,36,41 Algunos autores creen que los espermatozoides con morfología anormal son más susceptibles de sufrir daño en el ADN debido a una baja calidad en el empaquetamiento de la cromatina que hace que el ADN quede más expuesto a posibles factores dañinos, como las especies reactivas de oxígeno. Sin embargo, también existen otros estudios que, como el nuestro, no han podido encontrar esta relación.21,34 Por lo que se refiere a los días de abstinencia, cabría esperar más fragmentación a mayor cantidad de días de abstinencia. En el estudio efectuado por Wyrobek y colaboradores37 se encontró asociación estrecha entre el índice de fragmentación del ADN y el tiempo de abstinencia sexual, aunque no se mencionan los días de abstinencia del grupo de estudio. Su explicación fue que los espermatozoides que permanecen durante más tiempo en el aparato reproductor masculino pueden experimentar mayor exposición al estrés oxidativo. Sin embargo, en los pacientes de nuestro estudio no fue posible demostrar esta teoría, quizá por la ausencia de abstinencia prolongada.
En cada uno de los tres grupos de fragmentación se estudiaron los parámetros con medias significativamente distintas para evaluar su correlación con el índice de fragmentación del ADN; los porcentajes de espermatozoides progresivos y viables fueron los dos parámetros que más se correlacionaron con el índice de fragmentación del ADN (r = -0.613, r = -0.702, respectivamente). La concentración también mostró una correlación significativa con el grado de fragmentación; sin embargo, el coeficiente de correlación fue más bajo (r = -0.248) comparado con la movilidad y la vitalidad.
Existe bastante unanimidad entre los autores en cuanto a la afectación de la movilidad espermática en las muestras seminales con altos niveles de fragmentación del ADN.21,34,36,37,42 Las especies reactivas de oxígeno tienen un papel relevante en la producción de daño al ADN espermático y en los lípidos de su membrana plasmática, en donde impiden la correcta movilidad del espermatozoide.37,43
Los resultados de vitalidad también eran de esperarse porque la fragmentación del ADN sucede en las etapas previas a la muerte celular;44 es decir, que durante la apoptosis hay rupturas en la doble cadena del ADN. En la bibliografía está demostrada la relación incuestionable entre la fragmentación del ADN y la vitalidad espermática.45 En coincidencia con estudios previos, nuestros resultados también mostraron una correlación de la concentración con el grado de fragmentación.21,34,35,46 También existen otros estudios que no lograron encontrar esta relación32,36 o, incluso, ensayos en los que se observó una correlación positiva entre el grado de fragmentación y la concentración espermática.47
Uno de los objetivos de este estudio fue el análisis global del seminograma que analiza todos sus parámetros y determina cuántos están fuera de los límites de referencia de la OMS, utilizando el número total de parámetros alterados como un índice de calidad espermática. También se observó que el número total de parámetros alterados en el seminograma sí se relaciona con el grado de fragmentación espermática, con mayores índices de fragmentación del ADN a más parámetros alterados en el seminograma. Virro y colaboradores,48 con el método SCSA, observaron que los pacientes con más de 30% de fragmentación espermática tenían, al menos, un parámetro seminal alterado y bajas tasas de formación de blastocisto y de embarazo en curso. En nuestros resultados se obtuvieron tasas de fragmentación moderada a partir de dos parámetros seminales alterados (16.2 ± 12.30%) y fragmentación crítica a partir de cuatro parámetros alterados (32.7±22.81%). En los seis pacientes que se registraron con cinco alteraciones seminales, la media de fragmentación fue de 50.2 ± 31.80%.
Al final, con los parámetros relacionados con el índice de fragmentación del ADN se investigó el riesgo de fragmentación moderada o crítica mediante los hallazgos del seminograma. El parámetro seminal que parece evidenciar con más precisión el daño en la cromatina de los espermatozoides es la movilidad. El diagnóstico de astenozoospermia, independientemente de los otros factores seminales que pudieran estar alterados, otorga un riesgo 7.97 veces superior que el de un individuo con movilidad normal a tener fragmentación moderada y 26.17 veces superior de fragmentación crítica. La necrozoospermia también parece ser un factor predictivo de fragmentación, con un riesgo 10.47 veces superior a la fragmentación moderada y 19.76 de fragmentación crítica. El diagnóstico de oligozoospermia también determinó mayor riesgo de fragmentación; no obstante, es mucho menor que en la astenozoospermia y necrozoospermia (OR=2.16 para la fragmentación moderada y OR=1.91 para la fragmentaión crítica). Si se toman como valor de referencia tres o más alteraciones seminales se verá que en este grupo de pacientes el riesgo de fragmentación moderada fue 4.57 veces superior que en pacientes con menos de tres alteraciones seminales y 14.25 veces superior de fragmentación crítica.
CONCLUSIONES
Con base en los resultados de este estudio, los pacientes con un análisis seminal normal son los que menos se beneficiarán de la prueba de fragmentación porque en nuestro estudio ninguno de ellos tuvo fragmentación crítica del ADN espermático. Se recomienda realizarlo a pacientes en quienes el seminograma reporte astenozoospermia, necrozoospermia u oligozoospermia o en quienes tengan tres o más parámetros seminales alterados. Esta prueba debe considerarse una opción apropiada para evaluar el semen de pacientes, antes de llevar a cabo el ciclo de FIV-ICSI que puede reducir el riesgo de espermatozoides fragmentados para la fertilización y sus efectos adversos en los resultados del procedimiento de reproducción asistida.











 nueva página del texto (beta)
nueva página del texto (beta)




