ANTECEDENTES
El síndrome de ovario poliquístico es uno de los trastornos gineco-endocrinos más frecuentes y con múltiples complicaciones a corto y largo plazo.1,2,3,4 Es una de las causas más comunes de hiperandrogenismo y anovulación, que se refleja en hirsutismo, acné, alteraciones menstruales e infertilidad;3 incrementa el riesgo de síndrome metabólico, diabetes mellitus tipo 2 y enfermedad cardiovascular.5 La prevalencia varía de 4 a 26%, según diferentes autores, poblaciones y criterios diagnósticos.6,7,8,9,10,11
Su patogénesis sigue sin conocerse. En la última década se ha acumulado evidencia que apoya un papel central de la resistencia a la insulina o la hiperinsulinemia compensatoria como principal defecto.12-13 La hiperinsulinemia se inicia en alrededor de 80% de las pacientes con síndrome de ovario poliquístico y obesidad y en 30 a 40% de mujeres delgadas con diagnóstico del síndrome.14-15
También se ha demostrado que la resistencia a la insulina y la hiperinsulinemia contribuyen, directa e indirectamente, al hiperandrogenismo.16-17 La insulina estimula directamente a las células de la teca del ovario para producir andrógenos e inhibir la síntesis hepática de proteína fijadora de hormonas sexuales (SHBG), lo que indirectamente incrementa las concentraciones circulantes de andrógenos libres.
La resistencia a la insulina, observada en pacientes con síndrome de ovario poliquístico, predispone a la diabetes mellitus tipo 2, sobre todo si coexiste obesidad y antecedentes familiares de diabetes.18 Esto ha llevado a proponer que los compuestos sensibilizantes a la insulina, como la metformina, se indiquen como tratamiento de la hiperinsulinemia asociada con síndrome de ovario poliquístico.13,19,20 Estos fármacos pueden originar efectos adversos gastrointestinales que dificultan su consumo rutinario.
En este contexto, un compuesto de la familia de los azúcares (inositol) puede tener participación en el tratamiento de pacientes con síndrome de ovario poliquístico debido a sus efectos en el metabolismo de la glucosa.
La evidencia sugiere que la deficiencia de inositol (que actúa como segundo mensajero para la acción de la insulina) puede estar ligada a la resistencia a la insulina.21 En la bibliografía se señala que en las mujeres con síndrome de ovario poliquístico los genes involucrados en la vía de captación de glucosa están regulados negativamente en el ovario22 y puesto que dos de los esteroisómeros actualmente usados del inositol, mioinositol y D-chiro-inositol (DCI), tienen una acción similar a la insulina en vivo,23 pueden tener participación en el tratamiento de pacientes con síndrome de ovario poliquístico.
Ambos esteroisómeros se han estudiado, en mayor o menor medida, y la evidencia demuestra que pueden tener participación importante en el área ginecológica, la función reproductiva y la fertilidad.24 Hace poco se inició la comercialización de preparaciones que combinan ambos compuestos con la finalidad de beneficiarse de las ventajas propias de los dos esteroisómeros. El objetivo de esta investigación consiste en evaluar el efecto en el perfil metabólico y endocrino de pacientes con síndrome de ovario poliquístico con la monoterapia de inositol y D-chiro-inositol combinados.
MATERIALES Y MÉTODOS
Estudio experimental, prospectivo y longitudinal al que se incluyeron pacientes con diagnóstico de síndrome de ovario poliquístico, con vida sexual activa y que otorgaron su consentimiento para participar. Se confirmó que las pacientes no hubieran tomado medicación hormonal por lo menos tres meses antes del ingreso al estudio y que no hubieran sido objeto de otras opciones de tratamiento médico o modificaciones en el estilo de vida. Los criterios diagnósticos de síndrome de ovario poliquístico se consideran según Rotterdam.25-26
Cada criterio se definió como sigue:
Hiperandrogenismo clínico: una calificación en la escala Ferriman Gallwey (FG) de ≥ 6 sin importar la existencia o no de acné-alopecia.
Hiperandrogenismo bioquímico (hiperandrogenemia): testosterona total (tT) o índice de andrógenos libres (FAI) que exceda el percentil 95 de mujeres sanas, no hirsutas, eumenorreicas sin síndrome de ovario poliquístico en población española. Específicamente, los límites normales para testosterona total y andrógenos libres son 54.7 ng/dL, y 4.94, respectivamente.
Oligo o anovulación: ciclos menstruales más o menos mayores de 35 días.
Morfología de ovario poliquístico (PCOm): más de 19 folículos antrales en uno o ambos ovarios o volumen ovárico mayor de 10 mL.27
Exclusión de otras enfermedades: para descartar otras enfermedades que produzcan oligoanovulación se evaluaron las concentraciones de hormona estimulante de tiroides28 y prolactina. Las concentraciones de 17-OH progesterona se estudiaron para excluir hiperplasia suprarrenal congénita no clásica (NCAH).
Las mujeres fueron invitadas a participar a través de ginecólogos de primer contacto, a partir del establecimiento del diagnóstico de síndrome de ovario poliquístico. Todas las participantes firmaron un consentimiento informado y recibieron una evaluación médica, ecografía transvaginal y análisis de sangre en dos ocasiones.
Las mujeres recibieron la administración diaria oral de un preparado comercial (Soniase®, Adamed Laboratorios, S.L.U.) con mioinositol (2000 mg) y D-chiro-inositol (400 mg), además de ácido fólico (400 mcg) y manganeso (10 mg), durante tres meses. Todas las mujeres se evaluaron en dos ocasiones: al primer contacto y tres meses después del tratamiento.
Se utilizó el programa de cómputo IBM SPSS Statistics versión 21st para OSX (Mac). Para las características generales se hizo estadística descriptiva y para la comparación de las variables pre y postratamiento: t de Student pareada en variables continuas y Fisher en variables categóricas.
RESULTADOS
Las características generales de las pacientes se describen en el Cuadro 1. Como datos interesantes destaca que la prevalencia de ciclos menstruales irregulares es de 75.4%, poco más de la mitad de las pacientes tenían sobrepeso u obesidad (50.8%) y 37.7% refirieron infertilidad de tipo anovulatorio.
En el Cuadro 2 se enumeran las características clínicas de las pacientes antes y después del tratamiento. Se observó una diferencia estadísticamente significativa en todos los parámetros; sin embargo, los más significativos se debieron a que el intervalo de confianza no cruzó la unidad: escala Ferriman-Gallwey (6.06 ± 2.0 y 5.57 ± 1.1, p=0.003; IC95%: 0.169-0.814 pre y postratamiento, respectivamente), el volumen ovárico izquierdo (7.76 ± 3.2 y 7.18 ± 2.3; p=0.005; IC95%: 0.187-0.982 pre y postratamiento, respectivamente), la cuenta de folículos antrales del ovario izquierdo (10.65 ± 6.4 y 10.20 ± 5.7, p=0.029; IC95%: 0.047-0.861 pre y postratamiento, respectivamente) y la cuenta de folículos antrales del ovario derecho (12.11 ± 6.5 y 11.75 ± 6.1, p= 0.048; IC95%: 0.0040.723 pre y postratamiento, respectivamente).

IMC: índice de masa corporal
Escala FG: Escala Ferriman-Gallwey
OI: Ovario izquierdo
OD: Ovario derecho
CFA: Cuenta de folículos antrales
Significancia estadística: p<0.05
Cuadro 2 Características clínicas de las pacientes con síndrome de ovario poliquístico antes y después del tratamiento
Las características metabólicas de las pacientes con síndrome de ovario poliquístico antes y después del tratamiento se muestran en el Cuadro 3. Se destacan los valores del HOMA -para evaluar la resistencia a la insulina- (1.85 ± 1.0 y 1.67 ± 0.7, p = 0.015; IC95%: 0.038-0.326 pre y postratamiento respectivamente) y de la proporción LH-FSH (1.13 ± 0.8 y 0.99 ± 0.6, p = 0.018; IC95%: 0.023-0.242 pre y postratamiento, respectivamente).
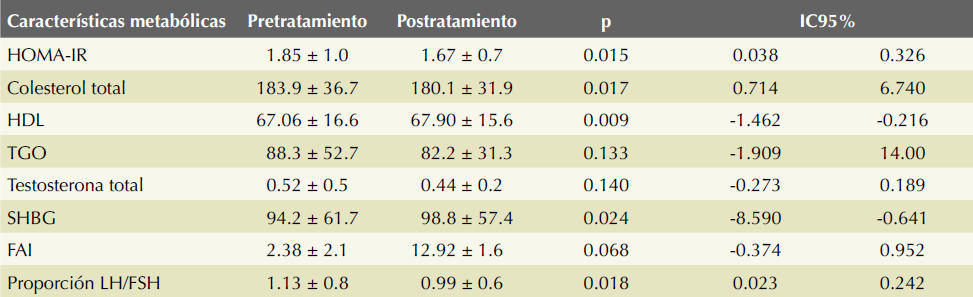
Cuadro 3 Características metabólicas de las pacientes con síndrome de ovario poliquístico antes y después del tratamiento
Previo al tratamiento, 75.4% de las pacientes tuvieron oligoamenorrea, posterior al mismo, solo 26.2% continuaron con alteraciones menstruales (p=0.001) (Cuadro 4). Además, de las 61 pacientes incluidas, 23 refirieron infertilidad de tipo anovulatorio, posterior al tratamiento, y a manera de seguimiento, 8 mujeres lograron el embarazo clínico sin ningún apoyo o algún tratamiento de reproducción asistida (Cuadro 4).
DISCUSIÓN
La resistencia a la insulina y el síndrome metabólico se asocian con síndrome de ovario poliquístico, con una prevalencia de entre 50 y 80%, dependiendo de los criterios diagnósticos y la población estudiada.29,30 La evidencia muestra una estrecha asociación entre la resistencia a la insulina y la disfunción ovárica, pues prácticamente todas las formas monogénicas de una resistencia a la insulina severa se manifiestan con disfunción ovárica.31
Es una teoría aceptada que la resistencia a la insulina del síndrome de ovario poliquístico se caracteriza por una sensibilidad selectiva a la insulina, donde algunos tejidos son altamente resistentes (hígado, músculo esquelético) y otros sensibles (adrenales y ovario); por lo tanto, estos últimos reaccionan a las altas concentraciones de insulina circulante mientras que se observan defectos selectivos en la acción metabólica de la insulina en el resto del cuerpo.32,33 En los tejidos afectados, las vías metabólicas casi siempre son resistentes a la estimulación de la insulina, pero las vías mitógenas o esteroidogénicas no lo son.34
Desde que se estableció la relación entre las alteraciones en la señalización de la insulina y el síndrome de ovario poliquístico, se han utilizado diferentes fármacos antidiabéticos e insulino-sensibilizantes, incluidos la metformina y las tiazolidinedionas.24 No obstante, aunque la metformina ha demostrado, a corto plazo, contrarrestar el hiperandrogenismo en mujeres con síndrome de ovario poliquístico, obesidad e insulino-resistencia,35 los resultados son controvertidos porque señalan su pobre eficacia en pacientes con síndrome de ovario poliquístico delgadas y sin resistencia a la insulina.36 Además, la metformina tiene un efecto negativo en el número de folículos y su calidad.37
Otro punto negativo de la metformina y las tiazolidinedionas son sus efectos adversos: síntomas gastrointestinales, complicaciones metabólicas, retención de líquidos, incremento del índice de masa corporal (IMC), enfermedad coronaria y cáncer de vejiga.38,39
El inositol actúa como segundo mensajero para la insulina y sus dos esteroisómeros más abundantes son mioinositol (MI) y D-chiro-inositol (DCI). Aunque tienen diferentes funciones metabólicas, ambos son mediadores de la acción de la insulina dentro de la célula.24
Nestler y su grupo40 publicaron resultados prometedores acerca del D-chiro-inositol en pacientes con síndrome de ovario poliquístico. Prescribieron dosis de 1200 mg diarios de D-chiro-inositol durante seis a ocho semanas a mujeres obesas con síndrome de ovario poliquístico y observaron una mejoría en la función ovular, disminución de las concentraciones séricas de andrógenos, tensión arterial y concentraciones plasmáticas de triglicéridos al compararlo con placebo.40
En otro estudio efectuado por Luorno y colaboradores41 se administraron 600 mg diarios de D-chiro-inositol a mujeres delgadas, con síndrome de ovario poliquístico, y concluyeron que el D-chiro-inositol disminuye las concentraciones circulantes de insulina, la concentración de andrógenos séricos y algunas de las alteraciones del síndrome metabólico al compararse con placebo. No obstante, Cheang y sus coautores42 no encontraron diferencia alguna cuando se indicaron dosis mayores de D-chiro-inositol, lo que sugiere que la liberación alterada de D-chiro-inositol en su población de estudio pudo representar un defecto funcional, más que una deficiencia nutricional del substrato.
Por su parte, Chiu y su grupo43 prescribieron mioinositol a pacientes de fecundación in vitro (IVF). El estudio reportó concentraciones elevadas de inositol en el suero de pacientes con embarazos por fecundación in vitro exitosos, lo que indica un posible papel del inositol en la etapa temprana de la fecundación in vitro como en el mantenimiento del desarrollo normal del embrión.43 Este grupo también examinó si el contenido del mioinositol en el líquido folicular se asociaba con mejor calidad ovocitaria y encontró que, estadísticamente, hay una correlación significativa entre las concentraciones de mioinositol en el líquido folicular y la calidad de los ovocitos recuperados.44
La efectividad de la complementación con mioinositol, el esteroisómero más abundante en nuestro organismo, la han demostrado varios autores al observar mejoría en el perfil hormonal de las pacientes con síndrome de ovario poliquístico, pues restaura su actividad ovárica espontánea y, por consiguiente, su fertilidad y mejora otros parámetros metabólicos en pacientes delgadas y obesas con síndrome de ovario poliquístico.45,46,47,48 También, pacientes con síndrome de ovario poliquístico que llevan a cabo procedimientos de inyección intracitoplasmática de esperma (ICSI) que recibieron mioinositol y ácido fólico requirieron dosis menores de FSH recombinante, menos días de estimulación y en la aspiración folicular se obtuvieron menos vesículas germinales y ovocitos degenerados.49
Estos datos estimularon la comparación de los efectos del D-chiro-inositol versus los de mioinositol en pacientes con síndrome de ovario poliquístico: a pesar de que el número total de ovocitos recuperados no fue diferente en ninguno de los grupos de tratamiento, el número de ovocitos maduros fue significativamente mayor y el número de ovocitos inmaduros menor en el grupo de mioinositol versus el grupo de D-chiro-inositol; hubo también un incremento en la media de embriones de alta calidad y el número total de embarazos en el grupo de D-chiro-inositol.50
También se ha dicho que, a diferencia de tejidos como el músculo y el hígado, los ovarios no se vuelven insulinorresistentes;51,52,53 por lo tanto, las pacientes con síndrome de ovario poliquístico con hiperinsulinemia, quizá con epimerización elevada en el ovario de mioinositol a D-chiro-inositol, resulta en una sobreproducción de D-chiro-inositol que llevará a una deficiencia de mioinositol.54 Esta disminución puede ser responsable de una pobre calidad ovocitaria observada en pacientes con síndrome de ovario poliquístico.55 Para apoyar esta teoría, se ha demostrado que al incrementar las dosis de D-chiro-inositol hay un efecto negativo en la calidad ovocitaria y una reducción progresiva en la respuesta ovárica a la FSH.57
Al comparar el líquido folicular de ciclos espontáneos de pacientes con síndrome de ovario poliquístico versus pacientes sanas, se demostró que estas últimas tienen altas concentraciones de mioinositol y bajas de D-chiro-inositol, mientras que en las pacientes con síndrome de ovario poliquístico la proporción es la opuesta.57
Para identificar la dosis adecuada necesaria, sin afectar la función ovárica, se identificó la proporción fisiológica de mioinositol-D-chiro-inositol. La proporción en plasma es de aproximadamente 40:1, y puesto que la dosis terapéutica de mioinositol varía entre 2 y 4 g al día, se manufacturó una cápsula de gel, blanda, de 550 mg de mioinositol y 13.8 mg de D-Chiro-inositol.58 Nordio y su grupo confirmaron un doble efecto con esta fórmula: 1) una acción en el hígado (por el D-chiro-inositol) que apunta a reducir las concentraciones de insulina en sangre; y 2) un efecto selectivo en el ovario, donde al parecer el mioinositol contrarresta las concentraciones disminuidas de D-chiro-inositol y reestablece la sensibilidad a la FSH.59
En nuestra investigación se utilizó una preparación comercial con 2000 mg de mioinositol y 400 mg de D-chiro-inositol, además de ácido fólico (400 mcg) y manganeso (10 mg). Los resultados preliminares obtenidos se correlacionan con los ya descritos en los que se ha registrado una reducción en el IMC, circunferencia abdominal, escala Ferriman-Gallwey, volumen ovárico y cuenta de folículos antrales. Esto se suma a los resultados en el perfil metabólico, incluido el HOMA y la proporción LH-FSH.
Las publicaciones recientes demuestran que el inositol, como primera línea de tratamiento en mujeres con síndrome de ovario poliquístico, disminuye significativamente la tensión arterial, mejora la calificación de la escala Ferriman-Gallwey (para hirsutismo), la proporción LH-FSH sérica, testosterona total, testosterona libre y el índice HOMA, así como la regularización de los ciclos menstruales.60,61 Este último dato es interesante debido a que nuestros resultados muestran una gran respuesta de las pacientes a esta variable (ciclos menstruales irregulares en 75.4% de las pacientes previas al tratamiento versus 26.2% posterior al mismo, p = 0.001).
La mejora en las concentraciones séricas de andrógenos, la corrección de la proporción LH-FSH y la regularización de los ciclos menstruales, pueden ser las causas en las que otros investigadores también se apoyan, en el efecto en la fertilidad.45,62 De 23 pacientes con infertilidad de tipo anovulatorio, observamos 8 embarazos clínicos sin recurrir a alguna técnica de reproducción asistida.
En general, los resultados son prometedores. Nuestro estudio carece, en este momento, de un tamaño de muestra significativo y creemos que hay otros aspectos a evaluar y considerar en futuras investigaciones: a) aunque ambos esteroisómeros parecen tener un efecto positivo en el metabolismo de la glucosa en tejidos altamente sensibles, el metabolismo de los inositoles y su dinámica continúa en investigación. El tratamiento mediante metabolómica debe ayudar a entender su papel en las vías moleculares específicas y conocer más de su función como segundos mensajeros;24 b) debe estudiarse más acerca de la actividad selectiva del mioinositol y D-chiro-inositol en los diferentes tejidos y el modo de su regulación para determinadas acciones;24,62 c) hacen falta más estudios controlados, prospectivos y con asignación al azar acerca de la prescripción de los inositoles a pacientes con síndrome de ovario poliquístico, así como estudios donde se utilice esta combinación de 40:1, que guarda mayor semejanza con las concentraciones fisiológicas normales; y d) explorar la combinación mioinositol-D-chiro-inositol en los diferentes fenotipos de síndrome de ovario poliquístico debido a las diferencias metabólicas de cada subtipo de pacientes, esto toma mayor importancia al diferenciar que la resistencia a la insulina predomina en determinados fenotipos11,63,64 y ésta, es la principal teoría de acción del compuesto.
CONCLUSIONES
Los resultados preliminares muestran un efecto positivo de la administración combinada de mioinositol y D-chiro-inositol en el perfil clínico y metabólico de pacientes con síndrome de ovario poliquístico. La mejora en las concentraciones séricas de andrógenos, de la proporción LH-FSH y la regularización de los ciclos menstruales, puede favorecer el aumento de la fertilidad en pacientes con síndrome de ovario poliquístico y factor ovárico. Hacen falta más estudios prospectivos, controlados y con asignación al azar para definir el papel exacto de los inositoles en las vías metabólicas y, sobre todo, conocer su efecto según los diferentes fenotipos del síndrome de ovario poliquístico, porque cada uno tiene características metabólicas y clínicas muy peculiares.











 nueva página del texto (beta)
nueva página del texto (beta)




