Introducción
El tema de prótesis de cadera actualmente es un tópico de estudio a nivel mundial, primeramente, porque las lesiones de cadera son un padecimiento muy recurrente, y, en segundo lugar, debido a que estas cirugías son las que han tenido mayor éxito en el reemplazo total o parcial. Además, la creciente población de adultos mayores, las inherentes fracturas asociadas a la edad y la osteoporosis, hacen centrar nuestra atención en atender las necesidades en cuanto a la reparación de las fracturas, mediante el análisis biomecánico y el diseño asistido por computadora.
Las prótesis de cadera han ido evolucionando a través del tiempo, desde la primera implementación de las prótesis de cadera en el año de 1960, han variado en las formas y en los materiales, desde aceros de grado quirúrgico hasta aleaciones de cromo, cobalto, níquel y titanio, entre otros; todas con la intención de proponer un modelo eficaz para la aceptación completa del cuerpo humano de un miembro no perteneciente a él [1].
Actualmente, el concepto básico de Charnley de artroplastia de baja fricción y la utilización del par metal-polietileno es el estándar de la artroplastia total de cadera. Los resultados clínicos de la prótesis de Charnley son hoy día referencia obligada para evaluar el rendimiento de otras artroplastias [1].
Las prótesis actuales, presentan un tratamiento superficial, el cual da un aspecto rugoso, en una pequeña sección el vástago y en el componente acetabular, cubierto con hidroxiapatita. Lo anterior con el propósito de favorecer la osteointegración, es decir la integración del tejido óseo a la prótesis, ya que los osteoblastos reconocen a la hidroxiapatita como si fuera hueso puesto que es el componente mineral de éste.
A diferencia de otras prótesis, las prótesis de cadera deben soportar los esfuerzos en actividades normales, caminar o subir escaleras, las cuales pueden superar cuatro veces el peso corporal del individuo implantado y en algunos casos 10 veces, por ejemplo, ante un tropezón. Todo supone un compromiso entre ligereza, diseño y las propiedades mecánicas de los materiales con que se fabrican las prótesis.
La exigencia de dichas solicitaciones nos orilla a buscar nuevos diseños y materiales. Tal es el caso de la aleación Ti-6Al-4V ampliamente utilizada para la fabricación de prótesis osteoarticulares. Las prótesis de Ti-6Al-4V presentan como principales ventajas: baja densidad, buenas propiedades mecánicas, gran biocompatibilidad, elevada resistencia a la corrosión y a la fatiga.
Otros materiales cuya aplicación es muy amplia, como en las placas temporales de osteosíntesis, tornillos, clavos y fijadores, además de prótesis de cadera son los aceros con contenidos de carbono de 0.08% como el AISI 316 o inferiores al 0.03% como el AISI 316L. Este material tiene como ventaja el ser de más bajo costo que las aleaciones de Titanio.
Así mismo, la aleación L605 que está formada por cobalto, cromo, wolframio y níquel. Está aleación presenta una alta resistencia a la corrosión y en los últimos años sus usos se han ampliado al campo de las endoprótesis vasculares, así como en la elaboración de stent y prótesis de cadera. Razón por la cual se ha considerado en el presente estudio.
Si bien es cierto, el avance científico en cuanto al desarrollo de materiales metálicos biocompatibles o bioinertes ha sido gradual, existe una gran diferencia con la biomecánica computacional que ha avanzado aceleradamente, desde su implementación hasta hoy en día. Lo anterior nos ha permitido reemplazar los ensayos en gran escala por simulaciones numéricas para reducir costos económicos, así como ensayos en animales. Al incorporarse la biomecánica computacional a la industria 4.0, que estamos viviendo actualmente, nos permite encontrar mejores soluciones a la investigación de una manera más eficiente, con mayores beneficios que la investigación convencional. Todo ello al reducir el tiempo de análisis, la optimización del equipo de cómputo disponible y derribar barreras espaciales con los entornos colaborativos.
Algunos autores se han centrado en realizar análisis de prótesis de cadera bajo determinadas condiciones de carga, con el propósito de poder determinar la resistencia a la fatiga de dichas prótesis [2,3]. También se han realizado ensayos con fluidos corporales simulados para estudiar el efecto de la corrosión y la fatiga de manera conjunta [4,5]. Al mismo tiempo, se ha investigado también el efecto que el apantallamiento de tensiones tiene sobre la interface prótesis-hueso [6-8]. Con respecto al estudio de prótesis mediante elementos finitos, podemos decir que las investigaciones van desde estudios comparativos de prótesis comerciales [9], hasta diseños completamente nuevos e innovadores [8,10-12]. Sin embargo, la investigación en torno al análisis por elementos finitos en la nube es escaso.
El objetivo de este trabajo es determinar el desempeño biomecánico de una prótesis de cadera bajo condiciones de cargas asociadas a actividades cotidianas. En el cual, se comparan tres materiales metálicos para la fabricación de una prótesis personalizada a partir de imágenes médicas, y la utilización de plataformas de diseño asistido por computadora en la nube, Onshape (Onshape Inc, Cambridge, MA); y de análisis por elementos finitos en la nube, SimScale (SimScale GmbH, München, Germany).
Metodología
El diseño de la prótesis personalizada requirió de información recabada previamente de imágenes médicas de un paciente anónimo con un peso de 75 kg, el cual estaba hospitalizado en el Instituto Mexicano del Seguro Social y que donó sus imágenes médicas para realizar la presente investigación mediante una carta de consentimiento informado. Se obtuvo un modelo tridimensional del hueso fémur con dichas imágenes y mediante segmentación de cada corte tomográfico en 3DSlicer (3Dslicer.org, Boston, MA). Derivado de dicha segmentación, se conocieron las medidas del perfil del hueso que permitieron crear las geometrías del modelo de prótesis. Las geometrías se desarrollaron con curvas SPLINE a través de la plataforma de diseño en la nube llamada Onshape. En la Figura 1 se muestra el modelo de prótesis creado, así como sus componentes principales indicados con distintos colores. La Figura 1 muestra además un modelo isométrico del vástago. Y finalmente en la Figura 2 se muestran las dimensiones obtenidas de las imágenes médicas que permitieron crear la geometría de la prótesis.
Debido a la complejidad de la forma de la prótesis se requirieron diferentes geometrías de acuerdo a cada elemento que la conforman. Para realizarla se crearon perfiles en el plano superior “TOP” a distintas distancias y a través de la función barrido “LOFT” se unieron los perfiles para crear la forma. Además, se requirieron planos inclinados adicionales de referencia para poder obtener la geometría.
Modelado del vástago
El vástago es el elemento que va injertado en el hueso fémur por medio de interferencia y es el único elemento con variación en los dos modelos de prótesis.
Para el modelo sólido se requieren los 5 perfiles del vástago (PV) externos enumerados del 1 al 5 (PV1 al PV5) unidos en una sola parte totalmente sólida. En el modelo hueco, se utilizan los mismos perfiles, pero a diferencia del anterior, los perfiles internos indicados del PV2 al PV4 muestran el área y la trayectoria de la cual se extrae el material que aligera el modelo (Tabla 1). Se muestran las formas de los perfiles obtenidos de los cuales las geometrías internas son únicamente para el modelo hueco en la Tabla 1. Cada punto de la geometría de cada perfil tiene coordenadas específicas en x, y, z.
Las distancias de separación de cada perfil constituyente del vástago se muestran en la Figura 2. Tanto el modelo sólido como el modelo hueco tienen una altura total de 110.5mm. Las distancias entre cada perfil, partiendo de la parte inferior hacia la superior, desde PV1 hasta PV5 son: 4.5 mm, 50 mm, 36 mm y 20 mm respectivamente. En el modelo hueco, la altura total de la cavidad es de 106 mm, haciendo uso de los perfiles internos con excepción del PV1.
En la Figura 3 se muestra el modelo de prótesis hueco exhibiendo la forma de la cavidad (A) y las geometrías tanto externas como internas (B) de cada perfil.
Unión vástago-cuello femoral
La unión vástago- cuello femoral tiene una altura total de 20 mm, está compuesta por 3 perfiles del cuello femoral (PCF) unidos desde su perfil inferior PCF1 con el perfil superior del vástago PV5 (Figura 4).
Los perfiles obtenidos para la unión del vástago con el cuello femoral se muestran en la Tabla 2 y corresponden a PCF1 al PCF3.
Cuello femoral
Esta parte del cuello femoral es de suma importancia, ya que en esta se presentan la mayor concentración de esfuerzos. Está constituida por dos perfiles sobre planos inclinados auxiliares separados por una distancia de 20 mm, uno corresponde al perfil superior PFC3 del cuello femoral que une el perfil de este cuello de nombre PCF4 (Tabla 2). La forma obtenida es la presentada en la Figura 5.
Cabeza femoral o cotilo
La cabeza femoral es simplemente una esfera de 23 mm de diámetro, creada encima del perfil PCF4. Se crea un plano inclinado con una línea guía de referencia en el plano x para indicar el diámetro que tendrá, y en el plano z para indicar la superficie de revolución.
Análisis biomecánico
El análisis biomecánico de la prótesis creada fue realizado en SimScale, una plataforma de análisis en la nube vinculada con Onshape.
Para realizar el estudio biomecánico se consideraron los siguientes tópicos:
Geometría: Modelo sólido en una sola parte realizado en Onshape.
Malla: La malla seleccionada a través de un análisis de sensibilidad de todos los tamaños de malla que ofrece SimScale.
Material: De los materiales seleccionados para este estudio, los datos de interés son las características mecánicas de cada uno (densidad, módulo de Young, módulo de Poisson y para posteriores comparaciones el último esfuerzo a la tensión y límite elástico).
Cargas: La carga principal es el peso de la persona en forma de fuerza que actúa sobre la articulación de la cadera, misma que es descompuesta en sus componentes x, y, z bajo la influencia de la realización de una actividad.
Restricciones: Se fijó el vástago en su parte inferior y en la parte superior de la cabeza femoral se aplicó la carga (Figura 6).
Las actividades para analizar el comportamiento del modelo de prótesis, simulando actividades cotidianas del usuario son: caminar, de pie, andar en bicicleta, levantarse, subir escaleras, bajar escaleras, sentarse y, trotar [13].
Se realizaron 56 simulaciones en SimScale, con un tiempo de cómputo de 39 minutos cada una; donde 8 de ellas sólo se realizaron para la selección de mallado óptimo, las restantes corresponden a 8 condiciones de prueba para el modelo de prótesis sólido y 8 condiciones de prueba para el modelo de prótesis hueco, y estas a su vez realizadas con 3 materiales distintos.
Selección de mallado
Las simulaciones se realizaron con la forma tetraédrico dominante, con los tamaños de malla que van desde 32,134 hasta 2,792,603 de elementos con el modelo de prótesis sólido, para poder seleccionar la que aporta mayor precisión sin implicar un costo computacional alto.
Se realizó un análisis de sensibilidad que consistió en evaluar la densidad del mallado, es decir el número de elementos que conforman cada una de las mallas. Posteriormente se contrastaron los resultados del esfuerzo máximo de von Mises para seleccionar la densidad que ofrece una variación en los resultados inferior al 0.01 de error y brinde el menor tiempo de cómputo.
En la Figura 7 se encuentran graficados el número de elementos tetraédricos en el eje horizontal, contra los valores del esfuerzo máximo de von Mises expresado en pascales en el eje vertical. De los ocho tamaños de malla graficados se optó por la malla con 2,537,684 de elementos tetraédricos, 471,335 nodos y con un valor de von Mises de 8.416e8 Pa.
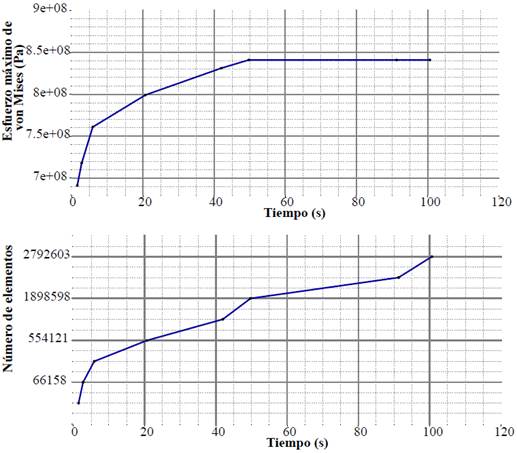
Figura 7 Gráfico de análisis de sensibilidad del mallado. Esfuerzo de von Mises y número de elementos contra tiempo.
La selección se realizó en virtud de que esta presenta poca variación con la tendencia global, además de que no representa mucho costo de tiempo de cómputo (39 min), incluyendo el tiempo de mallado, ni mucho menos consumo de memoria (7968.04 Mo) en el servidor.
Materiales seleccionados para el análisis biomecánico
Los materiales seleccionados pertenecen a la familia de los biomateriales con aplicación específica para prótesis de cadera, debido a sus propiedades fisicoquímicas y mecánicas que son Ti-6Al-4V, 316-L y el L-605.
Se tomó como referencia los valores de las propiedades mecánicas con los cuales autores como A. Maiques Oltra [14], R. E. Arellano Guerrero [15], K. B. Hazlehurst [16], O. Martel [9], P. Losa Zapico [17], Changning Sun [7], entre otros, han realizado sus simulaciones de prótesis de cadera para obtener resultados equiparables (Tabla 3).
Cargas aplicadas
Para simular las actividades cotidianas que realiza una persona, se aplicaron diferentes cargas estáticas resultantes de las fuerzas generadas por la inercia y los grupos musculares utilizados en cada una de las actividades para una persona de 75 kg (Tabla 4), para lo cual se tomaron como sistema de coordenadas local los ejes x, y, z sobre la cabeza femoral [13].
Tabla 4 Cargas generadas de las actividades cotidianas (Tomado textualmente de [13]).
| Actividad | Rx (N) | Ry (N) | Rz (N) |
|---|---|---|---|
| Caminar | 535.7 | -343.5 | -1747.2 |
| De pie | 575.8 | -120.3 | -1947.1 |
| Bicicleta | 242 | -202.5 | -651.75 |
| Levantarse | 649.8 | -203.7 | -1428.4 |
| Subir | 774.1 | -771 | -2852.4 |
| Bajar | 774.1 | -565.7 | -1999.6 |
| Sentarse | 460.2 | -245 | -1246.8 |
| Trotar | 777.2 | -762.7 | -2845.2 |
Resultados y discusión
En este proyecto se compararon los resultados de los esfuerzos de von Mises, también conocido como el esfuerzo de máxima energía de distorsión, o Maxwell-Huber-Hencky-Von Mises. Según esta teoría, la cedencia del material comienza cuando la distorsión máxima o la energía de corte en el material es igual a la distorsión máxima o la energía de corte al ceder en una prueba de tensión simple [18]. Se puede demostrar que, para materiales inicialmente elásticos, la energía de deformación o distorsión es proporcional al esfuerzo de von Mises (σvm), que es el que se muestra en la ecuación 1.
Donde σ1, σ2, y σ3 son los esfuerzos principales. El criterio de von Mises alude a que el cuerpo se comporta elásticamente cuando se alcanza la resistencia de cedencia (Ecuación 2):
Tomando el criterio anterior, comparamos cada valor obtenido del máximo esfuerzo de von Mises de cada material, de cada modelo de prótesis y de cada actividad realizada por el usuario, con respecto al valor del esfuerzo último y el límite elástico (Tabla 3).
Se sabe que la prótesis sufrirá deformación permanente al rebasar el límite elástico y se fracturará al rebasar el último esfuerzo a la tensión.
Una vez que se realizaron las simulaciones mediante el método de elementos finitos de los 48 casos resultantes, de las combinaciones de cargas debido a las actividades físicas del sujeto objeto de estudio y los materiales propuestos para la prótesis, se obtuvo la distribución de esfuerzos de von Mises sobre los modelos de las prótesis con un código de colores, indicando en color rojo el valor del esfuerzo de von Mises máximo.
Visualmente se puede apreciar que la concentración de esfuerzos se presenta en el cuello de la cabeza femoral, ilustrado en color rojo en la Figura 8c. En completa concordancia con la zona en la que el fémur del paciente sufrió la fractura. Los casos que una prótesis puede tener, derivados de las solicitaciones sobre la misma son: prótesis sin daño estructural, prótesis con deformación permanente y, fractura de la prótesis.
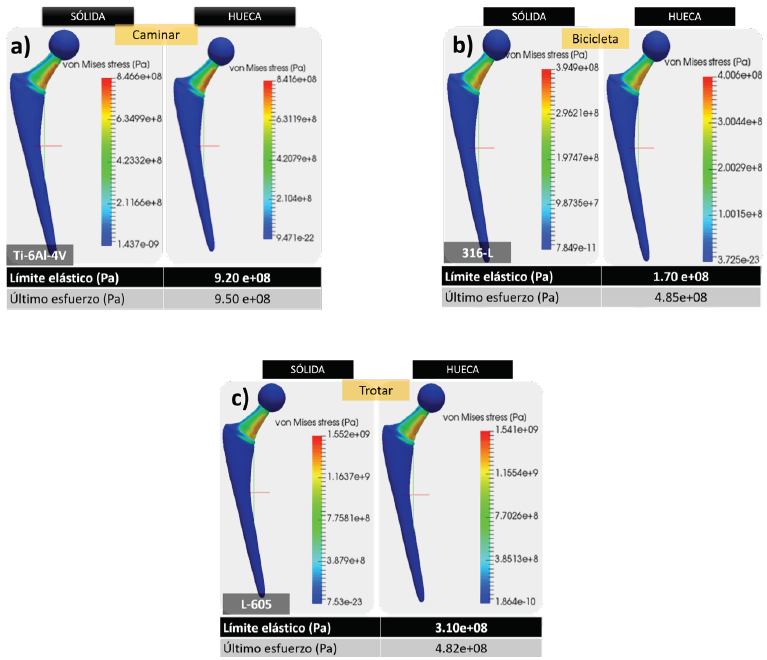
Figura 8 Casos tipo: a) Prótesis sin daño estructural, b) Prótesis con deformación permanente, c) Fractura de la prótesis.
Caso a) Prótesis sin daño estructural. En este caso, la prótesis sólida con el material Ti-6Al-4V, bajo la actividad de caminar presenta un valor del esfuerzo máximo de von Mises de 8.466e+08 Pa. Mientras que para la prótesis hueca el esfuerzo máximo de von Mises es de 8.416e+08 Pa.
Al comparar dichos valores del esfuerzo máximo de von Mises con el valor reportado en la literatura del esfuerzo en el límite elástico de 9.20e+08 Pa, se logra apreciar que la prótesis tendrá un comportamiento elástico lineal.
De acuerdo con la Ley de Hooke, la prótesis sufrirá deformaciones reversibles una vez que deje tener efecto la carga aplicada. Por otra parte, al tener esfuerzos máximos de von Mises inferiores al último esfuerzo que es de 9.50e+08 Pa, no es posible que sufra fractura alguna (Figura 8a).
Caso b) Prótesis con deformación permanente. En la prótesis de aleación 316-L sometida a las fuerzas derivadas de la acción de andar en bicicleta, se produce un esfuerzo de von Mises 3.949e+08 Pa, para la prótesis sólida. Y un esfuerzo de von Mises 4.006 e+08Pa para la prótesis hueca.
En ambos casos sobrepasan el valor de esfuerzo en el límite elástico que es de 1.70e+08 Pa, por lo que se produce una deformación plástica o permanente en el cuello femoral. Pero que, al no rebasar el último esfuerzo, dicha prótesis no llega a la fractura (Figura 8b).
Caso c) Fractura de la prótesis. En el supuesto caso de que la prótesis diseñada se fabrique de la aleación L-605 y que las fuerzas aplicadas sean el producto de realizar la actividad de trotar. El valor del esfuerzo máximo de von Mises es 1.552e+09 Pa, para la configuración sólida y de 1.541e+09 para la hueca. Dichos valores sobrepasan el valor de esfuerzo en el límite elástico que es de 3.10e+08 Pa, y también el valor del último esfuerzo que para la aleación L-605 es de 4.82e+08 Pa.
Los estados de esfuerzo antes mencionados, producirán una deformación más allá del límite elástico, es decir la cedencia, al alcanzar el esfuerzo último se ocasiona la fractura del material de la prótesis con su consecuente evolución en ruptura (Figura 8c).
Los resultados del esfuerzo máximo de von Mises para las 48 simulaciones en los casos de prótesis hueca y sólida se presentan en la Tabla 5, con sus respectivas condiciones de carga producto de las actividades cotidianas, así como de los materiales de fabricación propuestos.
Tabla 5 Resultados de los esfuerzos von Mises.
| Material | Ti-6Al-4V | 316-L | L-605 | |||
|---|---|---|---|---|---|---|
| Modelo | Hueco | Sólido | Hueco | Sólido | Hueco | Sólido |
| Actividad | Esfuerzos von Mises (Pa) | |||||
| Caminar | 8.42E+08 | 8.47E+08 | 8.47E+08 | 8.57E+08 | 8.49E+08 | 8.00E+08 |
| De pie | 7.54E+08 | 7.56E+08 | 7.62E+08 | 7.63E+08 | 7.65E+08 | 7.66E+08 |
| Bicicleta | 3.98E+08 | 3.90E+08 | 4.00E+08 | 3.95E+08 | 4.02E+08 | 3.97E+08 |
| Levantarse | 6.73E+08 | 7.03E+08 | 6.78E+08 | 7.11E+08 | 6.79E+08 | 7.14E+08 |
| Subir | 1.56E+09 | 1.53E+09 | 1.57E+09 | 1.55E+09 | 1.57E+09 | 1.56E+09 |
| Bajar | 1.16E+09 | 1.14E+09 | 1.17E+09 | 1.16E+09 | 1.17E+09 | 1.16E+09 |
| Sentarse | 6.22E+08 | 6.29E+08 | 1.17E+09 | 8.03E+08 | 6.27E+08 | 6.38E+08 |
| Trotar | 1.54E+09 | 1.52E+09 | 1.55E+09 | 1.55E+09 | 1.55E+09 | 1.54E+09 |
Factor de seguridad
Un aspecto importante en el diseño de prótesis es determinar el factor de seguridad (FS). Dicho factor está definido en función del criterio de falla de von Mises, y se muestra en la ecuación 3. El factor de seguridad debe ser mayor o por lo menos igual a uno.
Donde σlim es el esfuerzo en el límite elástico del material.
Como se puede observar en la Tabla 6, la prótesis hecha de Ti-6Al-4V tiene valores del factor de seguridades superiores a uno.
Tabla 6 Factores de seguridad.
| Material | Ti-6Al-4V | 316-L | L-605 | |||
|---|---|---|---|---|---|---|
| Modelo | Hueco | Sólido | Hueco | Sólido | Hueco | Sólido |
| Actividad | Factores de seguridad | |||||
| Caminar | 1.09 | 1.09 | 0.20 | 0.20 | 0.37 | 0.39 |
| De pie | 1.22 | 1.22 | 0.22 | 0.22 | 0.41 | 0.40 |
| Andar en bicicleta | 2.31 | 2.36 | 0.43 | 0.43 | 0.77 | 0.78 |
| Levantarse | 1.37 | 1.31 | 0.25 | 0.24 | 0.46 | 0.43 |
| Bajar escaleras | 0.59 | 0.60 | 0.11 | 0.11 | 0.20 | 0.20 |
| Subir escaleras | 0.79 | 0.81 | 0.15 | 0.15 | 0.27 | 0.27 |
| Sentarse | 1.48 | 1.46 | 0.15 | 0.21 | 0.49 | 0.49 |
| Trotar | 0.60 | 0.61 | 0.11 | 0.11 | 0.20 | 0.20 |
Lo que significa que resistirá las cargas máximas aplicadas como resultado de realizar las actividades de: Caminar, estar de pie andar en bicicleta, levantarse y sentarse.
Por otra parte, las actividades como subir y bajar escaleras no las podrá realizar, puesto que comprometen la integridad de la prótesis. Finalmente, se puede decir que las prótesis fabricadas de acero 316-L y L-605 no son recomendables para su uso, puesto que tienen un factor de seguridad inferior a uno.
Ciclo de marcha
Una prótesis de cadera no recibe cargas constantes, sino que más bien son aleatorias como en el caso del ciclo de marcha, para lo cual se han considerado los datos publicados por [19-21] y que se muestran en la Tabla 7.
Tabla 7 Cargas generadas por un paso completo en marcha humana normal.
| Posición | Tiempo(s) | Rx (N) | Ry (N) | Rz (N) |
|---|---|---|---|---|
| 0 | 0 | -119.30 | -0.45 | -528.30 |
| 5 | 0.059 | -181.20 | 176.94 | -1094.00 |
| 10 | 0.118 | -245.60 | 419.22 | -1840.00 |
| 15 | 0.177 | -282.80 | 518.40 | -2021.00 |
| 20 | 0.236 | -273.80 | 443.25 | -1892.00 |
| 25 | 0.295 | -247.10 | 315.99 | -1756.00 |
| 30 | 0.354 | -223.70 | 205.29 | -1667.00 |
| 35 | 0.413 | -186.20 | 125.64 | -1567.00 |
| 40 | 0.413 | -142.40 | 67.14 | -1465.00 |
| 45 | 0.472 | -71.67 | 47.48 | -1383.00 |
| 50 | 0.531 | -21.60 | 97.47 | -1398.00 |
| 55 | 0.59 | -143.80 | 115.20 | -1373.00 |
| 60 | 0.649 | -355.40 | 62.82 | -1080.00 |
| 65 | 0.708 | -322.00 | 32.27 | -801.30 |
| 70 | 0.767 | -295.40 | 7.74 | -643.00 |
| 75 | 0.826 | -240.20 | -9.00 | -499.00 |
| 80 | 0.885 | -202.10 | -16.83 | -401.30 |
| 85 | 0.944 | -164.00 | -503.00 | -327.20 |
| 90 | 1.003 | -123.20 | 9.77 | -323.60 |
| 95 | 1.121 | -100.70 | 8.69 | -437.90 |
| 100 | 1.18 | -97.20 | -9.00 | -509.90 |
En la Figura 9 se muestra el ciclo de marcha para la prótesis de Ti-6Al-4V. En la cual se pueden apreciar dos picos de esfuerzo de von Mises máximos que concuerdan con los resultados del análisis estático de caminar y de pie. Lo anterior es debido a que para el análisis estático se consideraron las condiciones de máxima carga, y que a los 0.177 segundos de iniciada la marcha se alcanza una condición de máximo esfuerzo, que además resulta ser el máximo absoluto. Por otra parte, el segundo máximo se alcanza a los 1.003 segundos de la marcha, es decir 3 posiciones antes de terminar el ciclo de la marcha.
Prótesis de Ti-6Al-4V
Para las actividades propuestas a realizar con la prótesis Ti-6Al-4V, podemos observar en la Tabla 5 que, en las condiciones de caminar, parado, andando en bicicleta, levantarse y sentarse, en ambos casos de prótesis (prótesis sólida y prótesis hueca), no sufre deformación alguna ni se presentaría riesgo de fractura del cuello femoral. Pero al realizar cualquiera de las actividades como subir escaleras, bajar escaleras y trotar, la prótesis no sólo se deformará permanentemente, sino que se fracturará del cuello femoral, siendo así que de optarse por este modelo el paciente estaría limitado a conservar su peso corporal y a tener restringido la práctica de subir y/o bajar escaleras, así como de trotar.
Prótesis de 316-L
Los modelos de prótesis realizados (sólida y hueca), en todas las actividades sugeridas (Tabla 5), presentan deformación permanente y ruptura del cuello femoral a excepción de andar en bicicleta, ya que al realizar esta actividad la prótesis sufrirá de formación permanente pero no llegará a sufrir fractura. Lo anterior, es debido a que, en una condición ideal, el peso corporal es soportado y distribuido por el asiento de la bicicleta.
Prótesis de L-605
El modelo hueco realizado en este material sufrirá deformación permanente en todas las actividades propuestas, pero únicamente en la condición de caminar, subir y bajar escaleras y trotar la prótesis fallará.
En cuanto al modelo sólido de este mismo material tenemos que la prótesis sufrirá deformación permanente en todas las actividades propuestas, pero a diferencia del modelo hueco solo fallará en tres actividades como la anterior a excepción de caminar (Tabla 5).
Conclusiones
Los resultados obtenidos demuestran que el material idóneo para la fabricación de este tipo de prótesis es el Ti-6Al-4V, además de que éste permitiría realizar modelos tanto sólidos como huecos, suponiendo este último, un ahorro de material y proporcionando mayor ligereza en el modelo.
Cabe mencionar que los resultados son en función del peso del paciente, la topografía que presenta su fémur y las actividades que habitualmente realiza, y que deben de tomarse en cuenta al diseñar la prótesis para una persona con características diferentes y/o con necesidades de actividad física diferente, lo que hace necesario robustecer el cuello femoral ya que es el punto donde la prótesis tiende a fallar.
Finalmente, y como resultado del factor de seguridad para las diversas actividades, se propone mejorar el diseño a nivel del cuello femoral para así obtener un factor de seguridad superior a uno y garantizar la durabilidad y funcionalidad de la prótesis.











 nueva página del texto (beta)
nueva página del texto (beta)


















