Introducción
La cetoacidosis diabética y el estado hiperosmolar hiperglicémico son complicaciones agudas de la diabetes que se caracterizan por ser claras emergencias hiperglucémicas que ponen riesgo la vida de los pacientes [1]. Su manejo amerita un control glucémico estrecho debido a las posibles complicaciones que pueden generar [2], lo que involucra una alta demanda de tiempo del personal de salud, un aspecto difícil de cumplir en centros hospitalarios de alta demanda y alta saturación. El objetivo de este trabajo es describir el diseño y simulación de un software para el control automatizado, tipo Proporcional Integral Derivativo (PID) para el manejo de pacientes con cetoacidosis diabética (CAD) o estado hiperosmolar hiperglucémico (EHH) en el servicio de urgencias. El sistema descrito basa su funcionamiento en los conocidos páncreas artificiales, sin embargo, su utilización busca el descenso controlado de la glucosa sérica en un servicio de urgencias médicas con la finalidad de evitar complicaciones en el manejo, como son la hipoglucemia, edema cerebral y deshidratación, además de buscar un posible mejoramiento en los resultados terapéuticos tras su utilización dentro de bombas de infusión autónomas.
Generalidades: CAD y EHH
A pesar de los avances en el manejo de la diabetes mellitus, la CAD y el EHH son aún causas importantes de morbilidad y mortalidad. La incidencia anual de la CAD se estima en 4 - 8 episodios por cada 1,000 pacientes diabéticos [2]. La incidencia de EHH es menor que la de CAD, siendo causa de menos del 1% de las admisiones en pacientes diabéticos, sin embargo, tiene mayores tasas de mortalidad [2].
La CAD se caracteriza por datos bioquímicos de hiperglucemia, cetonemia, y acidosis con anión gap elevado. Por su parte el EHH se caracteriza por hiperglucemia, grados mínimos y variables de cetonemia, existencia de hiperosmolaridad sérica, un mayor grado de deshidratación, y por lo general ausencia de acidemia [1]. Otra diferencia entre estas dos patologías es que el EHH afecta con mayor frecuencia a pacientes con diabetes tipo 2, mientras que la CAD se relaciona con diabetes tipo 1, sin embargo, dentro de la población mexicana existe mayor prevalencia de CAD asociada a diabetes tipo 2 [2,3,4].
Dentro de la CAD se genera una total deficiencia de insulina sérica, lo que desencadena un estado catabólico caracterizado por glucogenólisis, proteólisis, y lipólisis, permitiendo esto último la utilización de ácidos grasos para la síntesis de cuerpos cetónicos en el tejido hepático, que pueden ser utilizados como sustratos energéticos por algunos tejidos, sin embargo, resulta también en cetonemia con la consecuente disminución del pH sérico [5]. En el EHH hay una insulinopenia no tan extrema como en la CAD, lo que evita la generación de lipólisis y cetogénesis [5].
Estos eventos fisiopatológicos se generan tras algún factor precipitante, como lo puede ser una terapia inadecuada de insulina, infecciones, evento vascular cerebral y otros eventos isquémicos de corazón o pulmón, pancreatitis, abuso de alcohol o drogas, así como el uso de medicamentos como corticoesteroides, tiazidas, diuréticos, simpaticomiméticos, y antipsicóticos [6].
En cuanto a la presentación clínica de la CAD y el EHH, se basa en poliuria, polifagia, polidipsia, debilidad, y signos físicos de deshidratación. La respiración de Kussmaul, náuseas, vómito, dolor abdominal, y aliento a manzana, se relacionan más a CAD [7]. La presencia de alteraciones en el estado de alerta, que van desde la somnolencia hasta el coma, son más usuales en el EHH [7].
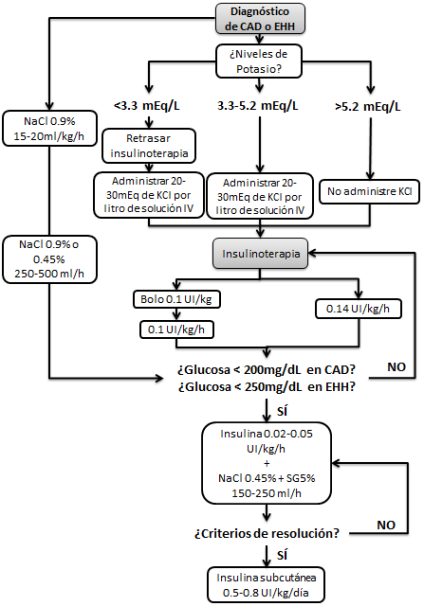
El manejo de dichas entidades clínicas consiste en primera instancia en la reposición de fluidos utilizando solución de cloruro de sodio (NaCl) al 0.9%, a una velocidad de 15 - 20 ml/kg/h en la primera hora, según la ADA (American Diabetes Association) [8]. En las siguientes horas es posible continuar el manejo con NaCl 0.9% o NaCl 0.45%, según sean los niveles séricos de sodio; ambas opciones se dan a 250 - 500 ml/h + 20 - 30 mEq/L de cloruro de potasio [5].
Los niveles séricos de potasio deben evaluarse antes de iniciar la insulinoterapia, ya que si estos son menores a 3.3 mEq/L se debe de reponer potasio antes de iniciar con la administración de insulina. En caso de tener niveles mayores a 5.2 mEq/L se recomienda no añadir potasio en las soluciones intravenosas. Si los niveles de potasio se encuentran en 3.3 - 5.2 mEq/L se recomienda añadir 20 - 30 mEq de cloruro de potasio (KCl) por cada litro de solución intravenosa (IV) infundida, procediendo a la insulinoterapia [5].
El tratamiento con insulina se inicia con un bolo de 0.1 UI/kg, seguido a los 5 minutos por una infusión continua de 0.1 UI/kg/h; alternativamente puede omitirse el bolo de insulina e iniciar con la infusión continua de 0.14 UI/kg/h. Si los niveles de glucosa no disminuyen en 50 - 70 mg/dL en la primera hora, se debe duplicar la dosis de infusión cada hora hasta alcanzar esta meta [5].
Al alcanzarse glucemias de 200 mg/dL en CAD y 250 - 300 mg/dL en EHH, se cambian las soluciones a solución glucosada al 5% (SG5%) + NaCl 0.45% a una velocidad de 150 - 250 ml/h, manteniendo una infusión de insulina de 0.02 - 0.05 UI/kg/h, siempre evitando valores de glucosa sérica menores a 200 mg/dL en CAD y 250 - 300 mg/dL en EHH, para evitar causar edema cerebral [5, 8].
Una vez alcanzados los criterios de resolución para CAD y EHH se suspende la insulina IV y se continúa con insulina subcutánea en dosis 0.5 - 0.8 UI/kg/día[2]. Los criterios de resolución para CAD incluyen glucosa < 200 mg/dL y dos de los siguientes: HCO3 ≥ 15 mEq/L, pH > 7.3, y anión GAP ≤ 12 mEQ/L [1,2].
En cuanto a los criterios de resolución para EHH, son osmolaridad sérica < 320 mOsm/kg y la recuperación del estado de alerta [1,2].
Entre las principales complicaciones del manejo de CAD y EHH se encuentran desequilibrios electrolíticos, principalmente de potasio, así como edema cerebral (0.3 - 1%) e hipoglucemia [9].
Sistemas PID y páncreas artificial
El objetivo de un sistema de control es regular las señales de salida de un sistema con base en respuestas o modificación de variables de operación, con el fin de mantener la o las variables objetivo dentro de parámetros preestablecidos, esto a pesar de perturbaciones que pudieran afectar el sistema [10]. En las últimas décadas, se ha buscado la aplicación de estos sistemas para el control de pacientes diabéticos, con la intención de mantener un control más estricto en los niveles de glucosa sérica, similar a como se haría de manera fisiológica. Estos equipos han sido llamados páncreas artificiales, los cuales sensan continuamente los niveles glucémicos del paciente y generan una respuesta de liberación de insulina, basados en el valor de referencia de glucosa y la señal de error del controlador, siendo común el uso de sistemas tipo PID para esta tarea [11,12].
Como ejemplo de la aplicación de sistemas de control PID en el manejo glucémico se encuentra el trabajo de Steil [13], donde se evalúa un sistema PID de lazo cerrado con monitoreo glucémico y liberación de insulina vía subcutánea, comparándolo con el uso de una bomba de infusión de insulina de lazo abierto, en el manejo de pacientes con diabetes mellitus tipo 1. En este trabajo se observó una incidencia de hipoglucemias similar entre ambos manejos, sin embargo, con el uso del sistema PID no se observaron hiperglucemias severas [13]. Otro trabajo que ejemplifica esta aplicación es el presentado por Huyett, el cual propone un sistema implantable con operación a nivel intraperitoneal con un funcionamiento que incluye un sistema PID, modelo de control predictivo y lógica fuzzy [14].
Dentro de los sistemas de lazo cerrado para el control glucémico, el algoritmo de control resulta una de las partes más importantes y complicadas de desarrollar, pero que marca la manera en cómo funcionará el sistema, sus ventajas y desventajas. En estos sistemas, es común el uso de algoritmos de control tipo PID, principalmente debido a su robustez y fácil desarrollo [15]. En el trabajo de Hu y Li, por ejemplo, se muestra el desarrollo y simulación de un algoritmo de control PID que basa su funcionamiento en la estimación del tiempo de acción de la insulina (IOB), un punto que resulta innovador. Estos autores establecen el IOB como un factor que varía de forma interpersonal e intrapersonal debido a múltiples factores, cuyo cálculo y uso dentro del algoritmo PID permite mejorar los resultados y evitar hipoglucemias [15]. El uso del IOB permite al algoritmo tomar en cuenta el estado metabólico actual del paciente para generar la señal de salida del sistema, un punto poco considerado por muchos de estos sistemas para insulinoterapia, pero de gran importancia en estados patológicos como CAD y EHH.
A pesar de que los algoritmos tipo PID son los más utilizados en sistemas automatizados de insulinoterapia, no son los únicos, existen los que emplean modelos de control predictivo (MPC), control adaptativo, control en modo deslizante, etc. En el trabajo de Pinsker et al, por ejemplo, se compara el uso de un algoritmo de control PID con uno MPC en el control glucémico de pacientes con diabetes tipo 1. Dentro del mismo se observó que el algoritmo MPC logró mantener a los pacientes en rangos glucémicos meta durante mayor tiempo que el algoritmo PID, además de lograr cifras glucémicas menores 5 h posteriores a la ingesta de alimentos. Sin embargo, no se encontraron diferencias estadísticas en el tiempo que tardaron ambos algoritmos para llevar a los pacientes a cifras glucémicas meta posterior a la ingesta de alimentos, lo que deja ver que ambos responden de manera similar ante cambios glucémicos bruscos [16].
A pesar de la existencia de diversos dispositivos de este tipo para el manejo glucémico de pacientes con diabetes mellitus, no existe en la literatura ningún trabajo que enfoque tales dispositivos al manejo de urgencias hiperglucémicas en este grupo de pacientes. Como se ha mencionado, las características intrínsecas de la CAD y el EHH vuelven todo un reto el control glucémico de estos pacientes, dado principalmente por las fuertes variaciones en la sensibilidad a la insulina, liberaciones incrementadas y variables de glucosa en el hígado, así como por los mismos desequilibrios fisiológicos generados por el propio manejo, como es el caso de la rehidratación hídrica agresiva y otros medicamentos que generan variaciones en el volumen intravascular. Esta dificultad en el control glucémico genera una gran demanda de tiempo para el personal en los servicios de urgencias médicas, por lo que la automatización de esta tarea podría resultar en una disminución de tiempo, costos y personal requerido para el manejo de pacientes con CAD y EHH.
En párrafos anteriores se ha mostrado que la utilización de sistemas de lazo cerrado con liberación automatizada de insulina podría resultar en mejores resultados terapéuticos en pacientes diabéticos, por lo que siguiendo esta premisa, el presente trabajo busca ampliar las aplicaciones y beneficios de estos dispositivos al área de las complicaciones agudas de la diabetes mellitus. Como primer paso en el desarrollo de un sistema de lazo cerrado con liberación automatizada de insulina para el manejo de CAD y EHH, se presenta el desarrollo y simulación de un algoritmo de control automatizado tipo PID, que fija las bases teóricas para el funcionamiento de este tipo de sistema. Por otra parte, se mencionó que el uso de variables como IOB mejora el funcionamiento de sistemas PID para el control glucémico, por lo que el algoritmo aquí planteado intenta retomar esta idea utilizando la sensibilidad a la insulina como método indirecto en la evaluación del estado metabólico altamente cambiante de pacientes con CAD y EHH.
Metodología
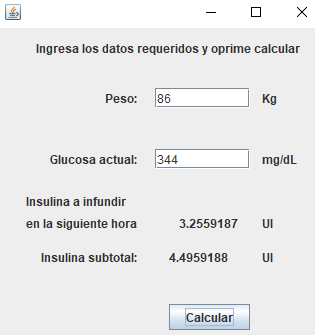
Se contempló un controlador automatizado tipo PID con retroalimentaciones de glucosa cada hora, que pudiera establecer la insulina necesaria para el manejo de paciente con CAD y EHH. La decisión de un sistema PID se basó en su robustez, adaptabilidad, fácil implementación y gran capacidad para compensar errores previos, actuales, así como predecir errores futuros, características de relevancia para el control de señales con alta variabilidad, como son los cambios glucémicos en pacientes con CAD y EHH [17]. El sistema se diseñó como software tipo aplicación (Figura 3), para mayor facilidad en el uso por parte del personal médico, bajo costo para su aplicación clínica, y pensando en una posterior fase de prueba, antes de una posible implementación como dispositivo biomédico autónomo con monitoreo glucémico continuo vía intravenosa o subcutánea.
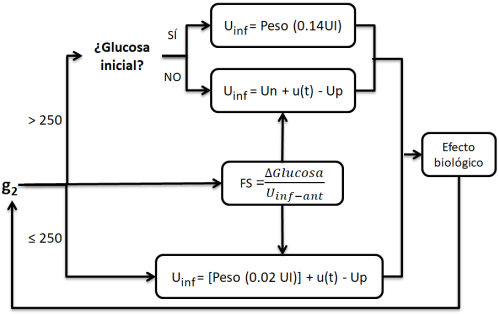
Figura 2 Algoritmo de decisiones del sistema. g2 : glucosa actual, Uinf: insulina total a infundir en la siguiente hora, Up: insulina activa de lo infundido en la hora anterior, Un: insulina necesaria para bajar glucosa 50 mg/dL en la siguiente hora, FS: sensibilidad a la insulina.
El controlador del sistema tendrá como señal de entrada, a través de cajas de texto en el software, los niveles de glucosa capilar ingresados cada hora (tiempo de muestreo del sistema) y el peso del paciente. Como señal de salida, se contempla las unidades de insulina (UI) a infundir durante la siguiente hora de tratamiento. Con esta señal de salida se busca cumplir como metas de tratamiento un descenso de la glucosa capilar de 50 mg/dL/hora hasta llegar a valores de 250 mg/dL, a partir de lo cual se buscará mantener los niveles de glucosa en 220 mg/dL con oscilaciones esperadas entre 200 - 250 mg/dL, que se llamarán hipoglucemias e hiperglucemias, respectivamente. Se eligió como valor de referencia 220 mg/dL, ya que es un punto entre lo recomendado para CAD (mayor de 200 mg/dL) y EHH (250 mg/dL) [6], además de ser un valor de referencia seguro ante posibles compensaciones excesivas del sistema que pudieran desencadenar hipoglucemias.
Según lo expuesto en el párrafo anterior, el funcionamiento del controlador se divide en 2 fases: el funcionamiento cuando existen niveles de glucosa capilar mayores a 250 mg/dL, y el funcionamiento del mismo con glucosas menores a 250 mg/dL. La Figura 2 muestra el algoritmo de decisiones del software para ambas fases.
Funcionamiento del sistema con glucosa > 250 mg/dL
Cuando las glucosas ingresadas al programa son mayores a 250 mg/dL se calculará la infusión de insulina con la finalidad de reducir la glucemia en 50 mg/dL/hora, como se recomienda en las guías de tratamiento [17]. El cálculo de la insulina a infundir se realizó tomando en cuenta: 1) la sensibilidad a la insulina del paciente en el momento actual, 2) la insulina necesaria para bajar la glucosa capilar 50 mg/dL/hora, 3) la insulina calculada por el sistema PID para corregir el error en el descenso de la glucosa capilar, 4) la insulina circulante con potencial actividad farmacológica dentro del cuerpo del paciente.
Como se mencionó, la sensibilidad a la insulina (FS) es un reflejo del estado metabólico del paciente en un momento dado, multifactorial, y altamente variable a lo largo del tratamiento de CAD y EHH. Para saber la insulina que necesita el paciente es necesario conocer antes la sensibilidad a la insulina, sin embargo, solo es posible saber el nivel de sensibilidad a la insulina observando la respuesta que tiene el paciente ante la administración de la misma. Según esto, no es posible saber la sensibilidad a la insulina sin antes infundirla al paciente, por lo que la primera acción del programa consiste en solicitar la glucosa inicial del paciente y su peso, para recomendar la infusión de insulina en dosis de 0.14 UI/kg durante la siguiente hora, según lo recomendado por las guías de tratamiento [7]. Tras dicha infusión, el programa espera reducir la glucosa en 50 mg/dL para la siguiente hora [18].
Una vez transcurrida la primera hora de tratamiento, el software obtiene la sensibilidad a la insulina del paciente conforme a la siguiente ecuación [19]:
Después de la primera hora, y sabiendo la sensibilidad a la insulina del paciente, el
software calcula la insulina necesaria para bajar 50 mg/dL (Un)
en la segunda hora de tratamiento, tomando en cuenta la glucosa actual
(g2) y el valor de referencia para la siguiente
hora
El siguiente paso sería calcular la insulina necesaria para compensar el error de descenso en la glucosa, la cual denotaremos como u(t), cuyo cálculo se basa en la siguiente ecuación general [10]:
Donde e(t) hace referencia al error en el descenso de la glucosa que se tuvo durante la hora anterior. Para explicar matemáticamente esto, tomaremos a (g1) como la glucosa obtenida en la hora anterior. Por ello, e(t) podría definirse como:
Las constantes para la ecuación 3 se establecerán como un tiempo derivativo (TD) de 90 min, y un tiempo integral (TI) de 150 min. Estos valores se derivan de simulaciones del algoritmo realizadas con valores prueba de TD entre 60 - 90 min, y de TI entre 150 - 450 min, valores utilizados por Steil [20], encontrándose que con TD = 90 min y TI = 150 min: se obtuvieron resultados menores en el e(t), así como menor frecuencia de hipoglucemias y descensos de glucosa por hora mayores a 100 mg/dL. La constante proporcional (Kp) se estableció como una variable dependiente de TD y la sensibilidad a la insulina según la siguiente ecuación [13]:
Con los valores de Un y u(t) se tiene la insulina que necesitará el paciente para la siguiente hora, lo cual se denotará como insulina subtotal (Usbt).
No obstante, a esta cifra es necesario restar aquella insulina que fue infundida la hora anterior y que aún permanece activa en el cuerpo del paciente. Ello depende de la tasa de degradación de la insulina. Para este trabajo se planteó un sistema unicompartimental intravascular, donde se considera que la tasa de degradación de la insulina es de 0.18 UI/min, es decir, 10.8 UI/hora [21,22,23]. Por ende, para obtener la cantidad de insulina que sigue activa de lo infundido en la hora anterior (Up), se deberá restar 10.8 unidades a la insulina infundida durante la hora anterior (Un-1):
Finalmente la insulina total a infundir durante la siguiente hora (Uinf), es decir, la señal de salida del controlador sería:
Este proceso se repite cada hora para el cálculo de la insulina a infundir en la hora siguiente.
Como medida de seguridad se limitó a U inf para valores máximos de ±15 unidades para pacientes con peso 50 - 90 kg, ±12 unidades con peso < 50 kg, y ±18 con peso > 90 kg. Tal decisión se tomó basada en simulaciones anteriores que mostraban la generación de fuertes descensos de glucosa/hora, por lo que esta adecuación al algoritmo busca limitar la intensidad en el descenso de la glucosa, así como el riesgo de hipoglucemia e hiperglucemias.
Funcionamiento del sistema con glucosa < 250 mg/dL
Una vez que se han alcanzado niveles de glucosa capilar menores a 250 mg/dL, o si la glucosa inicial del paciente era menor a esa cifra, el software cambia el valor de referencia de glucosa al cual quiere llegar, estableciéndolo en 220 mg/dL. En este punto, el software funciona de manera similar a lo explicado con niveles mayores a 250 mg/dL.
De igual manera, la infusión de insulina se hace basándose en la ecuación (7), sin embargo, se redefine la ecuación (2) con la que se obtiene Un. La nueva ecuación (2) consiste ahora en:
La anterior ecuación se deriva de la infusión de insulina base que recomiendan las guías de manejo una vez que se han alcanzado niveles de glucosa de 200 mg/dL en CAD y de 250 mg/dL en EHH, la cual es de 0.02 - 0.05 UI por kilogramo de peso [5,7,8]. Esta insulina de base se establece bajo la suposición de que al alanzar esas cifras glucémicas se iniciará una infusión continua de solución glucosada al 5% y cloruro de sodio al 0.45% a razón de 150 - 250 ml/hora, según lo marcado en las guías de manejo [5,7,8], algo que haría elevar la glucosa sérica del paciente, factor que se compensa por la insulina de base [7,8].
Para tal punto, lo que hará el sistema es regular la insulina de base para que la glucosa capilar se mantenga cercana a los 220 mg/dL. De igual manera, el sistema sigue tomando en cuenta la insulina circulante en el cuerpo del paciente.
Programación del algoritmo
Basado en las ecuaciones y estipulaciones antes mencionadas, se programó el algoritmo para el control glucémico utilizando el programa NetBeans IDE 8.2 con el lenguaje de programación Java (Figura 3), haciendo uso de un equipo de cómputo con sistema operativo de 64 bits Windows versión 10, procesador Intel Celeron N400 de 1.10 GHz, y 4GB de memoria RAM.
Para probar la funcionalidad del software diseñado se utilizaron los datos obtenidos del manejo de 10 pacientes con diagnóstico de CAD, tratados dentro del servicio de urgencias del Hospital Juárez de México durante los años 2018-2019.
La simulación consistió en utilizar la glucosa inicial reportada, el peso del paciente, y la sensibilidad a la insulina calculada durante cada hora de tratamiento. Con lo anterior se buscó observar la respuesta del software ante el cambiante estado metabólico de los pacientes. La Figura 4 muestra el método por el cual se realizó la simulación del software.
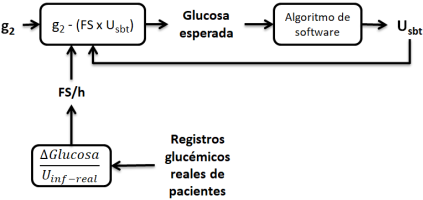
Figura 4 Metodología para la simulación. g2: glucosa actual, FS: sensibilidad a la insulina, FS/h: sensibilidad a la insulina por hora, Usbt: insulina subtotal, Uinf-real: insulina real infundida.
Se utilizó la ecuación (1) para la obtención de la sensibilidad a la insulina para cada hora de tratamiento, lo que permitió hacer una reproducción del estado metabólico del paciente a lo largo de su tratamiento. Posteriormente, se ingresó al software el peso y glucosa inicial del paciente. Una vez que el software estableció la insulina a infundir durante la siguiente hora se realizaron las predicciones sobre la glucosa esperada (GE), según la sensibilidad a la insulina del paciente durante la hora específica, basado en la siguiente ecuación:
Esta ecuación se deriva de un despeje y proyección hacia la próxima hora de la ecuación (1) haciendo a g1 = glucosa esperada, y a insulina usada en la hora anterior = Usbt. Se utiliza a Usbt debido a que la glucosa esperada dependerá del total de insulina que existe en el cuerpo del paciente durante la siguiente hora, es decir, la suma entre la insulina infundida y la aún circulante (Uinf + Up), que resulta matemáticamente en Usbt.
Los valores de glucosa esperada se ingresaron al software, repitiéndose el proceso el mismo número de veces que de horas de tratamiento en el servicio de urgencias hasta la resolución de la CAD o hasta el inicio de soluciones glucosadas intravenosa, siempre usando el valor de sensibilidad a la insulina que manejó el paciente en el momento específico del tratamiento.
Análisis estadístico
Con la finalidad de medir la efectividad del sistema con valores de glucosa > 250 mg/dL, se obtuvo el valor de descenso en la glucosa por hora (tanto en la glucosa real como en la simulada) para cada uno de los 10 casos, calculándose posteriormente el descenso medio de glucosa/hora (DMG), de las mediciones reales y simuladas. Además se evaluó la cantidad de horas necesarias para llevar la glucosa a niveles por debajo de 250 mg/dL en ambos tipos de mediciones, al igual que el número de descensos de glucosa mayores a 100 mg/dL/h.
Para valorar el funcionamiento del sistema en glucosas < 250 mg/dL se evaluó la existencia de hipoglucemias (glucosa < 200 mg/dL) o hiperglucemias (glucosa > 250 mg/dL después de haber entrado al rango de < 250 mg/dL) en mediciones reales y simuladas.
Se calculó además la cantidad total de insulina real infundida y de insulina simulada.
Finalmente, mediante el uso de IBM SPSS Statistics Versión 25 (IBM Corporation, USA) se buscó comparar las medias de las variables cuantitativas mediante el uso de la prueba t de Student para muestras relacionadas [24]. Para evaluar si los DMG real o simulada diferían de 50 mg/dL/h, valor establecido como referencia para los DMG, se aplicó la prueba t de Student para una muestra con un valor de prueba de 50 mg/dL/h. La comparación de las variables cualitativas binarias se realizó mediante la aplicación de la prueba de McNemar [24]. En todas las pruebas estadísticas realizadas se utilizó un valor p < 0.05 para considerar la existencia de diferencias significativas entre las mediciones evaluadas.
Resultados y discusión
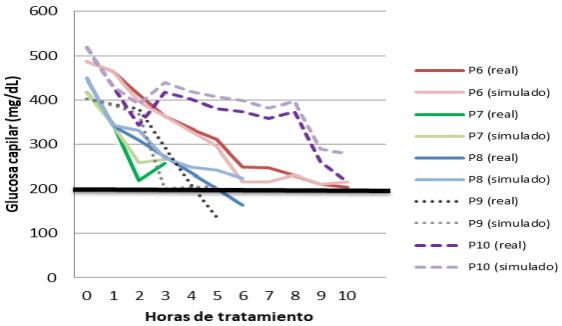
La población cuyos registros fueron utilizados en este estudio constó de 5 hombres y 5 mujeres, con una edad media de 36 años con DE 16.32, un peso medio de 71.9 kg con DE 22.42, así como una glucosa inicial media de 485.2 mg/dL con DE 90.69. Dentro de las Figuras 5 y 6 se muestran los descensos de glucosa por hora en las mediciones reales y simuladas, para cada uno de los 10 pacientes.
Se obtuvo un DMG de 51.94 mg/dL para las mediciones reales, mientras que para las mediciones simuladas el DMG fue de 51.73, no existiendo diferencia estadística entre ambas (Tabla 2). Por otra parte, si bien los DMG para mediciones reales y simuladas no mostraron diferencia estadística con los 50 mg/dL/h recomendados por las guías de tratamiento [17] (p = 0.8), aún así existieron algunos descensos de glucosa por hora que no se apegaron a las recomendaciones, tal y como se aprecia en las Figuras 5 y 6. En la Figura 7 se presenta de manera gráfica la dispersión los descensos de glucosa por hora, tanto en mediciones reales como simuladas. En esta figura se aprecia que las dispersiones de mediciones reales y simuladas resultan similares, es decir, el manejo brindado por médicos y por el algoritmo podría tener las mismas características.
Tabla 1 Insulina total infundida y simulada.
| Px | P1 | P2 | P3 | P4 | P5 |
|---|---|---|---|---|---|
| IR | 57 UI | 78 UI | 82 UI | 63 UI | 51 UI |
| IS | 42 UI | 38.8 UI | 51.4 UI | 56.3 UI | 27.1 UI |
| Px | P6 | P7 | P8 | P9 | P10 |
| IR | 154 UI | 19 UI | 65 UI | 36 UI | 165 UI |
| IS | 97.5 UI | 21.1 UI | 34.9 UI | 28.8 UI | 112 UI |
P: paciente, IR: insulina real, IS: insulina simulada, UI: unidades de insulina
Tabla 2 Pruebas estadísticas.
| Prueba t para muestras relacionadas | |||
|---|---|---|---|
| Variable | Media | T | Sig. |
| DMG real | 51.94 mg/dL | -0.58 | 0.955 |
| DMG simulada | 51.73 mg/dL | ||
| Descensos >100mg/dL/h reales | 0.7 | -0.557 | 0.591 |
| Descensos > 100mg/dL/h simulados | 0.8 | ||
| Insulina total real | 77.00 UI | 4.164 | 0.002 |
| Insulina total simulada | 50.99 UI | ||
| Horas necesarias para GR<250 mg/dL | 5.1 h | -0.802 | 0.443 |
| Horas necesarias para GS<250 mg/dL | 5.3 h | ||
| Prueba t para una muestra (valor de prueba = 50 mg/dL) | |||
| Variable | Media | T | Sig. |
| DMG real | 51.94 mg/dL | 0.259 | 0.802 |
| DMG simulada | 51.73 mg/dL | 0.194 | 0.851 |
| Prueba McNemar | |||
| Variable | Frecuencia | Sig. | |
| Hipoglucemias reales | 6 | 0.031 | |
| Hipoglucemias simuladas | 1 | ||
| Hiperglucemias reales | 1 | 1.000 | |
| Hiperglucemias simuladas | 0 | ||
DMG: descenso medio de glucosa, GR: glucosa real, GS: glucosa simulada, T: valor t, Sig: significancia estadística (valor p).
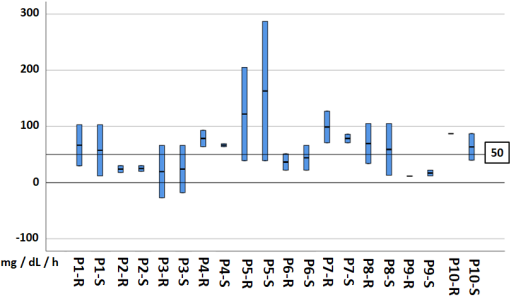
Figura 7 Dispersión en descensos de glucosa por hora en mediciones reales y simuladas. P: Paciente, R: Medición real, S: Medición simulada
Dentro de la Tabla 1 se muestra la cantidad total de insulina infundida de manera real y simulada en los pacientes. Dentro de algunas de las simulaciones, el software realiza la recomendación de valores negativos de insulina, debido a que busca generar un aumento en los niveles de glucosa, o contrarrestar la acción de un exceso de insulina circulante. En las sumas totales de insulina se toman en cuenta solo los valores positivos debido a que los negativos tienen otro significado que se comenta dentro de la discusión.
Se encontró una incidencia de hipoglucemias 6 veces menor en las mediciones simuladas, con respecto a las reales, cuya diferencia resultó estadísticamente significativa. Por otra parte, hubo una disminución del 33.7% en la cantidad de insulina necesaria para alcanzar las metas de tratamiento. No se encontró diferencia estadística entre las mediciones reales y simuladas en cuanto al DMG, así como en el número de horas de tratamiento necesarias para obtener glucemias menores a 250 mg/dL y en descensos de glucosa mayores a 100 mg/dL/h. Como se comentó anteriormente, tampoco se encontró diferencia estadística entre los DMG y el valor de prueba de 50 mg/dL de glucosa, meta de descenso glucémico por hora según las guías de tratamiento, lo que demuestra un apego a las guías de tratamiento [17]. En la Tabla 2 se resumen los resultados estadísticos de las pruebas de McNemar y t de Student para estas variables. Con estos resultados no solo se demuestra que el algoritmo presentado logra un manejo similar al brindado por el personal médico, sino que también podría generar mejoras en la frecuencia de hipoglucemias e insulina necesaria para el tratamiento, por lo que su utilización dentro de dispositivos automatizados de manejo glucémico para CAD y EHH resultaría viable.
Si bien dentro de la literatura reciente existen numerosos trabajos que proponen sistemas de control automatizado para el manejo glucémico de pacientes diabéticos [11,12,13,14], el presente trabajo buscó innovar en algunos puntos como son: la aplicación de estos sistemas en complicaciones agudas de la diabetes, su aplicación en el medio intrahospitalario y el uso de la sensibilidad a la insulina como parte de las variables de entrada para el control glucémico por parte del software controlador.
Según los datos arrojados por el análisis estadístico, el software genera DMG similares a cuando los niveles glucémicos son manejados por un médico, reduciendo además la incidencia de hipoglucemias. Esto da lugar a la suposición de que es posible la aplicación de este software dentro de un dispositivo biomédico autónomo para el manejo glucémico de pacientes con CAD sin la necesidad de la intervención del personal médico. Lo anterior resulta en una gran ventaja, ya que reduciría el tiempo que necesita invertir el personal médico del servicio de urgencias en este tipo de pacientes, un punto de gran beneficio principalmente en unidades hospitalarias de alta saturación y poco personal médico disponible. Asimismo, abre la posibilidad de una reducción en las complicaciones derivadas del tratamiento con insulina, aumentando la seguridad en el manejo de estos pacientes.
Por otra parte, en los resultados de la simulación se observó que el software a menudo recomienda la administración de cifras negativas de insulina, sin embargo de manera real esto no es posible realizarse, por lo que es de suponerse que en estos casos sería necesaria la administración de volúmenes específicos de solución glucosada intravenosa, ante la solicitud del sistema de un efecto hiperglucémico, contrario a lo generado por la insulina. Esta tarea debería ser realizada por el mismo equipo biomédico para conservar la autonomía de este, es decir, se requiere de una bomba de infusión dual de insulina y glucosa, similar a lo propuesto por Jacobs et al. con su propuesta de páncreas artificial dual de insulina-glucagón [25]. La cantidad de glucosa intravenosa a infundir deberá depender de la glucosa a aumentar en la siguiente hora, es decir, del error proporcional, obtenido mediante un despeje de la ecuación (1) con respecto a ∆Glucosa, así como de la farmacocinética de la glucosa en el cuerpo humano [26]. Este último punto no se evalúa dentro de este trabajo debido a que no es el objetivo, sin embargo, es un aspecto a resolver para la implementación del algoritmo en una fase clínica posterior.
Un resultado interesante en la simulación fue la reducción estadísticamente significativa de la cantidad necesaria de insulina para alcanzar las metas terapéuticas. Ello puede deberse a que el software toma en cuenta la sensibilidad a la insulina y la insulina circulante, logrando así aprovechar los momentos con alta sensibilidad a la insulina para generar descensos glucémicos apropiados para el estado metabólico del paciente, a la vez que evita infundir más insulina de la necesaria cuando aún existe insulina circulante en el organismo. Lo anterior resulta en otro potencial beneficio de la implementación del software en el manejo de pacientes con CAD, una posible reducción en el costo de la atención médica de los mismos.
Desafortunadamente no se encontró diferencia estadística entre los descensos de glucosa > 100 mg/dL entre las mediciones reales y simuladas, debido a que tales eventos se derivan de sucesos poco predecibles en el metabolismo de los pacientes que resultan en cambios drásticos en la sensibilidad a la insulina. La solución ante este problema es un monitoreo glucémico más frecuente, que permita al software notar a tiempo los cambios en la sensibilidad a la insulina, lo cual sería posible con la implementación de un monitoreo glucémico continuo que permita al software la toma de decisiones en periodos más cortos de tiempo. De tal manera que podrían generarse DMG más estables y con menor variación entre horas, lo que haría posible su aplicación no solo en pacientes adultos, sino también en pacientes pediátricos, donde el manejo glucémico debe ser más estricto dada la mayor facilidad con que generan edema cerebral, resultado de variaciones fuertes en la osmolaridad sanguínea [26].
Conclusiones
El algoritmo de control automatizado evaluado en el presente trabajo intenta brindar una opción de manejo que permita al médico ahorrar tiempo en el tratamiento de estos pacientes, así como mejorar los resultados terapéuticos y disminuir el riesgo de complicaciones derivadas del mismo. La principal limitación del estudio fue la imposibilidad de realizar pruebas del software con pacientes reales, sin embargo, la simulación fue un punto necesario debido a que: 1) no existe literatura sobre aplicaciones de sistemas de control automatizado en el manejo de estas patologías, y 2) el estado crítico de los pacientes vuelve poco ético su aplicación en humanos sin resultados previos de su funcionalidad. Dentro del trabajo se comprobó que el propio sistema podría ser capaz de lograr un manejo glucémico similar al brindado por el personal médico en el tratamiento de la CAD, apegándose a las guías de tratamiento, además de evitar hipoglucemias y generar un menor gasto de insulina durante la terapéutica. Lo anterior abre la puerta a una posible utilización de este sistema dentro de un dispositivo biomédico autónomo para el manejo glucémico de pacientes con complicaciones agudas de la diabetes dentro del servicio de urgencias, pudiendo así acercar a la medicina un paso más hacia la automatización de la terapéutica en el paciente crítico.











 nueva página del texto (beta)
nueva página del texto (beta)