INTRODUCCIÓN
Los adhesivos sensibles a la presión (PSA) son materiales viscoelásticos que, en su estado seco y a temperatura ambiente, se vuelven pegajosos cuando se aplica una pequeña presión. Debido a estas propiedades, los PSA tienen una gran cantidad de aplicaciones, desde la industria de la construcción hasta la medicina. Los PSA se han sintetizado mediante polimerización en emulsión y se han incorporado una amplia variedad de rellenos nanométricos para modificar sus propiedades o incluso añadir nuevas características. Las nanopartículas de ZnO (NPZnO) son materiales inorgánicos que se pueden incorporar en una matriz polimérica. Las propiedades intrínsecas del PSA dependen de la fase del polímero y de las propiedades antimicrobianas y citotóxicas del material inorgánico de relleno. ZnO tiene una amplia gama de aplicaciones en ingeniería, medicina y aeronáutica, entre otros. Dicha aplicación incluye dispositivos automotrices, sistemas de comunicación, sistemas biológicos tales como biomateriales para ingeniería de tejidos, polímeros de memoria de forma como interruptores moleculares, biosensores, diagnóstico de laboratorio y liberación de fármacos [1]. Existen diferentes factores que afectan la funcionalidad del PSA, entre los que se encuentran la composición, la morfología de las partículas, la resistencia adhesiva, la flexibilidad, entre otros [2]. Se han publicado varios trabajos relacionados con la síntesis de PSA con diferentes partículas nanoestructuradas, para mejorar las propiedades mecánicas y de liberación del fármaco, o aumentar la conductividad eléctrica. Por lo tanto, Jingyeong O. (2009) [3] prepararon composiciones de nanoarcillas de montmorillonita de poliacrilato (MMT) en diversos contenidos de arcilla por mezcla mecánica y polimerización en emulsión in situ. Descubrieron que la temperatura de transición vítrea (Tg) del polímero y las propiedades viscoelásticas dependen de la concentración final de MMT. Las propiedades mecánicas de PSA usando EA/EHA llena de NaMMT fueron estudiadas por Lofton L. (2004) [4]. Descubrieron que las propiedades adhesivas se ven fuertemente afectadas por el tipo y la cantidad de nanoarcillas incorporadas. Por ejemplo, la fuerza de delaminado y adherencia disminuyó gradualmente con una mayor cantidad de nanoarcilla de MMT. Y se observó un aumento sustancial en el esfuerzo cortante. El contenido máximo determinado de arcilla modificada fue 1% en peso. Mientras que se observó una influencia moderada sobre la adherencia, la resistencia al despegue y el esfuerzo cortante cuando se incorporaron nanoarcillas no modificadas [5,6].
Otra investigación presenta la incorporación de silicato de sodio a nanoescala a Poli (2-EHA-co-AA) con el fin de mejorar la absorción de sodiocloxacilina. También Wang et al. (2006) [7], desarrollaron un adhesivo de polibutilacrilato y SWNT (nanotubos de carbono de pared simple) para aumentar la conductividad eléctrica. Los SWCNT se funcionalizaron con poli (alcohol vinílico) (PVA), en una proporción de 0,3% en peso. Los resultados demostraron que la conductividad aumenta en diez órdenes de magnitud. También en este umbral, la adhesión cambia y se observó un aumento en la pegajosidad. De la misma manera, la energía de adhesión aumenta aproximadamente un 85% con la adición de PVA-SWNT a la misma concentración. Aunque hay varios informes sobre la preparación de nanocompuestos adhesivos de PSA acrílico, no se han encontrado informes que impliquen la incorporación de NPZnO, modificadas o no modificadas en la superficie, en la matriz de polímero adhesivo PSA.
Por lo tanto, en este trabajo se discute la síntesis de NP esféricas de ZnO y su incorporación a PSA. Las NPZnO se modificaron en superficie con dos agentes diferentes: 3-aminopropiltrietoxisilano (APTES) y dimetilsulfóxido (DMSO) a contenidos de 0.1, 0.2 y 0.3% en peso. Las nanopartículas obtenidas se caracterizaron por difracción de rayos X (XRD) y microscopía electrónica de transmisión (TEM). El compuesto PSA/NP obtenido se estudió mediante microscopía electrónica de transmisión (TEM), resistencia al delaminado y pruebas antimicrobianas contra dos microorganismos diferentes: Staphylococcus aureus (S. aureus) y Streptococcus pyogenes (S. pyogenes), y finalmente, se realizaron pruebas de citotoxicidad en los adhesivos obtenidos.
METODOLOGÍA
Materiales
Acrilato de 2 etilhexilo (2-EHA), Metilmetacrilato (MMA), ácido acrílico (AA), persulfato de amonio (APS), Latemul-180, dodecanotiol, hidroquinona (HQ) acetato de zinc (Zn(Ac)2•2H2O), hidróxido de sodio (NaOH), dimetilsulfoxido (DMSO) y aminopropiltrimetoxisilano (APTES) todos con 98% de pureza y de Sigma Aldrich. Etanol fue obtenido de J.T. Baker y agua desionizada de un sistema de columnas de intercambio iónico (Cole-Parmer Instruments).
Preparación de las nanopartículas de ZnO (NPZnO)
NPZnO fueron sintetizadas preparando una solución etanólica de 0.06 M de Zn(Ac)2•2H2O que fueron colocadas en un reactor. Enseguida la mezcla fue puesta en reflujo a 80 °C por 2 h a 100 rpm. Después de agregar una solución aucosa que contenía 0.22M de NaOH, la mezcla resultante se puso en marcha durante 12 h a temperatura ambiente y el precipitado se hizo pasar por centrifugado tres veces con el 500 mL de etanol y se secó en una estufa a 80 °C durante 24 h.
Modificación superficial
La modificación superficial de las NPZnO fue llevada a cabo colocando 10 g de nanopartículas en un matraz bola de 3 bocas provisto de un condensador al que se adicionaron 100 mL de octano como solvente. Los diferentes agentes modificantes (dimetil sulfóxido y 3 aminopropiltrietoxisilano) se añadieron en una relación en masa de 2:1. La reacción se llevó a cabo mediante reflujo durante 3 h a 80 °C y agitación constante. Después el sistema fue enfriado, el material se pulverizó y secó durante 12 h a 80 °C para su posterior caracterización.
Síntesis de adhesivo sensible a la presión (PSA)
Diferentes concentraciones de nanopartículas (0.1, 0.2 y 0.3%), sin y con modificación superficial con los agentes APTES y DMSO, fueron dispersadas en la mezcla de monómeros 2-EHA/MMA en una relación en masa de 4:1; es decir, se añadieron 16 mL de 2-EHA y 2 mL de MA del agente de transferencia de cadena AA, así como 2 partes por 100 partes de monómero en peso (phm) utilizando un sonificador Branson W700 con un 38% de potencia por 15 minutos, siendo esta la fase oléica en el sistema de polimerización. Asimismo, se preparó una solución micelar en una relación peso surfactante/agua (Latemul 180/H2O) de 0.8/99.2%, agitando durante 30 minutos; luego se adicionó la fase oléica y se mantuvo por 5 minutos. Después, los componentes de la emulsión se colocaron en un reactor enchaquetado con flujo de nitrógeno para prevenir la oxidación. La reacción se realizó a una velocidad de 400 rpm, a 80 °C, durante 2 h. También se controló el pH con una solución de NaOH al 10% como agente neutralizante para modificar la acidez de la emulsión.
Caracterización
Las NPZnO fueron caracterizadas mediante un análisis de XRD llevado a cabo en un difractómetro SIEMENS D-5000 con radiación CuKα para identificar la fase cristalina de las nanopartículas. Las NPZnO sin y con modificación y el PSA fueron caracterizadas con un JEOL 1200XII TEM para obtener la distribución de tamaños de partícula y la incorporación de las nanopartículas en el PSA. El análisis de FT-IR fue llevado a cabo en un espectrofotómetro Nicolet Magna 5500 utilizando ATR de las muestras de los PSA obtenidos para identificar las bandas de absorción presentes en cada uno de los materiales sintetizados. La determinación de la temperatura de transición vítrea (Tg) se determinó mediante calorimetría diferencial de barrido (DSC) en un DSC modelo 2920 (TA Instruments) a presión constante en una amplitud de ±1 °C cada 60 s a una velocidad de 10 °C/min hasta temperatura ambiente.
Resistencia a la delaminación
Las pruebas mecánicas que se practicaron a los adhesivos sin y con NPZnO, para determinar la fuerza de delaminación y de corte, se realizaron depositando material adhesivo en una película de polietileno, las cuales fueron puestas a secar a temperatura ambiente por 48 h para evaporar el agua y el monómero residual presente. Después se cortaron tiras de 25.4 mm de ancho, preparadas mediante un recubrimiento preciso de 0.03 mm de espesor del adhesivo con y sin nanopartículas aplicado, bajo condiciones fijadas por los estándares de ASTM, a una temperatura de 23 °C y 50% de humedad relativa y bajo los procedimientos establecidos por la ASTM para la evaluación de los materiales sintetizados en este trabajo, Pelaje: D3330/D 3330M-04 y adhesión de corte: D3654/D 3654M-02, la cual marca una velocidad de prueba de 300 mm/min (11.8100 in/ min). Se utilizó un rodillo de 2.06 Kg el cual se pasó tres veces por la muestra para ejercer presión sobre ella. Los ensayos se llevaron a cabo en una máquina de ensayos universal marca Instron.
Determinación de la actividad antimicrobiana de las nanopartículas y de los adhesivos
Con la finalidad de evaluar la sensibilidad antimicrobiana de los nanocompuestos y las nanopartículas en estudio, se procedió a la realización de pruebas microbiológicas, las cuales comprenden el método de difusión con disco en agar de acuerdo con los estándares marcados por CLSI (Instituto de Estándares Clínicos y de Laboratorio). En el caso de las nanopartículas se pusieron discos de nanopartículas de 1 cm de diámetro obtenidos por compresión y de los nanocompuestos se colocaron muestras de 2 cm de diámetro provistas de un soporte de polietileno.
La suspensión bacteriana se extendió en 3 planos sobre la superficie de la placa de agar sangre (AS) para S. pyogenes y Mueller Hinton (MH) S. aureus usando un hisopo de algodón. Los discos de NPs y de los nanocompuestos con diferentes concentraciones de NPs se depositaron sobre el agar inoculado, con al menos 3 cm de separación una de otra y no más de 5 discos por placa de agar. Cabe mencionar que el ensayo se realizó por triplicado. Las placas con agar se incubaron en un ambiente aeróbico a 37 °C, de 18 a 24 h. Al día siguiente se registraron las zonas de inhibición, de cada sistema en estudio, para cada una de las bacterias analizadas, se realizaron los cálculos respectivos para obtener la media de las tres repeticiones realizadas.
Ensayos de citotoxicidad
Se utilizó la línea celular HeLa (ATCC CCL-2), fueron crecidas utilizando Dulbecco's Modified Eagle Medium (DMEM) y en el medio RoswellPark Memorial Institute (RPMI-1640), respectivamente, fueron incubadas a 37 °C en una cámara de CO2 al 5%. Buffer fosfatos, suero bovino fetal, glutamina y piruvato de sodio (Gibco), y bromuro de 3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT, Sigma Aldrich).
Las células fueron cultivadas en placas de 96 pocillos, donde se sembraron 8,000 células por pozo y se incubaron con los adhesivos en forma de látex sin y con NPZnO, para determinar la citotoxicidad. Después de 24 h, se midió la viabilidad celular mediante el ensayo MTT [8]. Para ello, se añadió a cada pocillo 80 μL del reactivo MTT a una concentración de 5 mg/mL (Sigma-Aldrich St. Louis, Mo. USA), y se incubaron por 4 h.
Lectura de resultado
Pasadas las 4 h se retiró el sobrenadante de cada pocillo y se añadieron 800 μL de DMSO (Dimetilsulfóxido) para disolver los cristales formados. 200 μL se transfirieron a una caja de 96 pozos para realizar la lectura a 595 nm en un lector de placas de ELISA marca BioRad. El control sin NPs se tomó como un 100% de viabilidad celular y a partir de este punto se calculó el porcentaje de viabilidad del resto de los pocillos con la siguiente fórmula. % de viabilidad = (lectura 595 nm tratamiento/lectura 595 nm control sin tratamiento) X100.
RESULTADOS Y DISCUSIÓN
El patrón de difracción de XRD de las NPZnO obtenidas a partir del método de precipitación química se muestra en la Figura 1.
Las nanopartículas obtenidas presentaron una estructura hexagonal tipo wurtzita correspondiente al ZnO. El diámetro promedio de partícula se calculó a través de la ecuación de Debye-Scherrer [9], usando el ancho medio máximo β de las líneas de difracción de rayos X.
Donde, D es el diámetro de la partícula, k es la constante de scherrer, λ es la longitud de onda de los rayos X, β la anchura del pico a la mitad del máximo, θ es el ángulo de difracción de Bragg. De acuerdo con esta ecuación el diámetro determinado de las NPZnO mediante esta técnica fue de 17 nm aproximadamente.
La Figura 2a y b muestra una micrografía de TEM de las NPZnO sin modificación y la imagen de las NPs modificadas superficialmente con APTES, respectivamente. La Figura 2a muestra las NPZnO, las cuales presentan un tamaño promedio de 41 nm, estas tienden aglomerarse debido a la alta energía superficial de las nanopartículas. La Figura 2b muestra la imagen de las NPs modificadas en la que se observa un recubrimiento depositado sobre la superficie de las nanopartículas como resultado de la modificación. El espesor del agente de modificación no se aplicó uniformemente sobre la superficie de las NPZnO, como se puede apreciar en la Figura 2b. El espesor del recubrimiento de las nanopartículas se relaciona con el tiempo de funcionalización, temperatura y relación molar utilizada entre otros. El recubrimiento puede estar unido químicamente a la nanopartícula por medio de enlaces Si-O o enlaces covalentes, ya que durante el tratamiento se generan algunos radicales libres del ZnO en la superficie de las nanopartículas y estos pueden interactuar químicamente [10]. Esto produce que las nanopartículas tienden a tener una mejor dispersión cuando son incorporadas a una matriz polimérica, lo cual es atribuido al impedimento estérico entre las nanopartículas que reduce así su tendencia a aglomerarse [11]. Este efecto puede deberse a la interacción que tienen los agentes de modificación con los monómeros, debido a que hay un cambio en el grado de incorporación de las NPs con los agentes de modificación.

Figura 2. Micrografías obtenidas por TEM de las nanopartículas de ZnO sin modificar a) y b) modificadas con APTES.
La modificación superficial de las NPs puede llevarse a cabo en forma individual o como grupos de partículas. Es muy difícil recubrir sólo partículas individuales, ya que es muy conocido que las nanopartículas se adhieren entre sí debido a su alta energía superficial [10].
En la Figura 3 se muestra el espectro infrarrojo de los PSA con y sin NPZnO al 0.3%. En ambos casos, las bandas características de IR corresponden al estiramiento del enlace C=O de los grupos ésteres presentes en el copolímero en 1734 cm-1. De igual manera las bandas de 1241-1161 cm-1 corresponden a la flexión del enlace C-O, mientras las bandas de estiramiento de las cadenas saturadas (C-H) aparecen entre 3000-2880 cm-1, las cuales corresponden a los metilos y metilenos presentes [12]. A diferencia del espectro infrarrojo del PSA, en el FT-IR del PSA/NPs también aparece una señal de alrededor 1578 cm-1, la cual corresponde a los residuos de monómeros (C=C) [13], esto debido a que no se alcanzó una total conversión. Adicionalmente, también en el espectro infrarrojo del PSA/NPs aparece una banda alrededor de 618 cm-1, la cual corresponde a la banda de flexión del enlace Zn-O [14].

Figura 3. Espectro infrarrojo de los adhesivos sensibles a la presión (PSA) antes y después de la adición de nanopartículas.
La Tabla 1 presenta el estudio de las pruebas DSC que fue realizado a los adhesivos PSA/NPZnO, PSA/NPZnO-DMSO, PSA/NPZnO-APTES utilizando diferentes concentraciones de NPZnO (Tabla 1). En el PSA con menor concentración de nanopartículas sin modificar muestra una Tg de -59.35 °C la cual se incrementa conforme se incrementa la concentración de nanopartículas a -47.9 °C, mientras que con las NPZnO-APTES y NPZnO-DMSO se observa también el mismo efecto debido a que la estructura de los adhesivos se vuelve más rígida en presencia de las nanopartículas. Este comportamiento produce un incremento en las propiedades de pegajosidad (Tack) y adhesión de los adhesivos, además que nos indica que las NPZnO producen una alta estabilidad térmica, ya que retrasan la transmisión rápida de calor y lo que puede limitar la descomposición del material [15].
Tabla 1. Transición vítrea (Tg) de nanocompuestos de PSA con diferentes partículas.
| Muestra | Contenido de nanopartículas (%) | ||||
|---|---|---|---|---|---|
| Tg (ºC) | 0 | 0.1 | 0.2 | 0.3 | |
| PSA | -59.35 | --- | --- | --- | |
| PSA/NPZnO | --- | -50.29 | -47.9 | -50.71 | |
| PSA/NPZnO-APTES | --- | -49.21 | -49.51 | -48.63 | |
| PSA/NPZnO-DMSO | --- | -48.3 | -69.29 | -51.9 | |
Actividad antimicrobiana
Una vez modificadas las nanopartículas, se procedió a analizar el efecto antimicrobiano de éstas en comparación con las no modificadas, así como su efecto cuando son incorporadas a los PSA. Estos análisis se realizaron utilizando la técnica de difusión de disco en agar para los microorganismos S. aureus y S. pyogenes como se muestra en la Figura 4. Las NPs sin modificar y modificadas superficialmente exhibieron un efecto inhibitorio sobre el crecimiento bacteriano, para cada microorganismo. Este efecto puede ser debido a que como las bacterias Gram positivas carecen de una membrana protectora alrededor de las capas de peptidoglicano en la pared celular, esto les permite interactuar y romper la membrana externa más fácilmente y así inhibir, con mayor eficiencia, el crecimiento de bacterias Gram positivas [16]. La diferencia en la actividad antimicrobiana de las NPs modificadas y no modificadas se relaciona con el número de vacancias de oxígeno que son típicas de las propiedades del ZnO. Un aumento en el número de vacancias de oxígeno hace que las NPs se carguen positivamente y, por lo tanto, realza las interacciones electrostáticas entre las NPs. Para el caso de las NPs modificadas, el efecto inhibitorio se puede atribuir a la presencia de los enlaces Si-O que dan una buena cobertura superficial a las NPs y actúan como una barrera energética. La modificación superficial genera un aumento en la permeabilidad de la membrana y la penetración celular. Esto puede dar lugar a una disminución en la cantidad de proteína en las células expuestas en las NPs modificadas porque el ZnO es altamente reactivo con estas moléculas [17].
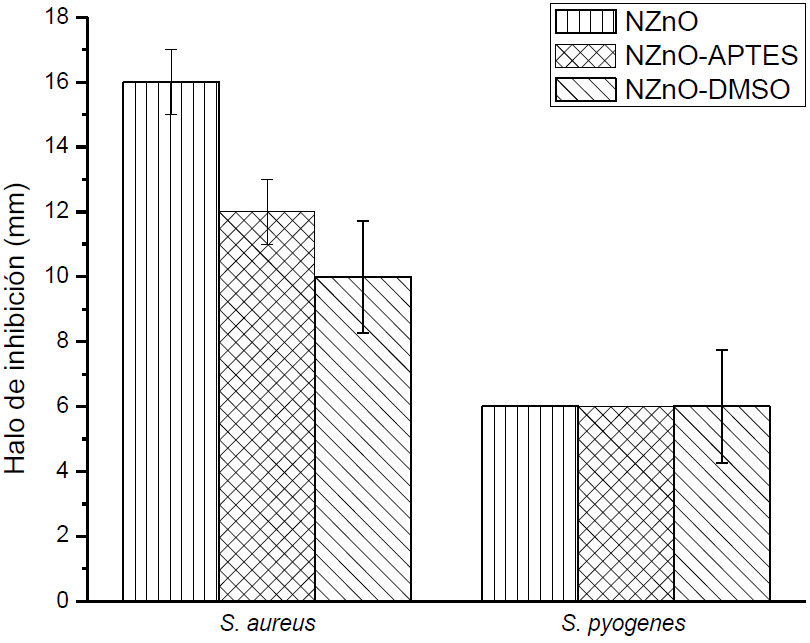
Figura 4. Halos de inhibición de las nanopartículas de óxido de zinc sin y con modificación frente a S. aureus y S. pyogenes.
La actividad antimicrobiana de los PSA con las NPs modificadas y sin modificar presenta un efecto inhibitorio muy similar contra ambos microorganismos cuando se incrementa la concentración de NPs en los PSA, ya que generan un aumento en el número de moléculas de oxígeno activo que causan la muerte celular. Lo que sugiere que las NPs se adhieran a la membrana celular interrumpiendo su respiración e interactuando con un tipo particular de enzimas causando así la muerte celular. Los resultados obtenidos nos indican que el uso de NPZnO sin modificar y modificadas como agentes antimicrobianos en matrices poliméricas produce grandes beneficios para la salud ya que estos microorganismos no generan resistencia a este tipo de NPs, contrario a la resistencia que pueden generar a algunos antibióticos (Figura 5).
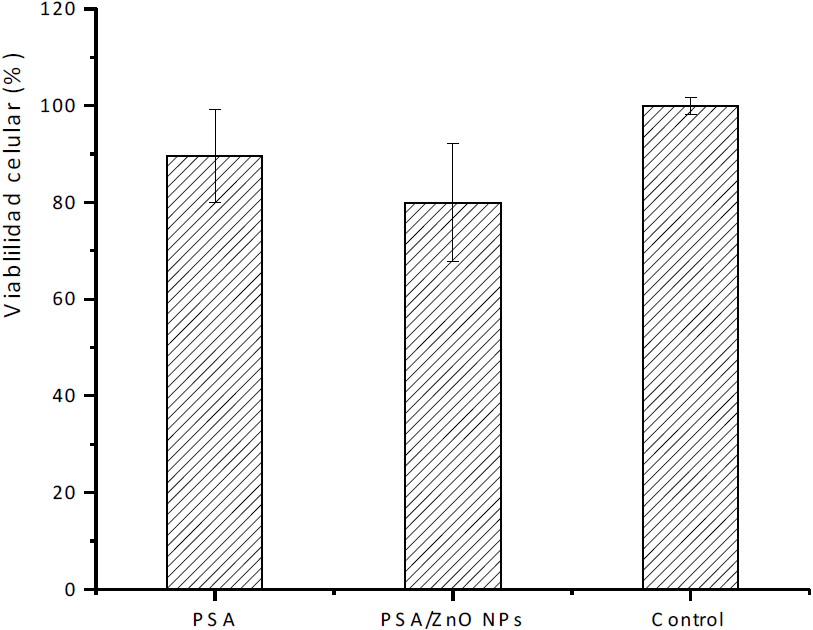
Viabilidad celular
Los resultados de viabilidad celular evaluada mediante el método MTT, señalan que los PSA sin y con la presencia de NPZnO (Figura 6), poseen una viabilidad del 90 y 80 % con respecto al control sin tratamiento. Esta disminución en la viabilidad celular puede ser atribuida a la liberación del ión Zn+2, el cual es capaz de penetrar en compartimiento ácido de los liposomas e incrementar la generación de especies reactivas de oxígeno (ROS) [18] Se sabe también que el incremento en la disolución de los iones Zn+2 en el medio, es capaz de incrementar la citotoxicidad de las partículas, por lo cual es posible que los iones metálicos liberados por NPZnO contribuyeran a la toxicidad [19]. Sin embargo NPZnO, en las concentraciones añadidas, no resultan ser tóxicas, para las células HeLa acorde a la norma.
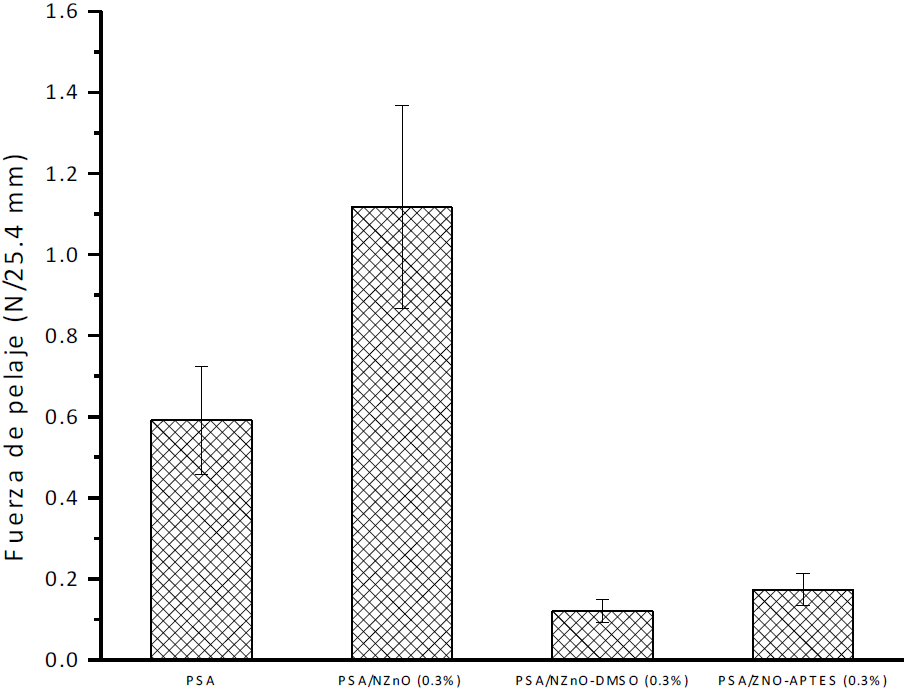
Resistencia al pelado (Prueba de adhesión a 180º)
Las propiedades de resistencia a la adhesión de los PSA preparados son las que definen el desempeño y uso final de los PSA (Figura 7). Los PSA sin y con la presencia de NPs muestran un marcado efecto en las pruebas de resistencia al delaminado (peel sterngth). En la muestra que contiene la mayor concentración de NPs sin modificar muestra un valor de 1.1 N/25mm que es el que presenta mejores propiedades. Esto se puede relacionar con el comportamiento en la Tg puesto que el incremento en la Tg produce un incremento en la adhesión [20]. Siendo estos resultados bastante adecuados para pegarse y despegarse de manera segura a la piel y alrededor de la herida, lo que ocasionaría menor trauma al ser removido de la piel.
CONCLUSIONES
Se sintetizó un copolímero de 2-EHA/MMA al cual, después de añadirle NPZnO presenta diferencias en composición y por consecuencia en su Tg. La modificación de las nanopartículas de ZnO incrementa las propiedades antimicrobianas frente a S. aureus y S. pyogenes, obteniéndose actividad antimicrobiana desde 0.1% del PSA-NPs. La adhesión se ve alterada por la modificación de las nanopartículas presentándose una mayor adhesión en el PSA-NPZnO. Esto es debido a que la modificación de las nanopartículas disminuye la presencia de grupos OH superficiales los cuales son responsables de la adhesión. En cuanto a la citotoxicidad, se muestra que ésta disminuye cuando se le incorporan NPs, sin embargo, esta disminución no es significativa.











 nueva página del texto (beta)
nueva página del texto (beta)