Introducción
Dentro de las problemáticas actuales de la medicina, el reemplazo y la regeneración de tejidos óseos es uno de los de mayor interés a nivel mundial, tanto en el área dental como ortopédica, ya que existen un sinfín de casos derivados de accidentes o enfermedades que comprometen severamente las habilidades motrices de las personas, ocasionando un serio problema económico y social. En los últimos años, se han realizado diversas investigaciones para el desarrollo de nuevos materiales que satisfagan las necesidades en el área biomédica, con el fin de ofrecer una mayor calidad de vida a los pacientes así como una solución a las problemáticas de salud actuales, aunado a esto, los avances tecnológicos para la obtención de materiales avanzados ha permitido desarrollar compuestos sintéticos capaces de interactuar directamente con los tejidos vivos, dando como resultado una integración completa del material.[1]
Así mismo, dentro de los materiales más estudiados actualmente para su posible aplicación como dispositivos ortopédicos o piezas dentales, son los de origen cerámico, ya que estos poseen propiedades esenciales para este tipo de aplicaciones, como lo son: alta estabilidad química (resistencia a la corrosión), baja toxicidad, resistencia a la abrasión, resistencia a la compresión, etc. Los óxidos de zirconio estabilizados en fase cúbica o tetragonal presentan propiedades mecánicas adecuadas, además de una baja toxicidad ya que este tipo de óxidos han demostrado ser inertes al ser introducido en el organismo. En general, la mayoría de las investigaciones de este tipo de materiales se han enfocado a aplicaciones en el área ortopédica, específicamente en el desarrollo de cabezas femorales. Sin embargo existen diversas aplicaciones del ZrO2 y sus compósitos tales como, injertos óseos, cementos óseos e implantes dentales y prótesis [2]. La estabilización del óxido de zirconio en estructura tetragonal o cúbica a temperatura ambiente, ha sido uno de los principales descubrimientos que han despertado el interés por este tipo de materiales, ya que estos polimorfos son los que exhiben las mejores propiedades físicas, lo cual deja un campo de aplicaciones muy diverso [3-6].
Por otra parte, los fosfatos de calcio son materiales cerámicos que han enfocado la atención de los investi gadores debido a que estos presentan, en algunos casos, interacciones químicas con los tejidos biológi cos y el medio, lo cual se deriva en una proliferación favorable de las células progenitoras, logrando así la regeneración de los tejidos circundantes y la integra ción del dispositivo constituido de fosfato de calcio. Sin embargo, este tipo de materiales presentan propie dades mecánicas limitadas, para su aplicación como piezas dentales o prótesis ósea, lo cual ha mermado su aplicación en estas áreas, limitándose a emplearse como recubrimientos o material de relleno [7]. Es por ello que en la actualidad el desarrollo de nuevos materiales es mediante la formación de compósitos, los cuales consisten en la fusión de dos o más materiales de dis tinta naturaleza, obteniendo de esta forma un material resultante con propiedades superiores o equivalentes a la suma de los materiales que lo conforman.
Los compósitos de HAp/ZrO2-8Y2O3 presentan excelentes propiedades mecánicas, así como una alta bioactividad en sistemas biológicos, específicamente en el sistema óseo, no obstante existen diversos problemas para la obtención de dichos compósitos, ya que estos poseen una combinación de materiales con propiedades muy distintas (dureza, temperatura de fusión, densidad), lo cual complica algunas de las variables más cruciales en el área de los cerámicos, como lo es la temperatura de sinterizado, así como la interacción de los componentes para formar fases distintas, es por ello que la metodología de síntesis es crucial para su obtención. La síntesis por mezclado líquido con base en el método de Pechini ofrece grandes ventajas para la obtención de dichos compósitos, ya que al ser una metodología sol-gel permite un gran control de la estequiometría, así como una alta homogeneidad de los materiales resultantes, [8-11].
Lo innovador de este trabajo radica en el hecho de que se pudo obtener en un solo paso, la formación de las fases de hidroxiapatita y óxido de zirconio estabilizado con un 8 % mol de itrio. Con las ventajas de lograr un sistema compuesto por ambas fases distribuidas uniformemente, con una distribución de tamaños de partícula uniforme en ambos casos, aunque la principal limitación del presente método, radica en la interacción de los cationes presentes en la reacción principal, ya que es posible propiciar la formación de otras fases secundarias. Aun así, fue posible la síntesis del compósito HAp/ZrO2-8Y2O3 por mezclado líquido utilizando el método de Pechini. Los materiales obtenidos demostraron ser bioactivos y no hemolíticos, aunque se requieres pruebas más específicas en cultivos celulares para garantizar su biocompatibilidad.
Metodología
La síntesis de los compósitos de HAp/ZrO2-8Y2O3 se realizó mediante mezclado líquido con base en el método de Pechini, la cual consiste en la generación de los soles. En un vaso de precipitado con 25 ml de agua se disolvieron las sales de itrio y zirconio en las cantidades estequiométricas requeridas para respetar una relación molar de 8% mol de itrio, los reactivos utilizados se presentan en la Tabla 1, por otro lado se pre aró una solución de nitrato de calcio y fosfato de amonio monobásico, en las cantidades necesarias para asegurar una relación estequiométrica de Ca/P de 1.67, posteriormente se agregó ácido cítrico a ambas soluciones que en conjunto dieron como resultado una relación molar de 2:1 entre etilenglicol y ácido cítrico, el cual se dispuso en una solución independiente a una temperatura de 70 °C. Una vez preparadas dichas soluciones, se procedió a adicionar las soluciones de zirconio y fosfato de calcio lentamente en el etilenglicol, aumentando la velocidad de agitación y dejando esta condición hasta observar un aumento en la viscosidad de la solución, el gel resultante se llevó a una temperatura de 150 °C en donde ocurrió la reacción de poliesterificación y la formación de una resina esponjosa; realizado esto se procedió a dar un tratamiento térmico de 1050 °C/2h, obtenidos los polvos de los compósitos, se procedió a conformar discos de 1 cm de diámetro y 0.5 cm de espesor mediante prensado uniaxial, empleando una presión de 400 Mpa y un proceso de densificación a 1400 °C /2h.
Tabla 1 Reactivos empleados en la síntesis de los compósitos de HAp/ZrO2-8Y2O3.
| Reactivo | |
|---|---|
| Nombre | Fórmula |
| Nitrato de itrio | N3O9Y • 6H2O |
| Hidroxiacetato de zirconio | (CH3CO2)xZr(OH)yx+y=4 |
| Ácido cítrico anhidro | HOC(CO2H)(CH2CO2H)2 |
| Etilenglicol | CH2OHCH2OH |
| Nitrato de calcio | Ca(NO3)2-4H2O |
| Fosfato de amonio monobásico | H2NH4PO4 |
Pruebas de Bioactividad en SBF
Las pruebas de bioactividad se realizaron preparando un fluido fisiológico simulado (SBF por sus siglas en inglés, simulated body fluid) siguiendo la metodología propuesta por Kokubo y colaboradores [12], dicha solución se preparó empleando un vaso de precipitado dispuesto con la cantidad calculada de agua desionizada y asistido con un agitador magnético y calentamiento a 36.5 °C, una vez alcanzada la temperatura se procedió a adicionar las sales de los iones presentados en la Tabla 2, una a una hasta su disolución completa, se estabilizó el pH a 7.4 mediante el empleo de un buffer de trisaminometano. Una vez preparada la solución SBF, se procedió a colocar los conformados de HAp/ZrO2-8Y2O3 en frascos de plástico de 100 ml dispuestos con 50 ml de solución SBF, se sellaron y colocaron en una incubadora marca Felisa modelo FE-291 a 36.5 °C durante 7, 14 y 21 días. Una vez concluido el tiempo se lavaron los conformados con agua desionizada y se secaron a temperatura ambiente. Para verificar el crecimiento de hidroxiapatita sobre la superficie del material se llevó a cabo un análisis por microscopia electrónica de barrido de alta resolución (MEB), así como espectrometría de fotoelectrones emitidos por rayos X (XPS).
Pruebas de citotoxicidad
Para esta determinación, se realizó cada prueba por triplicado de acuerdo a la norma ASTM F756-00 [13]. Se utilizaron tres concentraciones distintas de compósito HAp/ZrO2-8Y2O3 para realizar las pruebas de hemólisis: 2.5 mg/ml, 5 mg/ml y 10 mg/ml. Se extrajo sangre por venopunción del brazo de un donador sano y no fumador, se lavó dos veces la sangre con solución Alsever (10.45 g dextrosa, 4 g citrato de sodio y 2 g cloruro de sodio, en 500 ml de solución acuosa) centrifugando a 4 °C, 3000 rpm durante 4 minutos entre cada lavado. Se preparó una dilución de eritrocitos para realizar los ensayos de hemólisis, tomando 100 μl de eritrocitos purificados y llevando a 10 ml con solución de Alsever. Para realizar las pruebas se pesó el material en el tubo, se agregaron 1850 μl de solución Alsever y 150 μl del concentrado eritrocitario; se realizaron también dos controles, uno negativo (0% de hemólisis) y otro positivo (100% de hemólisis), para el control negativo se utilizó el concentrado de eritrocitos mas la solución de Alsever sin material y para el control positivo se utilizó el concentrado de eritrocitos con agua desionizada (para romper las membranas de los glóbulos rojos por ósmosis y liberar el total de la hemoglobina), se agitó en el vortex para homogeneizar, se incubó a una temperatura de 37 ± 2 °C durante 30 minutos y posteriormente se centrifugó a las mismas condiciones anteriores. Se tomó 1 ml del suero sobrenadante de cada tubo para analizar por espectrofotometría UV midiendo la absorbancia en un espectrofotómetro UV Jenway modelo 7315, utilizando una longitud de onda de 412 nm. El grado de hemólisis (%) se calcula como se describe en la Ecuación (1).
Resultados y discusión
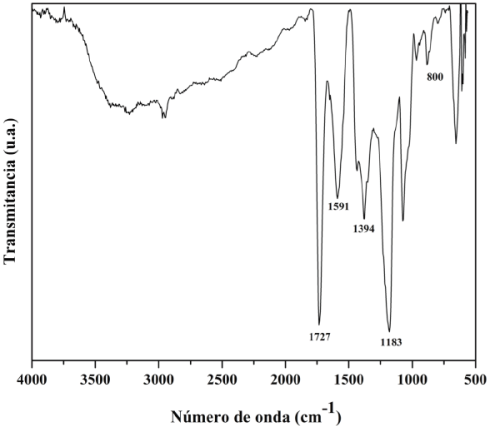
En la Figura 1, se presenta el espectro infrarrojo del precursor polimérico obtenido durante la síntesis de los compósitos de HAp/ZrO2-8Y2O3 por el método de mezclado líquido, para lo cual se utilizó un espectrómetro Perkin Elmer FTIR Spectrometer Frontier, mediante la técnica de ATR. En éste espectro se observan señales en 1727 cm-1, las cuales son atribuibles al estiramiento C=O del grupo éster, lo que indica la polimerización del ácido cítrico y el etilenglicol. Las bandas en 1591 cm-1 y 1394 cm-1 corresponden a los estiramientos simétricos y asimétricos del grupo carboxilato, presentes por la interacción del ácido cítrico y los cationes inorgánicos; la banda en 1183 cm-1 es atribuible a los grupos COH y las bandas presentes por debajo de 800 cm-1 pertenecen a los estiramientos provocados por interacciones entre metal y oxígeno; las señales presentes en el intervalo de 3000 a 3600 cm-1 se originan debido a los estiramientos de O-H [14].
Lo descrito anteriormente demuestra que efectivamente se llevó a cabo la reacción de poliesterifiación entre el ácido cítrico y el etilenglicol, así como la formación de un complejo organometálico de ácido cítrico y los cationes inorgánicos.
Con el fin de conocer las fases cristalinas presentes en el compósito, la muestra obtenida de HAp/ZrO2-8Y2O3 sinterizada a 1400 °C/2h se analizó en un difractómetro de rayos X Siemens modelo D-5000, en un rango de barrido de 10 a 80° en la escala 20.
El patrón de difracción obtenido se muestra en la Figura 2, en donde se puede observar la presencia de varias fases cristalinas formadas en el tratamiento, las cuales constan predominantemente de óxido de zirconio estabilizado en fase cúbica según la carta patrón 82-1246 de la base de datos PDF, mostrando reflexiones en 30°, 35°, 50°, 60°, 62° y 73° en la escala de 20, además de la presencia de reflexiones correspondientes a fosfato de calcio en fase monoclínica según la carta patrón 70-0364, con ello es posible afirmar que se logró sintetizar óxido de zirconio estabilizado en fase cúbica mediante la incorporación de cationes de Y3+, ya que no se observan señales de óxido de zirconio en fase monoclínica, además de la formación del fosfato de calcio en una reacción simultánea al someter el precursor polimérico formado tras la poliesterificación del complejo de ácido cítrico y cationes con el etilenglicol a un tratamiento térmico a 1400 °C/2h.
Con la finalidad de conocer la bioactividad de los compósitos de HAp/ZrO2-8Y2O3 sintetizados por el método de mezclado líquido con base en el método de Pechini, una vez terminados los 21 días de inmersión en SBF se secaron las muestras y se analizó la superficie de las mismas mediante microscopia electrónica de barrido de alta resolución (MEB), para lo cual se utilizó un microscopio modelo Jeol JSM-7041F. En la Figura 3 se presentan las imágenes tomadas a 500x, 2000x y 10,000x; a, b y c respectivamente, en donde se puede observar la presencia de esferas con un tamaño que oscila de 5-10 μm, las cuales se atribuyen a la apatita formada tras la inmersión en SBF, dichas esferas muestran un crecimiento sobre gran parte de la superficie del compósito.
Lo descrito anteriormente, permite inferir que el compósito sintetizado en este trabajo, presenta un cierto grado de bioactividad ya que se observa claramente la formación de la apatita sobre la superficie del material. En la Figura 3b, es posible observar una distribución homogénea de las fases de zirconio estabilizado (partículas blancas sólidas), y fosfato de calcio (sustrato obscuro), esta distribución se puede atribuir a que las partículas de zirconio estabilizado actúan como sitios de nucleación para la formación del fosfato de calcio, ya que estas se encuentran sobre los límites de grano del fosfato de calcio, además de esto se puede denotar una morfología compuesta de cavidades (poros) los cuales oscilan en un diámetro de 1-3 μm [15]. En la Figura 3c se observa la morfología característica de la hidroxiapatita presente en los tejidos óseos, la cual es de forma dendrítica [7].
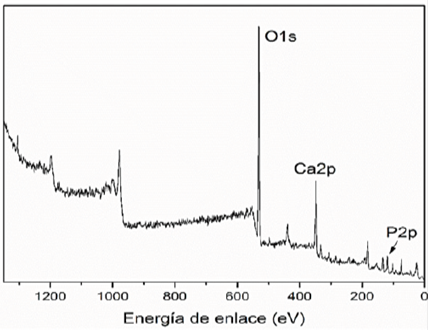
La Figura 4 corresponde al análisis por XPS del com pósito de HAp/ZrO2-8Y2O3 tras 7 días de inmersión en SBF, dicho análisis se llevó a cabo con un equipo Thermo scientific K-Alpha realizando bombardeo de iones durante 180 segundos con el fin de erosionar la muestra aproximadamente 80 nm. Se puede observar solamente la presencia de señales correspondientes a O1s, Ca2p y P2p, lo cual es indicativo de la presencia de hidroxiapatita en la superficie analizada.
Al realizar las deconvoluciones de las señales presentes (Figura 5) se puede observar que en todas las especies existen dos señales: en el caso del calcio se observan dos señales en 347 con su respectivo doblete las cuales son atribuibles a Ca2p3/2 de fosfato de calcio Ca3(PO4)2 el cual, como se demostró en el análisis de DRX, está presente en el sustrato del material, así como a Ca2p3/2 de hidroxiapatita con formula Ca10(PO4)6(OH)2 la cual proviene de las esferas formadas tras la inmersión en SBF, esto concuerda con las señales presentes en fósforo las cuales se encuentran en 132.9 y 133.3 correspondientes a P2p3/2 y P2p de fosfato de calcio é hidroxiapatita y de oxígeno 1s en 532 y 531.
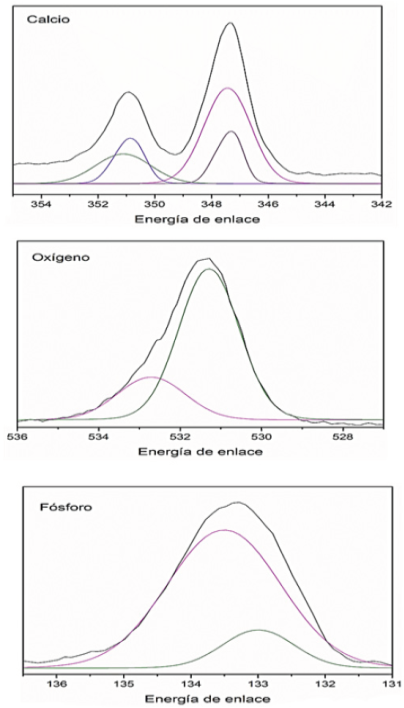
Figura 5 Espectros detallados del análisis por XPS de los compósitos de HAp/ZrO2-8Y2O3 después de 7 días de inmersión en SBF.
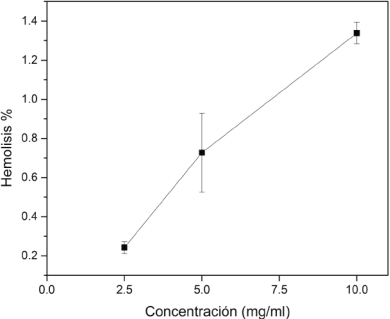
En cuanto a la evaluación de la citotoxicidad del material en cultivos con eritrocitos humanos, en la Figura 6 se presenta el porcentaje de hemólisis producido a las diferentes concentraciones de compósito, encontrándose que los valores están por debajo del 1.5%, lo cual indica, según la norma ASTM F 756-00 (estándar práctico para la evaluación de las propiedades hemolíticas en materiales), que estos compósitos se pueden considerar no hemolíticos ya que se marca que valores de hemólisis ≤ 2 % son considerados como no hemolíticos, lo cual sugiere que los compósitos de HAp/ZrO2-8Y2O3 son compatibles con los eritrocitos y son adecuados para su implementación en contacto directo con el torrente sanguíneo.
Conclusiones
Es posible obtener compósitos de HAp/ZrO2-8Y2O3 por el método de mezclado líquido con base en la síntesis de Pechini según los patrones de difracción de rayos X, los cuales mostraron la presencia de las fases de óxido de zirconio estabilizado en fase cúbica y de fosfato de calcio, además las pruebas de bioactividad por inmersión en SBF demostraron que los compósitos inducen la formación de hidroxiapatita sobre la superficie del compósito según las micrografías mostradas después de 21 días de inmersión, corroborados mediante los análisis por XPS Los ensayos de hemólisis mostraron un porcentaje por debajo del 1.5 %, lo cual según la norma ASTM F 756-00 es considerado como no hemolítico. En conclusión, fue posible la síntesis del compósito HAp/ZrO2-8Y2O3 por mezclado líquido utilizando el método de Pechini. Los materiales obtenidos demostraron ser bioactivos y no hemolíticos, sin embargo, se requiere pruebas de biocompatibilidad en tejidos óseos, lo cual está programado en trabajos a futuro.











 nueva página del texto (beta)
nueva página del texto (beta)