Introducción
La fibrilación auricular (FA) es una de las taquiarritmias más comunes: afecta alrededor del 2% de la población general y su incidencia está aumentando [1]. La FA está asociada con anormalidades hemodinámicas y eventos tromboembólicos, incrementando 5 veces el riesgo de sufrir un accidente cerebrovascular. En los últimos años, en Latinoamérica se ha alertado sobre los crecientes eventos de accidentes cerebrovasculares debidos a FA [2]. Los pacientes con FA son hospitalizados dos veces más que los pacientes sin FA, y su calidad de vida se ve disminuida. Asimismo, la FA genera importantes gastos a los sistemas de salud, solo en Estados Unidos, el gasto anual del tratamiento llega a los US$26 billones [3]. La carga financiera se agudiza en regiones en vía de desarrollo, como Latinoamérica.
La FA se clasifica en paroxística, cuando su duración es menor a 7 días, en persistente, cuando la fibrilación se sostiene por más de 7 días, o en persistente de larga duración cuando la fibrilación continua por más de un año. Para pacientes con FA sintomática el tratamiento se enfoca en restablecer y mantener el ritmo sinusal, en este caso, el manejo se realiza mediante medicamentos antiarrítmicos o a través de la terapia de ablación por radiofrecuencia utilizando catéteres intracavitarios [3,4].
El tratamiento por ablación auricular consiste en la generación de lesiones en el tejido que bloquean la propagación del impulso eléctrico para prevenir la formación y el mantenimiento de la conducción fibrilatoria [5]. La ablación por catéter, a diferencia de la medicación antiarrítmica, se convierte en una opción para curar definitivamente la FA, y puede evitar los efectos secundarios del tratamiento farmacológico a largo plazo.
Estudios clínicos han mostrado que la ablación por radiofrecuencia es efectiva en 70% de los pacientes con FA paroxística [6]. La guía de la Asociación Americana del Corazón para el manejo de pacientes con fibrilación auricular recomienda la ablación por catéter, como terapia de primera línea, en pacientes con FA paroxística sintomática, que son refractarios o intolerantes al menos a una medicación antiarrítmica [3]. Sin embargo, en pacientes con FA persistente la tasa de éxito, no alcanza el 50% [7,8]. En la misma guía [3], la terapia de primera línea en FA persistente es la medicación antiarrítmica, y solo recomienda considerar la ablación en pacientes con FA persistente cuando es refractario o intolerante al menos a una medicación antiarrítmica.
La baja tasa de éxito de la ablación en FA persistente, puede ser una consecuencia del poco entendimiento de los mecanismos que generan y perpetúan la arritmia [9]. La mayoría de los procedimientos de ablación para pacientes con FA están basado en consideraciones anatómicas, donde el procedimiento estándar es el aislamiento de venas pulmonares [10]. Por otro lado, existen propuestas para realizar ablación guiada por el análisis de las señales adquiridas con los catéteres intracavitarios, dichas señales se conocen como electrogramas (EGM). Estas estrategias están orientadas a la localización de los substratos arritmogénicos, sin embargo, no han sido universalmente aceptadas. Las principales propuestas que han sido probadas en la práctica clínica son la ablación guiada por electrogramas auriculares fragmentados complejos (CFAE) y la ablación de rotores guiados por mapeo panorámico (FIRM) [11].
Existen estrategias que se basan en la caracterización y clasificación de los electrogramas. Por ejemplo, mediante el cálculo de la frecuencia dominante [12] o el estudio de la entropía [13,14]. Sin embargo, ninguno de estos métodos ha encontrado un consenso en la práctica médica, debido en parte a la dificultad de reproducir los resultados con tasas de éxito similares [15].
La problemática a la que se han enfrentado estos métodos para su aceptación es que, a diferencia de la señal ECG, no existe una descripción del todo clara de los patrones que se pueden encontrar en las señales EGM y no hay un consenso entre los especialistas que defina claramente los tipos de electrogramas asociados a sitios arritmogénicos, lo cual hace que la ablación en FA siga limitada al aislamiento de las venas pulmonares y que cuando se realiza la ablación guiada por electrogramas, ésta dependa de la experiencia del electrofisiólogo [16,17].
Algunos estudios han mostrado que diferentes técnicas para la identificación de electrogramas no identifican necesariamente las mismas áreas de ablación, por lo cual, la caracterización precisa de EGM auriculares que pueden indicar un área particular como objetivo de ablación es actualmente un tema de debate [18].
A partir de esta problemática, el objetivo de este artículo es presentar el estado actual de las estrategias de ablación guiadas por electrogramas y un estado del arte de las propuestas que se reportan en la literatura para desarrollar nuevos métodos que permitan guiar la ablación a partir del procesamiento y análisis de las señales EGM.
El artículo está organizado de la siguiente forma: primero se presentan las tecnologías utilizadas en la práctica clínica para el mapeo electroanatómico, que es la base de los procedimientos de ablación; luego se presentan las principales técnicas de ablación utilizadas en la práctica clínica; posteriormente el artículo se enfoca en presentar las principales propuestas publicadas en la literatura para el análisis de electrogramas, las principales técnicas de procesamiento de señal para caracterización de electrogramas y su aplicación para guiar procedimientos de ablación. Por último, se resumen los esquemas que se han planteado para clasificar los electrogramas de acuerdo con su morfología y se describen las propuestas orientadas a realizar una discriminación de los electrogramas a partir de técnicas de reconocimiento de patrones, incluyendo técnicas de aprendizaje supervisado y semi-supervisado.
Mapeo intracardiaco como base para los procedimientos de ablación
El mapeo electro-anatómico es un procedimiento que permite identificar, caracterizar y localizar una arritmia y es la base para la realización de las terapias de ablación. Los catéteres cuentan con uno o varios electrodos metálicos expuestos en el extremo. Los EGM son adquiridos a través del contacto directo de los electrodos con el tejido endocárdico [19].
En el mapeo electro-anatómico es necesario combi nar la información eléctrica contenida en las señales EGM con información anatómica de las aurículas. Ésta se obtiene a partir de lecturas de posicionamiento de la punta del catéter mediante sistemas de triangulación a partir de campos eléctricos o magnéticos.
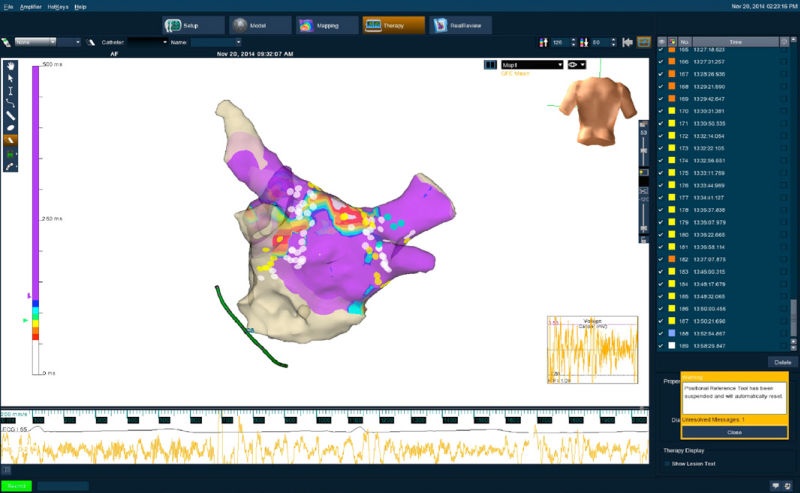
Los sistemas de mapeo electroanatómico más utilizados en la práctica clínica a nivel mundial son el EnSite Velocity NavX de St. Jude Medical y el Carto de Biosense Medical, filial de Johnson and Johnson. Estos sistemas proveen la tecnología necesaria para localizar los catéteres en interior de la aurícula y construir mapas anatómicos 3D que permiten al especialista visualizar en qué estructura anatómica auricular está posicionado el catéter [20]. Igualmente, los catéteres pueden registrar EGM unipolares o bipolares al estar en contacto con la aurícula (La Figura 1 muestra un mapa electroanatómico extraído del sistema NavX).
Técnicas de ablación guiadas anatómicamente y sus limitaciones
El procedimiento estándar de ablación en FA consiste en el aislamiento eléctrico de las venas pulmonares (PVI). Se realiza aplicando ablación circunferencial o ablación segmentada, con el objetivo de desconectar eléctricamente las venas pulmonares del sistema de propagación del potencial de acción del miocardio. Para su realización, se utilizan los sistemas de mapeo 3D, para guiar los catéteres al interior de la estructura de las aurículas sin necesidad de buscar substratos arritmogénicos mediante el análisis de EGM.
El procedimiento de PVI se basa en la evidencia que la mayoría de los focos ectópicos que desencadenan episodios de FA se localizan en las venas pulmonares [21]. Sin embargo, la FA puede ser iniciada y sostenida por otros gatillos y mecanismos, especialmente en casos de FA persistente. Estudios recientes han demostrado la presencia de circuitos fibrilatorios que generan una conducción de alta frecuencia alrededor de un vértice [22,23]. Basados en esto, Jalife et al. propusieron la hipótesis del rotor, según la cual, la FA es sostenida por circuitos de micro-reentrada que giran alrededor de un punto de singularidad [22]. Los rotores pueden ser iniciados por latidos ectópicos provenientes de las venas pulmonares, y posteriormente se auto sostienen.
A diferencia de la hipótesis de ondas circulares sugerida a principios del siglo XX, la hipótesis del rotor ase gura que no se requiere la presencia de un obstáculo anatómico para que se genere un rotor. Se han estudiado rotores mediante el registro de la propagación del potencial de acción a partir de métodos ópticos en cultivos celulares [24] y en corazones aislados de animales [23]. Recientemente, Narayan et al. han logrado observar rotores utilizando un catéter tipo balón con 64 electrodos, generando una mayor evidencia sobre la existencia de rotores en humanos con FA [25].
Por otra parte, Allessie et al., introducen la hipótesis del mecanismo de la "doble capa", la cual indica que la FA persistente se sostiene debido a una disociación progresiva endo-epicárdica, que va convirtiendo el miocardio en una doble capa de conducción que se autoalimenta constantemente [26]. Esta hipótesis es sustentada con base a estudios electrofisiológicos en pacientes con FA persistente, que indican que las ondas fibrilatorias observadas son de origen "focal" pero sin la presencia de un área con actividad focal sostenida [27], es decir, existe un avance disruptivo de la onda de propagación entre el epicardio y el endocardio. Aunque esta hipótesis explicaría por qué la ablación de FA persistente no es exitosa [28], requeriría de un mapeo endocárdico y epicárdico simultáneo para observarse [29], lo cual es inviable en humanos con la tecnología disponible actualmente.
Otras variantes de la ablación guiada por estructuras anatómicas, sugiere la generación de líneas de ablación adicionales en la aurícula izquierda. Los sitios más comunes para la generación de estas líneas son la pared superior de la aurícula izquierda conectando las lesiones de las venas pulmonares superior derecha e izquierda y la región de tejido entre la válvula mitral y la vena pulmonar inferior izquierda [30]. De esta forma se busca eliminar sitios críticos en el mantenimiento de la FA diferentes a las venas pulmonares.
Un procedimiento de ablación óptimo debería generar la cantidad mínima de líneas de ablación necesarias para eliminar los substratos arritmogénicos que generan o sostienen la arritmia. Sin embargo, en las estrategias guiadas anatómicamente, se generan líneas de ablación que no necesariamente garantizan la eliminación de estos puntos críticos y que, por el contrario, pueden lesionar parte del tejido sano. Para evitar este problema, se han propuesto métodos para realizar la ablación guiada por EGM en los cuales el resultado del análisis de los EGM es utilizado para detectar sitios objetivos de ablación.
Técnicas de ablación guiadas por electrogramas
A pesar del entendimiento parcial de los mecanismos de generación y perpetuación de la FA, se han propuesto múltiples métodos para realizar la ablación guiada por electrogramas (EGM), entre ellos el mapeo de electrogramas fragmentados y el mapeo panorámico. Es necesario tener en cuenta que, debido a la naturaleza desorganizada de la propagación del potencial de acción en FA, es muy difícil hacer el seguimiento de dicha propagación por medio de mapas de activación como se hace en casos de taquicardia y flutter auricular [3].
Electrogramas complejos fragmentados
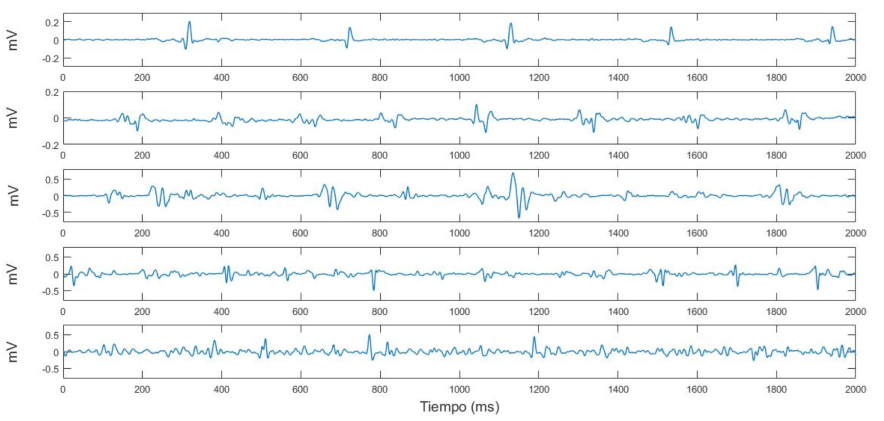
Una de las estrategias para guiar los procedimientos de ablación basados en los EGM, es el análisis de los llamados electrogramas auriculares fragmentados complejos (CFAE) [31]. La ablación de CFAE es uno de los métodos más utilizados en la práctica clínica, gracias a que ha estado disponible en los equipos comerciales de mapeo cardíaco más usados (EnSite Velocity NavX de St. Jude Medical y Carto de Biosense Medical). Esta aproximación diagnóstica inició en 2004 con Nademanee et al. [31] quien definió genéricamente los CFAE como: 1) Potenciales de EGM auriculares fragmentados que poseen 2 o más deflexiones y/o perturbaciones de la línea base con deflexiones continuas y activación prolongada. 2) EGM auriculares con una longitud de ciclo muy corta (≤ 120 ms) promediado sobre 10 segundos de registro. La Figura 2 ilustra un ejemplo de señal considerada normal y de una señal CFAE.

Figura 2 Ejemplo de señales EGM. Arriba una señal donde se observan las activaciones locales de forma organizada y abajo una señal fragmentada (CFAE).
Nademanee et al. [31] proponen identificar y tratar las áreas con CFAE como sitios susceptibles de ablación. Sin embargo, estudios posteriores han reportado resultados contradictorios [32,33] y por ello este método tiene múltiples críticos [34,35]. Uno de los problemas es que la definición de CFAE es muy general y no distingue entre diferentes morfologías presentes en los electrogramas fragmentados, por lo tanto, se caracteriza como CFAE a una familia muy amplia de señales que no necesariamente están relacionadas con substratos arritmogénicos [36]. Esto conlleva a una interpretación subjetiva de cuáles son los EGM fragmentados que verdaderamente pueden garantizar que el procedimiento de ablación sea exitoso [16,37].
Los estudios realizados para comparar las estrategias propuestas de ablación en FA persistente presentan mucha variación en los resultados y por lo tanto actualmente no es claro qué tipo de ablación presenta mejor desempeño. Por ejemplo, mientras los estudios de Nademanee et al. reportan un éxito del 91% sin recurrencia durante un año [31], Oral et al. no lograron reproducir dichos resultados y reportan una tasa de éxito solo del 40% [32], mientras que Elayi et al. alcanzaron un 69% de éxito [38]. Los estudios que utilizan PVI con ablación lineal reportan tasas de éxito que oscilan entre 11% y 74%. Así mismo, estudios que describen una estrategia de ablación secuencial (PVI + líneas + CFAE), reportan tasas de éxito entre 38% y 62% [7,39]. En general, la tasa de éxito promedio en FA persistente utilizando PVI + CFAE es de 47%, lo cual es muy cercano a los reportes para ablación donde solo se hace PVI (40%) [40]. Recientemente, Verma et al. en el estudio STAR-AF II, el cual incluyó el seguimiento de 549 pacientes, concluyeron que bajo las técnicas actuales lo más recomendable es realizar únicamente PVI [35].
Respecto a lo anterior, es necesario enfatizar que los descriptores utilizados para detectar CFAE, implementados en los dispositivos de mapeo intracardiaco utilizados en la mayoría de los estudios, están basados en la definición de Nademanee, que como se mencionó, es una definición cualitativa que no diferencia los patrones presentes en las señales EGM fragmentadas. Por otra parte, la poca reproducibilidad de los resultados se debe principalmente a que la definición de CFAE es muy amplia, y hace necesario que el electrofisiólogo evalúe visualmente las señales y a partir de su experiencia, seleccione los CFAE que pueden indicar un sitio objetivo de ablación [41,42]. Lo anterior implica que la clasificación binaria de señales EGM entre CFAE y no-CFAE es insuficiente. Este hecho, influye de una manera importante en los diferentes estudios clínicos.
Si bien la ablación guiada por CFAE tuvo un auge importante en los últimos años, su utilización ha sido cuestionada recientemente por los estudios START-AF-II y CHASE AF [35,43]. En respuesta a esto, Narayan et al. han propuesto un nuevo método de ablación guiado por mapeo panorámico, con el cual se realiza un seguimiento a la propagación de la conducción eléctrica a través de la aurícula [44]. El método propuesto y desarrollado por Narayan et al. se basa en un mapeo panorámico intracardiaco de las 2 aurículas, utilizando catéteres tipo balón con 64 electrodos. Dicho catéter cuenta con 8 líneas longitudinales, cada una con 8 electrodos, con lo cual se cubre casi toda la aurícula. Las señales son adquiridas y procesadas, mediante un patentado basado en mapas de fase, para determinar los patrones de propagación eléctrica presentes en cada paciente. Utilizando mapas isocrónicos, se determina el centro del rotor como zona objetivo de ablación para revertir la arritmia [25]. El método recibe el nombre de Focal Impulse and Rotor Modulation (FIRM) A partir de dicho método, un estudio prospectivo realizado en 92 pacientes (llamado CONFIRM) reportó la detección de rotores en humanos como fuentes conductoras de la arritmia [45].
Este esquema fue desarrollado bajo la hipótesis de la existencia de rotores estables, lo cual ha sido debatido y permanece como tema abierto [26]. Adicionalmente, a pesar de los resultados publicados por Narayan et al., varios autores cuestionan el método FIRM. Allesie y de Groot, sostienen que los resultados de Narayan et al. no son concluyentes y que todavía se deben realizar estudios adicionales en otros centros para validarlos [29]. Sostienen además que el método de Narayan utiliza un mapeo de baja resolución (64 electrodos), respecto a otros estudios en los que se ha realizado mapeo epicárdico en humanos con 128 y 256 electrodos, en los cuales no se observaron rotores estables en humanos [26,46]. Buch et al. [47] realizaron un estudio de cohortes en dos centros médicos de Estados Unidos con 43 pacientes en el cual utilizaron el método FIRM encontrando una eficacia muy pobre, en contravía de lo reportado por los estudios de Narayan et al. Ellos concluyen que aún se requieren una serie de estudios aleatorizados para comprobar la eficacia y utilidad critica del método FIRM.
Propuestas de mapeo basado en la caracterización de los electrogramas
En FA persistente la morfología de los electrogramas es muy desorganizada y dificulta la detección de las ondas de activación, lo que conlleva a imprecisiones en la localización de los substratos arritmogénicos a partir del mapeo panorámico. Por otra parte, las estrategias basadas en CFAE, dependen en gran medida de la capacidad del especialista de discriminar que tipo CFAE deben ser seleccionados para guiar la ablación. Como alternativa, en la literatura se han generado varias propuestas basadas en el procesamiento de las señales EGM con herramientas matemáticas que buscan caracterizar las señales por medio de índices o descriptores que no dependen del concepto de CFAE definido por Nademanee, y que puedan cuantificar las formas de onda encontradas en estas señales. Características basadas en la morfología de la señal [48], en el análisis en el dominio de la frecuencia [49], o en descriptores no lineales [50], han mostrado resultados prometedores en estudios sobre modelos computacionales o sobre modelos animales, pero todavía requieren ser validados antes de su aplicación en la práctica clínica. A continuación, se describen los desarrollos más relevantes en este sentido.
Estudios clínicos han mostrado que los sitios anatómicos que representan substratos de FA están caracterizados por señales EGM con un alto grado de desorganización y ondas de activación de alta frecuencia [51]. De acuerdo a esto, algunas propuestas para el procesamiento de la señal EGM están orientadas a calcular índices que cuantifican la frecuencia de las ondas de activación y la longitud del ciclo, tanto de los potenciales regulares como de los potenciales fragmentados. Posteriormente los algoritmos se han orientado a la caracterización del nivel de organización de la señal.
Para medir el grado de organización espacial de las ondas de activación durante FA, Botteron y Smith [52] propusieron un método de pre-procesamiento que genera una forma de onda variante en el tiempo proporcional a la amplitud de los componentes de alta frecuencia en el EGM auricular; esta señal resultante corresponde a la envolvente del EGM. Este método ha sido utilizado para calcular diferentes índices, basados en la aplicación de la transformada de Fourier, para encontrar el espectro de potencia de la envolvente de la señal EGM: frecuencia dominante (DF), índice de organización (OI) e índice de regularidad (RI) [53,54].
Sin embargo, existen autores que han discutido la utilidad práctica del análisis del DF, ya que es sensible al método de adquisición de la señal, a la relación señal a ruido (SNR), a la despolarización de campo lejano ventricular y a la complejidad de la señal [55,56]. Faes et al. [48] desarrollaron un método para cuantificar la organización de EGM bipolares simples, adquiridos en una aurícula humana durante FA. El algoritmo se basa en la comparación entre pares de ondas de activación para estimar su similitud morfológica, y retorna una medida llamada índice de similitud, el cual mide el grado de repetitividad en el tiempo de las ondas de activación.
Algunos autores han propuesto métodos basados en transformadas tiempo-frecuencia para la caracterización de la señal EGM o para la segmentación de la señal con el fin de detectar las ondas de activación y los segmentos con actividad eléctrica, ya sea de campo cercano -activaciones que representan la activación local- o de campo lejano -que representan las activaciones de zonas diferentes a las inmediaciones del catéter [57]. Houben, de Groot y Allessie [57] utilizaron la descomposición wavelet en EGM unipolares en FA para la detección automática de ondas de activación locales durante FA, a partir de las cuales se cuantifican los potenciales primarios y el grado de fragmentación de los EGM. Kremen et al. [58] propusieron un método basado en la transformada wavelet discreta para la detección de los segmentos con actividad eléctrica. De acuerdo a esta propuesta, se identificó que en señales EGM con una frecuencia de muestreo de 1000 Hz, el coeficiente de detalle 3 contiene información relevante para la detección de las ondas de activación.
Por otro lado, algunos estudios han propuesto la utilización de métodos no lineales para el estudio del fenómeno de fragmentación en los EGM auriculares [59,60]. Ganesan et al. [61] evaluaron la aplicación de la entropía de Shannon para detectar electrogramas fragmentados en un modelo computacional 2D, en modelos in-vivo (ratas y ovejas) y en pacientes con FA persistente. En este estudio encontraron que las áreas de alta entropía están relacionadas con rotores en los modelos computacionales y los modelos in-vivo, pero los resultados en humanos mostraron áreas de alta entropía que no están relacionadas con los mapas de CFAE generados por los equipos comerciales, y no fue posible distinguir a qué tipo de substrato se podrían asociar.
Han sido propuestas medidas de entropía basadas en la teoría de dinámica no lineal como la entropía aproximada (ApEn) y la entropía Sample (SampEn) para la evaluación del nivel de fragmentación de señales EGM, y se ha evaluado su relación con la detección de rotores en modelos computacionales que simulan la conducción fibrilatoria auricular [62,63]. También se ha propuesto la utilización de métodos de análisis multifractal en la evaluación de diferentes niveles de fragmentación en los electrogramas [64,65]. Sin embargo, estos métodos requieren nuevos estudios para su validación y aún no están siendo utilizados en la práctica clínica.
Esquemas de clasificación para el análisis de electrogramas
Los patrones de propagación en FA tienen una alta complejidad por lo que caracterizar las señales que se adquieren a través de un solo descriptor, por ejemplo, la frecuencia dominante, la entropía de Shannon o la entropía aproximada, puede no ser suficiente. Teniendo en cuenta esto, algunas investigaciones han abordado el tema como un problema de reconocimiento de patrones. Se han propuesto esquemas basados en modelos de aprendizaje supervisado para detectar los electrogramas con alto nivel de fragmentación [66,67]. Estos métodos requieren un sistema de clasificación avalado por expertos que permita generar un conjunto de señales etiquetadas para ser utilizadas en el proceso de entrenamiento de los algoritmos de aprendizaje supervisado. Aunque no existe un consenso en cuanto a la clasificación de los electrogramas, en la literatura se han planteado algunos esquemas de clasificación, basados principalmente en el nivel de organización de la señal y en el porcentaje de actividad eléctrica presente en la señal. A continuación, se resumen estos esquemas, los cuales sirven como base para los métodos de reconocimiento de patrones.
Clasificación de acuerdo al esquema de Wells
Uno de los primeros sistemas de clasificación de señales EGM fue propuesto por Wells et al. [68] quienes distinguieron los EGM auriculares en cuatro tipos basados en la presencia de activaciones en el EGM y la naturaleza de su línea base:
> Tipo I: Ondas de activación discretas separadas por una línea base isoeléctrica libre de perturbación.
> Tipo II: Ondas de activación con varias perturbaciones y línea base no isoeléctrica.
> Tipo III: EGM en los cuales se dificulta la identificación de ondas de activación o la distinción de una línea base definida.
> Tipo IV: Definido como el tipo III en el que adicionalmente se presentan periodos alternantes con características del tipo I o II.
Uno de los principales problemas de esta clasificación es que no tiene un criterio definido y cuantificado para evaluar que se puede considerar una perturbación de la línea base, y no tiene en cuenta diferentes morfologías que puedan aparecer en las ondas de activación, de tal forma que la clasificación se basa en parámetros subjetivos. Por otro lado, los EGM tipo IV están definidos como una señal que cambian su morfología por tramos. Esto dificulta su análisis de tal forma que usualmente solo se consideran los tres primeros tipos.
Clasificación escalada en cuatro niveles de fragmentación
Schilling et al. y Kremen et al. [69,70] han introducido un sistema de clasificación que puede ser considerado una modificación del criterio de Wells, basado en 4 grupos, de tal forma que los grupos con más alto nivel, presentan mayor nivel de desorganización o fragmentación:
> C0: EGM auriculares no fragmentados con alta frecuencia.
> C1: EGM fragmentados con actividad periódica (nivel bajo de fragmentación).
> C2: Mezcla de actividad periódica fragmentada y EGM no fragmentados con actividad no periódica (nivel intermedio de fragmentación).
> C3: EGM auriculares de alta frecuencia y con actividad continua (no se pueden diferenciar ondas de activación discretas de forma regular, lo cual se considera un nivel alto de fragmentación).
Este esquema de clasificación contempla la presencia de diferentes tipos de morfologías en la señal EGM, sin embargo, los criterios no son cuantitativos y esta clasificación depende en gran medida de criterios subjetivos del electrofisiólogo que evalúe las señales.
Clasificación según la duración de la actividad fragmentada
Hunter et al. [71] propusieron una clasificación de las señales en 5 tipos, fundamentada, principalmente, en la duración de la actividad fragmentada, con lo que se incluye un criterio adicional cuantitativo para definir los grupos:
> Grado 1: Presencia de actividad fragmentada ininterrumpida en más del 70% de la señal, que se caracteriza por la presencia de deflexiones continúas sin pausa en la línea isoeléctrica, con episodios perdurables mayores a 1 segundo. Se consideran continuas si la separación entre deflexiones es menor a 70 ms.
> Grado 2: Actividad fragmentada interrumpida, cuando la actividad fragmentada ocupa más del 70% de la señal, pero no hay episodios perdurables.
> Grado 3: Actividad fragmentada intermitente, cuando la actividad fragmentada ocupa entre 30 y 70% de la señal.
> Grado 4: EGM complejos, definidos como potenciales discretos (≥ 70 ms) y complejos (≥ 5 cambios de dirección), con cualquier tipo de actividad fragmentada ocupando menos del 30% de la señal (de otro modo, estaría considerada como de grado 3).
> Grado 5: Electrogramas normales, potenciales discretos (separación ≥ 70 ms) y simples (< 5 cambios de dirección).
Esta clasificación, aunque incluye criterios cuantitativos, no ha logrado convertirse en un estándar clínico. Algunas limitaciones de este esquema es que no evalúa la morfología de las ondas de activación y no se ha definido una relación directa de cada grupo con los sustratos arritmogénicos críticos en la perpetuación de las arritmias.
Se pueden encontrar algunos paralelismos entre los diferentes tipos de clasificación, ya que estos sistemas se basan en la valoración del nivel de desorganización de la señal, en la Tabla 1 se presenta una descripción de 5 clases de EGM que resume las asociaciones entre las clases definidas en los sistemas descritos anteriormente. La Figura 3, ilustra un ejemplo de señal EGM para cada una de estas 5 clases.
Tabla 1 Evaluación de la relevancia de las características utilizando el índice FDR. En negrilla se presentan las características seleccionadas para la implementación del clasificador.
| Nueva clase | Descripción/ clasificación | Hunter | Schilling-Kremen | Wells |
|---|---|---|---|---|
| A | EGM con activaciones discretas, periódicas y simples. | Grupo 5 | Clase 0 | Tipo 1 |
| B | EGM con activaciones discretas, periódicas, pero fragmentadas. | Grupo 4 | Clase 1 | |
| C | EGM con activaciones discretas pero desorganizadas con actividad no periódica. | Grupo 3 | Clase 2 | Tipo 2 |
| D | EGM con actividad desorganizada, con segmentos de activación continua y segmentos con actividad discreta pero no periódica y fragmentada. | Grupo 2 | Clase 3 | Tipo 3 |
| E | EGM auriculares de alta frecuencia y con actividad continúa. | Grupo 1 |
Métodos de aprendizaje supervisado para la clasificación de los electrogramas
Con el fin de utilizar modelos que combinen información de varias características simultáneamente, se han propuesto nuevos métodos basados en esquemas de reconocimiento de patrones. Algunos estudios han propuesto sistemas de reconocimiento de patrones para la detección de diferentes niveles de fragmentación basado en alguno de los esquemas descritos en la sección anterior.
El problema de la detección de patrones en EGM, ha sido abordado principalmente mediante el uso de algoritmos de clasificación basados en aprendizaje supervisado. Nollo et al. [72] presentaron un sistema automático para el análisis y clasificación de FA utilizando una máquina de soporte vectorial (SVM) para clasificar entre EGM tipo I, II y III de acuerdo al criterio de Wells. Ellos trabajaron con una base de datos limitada a 100 señales y obtuvieron una exactitud de 97.7%.
Kremen et al. [66] propuso un algoritmo para la detección automática de electrogramas fragmentados utilizando un método basado en la teoría de grupos de modelos de evolución adaptativa llamado GAME (Group of Adaptive Models Evolution), la cual se basa en redes neuronales artificiales. Para la caracterización de la señal fue utilizada la transformada wavelet además de otros algoritmos para la extracción de características basados en el dominio del tiempo, el dominio de la frecuencia y en dinámica no lineal. Utilizaron procedimientos de optimización para encontrar la mejor configuración posible de los algoritmos y las características para maximizar la efectividad de la etapa de clasificación. Los algoritmos desarrollados por Kremen et al. fueron validados en una base de datos etiquetada por expertos de acuerdo al criterio de Schilling et al. Los resultados mostraron un promedio de error en la clasificación para todas las clases del 6%, y un error de clasificación de alto grado de fragmentación de 9%.
Schilling et al. [67] implementaron un clasificador basado en un árbol de decisión difuso. Este sistema fue entrenado con una base de datos de 429 señales etiquetadas en 4 clases. En total utilizaron 18 características entre las que se incluyen descriptores en el dominio del tiempo, información a partir del espacio de fase, descriptores basados en wavelet, características basadas en la amplitud y el índice de similitud propuesto por Faes et al.
El trabajo reporta una tasa de aciertos para clasificar entre 4 clases del 80.6%. Duque et al. [73] reportan un esquema basado en un clasificador K-NN y una combinación de 41 características seleccionadas por medio de un algoritmo genético. Las características incluyen descriptores en el tiempo, la frecuencia, tiempo-frecuencia y características no lineales. Este clasificador obtuvo una tasa de aciertos de 91% trabajando en la misma base de datos de Schilling et al.
La metodología basada en clasificadores supervisados podría ser incorporada en un sistema de mapeo para facilitar la identificación de potenciales fragmentados y así guiar los procedimientos de ablación, sin embargo, ninguno de los esquemas descritos anteriormente ha sido aplicado en la práctica clínica. Una de las limitaciones radica en que estos sistemas dependen de un proceso de entrenamiento a partir de señales etiquetadas manualmente bajo los parámetros definidos por un determinado grupo de investigación, lo cual, debido al poco conocimiento de las morfologías presentes en las señales EGM y la falta de un estándar para clasificar las señales, hace que la solución encontrada esté sesgada por las propiedades estadísticas de la base de datos utilizada en el entrenamiento, y por la subjetividad del grupo de investigación que etiqueta las señales.
Otra limitación, es que hasta hoy no se ha logrado hacer una relación precisa entre las diferentes clases de electrogramas con los substratos arritmogénicos, y, por lo tanto, no ha sido posible validar en la clínica los procedimientos de ablación guiados por la clasificación de electrogramas. Una de las principales limitaciones para el desarrollo de técnicas que guíen la ablación es que las tecnologías actuales no permiten hacer un seguimiento preciso de la propagación del potencial de acción sobre la aurícula humana, dificultando la identificación directa del patrón de propagación real en cada paciente.
Método de aprendizaje semi-supervisado para guiar procedimientos de ablación
Con el fin de superar las limitaciones presentes en los métodos de reconocimiento de patrones basados en aprendizaje supervisado, Orozco-Duque et al. han propuesto un método de mapeo electro-anatómico basado en técnicas de agrupamiento semi-supervisado que permite la localización sobre la superficie auricular de las diferentes morfologías presentes en las señales EGM [74]. Este método, llamado FEPMAP (fractionated-electrogram-patterns-mapping), puede ser aplicado bajo las condiciones en que se realiza el mapeo electroanatómico, utilizando equipos comerciales como los equipos NavX y Carto.
La ventaja del esquema semi-supervisado, respecto a los esquemas supervisados, es que tiene una menor dependencia a las propiedades estadísticas del conjunto de señales etiquetadas utilizadas como información externa. El método FEPMAP, permite realizar una evaluación paciente-específico, para lo cual sólo se utiliza una pequeña cantidad de señales etiquetadas correspondientes a la clase 0, es decir, señales no fragmentadas. Esto permite una mayor generalización del modelo, por lo que es posible la identificación de morfologías de las ondas de activación con características estadísticas diferentes a las descritas por las bases de datos etiquetadas de las que se dispone. Esta propiedad es importante en la discriminación de las morfologías de los EGM, ya que no existe una definición estándar de fragmentación que describa claramente las clases que pueden ser encontradas en estas señales.
El método semi-supervisado, permite que la implementación del sistema pueda llevarse a cabo con señales adquiridas en condiciones diferentes a las utilizadas en la base de datos de entrenamiento, por ejemplo, cuando se utilizan diferentes tipos de catéteres. La Figura 4 presenta un mapa generado bajo el método FEPMAP a partir de las señales adquiridas en un paciente de FA persistente con un electrodo circular tipo LASSO® y utilizando el sistema NavX® (St Jude Medical, Inc., St. Paul, MN, USA).

Figura 4 Mapa electroanatómico generado con el método FEPMAP. Vista de la pared posterior de la aurícula izquierda de un paciente con FA. La barra de color indica el nivel de desorganización de la señal de acuerdo a las clases definidas en la Tabla 1. La zona roja indica actividad continua y desorganizada y podría estar asociada a un sitio crítico de actividad fibrilatoria.
Conclusiones
La ablación en FA persistente continúa siendo un tema de investigación abierto que requiere de un mayor conocimiento en los mecanismos que perpetúan la arritmia y que exige múltiples esfuerzos multidisciplinarios para aumentar las tasas de éxito.
Se han logrado avances significativos en el entendimiento de los mecanismos de la FA en la última década, los cuales han permitido el desarrollo de técnicas de ablación particularmente en los pacientes con FA paroxística. Múltiples estudios clínicos recientes en pacientes con FA persistente indican que agregar el procedimiento de ablación guiada por electrogramas fraccionados o la generación de líneas guiadas anatómicamente no incrementan la tasa de éxito, comparado con realizar exclusivamente el aislamiento de las venas pulmonares.
Estos hallazgos han dado pie a propuestas de modalidades novedosas de mapeo en FA persistente, basadas en métodos y herramientas avanzadas de procesamiento de señales. Los métodos de reconocimiento de patrones tanto supervisados como semi-supervisados podrían usarse como un complemento en la evaluación de sitios objetivos de ablación, ya que permite observar la distribución de las diferentes morfologías de las señales EGM sobre la reconstrucción 3D de la aurícula realizada durante los procedimientos de mapeo.
Estos métodos, aunque han mostrado evidencia prometedora en el laboratorio respecto a su desempeño en el análisis de señales EGM, deben ser evaluados en estudios clínicos de cohortes amplias para establecer la relación entre los patrones encontrados en las señales EGM con los substratos arritmogénicos y los diferentes mecanismos que sostienen la arritmia en el paciente. Igualmente, deben someterse a estudios clínicos para demostrar su eficacia para guiar procedimientos de ablación en pacientes con FA persistente.











 nueva página del texto (beta)
nueva página del texto (beta)