INTRODUCCIÓN
Según las últimas cifras reportadas por la Federación Internacional de Diabetes (IDF, por sus siglas en inglés de International Diabetes Federation) en la actualidad existen más de 514 millones de personas alrededor del mundo que padecen algún tipo de diabetes y se espera que para el 2040 la cifra aumente a 642 millones de personas. De los tres tipos de diabetes más comunes el que tiene mayor prevalencia en la actualidad es la diabetes tipo 2. En los países con mayor ingreso económico del total de adultos que padece diabetes, cerca del 91% son diabéticos tipo 2, esto sin considerar a los pacientes no diagnosticados [1]. Observando los datos por regiones, Norte América y el Caribe tiene 12.9% de la población adulta afectada por algún tipo de diabetes, esta región tiene la prevalencia mayor de diabetes comparada con las demás regiones. En México, según la Encuesta Nacional de Salud y Nutrición (ENSANUT) del 2016, la prevalencia del país fue de 7.2% en 2006 a 9.4% en 2016 en personas mayores de 20 años. De las personas afectadas, sólo el 87.8% contestó que llevaba algún tratamiento para el control del padecimiento; del total de diabéticos encuestados, el 46.4% no realiza alguna medida preventiva para evitar o retrasar las complicaciones derivadas de la diabetes [2].
Debido al impacto que tiene esta enfermedad en la salud pública, se han ido desarrollando diferentes metodologías para apoyar a la ciencia médica en el entendimiento de este padecimiento, una de ellas es el modelado matemático. Dependiendo del propósito y del proceso biológico que se desee reproducir, los modelos matemáticos de diabetes pueden ser clasificados en clínicos y no clínicos [3]. Los modelos clínicos son de estructura matemática sencilla y emulan datos clínicos considerando sólo la descripción sistémica del cuerpo humano [4, 5, 6]; mientras que los no clínicos son de estructura matemática más compleja y se basan en el conocimiento y la descripción mecanicista de los procesos fisiológicos que dan lugar al metabolismo de glucosa [7, 8, 9]. Los modelos clínicos se utilizan como herramientas de diagnóstico y se enfocan en la sensibilidad y secreción de la insulina, la efectividad de la glucosa y la funcionalidad de las células beta [10]. Éstos han sido desarrollados a partir de pruebas de tolerancia a la glucosa intravenosa (IVGTT, por sus siglas en inglés de intravenous glucose - tolerance test), dando a lugar los modelos mínimos, y sus modificaciones [5]. También existen modelos que se enfocan en la progresión de la enfermedad, basándose en la funcionalidad de las células beta, por lo que se usan más en diabetes tipo 2 [11].
Respecto a los modelos no clínicos, el enfoque es modelar los procesos fisiológicos de los principales órganos relacionados con el metabolismo de glucosa, para analizar la forma en que los órganos interaccionan entre sí. En el modelado fisiológico generalmente se propone dividir el cuerpo humano en compartimentos, en donde cada compartimento representa un órgano y se analiza la variación en el tiempo de las concentraciones de glucosa en cada uno de ellos. Por ejemplo, el modelo propuesto por Tiran et al., describe la dinámica de la insulina y la glucosa en los principales órganos involucrados en el proceso: cerebro, corazón, estómago, hígado, riñones y tejidos periféricos (músculo y grasa) y la interconexión entre ellos por medio del sistema circulatorio [12]. Del anterior, Sorensen propuso otro modelo que detalla el metabolismo de glucosa y su regulación por insulina y glucagón en los mismos ocho órganos y tejidos involucrados en el proceso [8]. Los modelos no clínicos permiten predecir el comportamiento dinámico del metabolismo de glucosa, lo cual puede ser usado para mejorar el tratamiento de la diabetes.
Una aplicación de los modelos matemáticos en el desarrollo de herramientas para mejorar el tratamiento de la diabetes son los pacientes virtuales (o modelos in silico) [13]. Respecto a diabetes tipo 1, existe un mayor desarrollo de estas herramientas. Un ejemplo de ello es el llamado UVA/PADOVA Type I Diabetes Simulator desarrollado por Cobelli et al. el cual cuenta con una población base de 300 sujetos (100 adultos, 100 adolescentes y 100 niños) que usando datos reales simula pacientes con diabetes tipo 1. Además, este simulador incluye un sensor simulado de monitoreo continuo de glucosa y un simulador de liberación de insulina. Este modelo in silico fue aprobado por la Administración de Alimentos y Medicamentos de Estados Unidos (U.S. FDA, por sus siglas en inglés de United States Food and Drug Administration) como sustituto de pruebas preclínicas realizadas en animales [14]. Posteriormente los desarrolladores del UVA/PADOVA propusieron modificaciones a este simulador, las cuales incluyen mejoras en el modelo de cinética de glucosa en hipoglicemia e incorporación de la cinética y secreción de glucagón, además de nuevas reglas para la determinación de insulina en función de la tasa de ingesta de carbohidratos y el factor de corrección de los pacientes virtuales [15]. Dado lo anterior, el objetivo de esta investigación es contribuir en el desarrollo de herramientas computacionales que ayuden en la comprensión del metabolismo de glucosa y su uso en el tratamiento de diabetes. Por lo tanto se propone un programa computacional que simule la evolución temporal de la concentración de glucosa en sangre, a partir de un conjunto de modelos matemáticos compartimentales. Esta herramienta permitiría observar de una manera gráfica dicha evolución, así como ingresar datos del metabolismo del paciente. Estos registros podrían ayudar posteriormente en la personalización de los tratamientos.
METODOLOGÍA
Modelos Matemáticos Compartimentales del Metabolismo de Glucosa
En investigación se consideran tres modelos matemáticos que describen el metabolismo de la glucosa, desde distintos enfoques: un modelo mínimo [5], un modelo que considera la ingesta alimenticia [16], y otro modelo que considera la administración de insulina por vía subcutánea [17]. Los tres esquemas modelan el balance de materia (glucosa e insulina) en los compartimentos del cuerpo humano que cada uno de ellos proponen. A continuación se describen los principales detalles de los modelos.
Modelo Mínimo de Metabolismo de Glucosa
Este modelo propuesto por Cobelli et al. modela el metabolismo de la glucosa considerando su relación con la insulina plasmática. En este modelo se proponen dos compartimentos en donde se analizan las tasas de cambio de glucosa e insulina. El balance de insulina considera como término de producción a la insulina plasmática que ingresa al compartimento a una cierta tasa (ver Figura 1, izquierda). La insulina disponible está relacionada con el compartimento de la glucosa ya que promueve los términos de producción hepática en el compartimento de la glucosa; así como el consumo hepático y de tejidos periféricos [5]. El balance de glucosa se obtiene a partir del balance neto de glucosa hepática y un término de absorción de glucosa en tejidos periféricos (ver Figura 1, centro). Las ecuaciones que modelan tanto el balance de la glucosa como de la insulina son las siguientes:

FIGURA 1 Esquema gráfico que representa el modelo mínimo de metabolismo de glucosa dependiente de insulina propuesto por Cobelli 'et al' [5] .
donde G (mg/dl) es la concentración de glucosa, X= (k4+k6)I’, I’ (μU/ml) es la concentración de insulina en un compartimento remoto de plasma, I(t) es la concen tración de insulina plasmática y p1= -(k1+k5), p2= -k3, p3= k2(k4+k6), p4= B0. La ecuación (1) considera el balance neto de glucosa hepática B= B0-(k5+k6I’)G y la absorción de glucosa en tejidos periféricos Up= (k1k4I’) G; donde, B0 es el balance neto esperado cuando la concentración de glucosa plasmática es extrapolada a 0; k1, k4, k5, k6 (min -1 ) representan las tasas fraccionales de volumen. Mientras que la Ecuación (2) considera los términos de producción k2I(t) y el término de consumo k3I’. Después de definir la insulina en el compartimento remoto X= (k4+k6)I’ y de realizar operaciones algebraicas, se obtienen las Ecuaciones (1) y (2) en términos de los parámetros p1, p2, p3 y p4. En la Figura 1 se muestra una ilustración del esquema propuesto por Cobelli et al. que indica las principales funciones del modelo mínimo.
Modelo de Metabolismo de Glucosa Considerando Ingesta Alimenticia
El segundo modelo fue propuesto por Dalla Man et al. y considera ingesta alimenticia, por lo cual es capaz de describir los eventos fisiológicos que ocurren después de la ingesta de alimentos. El modelo es capaz de reproducir el metabolismo después de una sola comida simple, así como de una rutina diaria de ingesta de los pacientes (desayuno, comida y cena) [16]. Dicho modelo se subdivide en los subsistemas y procesos que se describen a continuación.
El subsistema de glucosa se basa en el modelado de dos compartimentos, uno de glucosa plasmática y tejidos de equilibrio rápido y otro de glucosa en tejidos de equilibrio lento, descritos por las siguientes ecuaciones:
donde Gp (mg/kg) es la masa de glucosa en el plasma, Gt (mg/kg) es la masa de glucosa en tejidos, G(t) (mg/dl) es la concentración total de glucosa en plasma obte nida por la expresión G(t) = Gp(t)/VG, EGP (mg/kg/min) es la producción endógena de glucosa, Ra (mg/kg/min) es la tasa de aparición de glucosa en plasma, E (mg/kg/ min) es la excreción renal, Ui (mg/kg/min) es la utilización de glucosa independiente de insulina, Uid (mg/kg/ min) es la utilización de glucosa dependiente de insulina, k1 y k2 (min -1 ) son tasas, y VG (dl/kg) es el volumen de distribución de glucosa. Las ecuaciones auxiliares para las anteriores son:
si
entonces
si
entonces
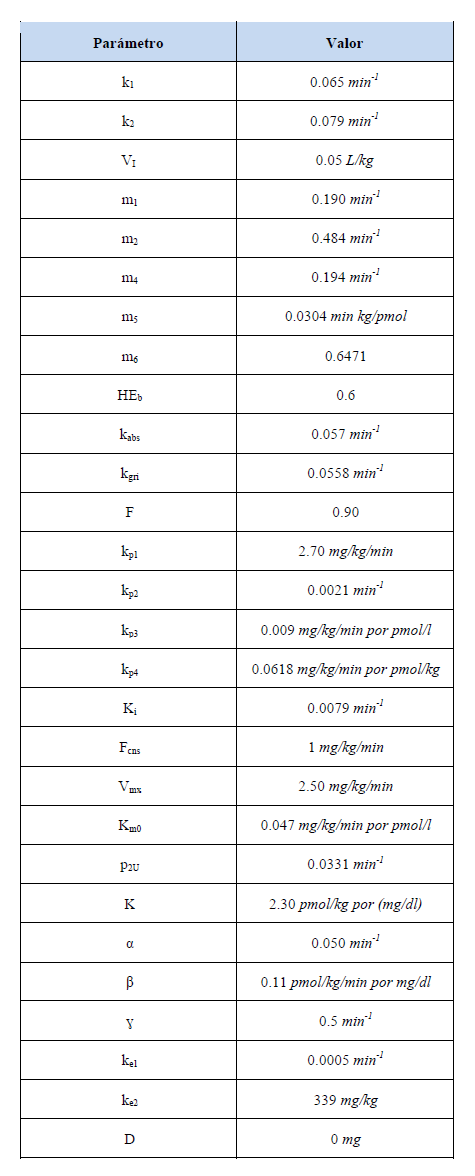
donde kp1 es la EGP (mg/kg/min) extrapolada a cero glucosa y cero insulina, kp2 (min-1) es la eficacia de la glucosa del hígado, kp3 (mg/kg/min por pmol/l) es la amplitud de la acción de insulina en el hígado, kp4 (mg/ kg/min por pmol/l) es la amplitud de la entrada de la acción de insulina en el hígado, f es la fracción de absorción intestinal que aparece en el plasma, kabs (min -1 ) es la tasa constante de absorción intestinal, Qgut (mg) es la cantidad de masa de glucosa en el intestino, BW (kg) peso del sujeto, Fcns es la utilización de glucosa del cerebro y los eritrocitos. El subsistema de insulina consta de dos compartimentos usados para describir la cinética de la insulina, dado por siguientes ecuaciones:
donde Il (kg) es la masa de insulina en hígado, Ip (pmol/kg) es la masa de insulina plasmática, I (pmol/l) es la concentración de insulina plasmática, y m1, m2 y m4 (min -1 ) son tasas. Con las siguientes ecuaciones auxiliares
El proceso de producción endógena de glucosa es descrito por las ecuaciones presentadas a continuación, consistiendo de una señal directa de glucosa y las señales retrasadas y anticipadas de insulina.
donde I1 (pmol/l) es la variable auxiliar debido a la señal retardada de insulina, Id (pmol/l) es una señal retrasada de insulina realizada con una cadena de dos compartimentos, y ki (min -1 ) es la tasa de retraso entre la señal de insulina y de la acción de insulina.
El proceso de aparición de glucosa es descrito por su tasa, la cual se basa en las tres Ecuaciones (9), (10) y (11), donde Qsto (t)= Qsto1 (t) + Qsto2 (t) representa una ecuación auxiliar. Este proceso describe el paso de la glucosa a través del estómago (que es representado por dos compartimentos, uno para la fase de sólidos y otro para la fase de trituración), y otro compartimento que describe a los intestinos.
donde Qsto1 (mg) es la cantidad de glucosa en estado sólido en el estómago, Qsto2 (mg) es la cantidad de glucosa en estado líquido en el estómago, kgri (min -1 ) es la tasa de fragmentación, kempt (Qsto) (min-1) es la tasa constante de vaciado gástrico, kabs (min -1 ) es la tasa constante de absorción intestinal, Qsto (mg) es la cantidad de glucosa en el estómago y D (mg) es la cantidad total de glucosa ingerida El proceso de utilización de la glucosa está dado por la siguiente ecuación diferencial, asumiendo dos compartimentos, uno dependiente de insulina y otro independiente de insulina.
donde X (pmol/L) es la insulina en el fluido intersticial, Ib (pmol/kg) es la insulina basal y p2U (min -1) es la tasa constante de acción de insulina en la utilización de la glucosa periférica. El proceso de secreción de la insulina pancreática es descrito por las ecuaciones (13) y (14).
Si
Si β(G(t)-h) < -Sb, entonces
Y la ecuación auxiliar Spo (t)= Y(t) + KG + Sb para G > 0 y Spo (t)= Y(t)+Sb para G ≤ 0, donde ɣ (min -1 ) es la tasa constante de transferencia entre la vena porta y el hígado, K (pmol/kg por mg/dl) es la respuesta pancreática a la tasa de cambio de glucosa, α es el retardo entre la señal de glucosa y la secreción de insulina (min -1 ), β (pmol/kg por mg/dl) es la respuesta pancreática a la glucosa, es el nivel del umbral de glucosa superior al cual las células β comienzan a producir nueva insulina (mg/dl), el cual su valor fue establecido igual que la glucosa basal Gb para garantizar que el sistema esté en estado estable en condiciones basales. En la Figura 2 se muestra una ilustración del esquema presentado por Dalla Man et al. basado en las principales funciones que se ven envueltas en el modelo de glucosa e insulina considerando ingesta alimenticia.

FIGURA 2 Esquema gráfico que representa el modelo de glucosa e insulina de humano sano considerando ingesta alimenticia propuesto por Dalla Man 'et al' [16] .
Modelo Metabolismo de Glucosa Considerando Insulina Subcutánea
El modelo propuesto por Hovorka et al. está basado en tres subsistemas: glucosa, insulina y acción de la insulina inyectada por vía subcutánea. Se emplearon ras treadores de glucosa para determinar la estructura y valores de los parámetros de la cinética de la glucosa en sujetos sanos durante condiciones basales y durante una prueba intravenosa de tolerancia a la glucosa [17]. Los tres subsistemas se describen a continuación.
El subsistema de glucosa consiste en la descripción de dos compartimentos, uno accesible y otro no accesible, describiendo la absorción, distribución y disposición mediante las siguientes ecuaciones.
donde Q1 (mmol) representa la masa del comparti mento accesible, Q2 (mmol) representa la masa del compartimento no accesible, VG (L kg -1 ) es el volumen de distribución del compartimento accesible, k12 (min -1 ) es la tasa constante de transferencia del compartimento no accesible al accesible, EGP0 (mmol kg -1 min -1 ) representa la producción endógena de glucosa extrapolada a la concentración cero de insulina, F01 c (mmol kg -1 min -1 ) es el flujo de glucosa no dependiente de insulina, FR es la eliminación de glucosa renal por arriba del umbral de glucosa de 9 mmol (L -1 ) y UG (min -1 ) es la tasa de absorción intestinal representada por una cadena de dos compartimentos con tasas de transferencia idénticas 1/ tmax,G, la cual puede ser calculada como
donde tmax,G (min) es el tiempo máximo de aparición de la tasa de glucosa en el compartimento de glucosa accesible, DG (mmol) es la cantidad de carbohidratos digeridos y AG es la biodisponibilidad de los carbohidratos.
El subsistema de insulina considera el comportamiento dinámico de la concentración de insulina inyectada en el tejido periférico; además de que describe su absorción, distribución y disposición, descritas respectivamente por las Ecuaciones (17), (18) y (19).
donde S1, S2 (mU) son una cadena de dos compartimentos que representan la absorción de la insulina de corta acción administrada subcutáneamente, u(t) (mU/min) representa la administración (en bolo e infusión) de insulina, tmax,I (min) es el tiempo máximo de absorción de insulina, ke (min -1 ) es la tasa fraccional de eliminación, VI (L kg -1 ) es el volumen de distribución, I(t) (mU/L) es la concentración de insulina plasmática y UI la tasa de absorción de insulina, que puede ser obtenida por
El subsistema de acción de insulina modela el transporte, disposición y producción endógena de glucosa con las siguientes ecuaciones.
donde x1, x2, x3 representan los efectos remotos de la insulina en la distribución, eliminación y producción endógena de glucosa, kai (donde i =1,...,3) (min-1) representa las constantes de la tasa de desactivación, kbi (donde i =1,...,3) (min-1) representa las constantes de la tasa de activación y I(t) (mU/L) es la concentración de insulina plasmática. En la Figura 3 se muestra un esquema ilustrativo, modificado, del modelo de sensibilidad de la insulina, incluyendo el mecanismo de absorción subcutánea, basado en el presentado por Hovorka et al.

FIGURA 3 Esquema gráfico que representa el modelo de sensibilidad a la insulina con absorción subcutánea propuesto por Hovorka 'et al' [17] .
RESULTADOS Y DISCUSIÓN
Solución Numérica
La implementación numérica de los modelos descritos en la sección anterior se realizó en la plataforma MATLAB®, por medio del método numérico de solución ode45, a continuación se especifican las condiciones de simulación para cada modelo, así como también se muestran las gráficas de los resultados obtenidos.
Se realizó la simulación del modelo mínimo dado por las Ecuaciones (1) y (2), para ello se consideró el conjunto de parámetros nominales definidos en la Tabla 1, como condiciones iniciales se tomó x(0)=[70; 0], el tiempo de simulación fue seleccionado de acuerdo con la respuesta dinámica típica de este tipo de sistemas, en este caso tspan= [0; 180]. Los parámetros del método de solución fueron los que tiene la herramienta ode45 por defecto.
En la Figura 4 se muestran las gráficas de G(t) (glucosa) y X(t) (insulina) obtenidas en la simulación. En la Figura 5 se comparan dos gráficas de glucosa, la primera, en color negro, obtenida por medio de la simulación del modelo contra la segunda, en color azul, que representa los datos experimentales obtenidos en el Experimento 4 de [5]. La simulación del modelo que considera ingesta alimenticia dado por el sistema de ecuaciones (3)-(14), fue realizada considerando condiciones iniciales dadas por x0= [78; 0; 0; 6; 0; 0; 0; 0; 0; 0; 2.328; 0] y un tiempo de simulación de tspan= [0; 400]. En la Tabla 2 se definen los parámetros nominales utilizados para la simulación.

FIGURA 4 Gráficas obtenidas en la simulación del modelo mínimo. (a) Gráfica de glucosa G(t) (línea negra) y (b) gráfica de insulina X(t) (línea azul).

FIGURA 5 Comparación de gráficas de G(t) con el modelo mínimo simulado (línea negra) y datos experimentales reportados en [5] (línea azul).
En la Figura 6 se muestran las gráficas de G(t) (glucosa plasmática) e I(t) (insulina plasmática) obtenidas en la simulación.

FIGURA 6 Gráficas obtenidas en la simulación del modelo de glucosa e insulina de humano sano considerando ingesta alimenticia. (a) Gráfica de glucosa plasmática G(t) y (b) gráfica de insulina plasmática I(t).
La simulación del modelo considerando inyección subcutánea de insulina definida por el sistema de ecuaciones (15)-(22), con condiciones iniciales x0= [0.1249; 0.0941; 0; 0; 0; 0.7665; 0.9519; 0.8473] y un tiempo de simulación de tspan= [0; 700]. En la Tabla 3 se definen los parámetros nominales utilizados para dicha simulación.
TABLA 3 Parámetros nominales usados en la simulación del modelo que considera inyección subcutánea de insulina.

En la Figura 7 se muestran las gráficas de (a) Q1(t) (masa del compartimento accesible de glucosa) y (b) I(t) (concentración de insulina plasmática) obtenidas en la simulación. Así como en la Figura 8 se puede observar una comparación de la gráfica de I(t) con la infusión de insulina administrada [17].
Interfaz Visual
Una vez que se realizaron las simulaciones de los modelos, se diseñó y desarrolló la interfaz que se encarga de presentar de una manera más intuitiva y amable la simulación de los modelos, además la interfaz permite que se puedan trabajar con datos obtenidos en experimentos como concentraciones de glucosa e insulina inyectada. El desarrollo de la interfaz visual también se llevó a cabo en MATLAB®, usando la herramienta de diseño de interfaz gráfica de usuario (GUIDE por sus siglas en inglés de Graphic User Interface Development Environment). La interfaz inicia con una ventana principal, ilustrada en la Figura 9, en la cual se encuentra un menú de opciones para el usuario donde puede escoger alguno de los tres modelos de metabolismo de glucosa que se programaron.
Sin importar el modelo que se seleccione, la estructura es muy similar entre ellos, teniendo cinco secciones sobresalientes: 'Parámetros de Simulación', 'Botones de Comandos', 'Gráficas de Simulación', 'Muestra Gráfica de Concentración de Glucosa e Insulina', y 'Regresar al Menú', las cuales se muestran en la Figura 10.
En la sección de 'Parámetros de Simulación' (ver Figura 11) es donde el usuario introduce los datos que se requieren para comenzar la simulación, entre los que se encuentran: tiempo final de simulación, condiciones iniciales del modelo (varía la cantidad dependiendo del modelo a simular), el nombre del archivo .mat que con1 iene el o los vectores de datos experimentales obtenidos de insulina y glucosa (según sea el caso, y es necesario expresar la extensión del archivo), y finalmente los nombres de los vectores que contengan los datos a usar en la simulación. La sección 'Botones de Comandos' se usa para establecer el inicio de la simulación (botón 'Ejecutar'), y cuando la simulación se haya detenido o simplemente no esté siendo ejecutada, se pueda limpiar las casillas de datos de los parámetros con el botón 'Reset'. En la parte inferior de la ventana, se encuentra la sección de 'Gráficas de Simulación', la cual se puede apreciar en la Figura 12, donde se muestran las gráficas del resultado de simulación para glucosa (izquierda) e insulina (centro) y a la derecha de ellas se muestran los vectores de datos graficados.
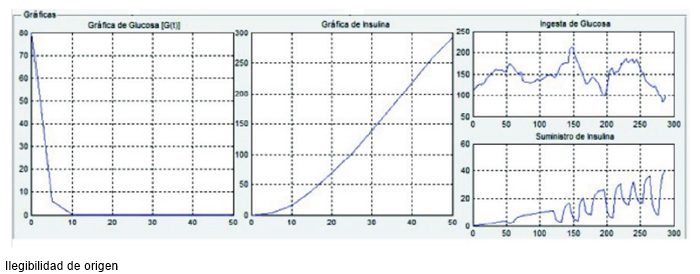
FIGURA 12 Gráficas de simulación. Gráfica de la glucosa simulada (izquierda), gráfica de la insulina simulada (centro) y gráfica de los vectores de datos experimentales (derecha).
A la derecha de la pantalla principal de simulación en la interfaz se encuentra la sección de 'Muestra Gráfica de Concentración de Glucosa e Insulina', ilustrado por la Figura 13, donde se muestra una imagen que representa una muestra sanguínea y, después de terminada la simulación, se muestra la concentración de insulina (indicadores amarillos) y glucosa (indicadores azules). Por último, el botón 'Menú' es el encargado de llevar de vuelta al usuario al menú principal de opciones de modelos sin cerrar la ventana del modelo con que se estaba trabajando.
Discusión
El proceso de metabolismo de glucosa se puede resumir en que, si el nivel de glucosa se incrementa habrá una respuesta de secreción de insulina hasta que el nivel de glucosa regrese a valores euglicémicos. El modelo mínimo modela la tasa de cambio de la glucosa plasmática (Ecuación (1)) en función de la producción interna de glucosa (hepática) y el consumo por el tejido hepático y periférico promovido por la acción de la insulina disponible en plasma (Ecuación (2)). Por otra parte, el modelo que considera ingesta alimenticia, incluye una descripción más detallada de la tasa de cambio de glucosa plasmática, considerando dos compartimentos (Ecuaciones (3) y (4)). El efecto de la insulina en la producción hepática de glucosa (producción endógena) se representa por las Ecuaciones (7) y (8). La aparición de glucosa debida a la ingesta se modela en las Ecuaciones (9), (10) y (11), mientras que la utilización de glucosa por tejidos se modela en la Ecuación (12). Por otro lado, la tasa de cambio de la insulina plasmática se modela con las Ecuaciones (5) y (6), mientras que la secreción de insulina pancreática se modela con las Ecuaciones (13) y (14). Finalmente en el modelo de inyección subcutánea de insulina, se consideran dos ecuaciones para modelar la tasa de cambio de la glucosa plasmática Ecuaciones (15) y (16). El proceso de absorción insulina inyectada por vía subcutánea se representa en las Ecuaciones (17) y (18). La tasa de cambio de la insulina plasmática se presenta por la Ecuación (19). Las tasas de transporte, disposición y producción endógena de glucosa en función de la insulina plasmática, se representan por las Ecuaciones (20), (21) y (22), respectivamente. Como se puede observar en este resumen, los tres modelos tienen como objetivo modelar las tasas de cambio de glucosa e insulina plasmática y su relación entre ellas. Los tres modelos consideran el término de producción endógena (o hepática) de glucosa, así como el consumo de glucosa por tejidos (hepático y periférico). Sin embargo, los modelos difieren en el detalle matemático de dichos procesos, siendo el modelo de Cobelli et al. el más simple, ya que no considera alguna fuente de disposición de insulina plasmática; mientras que el modelo de Dalla Man et al., considera un subsistema de secreción pancreática de insulina como fuente de producción en el compartimento de la insulina plasmática; por su parte Hovorla et al., considera un subsistema de absorción de insulina subcutánea como fuente de producción en el compartimento de insulina plasmática. El modelo propuesto por Dalla Man et al., incluye además una fuente de glucosa externa (ingesta de alimentos) al compartimento de glucosa plasmática.
Al observar los resultados de la simulación para el modelo mínimo, dado a que no hay entrada de insulina, se tiene sólo la acción de la glucosa, esto puede ser visto como una adaptación sencilla a un modelo para pacientes diabéticos tipo 1. Además los datos experimentales comparados con la gráfica de simulación, ambos del compartimento de glucosa, muestran una similitud en cuanto a forma de comportamiento, aunque es notorio que existe un error que es necesario disminuir (ver Figura 5). En cuanto al modelo que considera ingesta alimenticia, se puede observar el comportamiento de la glucosa a través del tiempo, lo cual nos permite ver la metabolización postprandial (ver Figura 6). De manera similar se presentan los resultados del modelo con absorción subcutánea de insulina. Al tener una curva de glucosa, podemos observar cómo va cambiando dependiendo de la insulina (ver Figura 7); esto es, cómo va metabolizándose la glucosa conforme aumenta a la cantidad de insulina en el plasma. Además de analizar la insulina en el sistema dependiendo de la administrada vía subcutánea. Teniendo en cuenta los resultados anteriores, se puede considerar que los tres diferentes modelos están listos para pasar a su validación y ajuste de parámetros para una población de interés. Con ello se podrían reproducir como pacientes virtuales para pruebas in silico.
CONCLUSIONES
La aplicación de los modelos antes presentados en una interfaz visual hace que su manejo se presente de una manera más accesible y amigable para los especialistas. Además, la interfaz permite representar diferentes procesos del metabolismo de glucosa, por ejemplo, si sólo interesa conocer las tasas de cambio de glucosa y/o insulina plasmática, o bien cómo éstas pueden modificarse cuando hay una ingesta de alimentos o una inyección de insulina por vía subcutánea, como ya se describió en la subsección de Discusión. Los modelos presentados también permiten representar tres tipos de pacientes: sujetos sanos (modelo mínimo), pacientes con diabetes tipo 2 (modelo que considera ingesta alimenticia) y pacientes con diabetes tipo 1 (modelo que considera inyección subcutánea de insulina).
Debido a la versatilidad del lenguaje de programación que presenta MATLAB® la estructura está preparada para, en un futuro, poder agregar diferentes modelos. Lo anterior también da lugar a una segunda etapa de trabajo en la cual, con parámetros estandarizados, se tenga una interfaz de paciente virtual que pueda predecir después de cierto tiempo el comportamiento de dicho padecimiento. Con ello se da pie a la mejora de los actuales tratamientos para pacientes diabéticos.











 nueva página del texto (beta)
nueva página del texto (beta)