INTRODUCCIÓN
El tejido óseo presenta una limitada capacidad auto-regenerativa bajo diferentes condiciones, tales como las lesiones de gran tamaño, baja actividad celular, cáncer, y otras patologías. En estas circunstancias, es necesaria la búsqueda de soluciones externas como prótesis e injertos biológico (autoinjertos, aloinjertos y xenoinjertos) [1], los cuales presentan diferentes limitaciones que abarcan desde la falta de integración con el organismo (osteointegración) hasta los riesgos de rechazo y transmisión de enfermedades [2, 3]. La ingeniería de tejidos nace como una alternativa viable, haciendo uso de componentes como células (progenitoras o diferenciadas), factores de crecimiento y diferenciación, y andamios biofuncionales hechos de biomateriales [1, 2].
En la actualidad los biopolímeros son los principales biomateriales utilizados en el área de la ingeniería de tejido óseo. Esto es en parte debido a la facilidad de modificación, a través de la introducción de grupos químicos funcionales o macromoléculas que puedan conferir propiedades específicas, incluyendo la inducción de actividades celulares de interés, como la adhesión, mitogénesis o diferenciación [4]. Por lo tanto, estos biopolímeros deben ser capaces de adoptar esta biofuncionalidad, además de ser biocompatibles, químicamente estables, tener buenas propiedades mecánicas, integrarse con el tejido circundante e inducir la regeneración de la zona afectada [5, 6]. Entre los biopolímeros mayormente utilizados en aplicaciones biomédicas, se encuentra el Quitosano, y, en el caso específico de la ingeniería de tejido óseo, este ha sido combinado con la hidroxiapatita (HAP), un análogo del componente mineral del hueso.
El QT es un polímero biodegradable derivado de la desacetilación parcial de la quitina, proveniente del citoesqueleto de los crustáceos. El QT ha demostrado ser biocompatible y aprovechable en numerosas aplicaciones biomédicas, siendo principalmente utilizado en la ingeniería de tejido óseo, a través de la fabricación de películas, andamios porosos, micro y nano-partículas, y en variadas formulaciones de hidrogeles [7, 8]. Sin embargo, el QT es soluble a pH ácido, dificultando su aplicación en ciertos sistemas implantables, especialmente los polimerizables in situ. Además de esto, generalmente, se utiliza un agente entrecruzante que puede conllevar ciertos niveles de citotoxicidad, actuando en detrimento del aspecto biocompatible del biopolímero. Como consecuencia, algunos investigadores han propuesto el uso de otros agentes entrecruzantes, y modificaciones que permitan la disolución del QT a pH fisiológico [9, 10].
Ono y col. Propusieron la modificación del QT, utilizando química de carbodiimida, utilizando ácido lactobiónico para la solubilización a pH fisiológico. Además, incluye, a través del mismo mecanismo, la modificación con ácido azidobenzoico, permitiendo que, bajo una corta exposición bajo luz UV, el QT pueda entrecruzarse y formar hidrogeles tridimensionales estables [11]. El quitosano modificado según este protocolo también ha sido utilizado como base para recubrimientos activos sobre superficies de Ti6Al4V, demostrando capacidad de adhesión y proliferación celular, así como su diferenciación osteogénica [2].
Por otro lado, la HAP ha sido ampliamente utilizada en aplicaciones biomédicas, debido a su alto grado de biocompatibilidad y bioactividad [12,13, 14]. Esta ha sido empleada en la fabricación de diferentes sistemas de andamios, tanto en forma de hidrogeles como en estructuras porosas pre-fabricadas, con potencial para la regeneración de tejido óseo [15]. En especial, las formas nano-particuladas de HAP han demostrado mayor potencial para la diferenciación osteogénica y osteogénesis in vivo, quizás debido a una alta actividad superficial, y estrucutra ultrafina que emula a la estructura mineral ósea [16,17].
La HAP ha sido, a su vez, combinada con el QT para la fabricación de andamios biofuncionales y osteoinductivos. En este sentido, resaltan las membranas de QT y nano-HAP para guiar la diferenciación osteogénica de células madre mesenquimales [18]. De igual manera, esponjas porosas de ambos materiales han demostrado potencial para regeneración ósea in vivo, a través de diferentes modelos animales [19, 21]. A pesar de las ventajas y el potencial regenerativo que puedan presentar los andamios compuestos de QT y HAP, estos generalmente son fabricados utilizando quitosano nativo, sin modificación, limitando así su uso para aplicaciones de polimerización o entrecruzamiento in situ, dadas las condiciones de pH. El uso de un quitosano modificado para ser entrecruzable bajo luz UV, por cortos períodos de exposición, y que además pueda ser soluble a pH fisiológico, en combinación con hidroxiapatita nanopartículada podría generar hidrogeles polimerizables in situ con un alto potencial para la regeneración ósea en zonas de baja demanda mecánica. Más aún, estos materiales “inyectables” podría servir de transportadores (carriers) en terapias de células madre, potenciando además el desempeño de las mismas.
Por todo lo expuesto anteriormente, en este trabajo se estudia la interacción entre los hidrogeles de quitosano fotoentrecruzable y nano partículas de hidroxiapatita (QT:HAP) con células madre mesenquimales (MSC) provenientes de la médula ósea de ratas, con el fin de evaluar su potencial como un material osteoconductivo, inyectable, en aplicaciones de regeneración de tejido óseo en zonas de baja demanda mecánica. El estudio de las interacciones células- biomaterial cobra importancia puesto que estas son de vital importancia en el desempeño celular dentro del proceso de regeneración tisular [1].
METODOLOGÍA
Elaboración de los Hidrogeles de Quitosano modificado: nano-Hidroxiapatita (QT:HAP)
Para la solubilización y modificación química del quitosano se utilizó el protocolo propuesto por Ono. K. y colaboradores [10]; en el cual se funcionaliza el quitosano por medio de reacciones de carbodiimida con el ácido lactobionico y ácido azidobenzoico para aumentar la solubilidad del quitosano a pH fisiológico y producir un hidrogel por fotoentrecruzamiento, respectivamente. Para este proceso se utilizó quitosano con un peso molecular promedio de 4.3x105 Da. Esta modificación fue utilizada previamente en nuestro grupo de investigación, demostrando estabilidad del QT modificado luego de ciclos de esterilización, a través de espectroscopia infrarroja por Transformada de Fourier, y resonancia magnética nuclear [2].
En la construcción de los hidrogeles se utilizó una solución al 2% p/v del quitosano modificado, disuelto en agua destilada/desionizada. A partir de la misma se tomaron alícuotas que fueron mezcladas con cantidades determinadas de nano partículas de hidroxiapatita (HAP) (Sigma-Aldrich); obteniendo las formulaciones de QT:HAP, 100:0 90:10, 70:30, 50:50 y 30:70 respectivamente. Las mezclas fueron esterilizadas en un autoclave durante 15 min, y luego fueron colocadas bajo luz UV (5000 μJ/cm 2 ) por 2.5 min a fin de inducir el entrecruzamiento de las cadenas de quitosano modificado.
Cultivos Celulares Sobre los Hidrogeles
Células madre mesenquimales (MSC) se obtuvieron de fémures provenientes de ratas Wistar (machos de aproximadamente 9 semanas). Las células aisladas se suspendieron en medio de cultivo α-MEM (GIBCO) con 10% de Suero Fetal Bovino (SFB; GIBCO) y 10% de antibiótico y antimicótico (antibiotic-antimycotic 100X, GIBCO), y se sembraron en placas de cultivo de 75 cm 2 . Las células madre mesenquimales extraídas a través de esta metodología han sido previamente caracterizadas por citometría de flujo, corroborando su linaje [22]. Una vez que alcanza ron un 80% de confluencia, estas fueron desprendidas enzimáticamente, utilizando tripsina (0.25 % Tripsina 0,1 % EDTA, GIBCO). Al final del segundo pase de proliferación, las MSCs se sembraron sobre los hidrogeles.
Para los cultivos celulares sobre los hidrogeles, se utilizaron placas de 24 pozos, con una formulación de hidrogel por pozo. Se utilizaron como control pozos que contenían exclusivamente células, sin el hidrogel. Se sembraron de 5x103 células por cm2 sobre los hidrogeles. Luego, se permitió la adhesión celular por 24 h, y una vez transcurrido este tiempo se cambió el medio, esta vez utilizando medio osteogénico [medio α-MEM suplementado con 10% SFB, 10-8 M dexametaxona (Sigma-Aldrich), 0.05 mM Ácido ascórbico (Sigma-Aldrich) y 10 mM β-Glicerolfosfato (Sigma-Aldrich)]. Los cultivos celulares se mantuvieron por 4, 10 y 16 días, realizando cambios de medio de las placas cada dos días hasta la fecha de culminación de cada experimento. Como control, se utilizaron cultivos, durante los mismos períodos de tiempo, utilizando medio α-MEM (control negativo de diferenciación osteogénica).
Determinación del número de células adheridas a los hidrogeles
Una vez finalizado el tiempo de cultivo, se descartó el medio y se reemplazó con agua bidestilada estéril. Con la finalidad de inducir la lisis celular, se sometieron los hidrogeles con las células a 3 ciclos de congelamiento-descongelamiento, y se desintegraron usando un homogeneizador de tejidos (Heidolph), a 10000 rpm por 3 min, y 4 °C. El ensayo de cuantificación de ADN se realizó utilizando el método Pico Green® (Invitrogen), una sonda fluorescente que se adhiere al ADN de doble cadena. La fluorescencia fue medida a 490 nm de excitación y 520 nm de emisión en un lector de placas TECAN, Infinitie200, y se utilizaron soluciones conocidas de λADN para realizar la curva patrón. El número de células se calculó utilizando la cantidad total de ADN determinado en la muestra, dividido por la cantidad de ADN contenido en una célula, el cual fue previamente determinado en el laboratorio en un valor de 3 pg.
Determinación de la actividad de fosfatasa alcalina (ALP)
Los lisados obtenidos para el ensayo de cuantificación de ADN se utilizaron también para la determinación de la actividad fosfatasa alcalina, un marcador de diferenciación osteogénica temprana. Este parámetro se midió mediante el uso de un ensayo espectrofotométrico, el kit empleado fue: “Alkaline Phosphatx Yellow (pNPP) liquid substrate system for ELISA”, (Sigma), utilizando p-nitrofenol para realizar una curva patrón. Alícuotas de 80 μl de muestras y de soluciones patrón se agregaron en una placa trasparente de 96 pozos, junto con 5 mM MgCl2, 0.5 M de 2-amino-2-metil-1-propanol y 100 μl de la solución sustrato (5 mM paranitrofenilfosfato). Después de transcurridos 30 minutos, la reacción se detuvo mediante la adición de 100 μl de 0.1 M NaOH. Se leyó la absorbancia 405 nm. La actividad de ALP se calculó usando la concentración de p-nitrofenol dividida entre el número de células y el tiempo de reacción (30 min).
Evaluación de la morfología celular por microscopia confocal
Culminados los tiempos de cultivo estipulados, las muestras fueron lavadas en solución buffer fosfato salino (PBS) y fijadas en 3.7% para-formaldehído por 10 min, seguida de lavados con PBS (2 x 10 min cada uno). Las células se permeabilizaron en 0.1% Triton-X 100 en PBS por 3 minutos a temperatura ambiente y tres lavados sucesivos en PBS. Se realizó el marcaje con 2 unidades de faloidina BODIPY FL (Invitrogen), una sonda fluorescente específica para los filamentos de actina del citoesqueleto, diluidas en albumina de suero bovino (Sigma-Aldrich) (BSA1% en PBS). Por último, se realizaron lavados en PBS (3 x 10 min cada uno). Para visualizar las células se utilizó un microscopio confocal marca Nikon TE200, con longitudes de onda de excitación y emisión de 558 y 569 nm, respectivamente.
RESULTADOS Y DISCUSIÓN
Elaboración de Hidrogeles de Quitosano modificado: Hidroxiapatita (QT:HAP)
Los hidrogeles se realizaron a través del foto-entrecruzamiento del QT modificado, encapsulando las nanopartículas de HAP en el entramado molecular. Esto se realizó previo al cultivo celular, manteniendo los andamios en PBS durante un tiempo igual al estipulado para los ensayos de adhesión y proliferación con la finalidad de determinar cuáles formulaciones serían estables durante el tiempo de cultivo. Es importante destacar que se realizaron otras formulaciones diferentes a las mostradas, con una mayor cantidad de HAP (20:80 y 10:90); sin embargo, estos no fueron estables en el tiempo, notándose una desintegración significativa para el día 10, que puede deberse a un exceso de HAP que interfiera con el proceso de entrecruzamiento de las cadenas de QT. Los hidrogeles con las formulaciones presentadas mantuvieron su forma y apariencia (Figura 1), siendo estos incubados a 37°C en PBS, demostrando que los mismos mantendrían su integridad durante los 16 días de estudio.
Ensayos de Adhesión y Proliferación Celular
Las células madre mesenquimales (MSC), en cada pase de proliferación, presentaron una morfología fibroblastoide característica que se mantuvo durante los tres pases de proliferación (Figura 2). Al momento de ser sembradas las células sobre los hidrogeles, se corroboró que estas mantuviesen dicha morfología y de tener una población suficiente para el estudio, hecho que se confirmó contando en una cámara de Neubauer, utilizando el método de exclusión de azul de tripano. Es importante destacar que las MSCs aisladas utilizando el protocolo empleado en este estudio resultaron positivas para marcadores típicos de este linaje como el CD90 y CD29 [23]
Proliferación y diferenciación temprana de las células sobre los hidrogeles
Durante el procesamiento de las muestras con el homogenizador de tejidos, se observó que tanto los hidrogeles en medio α-MEM, como los que no tenían células, se disgregaban en partículas finas; mientras que los hidrogeles en medio osteogénico fueron más difíciles de disgregar. En la Figura 3, se muestra la proliferación celular obtenida sobre cada una de las diferentes formulaciones. La Figura 3A representa la proliferación celular en medio osteogénico, mientras que la Figura 3B representa la proliferación celular en medio α-MEM, como control negativo de diferenciación.
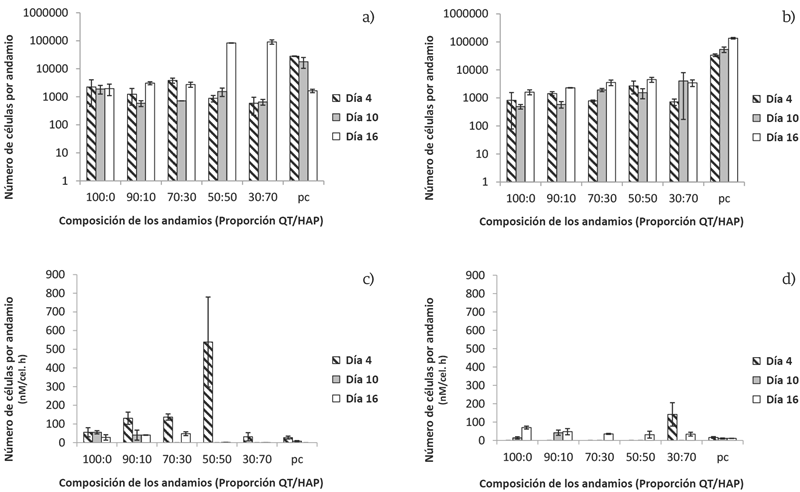
FIGURA 3 Proliferación celular reportado como el número de células en los hidrogeles a diferentes composiciones de QT:HAP a los 4, 10 y 16 días en medio osteogénico (A) y medio α-MEM (B). Se reporta la actividad de fosfatasa alcalina como un marcador de diferenciación temprana, de las células cultivadas sobre los hidrogeles a diferentes composiciones QT/HAP en medio osteogénico (C) y medio α-MEM (D). Con n= 3 de cada una de las réplicas.
La única composición que presentó el mismo comportamiento bajo todas las condiciones de cultivo es la de 90:10, en donde siempre hubo una disminución del número de células del día 4 al día 10 y un posterior aumento de las mismas en el día 16. En general, no se observan diferencias marcadas en los niveles de proliferación para las diferentes condiciones y formulaciones, y es importante destacar que él número de células obtenido en cada una de las formulaciones fue mucho menor a las sembradas en los hidrogeles inicialmente. Solo se encontró una proliferación marcada en los pozos control en medio α-MEM, en donde los valores obtenidos, luego de 16 días, fueron aproximadamente el triple de los iniciales.
La actividad de fosfatasa alcalina se utiliza como un marcador de diferenciación osteogénica temprana [22]. En medio osteogénico (Figura 3C), se observa una actividad significativamente mayor en el día 4 para las formulaciones 90:10, 70:30 y 50:50, con respecto a los otros tiempos de cultivo (10 y 16) (p< 0.05). En el caso del medio α-MEM, se observa una aparición de actividad ALP en los días 10 y 16, con la excepción de la formulación 30:70, que presentó una actividad significativa en el día 4 (Figura 3D).
Evaluación de la Morfología Celular e interacción con biomaterial
Este ensayo se realizó en cada una de las formulaciones y tiempos de cultivo a fin de evaluar posibles la interacciones células-biomaterial. En cada una de las composiciones evaluadas de los diferentes hidrogeles, se observó una forma cuboidal, y al final de los días de experimentación; se notó la formación de agregados celulares. En el día 4 (Figura 4), se observa que no hay diferencias en la morfología de las células, en las diferentes formulaciones. En estas, las células presentaron numerosos filopodios, y es apreciable un aumento en la densidad celular superficial (número de células por superficie) a mayores concentraciones de hidroxiapatita en el sustrato (70:30 y 30:70).
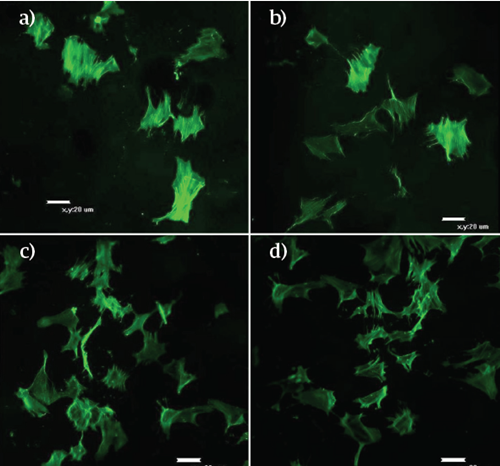
FIGURA 4 Evaluación morfológica, por medio de microsco pía confocal, de la diferenciación osteogénica de las MSC sobre los hidrogeles QT:HAP, día 4. (A). 100:0, (B). 90:10 (C). 70:30 (D). 30:70, no se pudo obtener imagen en la composición 50:50.
Para el día 10 (Figura 5), se apreció una disminución en la densidad superficial, pero fueron notables diferentes planos visuales cuando se desarrolló la microscopía confocal; esto es un indicio de que muchas de las células lograron penetrar la matriz. En este punto, se continuó apreciando una mayor densidad celular a más altas concentraciones de HAP, particularmente para 30:70; adicionalmente una mayor cantidad de filopodios en todas las concentraciones en comparación con las imágenes obtenidas con este sustrato en el día 4. Para el día 16 (Figura 6), la visualización de las células se dificultó para las composiciones 90:10 y 30:70, haciéndose notable una disminución en la densidad celular superficial. En esta oportunidad, para las formulaciones 70:30 y 50:50 la morfología fue más cuboidal y se observan agregados celulares, hecho que se dio con mayor preponderancia en los hidrogeles 30:70.
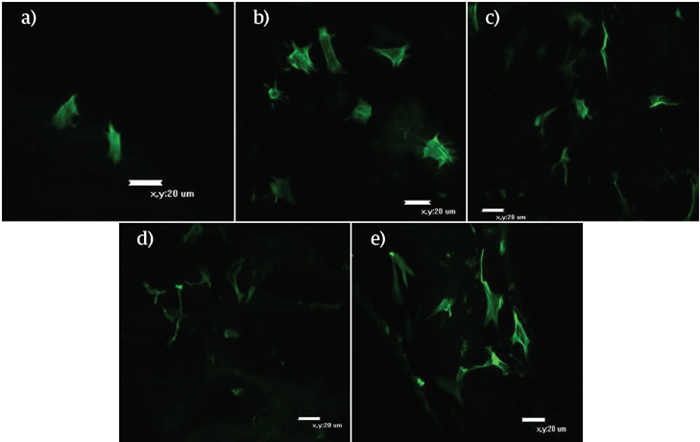
FIGURA 5 Evaluación morfológica, por medio de microscopía confocal, de la diferenciación osteogénica de las MSC sobre los hidrogeles QT:HAP, día 10. (A). 100:0, (B). 90:10, (C). 70:30, (D). 50:50, (E). 30:70.
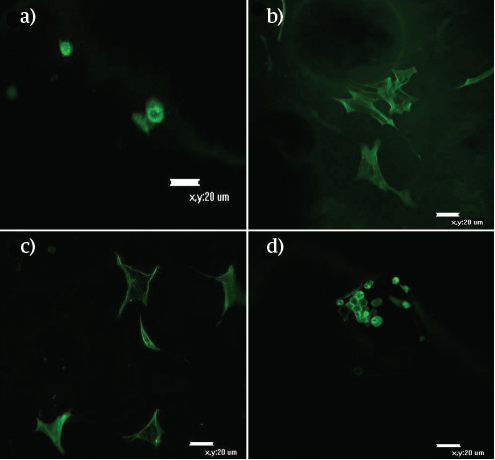
FIGURA 6 Evaluación morfológica, por medio de microsco pia confocal, de la diferenciación osteogénica de las MSC, sobre los hidrogeles QT:HAP, día 16. (A). 90:10, (B). 70:30, (C). 50:50, (D) 30:70. No se observaron células en 100:0.
Para ser utilizados en ingeniería de tejidos, los andamios deben cumplir una serie de condiciones que permitan su adecuado desempeño en aplicaciones terapéuticas, tales como permitir la adhesión, proliferación y diferenciación celular [23, 24]. El hidrogel utilizado en este trabajo tiene QT modificado como componente principal, con la encapsulación de nanopartículas de HAP, en distintas proporciones (90:10, 70:30, 50:50, 30:70), dentro la red polimérica.
Los biomateriales deberán proporcionar microambientes que imiten al nicho fisiológico de las células; en base a la composición y estructura de los mismos, se van a transmitir señales específicas, las cuales van a desencadenar reacciones bioquímicas [24]. El proceso de interacción celular con el material es dinámico y va a depender de varios factores que van a implicar una respuesta celular; este proceso se puede dividir en diferentes eventos. El primer evento es el contacto de la célula con el medio de cultivo, seguido de la adsorción de las proteínas de superficie al material; posteriormente ocurre la fase de contacto de las células, produciéndose de forma rápida. La fase de adhesión celular se lleva a cabo en períodos más largos e involucra moléculas de adhesión y del citoesqueleto (como filamentos de actina), los cuales van a interactuar para producir una respuesta bien sea en proliferación o diferenciación celular [24].
Es importante recordar que para la construcción de los hidrogeles no se utilizó un agente entrecruzante tóxico, como el glutaraldehído, sino que el entrecruzamiento se llevó a cabo por medio de una reacción de fotopolimerización entre las cadenas del quitosano. Esta reacción es posible debido a la modificación química realizada al quitosano en donde se produce un foto-entrecruzamiento en presencia de luz UV; además de esto, se ha modificado para hacerlo soluble a pH fisiológico dado que el quitosano es generalmente soluble en medio ácido; estas modificaciones fueron llevadas a cabo por medio del uso de un agente intermediario (EDC, N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride), el cual es un activador de los ácidos carboxílicos presentes en las moléculas de ácido lactobionico y ácido azidobenzoico, permitiendo la formación de compuestos intermediarios, y debido a características propias de este reactivo, no forma parte de la estructura química del producto final [10, 25,26].
Varios autores han reportado fuertes interacciones entre el QT y la HAP, mostrando que no se presentó separación de fases; y que, al formar la matriz de QT, las partículas de HAP quedaban dispersas en la mezcla de forma uniforme [27. 28, 29, 30, 31]. Sin embargo, en los estudios, la HAP sintética fue combinada con QT no modificado, a diferencia del utilizado en el presente trabajo. Estos hidrogeles de QT: HAP se utilizaron como andamios para el cultivo de MSC, demostrando gran potencial para aplicaciones biomédicas.
De acuerdo a los resultados del presente estudio, la eficiencia de sembrado (número de células adheridas sobre el número de células inoculadas) fue bajo. Esto puede deberse al hecho de que los biopolímeros son generalmente materiales inertes, con pocos grupos funcionales, como las aminas, que pueden interactuar con los receptores de tipo integrina, mediadores de la adhesión celular, afectando así las interacciones iniciales con el material [32]. Esta propiedad ha sido reportada anteriormente por varios autores, quienes han demostrado que la superficie, composición, y relieve pueden conllevar a la adhesión, proliferación y diferenciación celular [33, 34]. La falta de un aumento significativo en el número de células en algunos grupos, también podría implicar, potencialmente, un proceso de diferenciación avanzado en las etapas tempranas del cultivo.
Es posible que el proceso de osteogénesis in vitro se haya activado poco después del sembrado sobre los hidrogeles. Es importante destacar que, in vitro, la proliferación de las MSC disminuye significativamente cuando estas se encuentran en un proceso de diferenciación avanzada [22]. Esta hipótesis de diferenciación temprana se corrobora, en muchos grupos, por una actividad de ALP marcada en el día 4 de cultivo.
Solo en el pozo control se observó el aumento en la proliferación celular sostenido durante el periodo de tiempo evaluado, el cual es un comportamiento típico de las MSC en las cuales no se ha activado la cascada de diferenciación osteogénica. Dado que la HAP es un fosfato de calcio, el cual es considerado como un material cerámico bioactivo, su presencia en los hidrogeles tiende a estimular la diferenciación temprana hacia el linaje osteogénico, como ha sido demostrado en varios estudios en donde la HAP produce la formación de hueso en procesos in vivo [35, 36], hecho que queda demostrado en este estudio, al obtener actividades de ALP mayores en muchas de las formulaciones con HAP (90:10, 70:30 y 50:50), con respecto a los controles de quitosano solo y la placa de cultivo (Figura 3C).
La morfología de los andamios o sustratos, es un factor importante para que ocurra el proceso de interacción células-biomaterial. Ya en el paradigma de la ingeniería de tejido óseo, la cual se basa en el aislamiento y expansión de las MSC que son sembradas en matrices biodegradables [35, 36] los biomateriales van a suministrar no solo el microambiente de las mismas para que permitan su diferenciación, sino que pueden contener factores que lo induzcan. Durante el proceso de osteodiferenciación, las MSC van perdiendo su morfología fibroblastoide para convertirse en osteoblastos de morfología cuboidal, formando agregados o nódulos y aumentando la expresión de fosfatasa alcalina para la posterior mineralización de la matriz extracelular [39]. Inicialmente las células presentaron una morfología diferente a la fibroblastica con tendencia a una morfología cuboidal, indicando un posible proceso de diferenciación temprana. En la etapa inicial del cultivo las células se ven extendidas sobre las superficies de los hidrogeles con un arreglo claro de los filamentos de actina, generalmente en paralelo, hasta formar filopodios, una señal clara de fuertes interacciones célula-biomaterial, que se da a través de los receptores de tipo integrina e interacciones típicas debido a cambios morfológicos del citoesqueleto [40]. Es difícil definir a este punto qué componente de los hidrogeles es mayormente responsable por las interacciones; sin embargo, ha sido ampliamente reportado el papel de la topografía superficial sobre la adhesión, e incluso diferenciación celular. Materiales y superficies nano-estructuradas de HAP son capaces de sostener mayores grados de diferenciación osteogénicas [40, 41].
Es claro que los resultados de proliferación, actividad de fosfatasa alcalina y morfología celular apuntan hacia una hipótesis de diferenciación celular temprana. A futuro, sería interesante estudiar más a fondo este proceso de diferenciación, realizando cultivos por tiempos menores a los considerados en este trabajo. Sin embargo, los resultados de este estudio demuestran, fuerte interacciones entre las células y los hidrogeles compuestos después de los 4 días de cultivo, e indican una diferenciación osteogénica significativa, lo que implica que las formulaciones planteadas podrían ser utilizadas como hidrogeles foto-polimerizables in situ para la regeneración de tejido óseo.
CONCLUSIONES
Los resultados encontrados en el presente trabajo tanto de proliferación y actividad de ALP, como los obtenidos por microscopia confocal se compaginan para indicar un proceso acelerado de diferenciación osteogénica, con fuertes interacciones células-biomaterial. Las composiciones 70:30 y 50:50 parecieron ser las más apropiadas para proliferación y diferenciación. De esto, se puede concluir que el material compuesto de QT foto-entrecruzable y nano-partículas de HAP tiene un gran potencial para ser utilizado como un sistema de hidrogel polimerizable in situ para la regeneración de tejido óseo en zonas de baja demanda mecánica. Se propone así un estudio más detallado de caracterización del material, y de la diferenciación osteogénica utilizando marcadores moleculares











 nueva página del texto (beta)
nueva página del texto (beta)




