INTRODUCCIÓN
La piel es el órgano más extenso en el ser humano, dentro de sus funciones principales se encuentra el proteger al organismo contra agentes químicos, radiación solar o microorganismos patógenos [1]. Al estar en constante interacción con el medio físico puede sufrir heridas, que bajo condiciones normales se resuelven de forma favorable, mediante la formación de una cicatriz, sin embargo, en un grupo de personas el proceso de cicatrización es exacerbado, llegando a generar cicatrices aberrantes poco estéticas, conocidas como cicatrices queloides o hipertróficas, que pueden llegar a causar dolor, prurito y contracturas, afectando física y psicológicamente la calidad de vida [2,3]. Se cree que este tipo de condición es producida por los estímulos pro-inflamatorios generados en la zona de daño sobre los fibroblastos residentes en la dermis, por lo que, los antiinflamatorios esteroideos han sido los fármacos de elección para el tratamiento de este tipo de lesiones [4,5]. Los corticosteroides, glucocorticosteroides, glucocorticoides o esteroides son moléculas sintetizadas a partir del colesterol por las glándulas suprarrenales, estas moléculas modulan la respuesta inmunológica durante los procesos inflamatorios, y participan en una gran variedad de funciones fisiológicas como: el metabolismo de glucosa y lípidos [6,7]. Desde hace décadas, los corticoides, son muy empleados como anti-inflamatorios ya que son altamente eficaces en enfermedades caracterizadas por esta condición, incluidas las cicatrices hipertróficas y queloides; sin embargo, aunque el uso de los corticoides es realizado a nivel mundial, no se sabe con exactitud el mecanismo de acción, la dosis eficaz, o su eficacia clínica [8,6]. Una molécula sintética, el AT (9α-fluoro-16α-hidroxiprednisolona), posee potentes propiedades anti-inflamatorias, y su aplicación clínica se ha enfocado a condiciones inflamatorias aberrantes como es el caso de las cicatrices queloides [9]. Otra molécula, la DHEA posee una gran variedad de efectos biológicos como la regulación de la síntesis de fibras de colágeno, protección celular, propiedades antitumorales, antiinflamatorias y antioxidante [10,7,11,12]. Es por ello que en este trabajo se realizó la aplicación de AT y/o DHEA y su combinación, sobre la línea celular de fibroblastos (3T3-L1), para saber su efecto sobre la proliferación y muerte celular, con el objetivo de emplear dosis menores en cicatrices hipertróficas o queloides a las reportadas por otros autores.
METODOLOGÍA
La línea celular fibroblástica de ratón 3T3-L1 fue cultivada en medio de cultivo DMEM-F12 suplementada con suero fetal de bovino (SFB) al 10%, antibiótico-antimicótico 1X, y fueron mantenidas a 37°C, 5% de CO2 en un ambiente húmedo.
Ensayo de cristal violeta: Las concentraciones utilizadas fueron tomadas de estudios in vitro y clínicos, realizados por diferentes autores. Se sembraron 1x103 cél/pozo en una placa de 96 pozos y fueron cultivadas en presencia/ausencia de diferentes concentraciones de AT (0.1, 1, 10, 100, 1000, 10,000 y 20,000 µM), DHEA (0.1, 1, 10, 100 y 200 µM) o AT-DHEA (AT 1000 + DHEA 50 µM; AT 10,000 + DHEA 10 µM) durante 48 horas. Transcurrido el tiempo, las células fueron fijadas con glutaraldehído al 1.1% por 5 minutos, se lavaron 2 veces con solución amortiguadora de fosfatos (SAF) (SIGMA) y dejaron secar al aire. Se agregó cristal violeta (50 µL/pozo al 0.1%, pH 6), en agitación constante. Posteriormente, se realizaron tres lavados con agua bidestilada, para retirar el colorante no asimilado. Por último, se adicionó ácido acético al 10% (50 µL/pozo), se agitó por 10 minutos a temperatura ambiente para desteñir a las células y se tomaron lecturas de cada pozo en un lector de placas de ELISA (Elx800; Bio-Tek) a una λ de 570 nm. Las densidades ópticas fueron graficadas como % de proliferación celular respecto al control (sin ningún estímulo).
Microscopía de fluorescencia: Se sembraron 2x103 cél/pozo en placas Lab-tek y se estimularon con diferentes concentraciones de DHEA (10 µM y 100 µM), AT (1000 µM y 10,000 µM) y combinadas (AT 1000 µM + DHEA 50 µM y AT 10,000 µM +DHEA 10 µM) durante 6 horas. Transcurrido el tiempo, se lavaron con SAF estéril, fijaron con paraformaldehído al 4% por 20 minutos y se realizó otro lavado con SAF. Las células fueron permeabilizadas con una solución de EDTA 0.5 M, ácido cítrico 0.1M, Na2HPO4 0.2M, glucosa 1% y tritón X-100 1% por 5 minutos, posteriormente fueron teñidas con naranja de acridina cubriendo toda la superficie por 5 minutos, finalmente se realizaron 3 lavados con SAF, se montaron con medio de montaje Dako para observarlas en un microscopio de fluorescencia NIKON Eclipse-E600 por la emisión de dos colores a 530-640 nm bajo el objetivo 20X.
Análisis estadístico: El análisis de los resultados se realizó mediante t-student para muestras relacionadas con el programa Microsoft Excel, se consideró con diferencia significativa los datos con p<0.05.
RESULTADOS Y DISCUSIÓN
La AT y DHEA solas o en combinación inhiben la proliferación celular de los fibroblastos 3T3-L1: El AT inhibe la proliferación celular de manera significativa (p<0.05) en un 50% con respecto al control a concentraciones de ≥100 µM (ver Figura 1). De igual forma, la DHEA, inhibe la proliferación celular de manera significativa (p<0.05) en un 40% a concentraciones ≥ 1,000 µM (ver Figura 2). Debido a esto, se eligió una concentración de ambos compuestos por debajo de 100 y 1000 M para AT y DHEA respectivamente. La combinación de ambos compuestos disminuye la proliferación celular de los fibroblastos 3T3-L1 de manera significativa en un 30% con respecto al control (p<0.05) (ver Figura 3).

Figura 1 Efecto del AT sobre la proliferación de células 3T3-L1. Concentraciones ≥1000 μM de AT inhiben la proliferación celular en un 50% de manera significativa con respecto al control. El porcentaje de proliferación fue determinado a las 48 horas de estímulo como se describe en materiales y métodos. Donde el 100% fue tomado con la proliferación de células sin estímulo. t-student de una vía, p < 0.05.
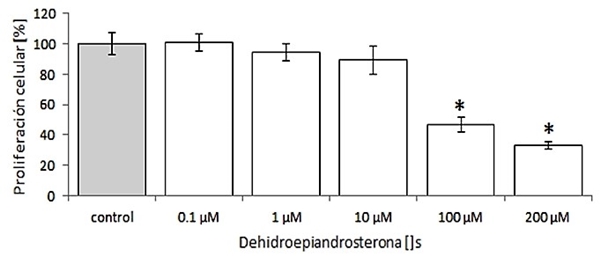
Figura 2 Efecto de la DHEA sobre la proliferación de células 3T3-L1. Concentraciones ≥100 μM de DHEA inhiben la proliferación celular en un 40% de manera significativa con respecto al control. El porcentaje de proliferación fue determinado a las 48 horas de estímulo como se describe en materiales y métodos. Donde el 100% fue tomado con la proliferación de células sin estímulo. t-student de una vía, p < 0.05.
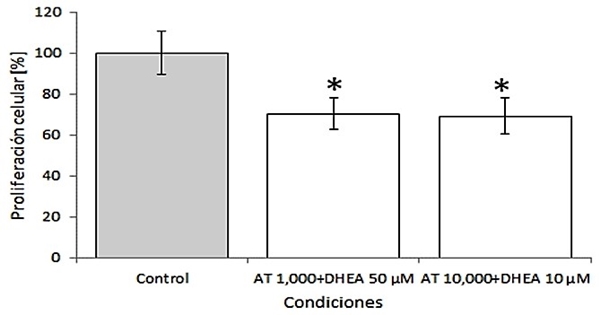
Figura 3 Efecto de la combinación de AT y DHEA sobre la proliferación de células 3T3-L1. La combinación de AT a 1000-10000 mM más 50-10 μM de DHEA inhiben la proliferación celular en un 30% con respecto al control de manera significativa. El porcentaje de proliferación fue determinado a las 48 horas de estímulo como se describe en materiales y métodos. Donde el 100% fue tomado con la proliferación de células sin estímulo. t-student de una vía, p < 0.05.
La DHEA, AT y su combinación inducen muerte celular programada en la línea 3T3-L1. Para determinar si la DHEA, AT o su combinación inducen muerte celular por apoptosis en la línea 3T3-L1 se realizó la tinción con naranja de acridina, considerando que las células en apoptosis temprana presentan condensación de la cromatina observando un color verde más brillante mientras que las células apoptóticas tardías generan un color anaranjado brillante más intenso.
Las células cultivadas en medio DMEM y 10% SFB (control) presentan un núcleo redondo, granular, céntrico y homogéneo (ver figura 4a), mientras que las células tratadas con DHEA 10 y 50 µM presentan alteraciones en membrana nuclear y se evidencia deformación nuclear (hipercromía moderada) y también se evidencian células en apoptosis temprana (ver figura 4b y 4c). Sin embargo, a concentraciones de 100 µM de DHEA todas las células muestran condensación o fragmentación nuclear y del citoplasma evidenciando de esta forma un estado de apoptosis tardía (ver figura 4d). Todos estos cambios morfológicos indican que las células en presencia de DHEA son inducidas a un proceso de muerte celular por apoptosis. Por otro lado, cuando las células 3T3-L1 son cultivadas con AT a 1,000 µM se observan tanto células que presentan condensación de la cromatina (apoptosis) y también células con hipercromía moderada (aumento del tamaño del núcleo con difusión de la cromatina al citoplasma), (ver figura 4e). De igual forma, las células cultivadas con AT a 10,000 µM presentan mostraron disminución del espacio citoplasmático y condensación de la cromatina encontrándose en un estado de apoptosis temprana (ver figura 4f). Finalmente, las células estimuladas con AT 1,000 más DHEA 50 µM se observan con cromatina condensada y con hipercromía evidente lo cual indica que se encuentran en un estado de apoptosis tardía (ver figura 4g), mientras que el tratamiento con AT 10,000 más DHEA 10 µM se observa homogenidad en la disminución del tamaño celular, se preservan los organelos y la membrana celular y condensación de la cromatina por lo que es evidente un estado de apoptosis temprana en todas las células (ver figura 4h). Los resultados muestran que la combinación de AT/DHEA evidencian una muerte celular más homogénea en la línea celular 3T3-L1 a diferencia de las tratadas por separado.
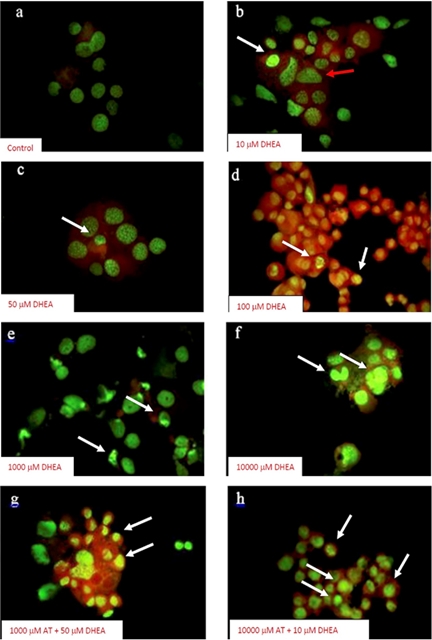
Figura 4 La AT, DHEA y la combinación de ambas inducen muerte celular programada de las células 3T3-L1. a) células control, donde hay integridad de la membrana celular y nuclear; b) y c) células tratadas con 10 y 50 μM de DHEA, algunas células presentan alteraciones en núcleo (flechas), citoplasma y hay condensación del material genético (flechas); d) células tratadas con 100 μM de DHEA, todas las células presentan compactación nuclear e hipercromía del citoplasma (flechas); e) y f) células tratadas con 1000 y 10000 μM AT, hay condensación nuclear (dispersión de la cromatina en el citoplasma) (flechas); g) la combinación de 1000 mM de AT + 50 mM de DHEA, algunas células presentan compactación y fragmentación de los núcleos (característicos de células apoptóticas tardías) e hipercromía del citoplasma; h) la combinación de 10,000 mM de AT + 10 mM de DHEA, todas las células presentan fragmentos nucleares rodeados por membrana celular intacta, (cuerpos apoptóticos). Tinción con naranja de acridina. 40X.
En las lesiones cutáneas, los factores inflamatorios y antiinflamatorios juegan un papel muy importante para la sanación de las mismas, sin embargo, factores endocrinos, genéticos, fisiológicos y/o traumas, pueden alterar este proceso, e incrementan la proliferación de los fibroblastos y la síntesis de moléculas de la matriz extracelular, principalmente el colágeno, dando lugar a una cicatriz queloide o hipertrófica [13,3]. Las cicatrices queloides o hipertróficas son generalmente tratadas con una inyección intralesional de corticoesteroides, principalmente el AT, sin embargo, la principal desventaja es que las cicatrices presentan una tasa de recurrencia muy significativa [14]. La línea celular de fibroblastos 3T3-L1 representa un modelo apropiado para el estudio de los efectos sobre la proliferación y muerte celular inducida por los corticoesteroides, a diferencia de los cultivos primarios, los fibroblastos 3T3-L1 pueden cultivarse y mantenerse in vitro fácilmente, por lo que facilita la obtención de información para comprender a fondo los procesos antes mencionados. En literatura se ha demostrado que los esteroides poseen alta actividad de glucocorticoides in vivo como el AT, así a una concentración de 0.1 µM estimulan la síntesis de DNA y la división celular de las línea celular 3T3-L1 [15]. Por otro lado, una concentración superior a 1,000 µM de AT inhibe de forma significativa la proliferación de las células troncales mesenquimales [16]. Estos antecedentes concuerdan con nuestros resultados, ya que de forma similar, se observó que bajas concentraciones de AT aumenta la proliferación celular y altas concentraciones la inhiben (ver figura 1). Otro estudio demostró que el AT a concentraciones de 0.7-33 nM estimula o inhibe la proliferación de las células 3T3-L1 dependiendo de la interacción con diferentes factores de crecimiento, por ejemplo el FGF que aumenta la proliferación, y el EGF que la inhibe, por lo que el efecto del AT es tejido específico y para tratar ciertas patologías, como las cicatrices queloides, se debe tener en consideración la etiopatogenia de la misma, así como un estudio detallado de la expresión de citocinas y factores de crecimiento involucrados en dicha enfermedad, además, se deben estudiar moléculas alternas para lograr un tratamiento más efectivo [17]. Al igual que el AT, la DHEA, posee propiedades antiinflamatorias y también antioxidantes, por ello se le ha considerado para el tratamiento de desórdenes inflamatorios; el antecedente más reciente reporta que la DHEA (0.1-10 µM) disminuye la proliferación celular de las células 3T3-L1 en forma dosis dependiente [18]. En el presente trabajo, no se observó este fenómeno por lo que se amplió el rango hasta 200 µM. Los resultados demuestran una disminución significativa de la proliferación a una concentración de 100 µM de DHEA (ver figura 2), nuestros resultados concuerdan con otro trabajo donde se reporta una disminución significativa de en la línea 3T3-L1 con DHEA 100 µM [19]. La acción de la DHEA sobre los adipocitos es opuesta a la acción de los glucocorticoides, los cuales potencian la adipogénesis, altera la síntesis de citocinas pro-inflamatorias y adipocinas, como el TNF-α en modelos de ratas obesas. También regula la expresión de colágeno y de las metaloproteinasas de matriz [7,20,21]. Estas propiedades podrían ser aprovechadas para controlar desórdenes inflamatorios e hiperproliferativos, como las cicatrices queloides e hipertróficas.
Debido a las características que comparten el AT y la DHEA y a los diferentes mecanismos moleculares por los cuales inhiben la proliferación celular, se probó la combinación de ambos compuestos para observar los efectos que ocasionan sobre las células 3T3-L1. La combinación de ambos disminuye de forma significativa la proliferación con dos condiciones combinadas (DHEA 10 más AT 10,000 µM y DHEA 50 más AT 1,000 µM) (ver figura 3), estos resultados mostraron que no eran necesarias concentraciones elevadas de ambos compuestos para inhibir la proliferación celular. También se optó por estudiar los cambios morfológicos inducidos por AT y DHEA solas y en combinación (ver figura 4) mediante la tinción con naranja de acridina. La variabilidad de la fluorescencia nuclear indica las anormalidades y alteraciones morfológicas que sufren las células sanas [22]. Un hallazgo importante es que al combinar ambas moléculas (ver figura 4g-h) se incrementa el número de células en muerte celular al presentar cambios morfológicos característicos de muerte celular programada o apoptosis, como compactación del núcleo, hipercromía del citoplasma y presencia de cuerpos apoptóticos. La hipercromía puede deberse a una gran cantidad de síntesis de RNA o incluso un proceso de reciclaje del contenido citoplasmático llamado autofagia, que se caracteriza por un mecanismo de sobrevivencia celular que también puede formar un papel en la muerte celular programada [23].
CONCLUSIÓN
Nuestros resultados indican que posiblemente el tratamiento combinado de la DHEA (10 M) y AT (10,000 M) inducen muerte celular por apoptosis, aunque estos hallazgos son relevantes, aún falta por determinar si el efecto sobre la proliferación es similar en cultivos de fibroblastos derivados de cicatrices queloides, y si estos resultados concuerdan con modelos in vivo, podrían darnos un indicio sobre el uso y eficiencia de la DHEA-AT en procesos similares.











 nova página do texto(beta)
nova página do texto(beta)


