INTRODUCCIÓN
Como consecuencia de los procesos de enfermedad o de daño traumático, los sistemas de órganos y tejidos pierden la capacidad de llevar a cabo su función biológica y estructural, por lo cual han surgido diferentes estrategias para tratar de recuperar la salud de los tejidos. La ingeniería de tejidos es una nueva metodología y tecnología biomédica que busca las estrategias necesarias para restaurar, mantener o regenerar la función de tejidos enfermos o dañados del cuerpo humano [1].
Hay cuatro principios fundamentales en la ingeniería de tejidos: 1) diseño de un andamiaje que favorezca la adhesión, proliferación y diferenciación celular, 2) el aislamiento y el cultivo de células trocales mesenquimales, 3) un sistema de liberación de fármacos y/o de factores de crecimiento y, 4) el mantenimiento del espacio para inducir o guiar la regeneración del tejido [1].
De los anteriores principios el diseño de andamios fibrilares ha recibido mucha atención en los últimos años debido a que es clave en la regeneración de tejidos, ya que con el diseño de estos andamios se pretende imitar la parte fibrilar de la matriz extracelular nativa (MEC) de los tejidos del cuerpo; la cual cumple con diferentes funciones tanto un carácter estructural para soportar a las células y proveer de un andamiaje específico para la proliferación y migración celular [2,3], bioquímica: para secuestrar factores de crecimiento y otras señales químicas que regula el destino celular, biológica: se presentan secuencias de péptidos bioactivos que puedan unirse directamente a receptores que activen o interfieran en la señalización intracelular de rutas de respuesta celular [4].
Son varias las técnicas que existen para el diseño de andamios fibrilares, siendo la técnica de electrohilado una de las más utilizadas en la ingeniería de tejidos, el cual es considerado como un método sencillo y versátil para producir fibras en rangos micro- y nano- métricos, ofreciendo ventajas como una alta área superficial y la capacidad de incorporar componentes inorgánicos u orgánicos [5]. Sin embargo el electrohilado está limitado por su lenta tasa de producción y requiere una adecuada conductividad para formar la eyección de la solución polimérica que dará lugar a la fibra, la necesidad de un alto voltaje, añadiéndose el alto costo y la complejidad del proceso debido a que los parámetros aún no están bien establecidos [6,7,8]. Otra alternativa para el diseño de andamios fibrilares es el hilado por propulsión de gas (air jet spinning “AJS”, por sus siglas en inglés) que al igual que el electrohilado permite la síntesis de membranas fibrilares a escalas micro- y nano- métricas [9], teniendo como ventaja su bajo costo (100 veces más barato que el electrohilado), la rápida tasa de producción (10 veces más rápido que el electrohilado) y que no requiere de una fuente de alto voltaje [9,10].
Esta técnica de AJS se basa en el uso de un gas a presión (aire, nitrógeno u argón) que se dispensa a una velocidad extrema entre los 10 a 35 psi con el fin de estirar la solución polimérica en forma de fibras finas en la salida de la boquilla del aerógrafo. Las fibras se forman debido a que en el mismo instante que se eyecta la solución polimérica de la punta, el disolvente comienza a evaporarse debido a que el gas propulsor compite por el oxígeno y continúa haciéndolo después de que las fibras se han depositado sobre el colector [1,9]. Debido a la rápida y barata tasa de producción de fibras, se han probado una gran variedad de polímeros sintéticos y biopolímeros, entre los que encontramos el ácido poliláctico (PLA por sus siglas en inglés), un poliéster alifático del ácido láctico. El PLA es una molécula quiral simple en la cual existen dos estero isómeros L-y D- ácido láctico, en la cual la forma L difiere de la forma D en su efecto sobre la luz polarizada, es decir para el L-ácido láctico el plano quiral rota levógiramente, mientras que en la forma D rota dextrógiramente [11,12,13].
En la actualidad el PLA es de manufactura económica ya que se obtiene de recursos renovables como el almidón y azúcar, es aprobado por la FDA debido a que es biodegradable por la hidrólisis del enlace de éster de PLA que da como resultado agua y CO2, además de que es un polímero que puede ser disuelto en varias soluciones no tóxicas y fáciles de procesar; características que lo convierte en un excelente candidato para su uso en el estudio y aplicación de biomateriales en la ingeniería de tejidos. Por ello; el objetivo de este estudio fue sintetizar y caracterizar un andamio fibrilar de PLA por la técnica de AJS y evaluar los procesos de biocompatibilidad celular con la finalidad de proponerlo como una membrana que pueda imitar la matriz extracelular (MEC) con aplicaciones en el campo de la regeneración tisular.
METODOLOGÍA
Síntesis y caracterización de los andamios de PLA
Las fibras poliméricas se sintetizaron a partir de una disolución de ácido poli-láctico (PLA) (C3H6O3 Natural Works, con un peso molecular de 192.000) en cloroformo (CHCl3, J. T. Baker) y alcohol etílico anhidro absoluto (CH3CH2OH, J. T. Baker) a una razón de 3:1. EL aparato de hilado por propulsión de gas (AJS) se encuentra dentro de una cámara Plexiglás para aislar el sistema de campos externos y evitar cambios en las condiciones durante el proceso de hilado. La producción del andamio se realizó por medio de la técnica de AJS a partir de soluciones poliméricas de PLA a diferentes concentraciones (6, 7, y 10 %) utilizándose un aerógrafo (ADIR modelo 684) con un diámetro de boquilla de 0.3 mm con una alimentación gravitatoria de la solución para síntesis del andamio. El aerógrafo se conectó a un compresor de aire (WorkForceTM) y para el depósito de las fibras se mantuvo constante una presión de 30 psi con 15 cm de distancia de la boquilla al colector recubierto con papel encerado (Reynolds). Durante el proceso se determinaron parámetros optimizados de 8 ml de volumen de la solución polimérica con respecto a 30 min de tiempo para la alta calidad del depósito de las fibras. La caracterización de los andamios hilados de PLA (6, 7, y 10 %) fue por espectrometría Infrarroja con Transformada de Fourier (FTIR) mediante el equipo Nicolet Instruments modelo Nexus 407 en el rango de 500 a 2000 cm -1 a 32 escaneos con una sensibilidad de 2 cm -1 de longitud de onda y por Microscopía Electrónica de Barrido (SEM, JSM-6701F JEOL) para obtener imágenes de la morfología de los andamios hilados donde posteriormente, el diámetro de las fibras se midió con la ayuda de software de imagen Image J.
Cultivo Celular
Las células troncales mesenquimales derivadas de médula ósea (BM-MSC) fueron donadas por el Dr. Juan José Montesinos del Hospital de Oncología, Centro Médico Nacional, Siglo XXI, IMSS. Dicha línea celular se utilizó para caracterizar la biocompatibilidad sobre los andamios hiladas de PLA. Las células BM-MSC, se mantuvieron en medio de cultivo alfa-MEM suplementado con 10 % de suero fetal bovino (SFB), una solución de antibióticos (penicilina (100 UI/ml), estreptomicina (100 μg/ml) y fungisona (0.3 μg/ml), 2 mM de glutamina y 50 mM de aminoácidos no esenciales. Los cultivos se mantuvieron a una temperatura de 37 °C y en una atmósfera de 95 % de aire y 5 % de CO2 en un ambiente con 100 % de humedad.
Ensayo de Adhesión Celular
Para establecer el efecto de los andamios hilados de PLA sobre la adhesión celular, las células BM-MSC fueron cultivadas en contacto directo sobre los andamios hilados y películas delgadas de PLA (6, 7, y 10 %) a una densidad celular de 5x103 células/ml y se cultivaron durante 2, 4 y 24 h. Después del tiempo de incubación, los cultivos fueron lavados cuidadosamente con una solución de fosfatos (PBS) para retirar las células no adheridas e incubados con una solución al 4 % de paraformaldehído (PFA) durante 30 min. Pasado el tiempo, se lavaron con PBS y se incubaron con una solución de cristal violeta al 0.1 % por 15 min. Posteriormente, la solución de cristal violeta fue retirado y se realizaron lavados con agua bidestilada por 15 min y el colorante fue extraído con 400 μl de una solución de dodecilsulfato de sodio (SDS) al 1 %. De la solución obtenida se tomaron 200 μl que se colocaron en un pozo de una placa de 96 pozos para ensayos de ELISA y fue sometido a lectura en un espectrofotómetro (ChroMate, AWARNESS) a 545 nm. Los cultivos controles fueron las células sembradas sobre los platos de cultivo considerándose como 100 % de adhesión celular en los tiempos de incubación para obtener el porcentaje de adhesión a los andamios hilados o películas delgadas de PLA.
Ensayo de Viabilidad/Proliferación Celular
Para establecer el efecto de los andamios de PLA sobre la proliferación celular, las células BM-MSC se cultivaron sobre los andamios hilados y películas delgadas de PLA a una densidad celular de 5x103 células/ml durante 3, 5, 7, 14, y 21 días de cultivo por medio del ensayo de azul de triazol (MTT) basado en la habilidad de la enzima deshidrogenada mitocondrial para oxidar una sal de tetrazolio (3-[4,5-dimetiltiazol-2-y]-2-5 bromuro difeniltetrazolio) a un producto insoluble de color azul. Después de cada periodo experimental, las cultivos fueron incubadas con MTT (50 mg/ml) a 37 °C por 4 h. Pasado este tiempo, el sobrenadante fue removido y se adicionaron 400 μl de dimetil sulfóxido (DMSO) para extraer el precipitado incubándose durante 30 min a 37 °C en oscuridad. Pasado el tiempo, se retiraron 200 μl de la solución que se colocaron en un pozo de una placa de 96 pozos para ensayos de ELISA y fue sometido a lectura en un espectrofotómetro (ChroMate, AWARNESS) a 570 nm. Debido a que la generación del producto azul es (directamente) proporcional a la actividad oxidativa de la enzima deshidrogenasa, una disminución en los valores que se obtengan en la absorbancia se puede correlacionar a la actividad metabólica y determinar la citotoxidad del material.
Interacción Célula-Material
Las células BM-MSC se sembraron a una concentración de 5x103 células/ml durante 24 h sobre los andamios hilados de PLA. Posteriormente, para visualizar la interacción de las células con el material; las células se tiñeron con una solución stock de calceína-AM con una concentración final de 5 µM (CellTracker) y DAPI a una concentración de 0.5 µg/ml en medio libre de suero por 30 min. Pasado el tiempo se lavaron con PBS y la morfología que adquieren las células al interactuar con las membranas fibrilares de PLA se observó por medio de microscopía de fluorescencia.
RESULTADOS
Caracterización de los andamios hilados de PLA
En la Figura 1; se puede observar la morfología de los andamios hilados de las diferentes concentraciones poliméricas de PLA por medio de SEM. Las micrografías indican que la técnica de AJS logra producir fibras con morfología homogénea en las diferentes concentraciones de PLA (6, 7, y 10 %) con una organización aleatoria y con un notable diferencia en el diámetro de las fibras cuando la concentración de PLA se incrementa. El andamio hilado de PLA con 6 % presenta un diámetro promedio de 261 nm, seguido del andamio con 7 % con un diámetro promedio de 407 nm y finalmente el andamio de PLA al 10 % con un diámetro promedio de 599 nm (Figura 1). Esto significa que la técnica depende de la viscosidad de la solución y que puede determinar un diámetro específico con una morfología superficial por la técnica de AJS.
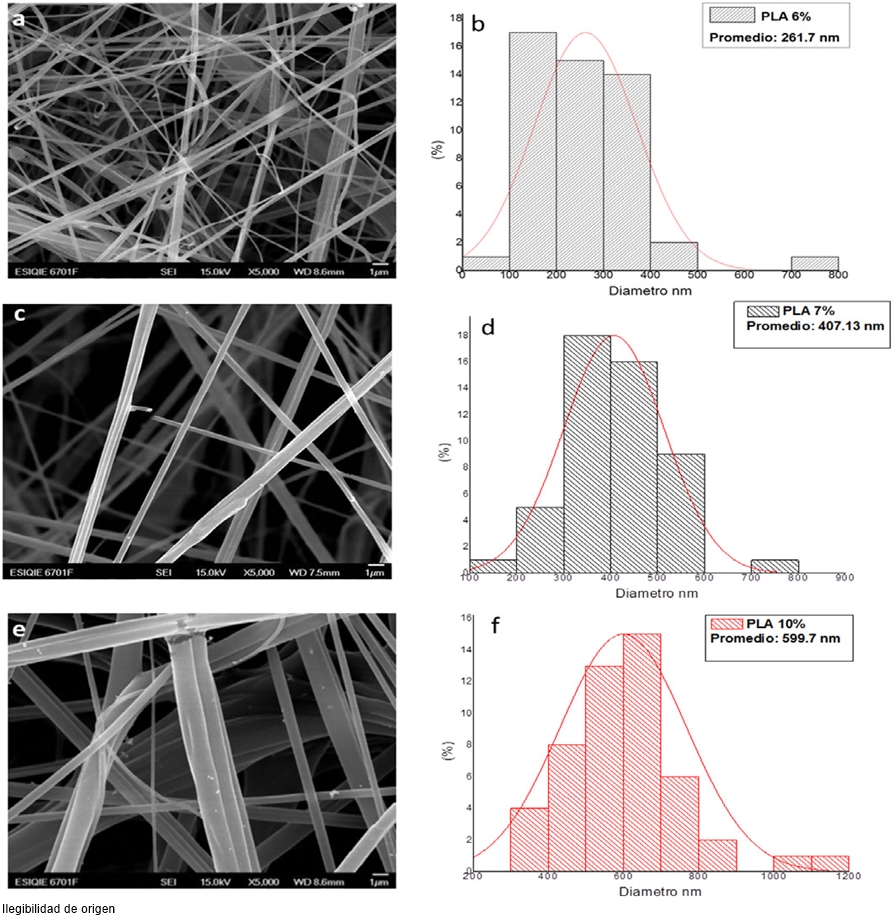
Figura 1. Micrografías de SEM de los andamios hilados de PLA por la técnica de AJS. En (a y b) se muestra las fibras hiladas al 6% con el histograma del diámetro promedio de fibras; en (c y d) el andamio hilado de 7% y en (e y f) el andamio hilado de 10% de la solución polimérica de PLA.
En la Figura 2 se puede apreciar los espectros de infrarrojo que nos indica las bandas características del espectro PLA (Tabla 1), donde se puede apreciar que hay mínimas diferencias entre los espectros de los andamios hilados la cual se debe a las diferentes concentraciones de PLA utilizadas.

Figura 2. Espectro infrarrojo de los andamios hilados a diferentes concentraciones de PLA (M6 %, N7 % y L10 %).
Caracterización de la Biocompatibilidad Celular
La caracterización de la biocompatibilidad se realizó con el objeto de investigar si el diámetro de los andamios hilados afecta la respuesta celular de las células BM-MSC, utilizando el sistema de cultivo celular in vitro. En la Figura 3; se muestra la evaluación de la adhesión de las células BM-MSC después de un periodo de incubación de 2, 4, y 24 h. Los resultados se presentan como porcentajes de células adheridas a la superficie de los andamios hilados de PLA en relación al cultivo control que son las células BM-MSC adheridas a la superficie del plato de cultivo celular. Como se puede observar la adhesión de las células mesenquimales se ve favorecida en los andamios hilados de PLA en las diferentes concentraciones (6, 7, y 10 %) cuando se comparan con las películas delgadas de PLA (6, 7, y 10 %) a los diferentes tiempos de incubación encontrándose diferencias estadísticamente significativas a p < 0.05. Al tiempo de 2 h los andamios hilados de 6 y 10 % de PLA muestran un aumento de ~ 80 % en la adhesión celular con respecto al control y de ~ 30 % más en comparación con las películas delgadas a las mismas concentraciones (6 y 10 %) de PLA. En cuanto al andamio hilado de 7 % de PLA se observa una menor respuesta de adhesión celular con valores de ~ 40 % con respecto al control, sin embargo en comparación con la película delgada a la misma concentración de 7 % de PLA se observa que existe una mejor respuesta en la adhesión celular (~ más del 20 %). A las 4 h podemos observar que en el andamio hilado al 6 % de PLA existe un aumento de más del 100 % en la adhesión celular con respecto al control y de ~ 66 % más en comparación con las películas delgadas a la misma concentración (6 %) de PLA. Sin embargo, los andamios hilados de 7 y 10 % de PLA muestran un aumento de ~ 60 y 70 % en la adhesión celular con respecto al control y de ~ 20 y 40 % más en comparación con las películas delgadas a las mismas concentraciones (7 y 10 %) de PLA. A las 24 h se observa un comportamiento similar donde el andamio hilado al 6 % de PLA excede en ~ 30 % más en la respuesta de adhesión celular con respecto al control y de ~ 70 % más en comparación con las películas delgadas a la misma concentración de 6 % de PLA. Sin embargo, los andamios hilados de 7 y 10 % muestran un aumento de ~ 70 y 90 % en la adhesión celular con respecto al control y de ~ 20 % más en comparación con las películas delgadas a las mismas concentraciones (7 y 10 %). Estos resultados nos indican que la respuesta de adhesión celular se incrementa en los andamios con fibras en rangos nanométricos la cual, también es un parámetro de que la superficie no es toxica para las células BM-MSC.
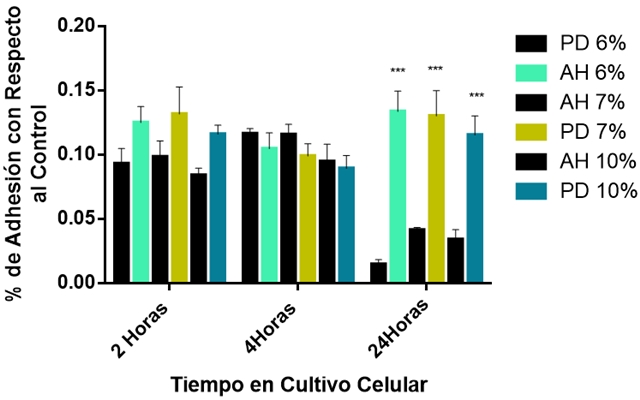
Figura 3. Adhesión celular de las células BM-MSC en los andamios hilados (AH) y en las películas delgadas (PD) de PLA a diferentes concentraciones (6, 7 y 10%) después de un periodo de incubación de 2, 4 y 24 h de cultivo. Los asteriscos denotan la diferencia estadísticamente significativa a p < 0.05 entre los andamios hilados y las películas delgadas de PLA a diferentes concentraciones (6, 7 y 10%).
Para corroborar lo anterior, nosotros llevamos a cabo un ensayo de viabilidad celular para confirmarlo. Los resultados son presentados como absorbancia a 570 nm (Figura 4). Como se puede observar los resultados del ensayo de viabilidad por la conversión de la sal de MTT por parte de las células mesenquimales se ve favorecida en los andamios hilados de PLA en las diferentes concentraciones (6, 7, y 10 %) cuando se comparan con las películas delgadas de PLA (6, 7, y 10 %) a los diferentes tiempos de cultivo celular encontrándose diferencias estadísticamente significativas a p < 0.05. Sin embargo los andamios hilados de PLA al 6 % muestran un incremento en dicha reacción en comparación con las películas delgadas de PLA al 6 % desde el tiempo 3 hasta el día 21 de cultivo. Asimismo; en los andamios hilados de PLA al 7 y 10 % se observa mayor proliferación a partir del día 7 al 21 en comparación con las películas delgadas a las mismas concentraciones de PLA (7 y 10 %). Este incremento que se observa en los andamios hilados de PLA (6, 7 y 10 %) es directamente proporcional al incremento de las células metabólicamente activas sobre las superficies; lo cual nos indica que las células están proliferando, creciendo y no existe ningún efecto citotóxico del material a las células BM-MSC.
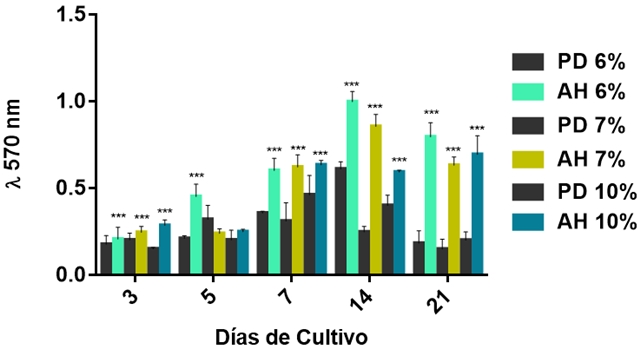
Figura 4. Grafica de viabilidad celular determinada por MTT de las células BM-MSC en los andamios hilados (AD) y en las películas delgadas (PD) de PLA a diferentes concentraciones (6, 7 y 10 %) después de un periodo de incubación de 3, 5, 7, 14 y 21 días de cultivo. Los asteriscos denotan la diferencia estadísticamente significativa a p < 0.05 entre los andamios hilados y las películas delgadas de PLA a diferentes concentraciones (6, 7 y 10 %).
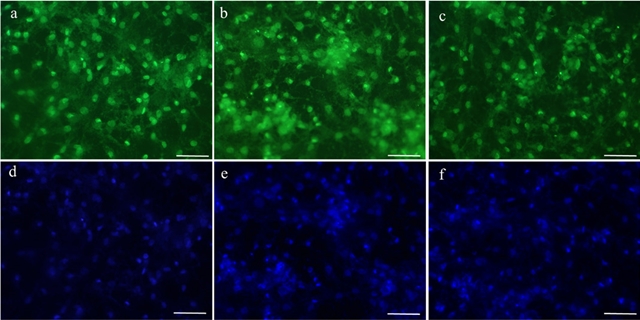
En la Figura 5 se puede apreciar la distribución de las células BM-MSC sobre los andamios hilados de PLA a las diferentes concentraciones (6, 7, y 10 %). En las imágenes de microscopía de fluorescencia se observa la expansión celular con las prolongaciones citoplásmicas formando un mayor número de contactos del citoesqueleto celular con la superficie fibrilar de los andamios. Asimismo; las células se encuentran homogéneamente distribuidas, mostrando una interacción con la topografía fibrilar adquiriendo una morfología aplanada que confirman la mayor tendencia de las células para adherirse y extenderse sobre el andamio.
DISCUSIÓN
En este trabajo se llevó a cabo la síntesis de andamios hilados por medio de la técnica de hilado por propulsión de gas (AJS) y se evaluaron diversos procesos celulares involucrados en el proceso de biocompatibilidad como: adhesión, proliferación e interacción célula-superficie fibrilar del andamio.
Recientemente, los andamios fibrilares han recibido mucha atención debido a que sus rangos superficiales logrados con las técnicas de síntesis como electrohilado y fuerza centrífuga pueden imitar las fibras nativas que se encuentran en la matrices extracelulares de muchos tejidos y en los últimos años se han investigado nuevas formas de lograrlos [9]. En nuestro estudio propusimos la síntesis de andamios fibrilares a partir de distintos porcentajes de soluciones poliméricas de PLA por medio de la técnica de AJS, la cual nos permitió lograr andamios fibrilares que se encuentren en los rangos nanométricos muy similares a los logrados por la técnica de electrohilado, las cuales por sus diámetros fibrilares en rangos de 200 a 600 nm pueden mimetizar el diámetro promedio de las fibras de la matriz extracelular (MEC) como la colágena tipo I, II que se está en el intervalo de 90 a 600 nm de diámetro [14,15] que permitirían su utilización en áreas como la ingeniería de tejidos y en la liberación controlada de fármacos en la cual permiten la entrega oportuna de medicamentos [16,17].
Los resultados obtenidos de los ensayos de biocompatibilidad celular que involucra los procesos de adhesión, proliferación e interacción célula-andamio, muestran que la superficie nanofibrilar favorece la respuesta celular cuando se comparan con las películas delgadas de PLA que sirvieron como control. Este incremento en la respuesta de biocompatibilidad celular, indica que las propiedades de un aumento en el área superficial en relación al volumen lograda por la morfología fibrilar de carácter aleatorio, una alta interconexión porosa son características que influyen directamente en la respuesta celular y esto concuerda con resultados de investigaciones recientes que reportan que el tamaño de fibra, su orientación y la interconexión de poros juega un papel esencial en mediar la respuesta de adhesión y proliferación celular [18,19,20]. Asimismo, los andamios nanofibrilares al imitar a las matrices extracelulares estas podrían dar señales a las células, las cuales son capaces de sensar al interaccionar con fibras en rangos nanométricos y esto puede observarse en la imagen de la Figura 5, donde las células se pueden apreciar en contacto directo siguiendo la morfología del andamio fibrilar y por consiguiente con un incremento en las prolongaciones citoplasmáticas por área [19,20].
CONCLUSIONES
De los resultados obtenidos en este estudio, podemos concluir que la técnica de AJS nos permite sintetizar andamios con topografías nanofibrilares y que los andamios producidos no son citotoxicos.
Estas topografías en rangos nanométricos y con morfología fibrilar permiten que las células troncales mesenquimales de médula ósea generen un ambiente adecuado que aumenta la respuesta de biocompatibilidad celular, lo cual es de gran importancia para el diseño de biomateriales con futuras aplicaciones en la medicina regenerativa.











 nova página do texto(beta)
nova página do texto(beta)