INTRODUCCIÓN
Las enfermedades cardiovasculares (ECV) constituyen un grave problema de salud, ya que son una de las principales causas de muerte a nivel mundial [1]. Uno de los factores implicados en el desarrollo de estas, es la progresión de la edad y con ello el descenso en los niveles de hormonas sexuales [2,3].
El tratamiento actual para ciertas ECV lo constituyen los inhibidores de la enzima convertidora de angiotensina y la terapia antiagregante plaquetaria [4], sin embargo, en dichos tratamientos, los pacientes no tienen una recuperación satisfactoria [5]. Por otro lado, las terapias con células troncales mesenquimales (CTM) como estrategia de tratamiento en ECV, han sido utilizadas con éxito en modelos experimentales [6,7]. Dichas terapias se basan en la administración de células para reparar tejidos u órganos afectados [8] sin embargo el efecto que estas ejercen en el corazón es aún discutido [9]. Se ha comprobado que las CTM pueden migrar hacia órganos blanco dañados, participar en procesos de homeostasis y reparación tisular, así como diferenciarse a células cardiacas para contrarrestar la pérdida de las mismas [10,11,12,13]. Por ello, una alternativa que actualmente ha sido poco explorada para la terapia es lograr que las células totipotenciales (capaces de diferenciarse hacia varios tejidos) ya existentes en el organismo se movilicen hacia el órgano blanco a través de vías de señalización paracrina para ejercer sus funciones regenerativas o de reparación [14]. Por otro lado, la disminución de hormonas sexuales y de sus precursores que declinan a consecuencia de la edad, es un factor de riesgo para el desarrollo de las ECV. Sin embargo, existen evidencias de que factores de reemplazo hormonal, mejoran la condición cardiaca. [15,16] Uno de los más importantes factores con efectos benéficos en diferentes padecimientos cardiacos es la dehidroepiandrosterona (DHEA) [17]. Se ha demostrado que el consumo de 50 mg/día de DHEA reduce la rigidez arterial en los adultos y disminuye o previene el desarrollo de padecimientos cardiacos [18,19,20]. Sin embargo, es posible que los efectos cardioprotectores de la DHEA se deban además de lo que ha descrito en la literatura, a los efectos paracrinos que ésta induzca sobre los cardiomiocitos dañados y que favorezcan la migración de las CTM. Para determinar lo anterior, se utilizó un modelo de señalización paracrina, que consistió en el cultivo de la línea H9C2 preincubada con DHEA y expuesta a peróxido de hidrógeno (H2O2) para inducir daño cardiaco y el medio condicionado (conteniendo las moléculas de señalización) se utilizó en un ensayo de cierre de herida consistente en una monocapa de células madre mesenquimales, con lo anterior, fue investigada la motilidad inducida por DHEA.
METODOLOGÍA
Para la obtención de las CTM, primero se recuperó en PBS la médula ósea de los fémures de ratas Wistar macho de 250g. Se obtuvo un pool de células por centrifugación y se distribuyeron en placas de Petri con medio DMEM/F12 suplementado con 10% de suero fetal de bovino (SFB) y se mantuvieron en condiciones de 37°C y 5% de CO2 en una incubadora para cultivos celulares. Posteriormente, las células se monitorearon a lo largo de 1 semana con cambio de medio cada tres días. Las células adheridas a la placa de cultivo se mantuvieron hasta una confluencia mayor de un 80% (ocupación del espacio en la placa), para disgregar con tripsina/verseno al 0.025% y centrifugar; finalmente el pellet obtenido fue sembrado en medio nuevo (conocido como pase) mientras que las que quedaron suspendidas en el sobrenadante se descartaron.
En los cultivos obtenidos, al pase número 3, se observó una población homogénea enriquecida con Células Troncales Mesenquimales, como se muestra en la Figura 1.
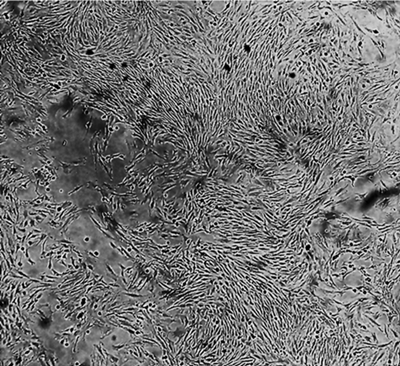
FIGURA 1 Cultivo y morfología de las Células Troncales Mesenquimales de médula ósea in vitro. Las CTM en pase 3 muestran una morfología larga, plana, espiculada y fibroblastoide. Microscopia de Luz 10X.
Como modelo de daño cardiaco, se utilizaron células H9C2 de cardiomioblastos de rata, (ATCC® CRL-1446™) sembradas en placas de 6 pozos, y se indujo daño con H2O2 (1:1000) durante 30 minutos. En otra condición, las células fueron preincubadas con DHEA a concentraciones de 0.1, 1, 10, 100 µM (micromolar) por 24 horas y luego fueron expuestas a H2O2 durante 30 minutos. Todas las células se lavaron con PBS y se les añadió medio fresco para dejar incubar nuevamente por 24 horas. Transcurrido el tiempo, se colectó el medio condicionado (MC) de las células con todos los tratamientos para su posterior incubación con las CTM previamente obtenidas. Para determinar la motilidad de las CTM inducida por los medios condicionados, se utilizó un modelo in vitro de cierre de herida. Para ello, las CTM en pase 4 se cultivaron en una placa de 48 pozos con medio DMEM F-12 al 10% de SFB y con medio condicionado de la línea H9C2 en una proporción 1:1 para cada condición por triplicado. La herida se realizó en cada pozo mediante un rasgado con una punta de pipeta de 10 µL, y se dejó incubar durante 48 horas con el medio de las condiciones mencionadas. Para evaluar la morfología y la motilidad, las células se fotografiaron (0h y 48h), y por otro lado se realizó el análisis del área de herida con el programa ImageJ. Posteriormente, las células se tiñeron con cristal violeta al 10%, y para observar si el cierre de herida se relacionaba a la proliferación de CTM, se colectó el cristal violeta y se transfirió a una placa para su cuantificación en un espectrofotómetro de ELISA a una absorbancia de 540 nm. Los valores de densidad óptica fueron obtenidos, y una mayor densidad de colorante indicó una mayor cantidad de células presentes en cada pozo. Como controles de población celular se utilizaron células fijadas al tiempo cero (inicio de incubación) y las células fijadas a las 48 h sin estímulo. Para el análisis estadístico de los datos de cierre de herida y proliferación, se utilizó ANOVA y una p <0.01 en el programa Excel.
RESULTADOS Y DISCUSIÓN
Las células cultivadas y utilizadas en este estudio presentaron adherencia a la placa de cultivo, permaneciendo en monocapa con una morfología fibroblastoide, característica de las CTM definida por la ISCT (International Society for Cellular Therapy), como se muestra en la Figura 1.
Las CTM se cultivaron en presencia de diferentes medios condicionados obtenidos previamente como se describió en los métodos; a estas monocapas se les realizó un rasgado y 48 horas después se observó la invasión del espacio por las células.
El espacio llenado por las células se analizó y éste se representa en la Figura 2, el eje de las X indica las condiciones en que se encontraban las CTM, en el eje de las Y, 100% indica la abertura completa de la monocapa de CTM por el rasgado, de manera que al disminuir el porcentaje, esto indica un mayor cierre del espacio del rasgado. Se observa que el MC de las células H9C2 sin tratamiento, así como las que se trataron sólo con H2O2 cubrieron un 20% de la apertura total con respecto al control. Cuando las células se preincubaron con DHEA a 0.1 µM y se indujo el daño con H2O2, el comportamiento de las células fue similar a los de MC y MC más H2O2. Sin embargo, el medio condicionado de las H9C2 preincubadas con 1, 10 y 100 µM de DHEA y sometidas a daño con H2O2, presentaron un cierre de apertura de la herida alrededor de un 50% de acuerdo al análisis de imagen. Para evaluar si el llenado del espacio de la herida del rasgado se debió a que la motilidad de las células se modificó por los medios condicionados de las H9C2 preincubados con DHEA, y no por la proliferación de las CTM, los mismos pozos utilizados para el análisis de la herida fueron cuantificados en su población celular por la tinción con cristal violeta (Figura 3).
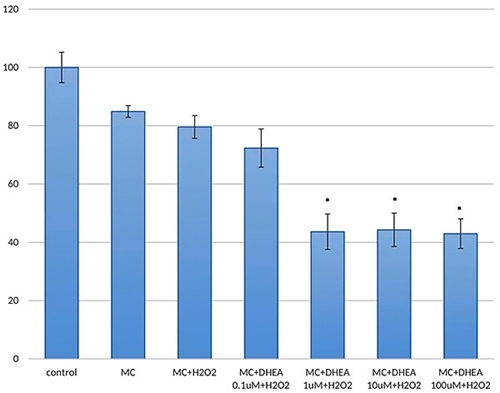
FIGURA 2 Análisis de apertura de Herida. Las CTM con una apertura de la herida del 100% (control), en presencia de MC obtenido de la línea H9C2 (MC), MC de la línea H9C2 tratadas con H2O2 (como agente de daño) o MC de la línea H9C2 pre-tratadas con H2O2 y DHEA a 0.1, 1, 10 y 100 μM. MC: Medio Condicionado de células H9C2, H2O2: peróxido de hidrógeno.

FIGURA 3 Evaluación de la proliferación celular de las CTM con cristal violeta. Las CTM con apertura evaluada a las 0 horas (control 0h), 48 hrs (control 48h), CTM en presen cia de MC de H9C2 (control MC) o MC de la línea H9C2 pre-tratadas con H2O2 y MC de la línea H9C2 pre-tratadas con H2O2 mas DHEA a 0.1, 1, 10 y 100 μM. MC: Medio Condicionado de células H9C2, H2O2: peróxido de hidrógeno.
El eje X representa las condiciones de incubación de las CTM y el eje de las Y los valores de absorbancia. Se puede observar que la proliferación del control a las 48 horas, el de MC de H9C2 y el de las células con daño, presentaron densidades ópticas más altas que las de 0 horas. Los MC de células sin daño con DHEA o daño con DHEA a 0.1 y 1 µM se comportaron de igual forma que la de 48h (proliferación). Sin embargo, la proliferación de CTM con el MC de las células H9C2 pretratadas con DHEA a 10 y 100 µM y sometidas a daño presentó una densidad óptica significativamente menor que las de 48 horas, comportándose similar a las de 0 horas.
Como se describió anteriormente, las CTM fueron obtenidas como se ha indicado en trabajos previos [21,22] y éstas presentaron las características de adherencia y morfológicas reportadas por diferentes estudios [23,24,25]. Los resultados indicaron que el cerrado de la herida por las CTM, aumenta al usar el MC de H9C2 pretratadas con 3 distintas concentraciones de DHEA y someterlas a daño. Se ha discutido el efecto paracrino de los MC de H9C2 solos en cultivos de CTM [26,27], pero en el presente trabajo se observa como el MC de H9C2 pretratadas con DHEA e inducidas a daño, producen mayor cierre de herida que el MC solo, y para descartar que el llenado del espacio se debía a una inducción de la proliferación, se cuantificó la población celular en cada caso. El análisis de proliferación, de las CTM, arrojó que el MC de H9C2 con DHEA más daño, desde 10 µM, es menor a la que se observa en las CTM sin tratamiento o con MC solo después de 48 horas, aunque los espacios de rasgado si se están cerrando; lo anterior significa que se presenta un estímulo de la migración inducido de forma indirecta por la DHEA como efecto paracrino de las H9C2 dañadas. Los análisis de motilidad en las CTM incubadas con medio normal no indicaron migración, sino proliferación celular, la cual ocasionó el llenado del espacio en el rasgado. Este efecto de cerrado de la herida se ha relacionado con los beneficios al sistema cardiaco que se obtienen en la terapia con CTM [28,29], aunque, en este trabajo se propone que la mejora en la condición cardiaca se debe a los mecanismos de reparación de las células propias que se ponen en marcha al consumir DHEA, aunado a los efectos descritos de la DHEA ante las ECV al activarse diferentes vías protectoras [30,31]. En un trabajo de Liu y colaboradores [32], observaron que células troncales de placenta a las que se agregó angiotensina II, desencadenaron la señalización de VEGF, un factor que estimula la angiogénesis, al trasplantarlas a un corazón isquémico. Es posible que la DHEA al estar presente en un evento de daño, estimule en los cardiomiocitos la expresión de VEGF, así como vías de la migración que se observa en este trabajo. En un análisis proteómico del medio de cultivo de H9C2 sometidas a hipoxia y luego a reoxigenación, se observó principalmente en éste último que las proteínas secretadas al MC se relacionan tanto a procesos de cicatrización, como de remodelación de la matriz extracelular [33], procesos que resultan interesantes estudiar en nuestro modelo. Por otro lado, en un trabajo realizado por nuestro grupo de investigación, se encontró que la DHEA directamente incubada con las CTM, promueve procesos de diferenciación osteogénica [34], por lo cual se descarta que los efectos observados en este trabajo se deban a residuos de DHEA presentes en las H9C2, ya que éstos fueron eliminados por lavados antes de inducir el daño. Por lo tanto, este trabajo es el primero en describir que la DHEA promueve la migración de CTM cuando en los cardiomiocitos se presenta un proceso de daño, lo que resulta no solo atractivo para la terapia celular, sino para describir los efectos que la DHEA puede ejercer sobre las CTM para disminuir o prevenir los eventos de daño cardiaco.
CONCLUSIONES
La DHEA es considerada como un agente cardioprotector no solo por su efecto antioxidante/ antiinflamatorio, lo cual ya se ha demostrado en diferentes estudios; sin embargo, en este trabajo se muestran los primeros hallazgos que indican que la DHEA al utilizarla en un pretratamiento in vitro, favorece la movilización de CTM estimulada por los cardiomioblastos H9C2 cuando éstos son sometidos a procesos de daño por adición de H2O2. Las evidencias muestran que los espacios que son llenados por las células se deben a un proceso de motilidad y no por un aumento de la proliferación. Lo anterior ayuda a comprender que la condición cardiaca mejora cuando los pacientes con ECV consumen DHEA, y que los beneficios, además de ser directamente por acción de la DHEA, también pueden provenir de los efectos parácrinos que puedan estar desencadenándose.











 nueva página del texto (beta)
nueva página del texto (beta)


