INTRODUCCIÓN
Previos estudios han revelado que el quitosano (CH) tiene propiedades hemostáticas, acelerantes de la cicatrización y estimulantes del sistema inmune del hospedero contra infecciones virales y bacterianas [1]. El CH es un carbohidrato conformado por unidades β-(1-4)-D-glucosamina y β-(1-4)-N-acetil-D-glucosamina, que se obtiene por la desacetilación termo-alcalina de la quitina y es considerado un biopolímero biodegradable, no tóxico, antigénico, antimicrobiano, biocompatible y con capacidad de formar membranas [2]. Debido a estas propiedades, el CH fue aprobado para su uso como biomaterial por la Administración de Drogas y Alimentos (FDA, por sus siglas en inglés) [3]. Actualmente, se han usado diferentes tipos de materiales como membranas, micro y nanopartículas, andamios y apósitos para heridas con potencial uso en el área biomédica. Debemos mencionar que una partícularidad importante del CH es que puede acarrear y liberar compuestos bioactivos [4] y esto tiene gran importancia cuando diversos estudios revelan la existencia de aceites esenciales con compuestos bioactivos con potenciales aplicaciones en la salud humana. Como ejemplos podemos mencionar los aceites esenciales de Rosmarinus officinalis (RMO) y el árbol de té (TTO) [Melaleuca alternifolia]. El primero es comúnmente conocido como romero y contiene una serie de compuestos bioactivos como diterpenos, carnosol, ácido carnósico y ácido rosmarínico, a los que se le han atribuido propiedades antimicrobianas, antiinflamatorias y antioxidantes [5]. El aceite esencial del segundo, es usado como material bioactivo seguro y parece tener propiedades antibacteriales, antiinflamatorias, anticancerígenas y acaricidas, atribuidos principalmente a la presencia de terpineno-4-ol, γ-terpineno y α-terpieno [6]. Sin embargo, debido a su alta volatilidad y reactividad no se les ha reconocido como materiales de utilidad en el campo de la salud [7]. Por ello, las propiedades de estos aceites de RMO y TTO podrían aprovecharse de manera óptima si son incorporados a una membrana de CH, que a su vez funcionaría como reservorio de RMO y TTO para su uso como apósitos para heridas. Considerando lo anterior, este estudio incorporó los aceites esenciales de RMO y TTO a membranas de CH y evaluó sus propiedades físicas (degradabilidad, permeabilidad al vapor de agua, color, transparencia y capacidad de bloqueo de la luz ultravioleta), capacidad antioxidante y de protección del eritrocito humano.
METODOLOGÍA
Preparación y caracterización del CH
Para la obtención del CH se utilizó el caparazón del camarón utilizando el método establecido por Khanafari et al., 2008[8], con algunas modificaciones. Para iniciar, los caparazones de los camarones fueron lavados y posteriormente secados a 50 °C durante 24 h y posteriormente molidas en una licuadora convencional, hasta obtener las formas de hojuelas. Posteriormente, se aplicó un proceso de desproteinización a las hojuelas, para ello fueron colocadas en una solución de hidróxido de sodio (5% p/v) en una proporción de 1:30 p/v a 90 °C por 2 h. Transcurrido el tiempo, se ajustó el pH 7 y se realizó un proceso de desmineralización con HCl 2N (proporción 1:10 p/v) por 2 h. Por último se realizó un proceso de decoloración con H2O2 al 3% v/v (proporción 1:7 p/v), seguido por un ajuste de pH y secado en condiciones similares a las iniciales, para obtener la quitina. El CH se obtuvo por desacetilación termo-alcalina de la quitina de camarón. Un gramo de quitina fue homogenizado con 15 mL de NaOH (50 % p/v) a 95 ºC por 2 h [9] y fue caracterizado en base a su peso molecular y el grado de acetilación. Para la primera determinación, una muestra de CH fue solubilizada en ácido acético (0.25 M) hasta obtener una concentración de 4 g/L. Esta solución fue inyectada en un HPLC-SEC equipado con una columna ultrahydrogelTM 500 (7.8 x 300 mm) y una detector de dispersión de luz PL-ELS 1000 (Polymer Laboratories, US). La separación se realizó con una bomba isocrática (HP serie 1100) ajustada a un flujo de 0.3 mL/min con la solución de ácido acético arriba descrita. El peso molecular promedio del CH fue de 128 kDa. Por otro lado, el grado de N-acetilación (DA) del CH fue determinado en un espectrómetro ATR-FTIR Perkin-Elmer (Connecticus, US) en modo de absorbancia. El espectro de la muestra fue medido a 24 °C y 35% de humedad relativa, con una resolución de 4 cm -1 . El grado DA fue estimado utilizando las bandas a 1320 y 1420 cm -1 . El CH medido mostró un grado de acetilación de 34%. Los resultados de la caracterización del peso molecular y el grado de CH fueron previamente reportados por nuestro grupo de trabajo [10].
Preparación de la membrana de CH con RMO y TTO
Se preparó una solución de CH al 2 % (p/v) en ácido acético (1 % v/v) y fue homogenizada por 4 min a 15,500 rpm (Ika Ultra-turrax, Alemania). Una vez homogenizada, se adicionó glicerol como plastificante (500 µL/g of CH) y se volvió a homogenizar bajo las mismas condiciones. Ya obtenida la solución de CH, se agregaron los aceites de RMO (SARC USA; densidad relativa 0.903 g/cm 3 ) y TTO (SARC USA; densidad relativa 0.898 g/cm 3 a 25 °C) como emulsiones [(1% v/v de tween 80, etanol-agua (50 % v/v), RMO y TTO] en concentraciones de 0 (control), 0.5, 1.0 y 1.5 % (v/v). Posteriormente estas soluciones fueron colocadas en cajas Petri y secadas a 37 ºC por 24 h hasta la formación de las membranas (Figura 1).
Grosor
El grosor de las membranas fue medido con un micrómetro manual (Mitutoyo, Japón) a una precisión de 0.025 mm. Posteriormente se realizó aleatoriamente una repetición de 5 mediciones para cada una de las membranas. El grosor fue utilizado para calcular la transparencia y la permeabilidad al vapor de agua.
Solubilidad en agua (degradabilidad)
La determinación de solubilidad se realizó de acuerdo a lo publicado por Casariego el al., 2009[11]. Las membranas se cortaron en cuadros de 20 x 20 mm y fueron colocadas en un horno al vacío (70ºC, 35 kPa x 24 h) para obtener el peso seco de la membrana. Posteriormente, las membranas fueron inmersas en 10 mL de agua tridestilada en cajas Petri y mantenidas a 25ºC por 24 h con agitación ocasional. Una vez transcurrido el tiempo, se secaron de nuevo hasta obtener un peso constante (mismas condiciones ya descritas), para determinar el peso de la materia seca insoluble en agua. La solubilidad se calculó de la siguiente manera con la Ecuación (1).
Donde Mi representa a la masa inicial y Mf la masa final.
Medición de la permeabilidad al vapor de agua (PVA)
La PVA se determinó por gravimetría de acuerdo al método ASTM E96-92 [12]. Para ello, las películas a probar fueron colocadas y selladas en la parte superior de una copa de vidrio de 50 mL, la cual contenía 10 mL de agua destilada (100 % HR; 3.168 kPa de PVA a 25ºC). Posteriormente, las películas fueron colocadas en un desecador con sulfato de calcio anhidro a 25ºC y 0% de HR (0 kPa de PVA). Las copas fueron pesadas en intervalos de 3 h por 12 h en condiciones ambientales uniformes y circulación de aire constante. Para ello, se usó un ventilador miniatura dentro del desecador. El peso perdido de la copa se graficó con respecto al tiempo, para estimar la pendiente mediante la ecuación de la recta (coeficiente de correlación fue de 0.99). Una vez calculada la pendiente se determinó la razón de transmisión de vapor de agua (RTVA) mediante la siguiente Ecuación (2).
La PVA de las membranas se calculó dividiendo la RTVA por la diferencia de las presiones parciales dentro (PA1) y fuera de la copa (PA2) y multiplicando por el grosor promedio de la membrana (G) como se expresa en (3).
Propiedades ópticas
El color y la transparencia se determinaron con un espectrofotómetro UV-vis Marca Cintra 10e (Australia). Para la medición de color se seleccionaron tres membranas de cada concentración, de las cuales se registró la lectura de cinco puntos de muestreo al azar. El color de la membrana se expresó en base al modelo de CIE L* (luminosidad) a* (rojo-verde) y b* (amarillo-azul). La transparencia se determinó por espectrofotometría utilizando el método establecido por Han y Floros, 1997[13]. La transmitancia fue leída a 600 nm y la transparencia de la membrana fue calculada (4).
Donde T600 es la transmitancia a 600 nm y G representa el grosor de la membrana (mm).
También se determinó el comportamiento de las propiedades de transmisión de la luz UV (200-400 nm).
Actividad antioxidante (radical ABTS)
Se tomaron 50 mg de cada membrana y se homogenizaron en 5 mL de metanol al 80% (v/v) usando un homogeneizador a 5ºC por 5 minutos a 11,000 rpm. Posteriormente, la muestra fue centrifugada a 16,000 g x 10 min a 5ºC, y el sobrenadante colectado y fue filtrado usando papel filtro Whatman No 1. Los extractos de las películas, fueron utilizados para el ensayo de ABTS [ácido 2,2´ azinobis-(3-etilbenzotiazolina-6-sulfónico)] y para la evaluación del efecto protector sobre eritrocitos humanos. La actividad antioxidante fue realizada por el ensayo de decoloración del radical catiónico ABTS según lo establecido por Re et al., 1999 [14]. El radical ABTS fue generado por interacción entre 5 mL de la solución ABTS (7 Mm) y 88 µL de la solución de persulfato de potasio (0.139 mM). La prueba se realizó agregando 245 μL de solución de ABTS+ y 5 μL de extracto de película. La absorbancia fue monitoreada a 734 nm en un iMark Bio-Rad (Japón) El porcentaje de inhibición del radical fue calculado de la siguiente manera (5).
Donde Ab es la absorbancia del blanco y Aa la absorbancia de la muestra.
Evaluación del efecto protector sobre eritrocitos humanos
La hemólisis inducida por AAPH [2,2´-azobis (2-metilpropionamidina) dihidro clorhídrico] fue determinada por el método establecido por Lu et al., 2010 [15] y modificado para la utilización con extracto de membrana. Primero se colectó una muestra de sangre mediante venopunción del área antecubital en un tubo con EDTA y posteriormente la muestra fue centrifugada a 350 g por 5 minutos. Una vez centrifugada, se descartó el plasma y se recolectó el paquete eritrocitario. Los eritrocitos fueron lavados en tres ocasiones con 3 mL de solución salina al 0.9 % (p/v) y centrifugados después de cada lavado a 350 g por 5 minutos. Después, se preparó una suspensión de eritrocitos al 5% con PBS (v/v). Para la prueba de protección al eritrocito se colocaron 50 µL de eritrocitos (5%) con 50 µL de extracto de membrana y 400 mmol de AAPH en un tubo de vidrio. Después se preparó de igual forma, una mezcla control pero sin extracto y sin membrana (hemólisis completa). Las suspensiones fueron incubadas a 37ºC con agitación continua a 30 rpm en oscuridad por 3 h. Posteriormente se centrifugó a 2000 x g por 5 min y la absorbancia del sobrenadante se leyó a 540 nm en microplaca iMark Bio-Rad. Los resultados se expresaron en porcentaje de inhibición de hemólisis del eritrocito humano usando (6).
Donde AAPH = absorbancia de la hemólisis completa y HM= absorbancia del sobrenadante.
RESULTADOS Y DISCUSIÓN
Solubilidad (degradabilidad): La solubilidad proporciona información sobre la resistencia de las membranas al contacto con el agua. Los valores de solubilidad (Tabla 1) indicaron que la adición de RMO o TTO reducían la solubilidad de CH comparada con el control (p< 0.05). Las membranas de RMO-0.25% (39 %) y TTO-1.00% (67%) fueron las que mostraron menor solubilidad (p< 0.05) comparada con las membranas con otras concentraciones de aceites esenciales. Otros autores han reportado una reducción de solubilidad (41 a 55%) en películas de CH incorporadas con aceite de canela al 1.5 y 2.0% [16]. Ojagh et al. [17] también observaron una reducción superior al 50% en la solubilidad de películas de CH con arcilla de montmorillonita incorporadas con RMO (1.0%) y TTO (1.0%). Los resultados también mostraron que entre mayor es la concentración de aceites esenciales en la membrana CH, menor es su solubilidad. Por otro lado, la solubilidad mostrada por la membrana control podría ser relativamente normal, porque las membranas de CH generalmente están protonadas, lo que incrementa su solubilidad al contacto con el agua [18].
TABLA 1 Valores obtenidos de grosor, solubilidad y PVA de membranas de CH con RMO o TTO.

Medias (± DE) en una misma columna con diferentes superíndices indican diferencia (Prueba de Duncan; p < 0.05).
PVA: Los valores de PVA de las membranas de CH incorporadas con RMO y TTO se muestran en la Tabla 1. Se observa que la membrana de CH con baja concentración de TTO (0.25%) mostró el mejor comportamiento como barrera contra el vapor de agua comparado con las membranas con el resto de las concentraciones de aceites y el control. La membrana con TTO-0.50% y la TTO-0.25% redujeron significativamente la PVA de CH (29% y 58% respectivamente) al compararlas con la membrana control.
Sánchez-González et al. [18] desarrollaron películas de CH incorporadas con TTO (2.0%) y observaron una reducción de PVA de hasta 40%. Estos resultados difieren de nuestro estudio, ya que una concentración más baja de TTO (0.25%) confirió a la membrana una mayor reducción de la PVA. Por otro lado, la incorporación de RMO-1.00% confirió una reducción de PVA de 28% y RMO-0.25% de 32% aunque significativamente menor que las conferidas por TTO. Estos resultados mostraron que las propiedades de barrera contra la humedad son significativamente mejores a más bajas concentraciones de RMO y TTO.
Propiedades ópticas: El color medido indica la apariencia de las membranas. En la Tabla 2 se observan los valores de color mostrados por las membranas (valores de b*).
TABLA 2 Parámetros de color de membranas de CH con RMO y TTO.

Medias (± DE) en una misma columna con diferentes superíndices indican diferencia (Prueba de Duncan; p < 0.05).
La membrana control presentó la mayor intensidad del color amarillo, pero con la incorporación de RMO y TTO se observó una reducción significativa de la misma (p < 0.05). Las membranas de RMO y TTO al 0.25% mostraron un amarillo menos intenso. El incremento en la concentración de aceites en las membranas de CH no redujo la coloración amarilla.
Se ha reportado que el incremento de la cantidad de aceite esencial incorporado en películas de CH no necesariamente confiere comportamiento lineal de la coloración, y que incluso, la coloración observada puede atribuirse a otras propiedades del CH como el peso molecular, grado de desacetilación y presencia de calor durante su elaboración [11,19]. Por otro lado, observamos que la incorporación de TTO a las membranas de CH no redujo los valores de L* (luminosidad y brillo) en comparación con el control. En cambio, la incorporación de RMO al 0.50 y al 1.00% redujo significativamente los valores de L*. Esta variación en la luminosidad podría explicarse a la alteración molecular del CH con RMO. En general los valores observados de L* en este estudio fueron mayores que los reportados por otros autores que han incorporado polifenoles de té (35- 27 valores L*) pero menores a los de películas de CH con EDTA y aceite de canela (90-89 valores de L*) [20].
En la Tabla 3, se muestra el comportamiento de la transparencia y la transmitancia de la luz de las membranas. En general, todas las membranas fueron ligeramente opacas, pero las membranas control y aquella con TTO-0.25% mostraron la mayor transparencia.
TABLA 3 Transmitancia de la luz (%) y valores de transparencia de membranas de CH incorporadas con RMO y TTO.
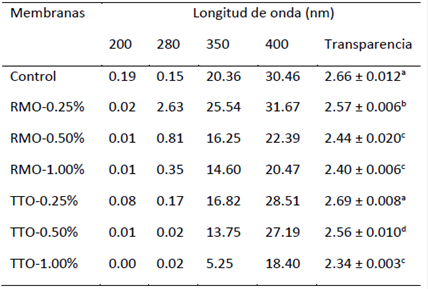
Medias (±DE) en una misma columna con diferentes superíndices indican diferencia (Prueba de Duncan; p < 0.05).
De acuerdo a Sánchez-González et al., 2010 [18] la diferencia en los niveles de transparencia de las membranas podría estar ligada a la estructura interna desarrollada durante el proceso de secado debido a la dispersión de la fracción del volumen de los aceites esenciales y el tamaño de formación de sus gotas. Por otro lado, las membranas estudiadas fueron capaces de bloquear la transmisión de la luz ultravioleta (200 y 280 nm). Esto probablemente se deba a la compleja mezcla de compuestos de los aceites de RMO y TTO. Comportamientos similares de bloqueos de la luz ultravioleta han sido observados con membranas de gelatina de pescado y aceite esencial de orégano [21].
Actividad antioxidante (radical ABTS): La Figura 2 muestra que la membrana con RMO-0.25% presentó la mayor capacidad antioxidante (9.0%). Por otro lado, las membranas con RMO-0.50% (6.4%) y TTO-0.25% (6.0%) mostraron la actividad más baja. Las membranas control (7.5%), las incorporadas con RMO (7.2%), TTO (7.1 %)-0.50% y TTO (7.0%)- 1.00% no presentaron diferencias en su capacidad antioxidante (p > 0.05).

FIGURA 2 Capacidad antioxidante (radical-ABTS) de los extractos de las membranas incorporadas con TTO y RMO. Los datos muestran los valores medios (barras para cada tipo de membranas). Literales diferentes indican diferencias (p < 0.05).
La capacidad antioxidante mostrada por la membrana control ha sido ya reportada y se atribuye a la reacción de los residuos del grupo amino del carbono número 2 (CH) con radicales libres [22]. No observamos cambios en la actividad antioxidante al incorporar los aceites esenciales en las membranas de CH, con excepción en TTO-0.25%. Sin embargo, las capacidades antioxidantes de RMO y TTO son reconocidas, el primero debido a la presencia de tres compuestos terpénicos (α- terpineno, α-terpinoleno y γ-terpineno) y el segundo a diversos compuestos fenólicos como carnasol, ácido carnósico, rosmanol, rosmadial, epirosmanol, rosmadifenol, ácido rosmarinico [16,23].
En este estudio observamos baja actividad antioxidante. Probablemente la matriz de CH pudo haber formado encapsulación parcial de RMO y TTO inducida por el grupo carboxilato (NH3+ -OOCH) o bien haber resultado de la interacción química de los compuestos de los aceites esenciales con la matriz de CH.
Efecto protector sobre eritrocitos humanos: Esta prueba simula el efecto del ataque del radical AAPH sobre la membrana eritrocitaria (peroxidación de fosfolípidos) y es complementaría a la actividad antioxidante medida por el radical ABTS (método químico). Esto nos da un mejor perspectiva del comportamiento que pudieran tener los extractos de las membranas al estar en contacto con radicales y la protección que pudiera brindar sobre la célula eritrocitaria (simulación in vivo), bajo el principio de que el daño de la membrana eritrocitaria acompaña eventualmente a la hemólisis y donde la liberación de hemoglobina es el indicador de daño [24] . La Figura 3 muestra que todas las membranas brindan un efecto protector al eritrocito (mayor a 63 %).

FIGURA 3. Efecto protector sobre el eritrocito humano de los extractos de las membranas incorporadas con TTO y RMO. Los datos muestran los valores medios (barras para cada tipo de membranas). Literales diferentes indican diferencias (p < 0.05).
El mayor efecto protector fue mostrado por la membrana con TTO-0.50% (81 %) y el más bajo por la membrana con RMO-0.25% (63 %). Los extractos de la membranas con 0.25% y 0.50% de TTO, mostraron mejor efecto protector comparadas con aquellas incorporadas con RMO y el control (p< 0.05).
Es importante resaltar que el comportamiento de los resultados obtenidos por el método del radical ABTS fueron diferentes comparados con aquellos del efecto protector sobre el eritrocito humano. El método del radical ABTS mide la capacidad de las moléculas para reducir un radical libre artificial, mientras que el ensayo del efecto protector sobre el eritrocito simula las condiciones in vivo a través de un modelo celular. Por otro lado, la membrana control presentó buen efecto protector al eritrocito que aparentemente puede atribuirse a los grupos protonados del grupo amino en la matriz de CH. Estos grupos pudieran inducir interacciones electrostáticas con las cargas negativas de la membrana de los eritrocitos e inducir una forma de agregación celular que evita el daño de la membrana celular [25]. Aunque los componentes de RMO y TTO son conocidos como excelentes antioxidantes, en este estudio observamos que el efecto de protección al eritrocito pudiera ser inducido más por el CH que por los aceites esenciales incorporados, o bien, a la excesiva liberación de los aceites incorporados en la membrana o baja liberación de los aceites esenciales encapsulados [18].
CONCLUSIONES
La membrana de TTO-1.00% mostró la mejor reducción de solubilidad con 67%. Por otro lado, la membrana con baja concentración de TTO (0.25%) mostró el mejor comportamiento como barrera contra el vapor de agua, con una reducción de 58% en relación con la membrana control. Todas las membranas presentaron una coloración amarilla, fueron ligeramente opacas y con propiedades de bloqueo de la luz UV. Los extractos de las membranas presentaron una baja capacidad antioxidante (9%).
Por el contrario, las membranas mostraron altos porcentajes de inhibición de hemólisis eritrocitaria (>63%). Aunque se requieren estudios adicionales sobre las características fisicoquímicas, mecánicas, microestructura y antimicrobianas, consideramos que los resultados de este estudio son un punto de inicio para que las membranas de CH incorporadas con RMO y TTO puedan ser consideradas como biomaterial de estudio con gran potencial de uso en el campo de la salud.











 nueva página del texto (beta)
nueva página del texto (beta)



