INTRODUCCIÓN
Los aceites esenciales (AE) son una mezcla de sustancias químicas complejas con un perfil fuertemente aromático, que son obtenidos a partir de las plantas [1]. Los AE y sus extractos, continúan en uso por la medicina popular, aunque actualmente la industria farmacéutica y cosmética, han aumentado el interés por estos, debido al relativo estatus de seguridad y a la amplia aceptación por la población [2], debido a las diversas propiedades antimicrobianas y antioxidantes [3,4,5]. Sin embargo, las limitantes en el uso y aplicación de los AE se atribuyen principalmente a la naturaleza fotosensible, volátil e hidrofóbica, lo que a su vez ha estimulado la búsqueda de nuevos sistemas de conservación [6]. Entre estos sistemas se encuentran los procesos de microencapsulación que involucra la incorporación de compuestos bioactivos en pequeñas cápsulas. Varias técnicas han sido utilizadas para encapsular compuestos bioactivos las cuales incluye secado por pulverización, enfriamiento por pulverización, extrusión, cubertura de lecho fluidizado, liposomas, coacervación y emulsión [7]. Uno de los sistemas que ha merecido especial atención para la encapsulación de AE ha sido el uso de emulsiones [8]. La finalidad de una emulsión es lograr que los compuestos de naturaleza hidrofílica e hidrofóbica puedan coexistir de manera más estable [4]. En particular, se le han atribuido diversas ventajas sobre otros tipos de sistema con respecto a la liberación y el incremento de la biodisponibilidad de los componentes bioactivos [9].
Por otro lado, existen diversos AE, pero aquellos del árbol de té [AET] (Melaleuca alternifolia) ha ganado buena reputación como un material bioactivo seguro. Estudios previos han publicado que el AET posee propiedades antibacteriales, antiinflamatorias, anticancerígenas y acaricidas [10]. Este amplio espectro de actividad biológica ha sido atribuido a la presencia de terpineno-4-ol, γ-terpineno y α-terpieno [11]. Otro aceite que se ha utilizado en la medicina tradicional como analgésico y antiinflamatorio, es el aceite esencial de romero [AER] (Rosmarinus officinalis). Algunos estudios han evidenciado que sus efectos farmacológicos han sido atribuidos principalmente a la presencia de diterpenos, carnosol, ácido carnósico y ácido rosmarínico [12]. Sin embargo, se desconocen los efectos que pudieran tener al ser aplicados como microemulsiones de AER y AET sobre las células humanas (modelo eritrocitario) y microorganismos patógenos. Por lo anterior, el objetivo de este trabajo fue evaluar el tamaño, el efecto antibacterial antibacterial, hemolítico y de protección al eritrocito de las microemulsiones de AER y AET.
METODOLOGÍA
Preparación de las Emulsiones de AET y AER: Fueron elaboradas con base a lo establecido por Rao y McClements [9], con algunas ligeras modificaciones. Para ello, se prepararon emulsiones al 8% (v/v), 5% (v/v) y 2.5% (v/v), tanto para AET y AER. Para ello los AET (SARC supply solutions, USA; densidad relativa 0.898 g/cm 3 a 25 °C) y AER (SARC supply solutions, USA; densidad relativa 0.903 g/cm 3 a 25 °C), se mezclaron con tween 80 (polioxietilensorbitanmonooleato 80) (1% v/v) y una solución de buffer fosfato (PBS) a un pH de 7.4 y posteriormente se agitaron a una velocidad constante 200 RPM por 20 minutos hasta adquirir una consistencia lechosa y homogénea. Las emulsiones fueron conservadas en viales de color ámbar a 5 °C.
Tamaño: Se realizó por el método de Poyato et al. [13], haciendo una medición del diámetro de las micelas en un microscopio óptico Ziess Primo Star (Carl Zeiss Microscopy GmbH), adicionado con una cámara AxioCamERc 5s Ziess (Alemania). Después, se caracterizaron por tamaño de micelas encontradas en 3 campos (40x). Los rangos de distribución de los tamaños de las emulsiones fueron reportados en rangos de amplitud de 2-110 µm (AER) y 4-60 µm (AET).
Porcentaje de Hemólisis: Se realizó con base a lo establecido por Sundaram et al. [14], con las modificaciones siguientes; se utilizaron muestras de sangre humana recolectadas en un tubo con anticoagulante EDTA (ácido etildiamino tetraacético). La muestra fue centrifugada a 350 g por 5 minutos, se descartó el plasma y se recolectó el paquete eritrocitario. Los eritrocitos fueron lavados en tres ocasiones con 3 mL de solución salina al 0.9% (p/v), siendo centrifugados después de cada lavado a 350 g por 5 minutos. Después, se preparó una suspensión de eritrocitos al 5% (v/v). Para determinar la hemólisis eritrocitaria se adicionaron 1979 µL de PBS y 14 µL de la suspensión de eritrocitos al 5% (v/v) con 7 µL de cada una de las emulsiones de AET o AER, al 8% (v/v), 5% (v/v) y 2.5% (v/v) de manera independiente. También se utilizó un tubo control con las mismas cantidades antes descritas, pero con agua (100% hemólisis). Una vez confrontada las emulsiones con el eritrocito, se colocaron en agitación constante a 37 °C por 2 horas. Una vez transcurrido el tiempo se centrifugaron (350 g por 5 min) y los sobrenadantes se leyeron a 540 nm en un fotómetro semi-automático SPINLAB (Spinreact S.A.). Posteriormente se calculó el porcentaje de hemólisis (1):
Donde: AM=Absorbancia de la muestra (eritrocitos-emulsión y PBS) y AHT=Absorbancia de la hemólisis total.
Porcentaje de Inhibición de Hemólisis: Para ello se preparó una suspensión de eritrocitos al 5% (v/v) que se expuso con los preparados de las emulsiones y peróxido de hidrógeno. La cantidad de emulsión utilizada en el presente análisis fue de 7 µL de cada una de las emulsiones y 2.5 µL de peróxido de hidrógeno al 30% (v/v). También se utilizó un control de 100% de hemólisis, que se preparó con agua y suspensión de eritrocitos. Una vez que se expuso el eritrocito a la emulsión y al oxidante, se incubaron a 37 ºC por 2 h. Posterior al tiempo de incubación, la muestras se centrifugaron a 350 g por 5 minutos, se descartó el precipitado y el sobrenadante se introdujo a un analizador semi-automático SPINLAB y se leyó a 540 nm [15]. Para establecer el grado de protección al eritrocito por las emulsiones, se calculó el porcentaje de inhibición de hemólisis (2):
Abs muestra: absorbancia de la mezcla de suspensión de eritrocitos, emulsión y oxidante. Abs total: absorbancia obtenida de la mezcla de agua, más suspensión de eritrocitos y oxidante.
Actividad Antibacterial: Se utilizó el método descrito por Hu et al. [16] modificado, donde se determinó la sensibilidad bacteriana en cepas de E. coli O157:H7 (ATCC 43890) y S. aureus (ATCC 9144) expuestas a las emulsiones preparadas de AET y AER a diferentes concentraciones [8.0% (v/v), 5.0% (v/v) y 2.5% (v/v)]. El ensayo para la determinación del efecto inhibitorio de las emulsiones, se realizó por medio de la adición de 100 µL de caldo nutritivo inoculado con aproximadamente 1 x 106 ufc/mL de cada cepa. A cada caldo se le adicionaron emulsiones en sus diferentes concentraciones 200 µL y se ajustó hasta 10 mL con PBS estéril. Posteriormente, el caldo se incubó a 37 °C por 24 h, con agitación ocasional. Una vez finalizada la incubación, el contenido de los caldos (100 µL) fueron depositados en placas de agar Muller-Hinton (por triplicado) y se incubaron a 37 °C por 24 horas. Después, se procedió con la cuenta de colonias desarrolladas. Con los datos obtenidos se realizó el cálculo para la determinación del efecto antibacteriano (3):
Dónde: A= Número de colonias en control y B= Número de colonias desarrolladas.
RESULTADOS Y DISCUSIÓN
Tamaño: Las micelas fueron clasificadas de acuerdo a los diferentes tamaños que presentaron en las distintas concentraciones de emulsiones. Para las emulsiones preparadas con AER se pudo observar que el diámetro de la partícula predominante fue de 2 a 35 µm (Figura 1).
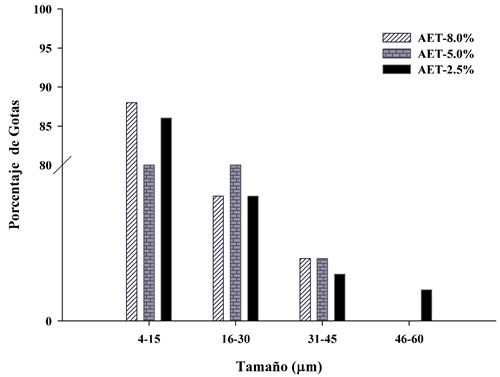
En las emulsiones preparadas con AET (Figura 2), los diámetros del tamaño de la partícula fueron más variados, con mayor porcentaje de partículas con diámetros de 4-15 µm, seguido por partículas con diámetros de 16 a 30 µm. Para el caso de las emulsiones con AER, se observó una cantidad mínima de partículas con diámetros mayores de los rangos ya mencionados.
Según Salager [17], el tamaño de la gota y la distribución de tamaños son dos tipos de información muy importantes, ya que por un lado dan lugar a características de las emulsiones, y por otro son útiles para definir estabilidad.
Porcentaje de Hemólisis: El termino hemólisis hace referencia al proceso de destrucción de los eritrocitos, que genera la liberación de los componentes intraeritrocitarios, por lo tanto, la prueba de porcentaje de hemólisis se utiliza para conocer el efecto provocado sobre la célula eritrocitaria al enfrentarla con emulsiones de AET y AER en diversas concentraciones de aceites esenciales.
En la Figura 3 podemos observar que conforme se aumenta la concentración de AET, se incrementa significativamente el efecto hemolítico sobre la células eritrocitarias (p< 0.05).
El máximo incremento de hemólisis fue hasta de 70% para las emulsiones cargadas con 8.0% y de 32% para la concentración del 5.0%. En cambio para las emulsiones con 2.5%, la hemólisis presente no fue significativa. No se han encontraron reportes previos de los efectos del aceite de AET sobre los eritrocitos de animales o humanos. Pero otros estudios han evidenciado que AET puede tener la capacidad de desnaturalizar proteínas y alterar la estructura de la membrana celular [18]. Otra parte importante que se ha estudiado de AET, ha sido su efecto sobre células epiteliales y fibroblastos. Además se ha observado que a bajas concentraciones de AET, los efectos citotóxicos son bajos, pero se incrementan cuando se aumenta la concentración y el tiempo de contacto de AET con las células eritrocitarias [19]. En el caso de las emulsiones preparadas con AER, se observó que el incremento en la concentración, no se asoció con un aumento en la hemólisis. Esto nos indicó que las concentraciones estudiadas no tienen efectos citotóxicos para la célula eritrocitaria. Estudios previos han evidenciado que AER administrado al 4% sobre el área de una herida de un ratón modelo, induce infiltración de macrófagos y consecuentemente la proliferación de fibroblastos. Esto ha sugerido que la AER puede proteger a las células e incluso acortar el tiempo de recuperación de las heridas [20]. Al igual que el estudio anterior, en nuestro estudio también observamos un efecto de protección importante sobre el eritrocito humano. Por otro lado, durante la preparación de las emulsiones con los aceites esenciales se utilizó un surfactante no iónico (tween 80) el cual tiene la capacidad de incrementar la permeabilidad de la membrana de los eritrocitos de sustancias de peso molecular bajo causando hemólisis por presión osmótica coloidal [21]. El estudio anterior, desafortunadamente usó células obtenidas de un banco de sangre con ≈ 21 días después de la venopunción. Igualmente, el tiempo de almacenamiento y la conservación de las células pudieron haber sido también una causa importante de hemólisis por senescencia y por proceso, los cuales fueron factores que no ajustaron en ese estudio. En nuestro estudio, podemos considerar que la influencia de tween 80 sobre células obtenidas de reciente venopunción (≈ 5 horas) podría representar una baja hemólisis. Esto se concluyó cuando las emulsiones de AET y AER fueron preparadas con las mismas concentraciones de tween 80 y como se observa en la Figura 3, el efecto hemolítico observado por las emulsiones elaboradas con AER, fué muy bajo, mientras que en AET el efecto se elevaba en relación al incremento en la concentración de aceite esencial.
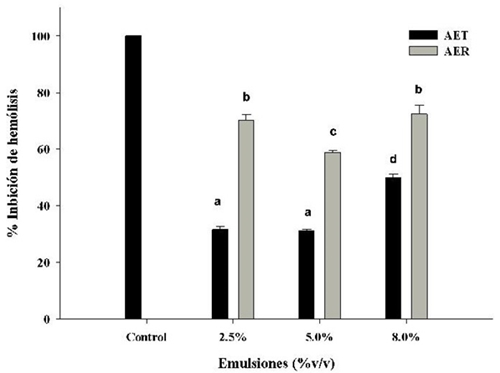
Porcentaje de Inhibición de Hemólisis: Contrario a la prueba de porcentaje de hemólisis, la determinación del porcentaje de inhibición de hemólisis tiene la finalidad de medir la capacidad que tienen ciertas sustancias (antioxidantes) para proteger al eritrocito, bajo condiciones de ataque a la membrana celular (oxidante). En el presente estudio se generó un proceso de peroxidación para producir radicales libres, que es una de las principales causas de daños y destrucción de la membrana eritrocitaria. En la Figura 4, se observa que la emulsión cargada con AER presentó mayor capacidad de inhibición de hemólisis (p< 0.05) en todas sus concentraciones comparadas con las de AET.
De manera específica se pudo observar que las emulsiones de AER al 2.5% y 8.0% mostraron porcentajes de inhibición de hemólisis >70%. En cuanto a las emulsiones de AET se observó un porcentaje de inhibición de hemólisis <40% para las emulsiones cargadas al 2.5% y 5.0%, mientras que para una concentración del 8.0%, el porcentaje de inhibición de hemólisis fue >40%. También se observó que las emulsiones con AER fueron más eficientes en proteger al eritrocito contra el ataque oxidativo, que las cargadas con AET. Por el contrario, Yesil-Celiktas et al. [22] monitorearon la capacidad de extractos de romero para inhibir el ataque oxidativo (H2O2) a la membrana eritrocitaria, con la consecuente producción de malondialdehído, un componente mutagénico y carcinogénico que resulta de la inserción de un átomo de oxígeno en el componente lipídico de la membrana. Ellos observaron que los extractos de romero presentaban una baja protección a la peroxidación de la membrana del eritrocito, con respecto a antioxidantes conocidos (BHT), que eran atribuidos a sus componentes hidrofóbicos. Es importante mencionar que en nuestro estudio, se evaluaron las emulsiones de AER y no extractos, los cuales pueden contener diversos solventes. Esto nos podría indicar que las formas en las que se prueban los antioxidantes pueden estar en función de su disponibilidad de sus componentes bioactivos. Por otro lado, podemos mencionar que AET ha sido reconocido por su capacidad antioxidante, particularmente por la presencia de α-terpineno [23]. La estimación de la capacidad antioxidante de AET ha sido reportada por DPPH o ABTS u otros métodos que se fundamentan en reacciones químicas in vitro y que puede ser diferente a lo que realmente sucede en el cuerpo humano. Esto significa, que aunque la estimación de la capacidad antioxidante del AET sea alta, esto no necesariamente puede traducirse en un efecto benéfico para las células humanas (Figura 3). Previamente, se ha observado que AET puede exhibir cierta toxicidad sobre células humanas (no eritrocitarias) en función de la concentración y tiempo de contacto [20]. Estudios recientes han identificado que α-terpineno puede oxidarse fácilmente produciendo epóxidos alílicos, que pueden ser alérgenos de importancia [24].
Actividad Antibacterial: En la Tabla 1, se puede observar que la emulsión de AET y AER al 8.0%, presentaron inhibición alta sobre el crecimiento de E. coli O157:H7. Por otro lado, el crecimiento de S. aureus fue inhibido en un 100% y 99% por la emulsión de AET al 8.0% y 5.0% respectivamente. En cambio, ninguna emulsión cargada con AER, presentó efecto inhibitorio contra S. aureus.
En el caso de AET, Orozco et al. [25], también observaron actividad antibacteriana significativa durante la exposición de microemulsiones con AET contra cepas de E. coli. Otros estudios, también han evidenciado que AET puede ser usada en el tratamiento de infecciones por S. aureus [27]. Actualmente se atribuye la propiedad antibacterial de AET a los compuestos como el terpineno-4-ol, linalol y α-terpineol. Se ha observado que estos compuestos (terpineno-4-ol, principalmente) pueden afectar la pared celular bacteriana, provocando daño en el núcleo celular [11]. Este mecanismo de acción podría explicar el efecto de AET sobre las células de E. coli [26]. Por otro lado, Ojeda-Sana et al. [28], aseguraron que los componentes de AER como el 1-8 cineol, alcanfor, verbenone y borneol pueden ser capaces de romper la membrana celular de E. coli. Con respecto a su selectividad bacteriana, se ha considerado que AER suele ser más efectivo contra bacterias Gram negativas que contra Gram positivas [29]. Esto podría explicar la ausencia de inhibición de crecimiento contra S. aureus. El mecanismo de acción de AER contra los Gram negativos aún no está bien elucidado pero existe evidencia que indica que los primeros efectos ocurren sobre la membrana externa. Sin embargo, para que esto suceda, la concentración de AER debe encontrarse en cantidades suficientes para permitir que sus componentes se difundan a través de la cobertura de lipopolisacáridos [30]. Previamente también se ha reportado que los daños en la membrana externa pueden progresar más rápidamente que los ocurridos en la membrana citoplasmática [31].
CONCLUSIONES
El tamaño de gota de las microemulsiones de los AE estudiados fue predominantemente entre 2 a 35 µm. También encontramos que las emulsiones con AER en las concentraciones evaluadas inhiben la lisis del eritrocito expuesto a peróxido de hidrógeno. En relación al efecto antimicrobiano, solo las emulsiones con concentración más altas de AER y AET lograron inhibir el crecimiento in vitro de E. coli. Por otro lado, las emulsiones de AET mostraron actividad antimicrobiana significativa contra E. coli y S. aureus. A pesar de que mostraron buena actividad antibacterial, las emulsiones de AET mostraron efecto hemolítico sobre el eritrocito humano, lo cual representan una desventaja en un posible uso para fines terapéuticos en humanos. Finalmente este estudio sugiere que es importante seguir estudiando los efectos tóxicos del AET sobre las células humanas.











 text new page (beta)
text new page (beta)