Introducción
El sistema nervioso autónomo (SNA), con sus ramas simpática y parasimpática, se encarga de regular los procesos fisiológicos del organismo para mantener la homeostasis. La disautonomía puede definirse como el desbalance o respuesta lenta del SNA [1,2]. El SNA puede resultar dañado debido a alguna enfermedad degenerativa como lo es la enfermedad de Parkinson (EP). El proceso patológico de la EP se caracteriza por una pérdida progresiva de neuronas dopaminérgicas de la sustancia negra y el desarrollo de cuerpos de Lewy, afectando de esta forma al SNA a nivel central y periférico [1-3], lo cual se refleja en una presencia de disautonomía mayor al 50 % en pacientes con EP [4-6]. Dicha disautonomía en EP incluye síntomas como: disfunción sexual, disfunción urinaria e intestinal, desórdenes del sueño y alteraciones en la regulación cardiovascular [7].
Sin embargo, los síntomas de la disautonomía se pueden confundir con el cuadro clínico de EP u otra enfermedad, por lo que es importante realizar la evaluación de la presencia de disautonomía durante la evolución de EP contribuyendo a un mejor diagnóstico y tratamiento.
Una de las pruebas más utilizadas para la evaluación del SNA consiste en cambios ortostáticos, con la finalidad de revelar la presencia de hipotensión ortostática, definida como una disminución de la presión sistólica mayor a 20 mmHg después de un cambio de postura. La prueba de la mesa inclinada, conocida como Tilt test, consiste en realizar cambios de postura pasivos mientras se monitorean señales cardiovasculares. Sin embargo, esta prueba no está completamente estandarizada ya que se puede realizar variando los ángulos de inclinación y la duración de las posiciones [8].
En este trabajo se propone la implementación de maniobras ampliamente utilizadas en la evaluación del sistema cardiovascular, como el cambio de postura y maniobras respiratorias, que permitan valorar la respuesta del SNA y posibiliten detectar la presencia de una posible disautonomía de una forma rápida y sencilla, a través del análisis de la variabilidad de la frecuencia cardiaca (VFC), el cual es una herramienta ampliamente utilizada en la evaluación del SNA y ofrece la ventaja de ser un método no invasivo. La evaluación de la VFC puede abordarse considerando métodos lineales y no lineales. En este estudio se consideraron índices lineales de la VFC en el dominio del tiempo y la frecuencia, además de evaluar la entropía aproximada (EA) como una herramienta de análisis no lineal.
Un análisis no lineal ayuda a revelar información sobre las fluctuaciones complejas presentes en señales fisiológicas, lo cual ha demostrado ser relevante en la caracterización de diferentes condiciones patológicas [9]. Además el análisis no lineal ofrece la ventaja de poder ser aplicado a series de tiempo cortas y ruidosas.
El estudio de la VFC en pacientes con EP ha sido previamente reportado en diferentes investigaciones [4,6,10]. Sin embargo, en este trabajo se comparan índices lineales y no lineales de la VFC durante un protocolo de adquisición alternativo orientado a la evaluación de disautonomías.
Por otra parte, es importante realizar estudios sobre la respuesta del SNA en una población mexicana de pacientes con EP, ya que su comportamiento varía según la etnia y son pocos los estudios realizados al respecto [6].
El objetivo de este trabajo es evaluar la presencia de disautonomía en pacientes mexicanos con EP mediante el análisis de la VFC, a través de las señales de electrocardiograma (ECG) y pletismografía de pulso (PPG) durante la realización de un protocolo clínico formado por una secuencia de maniobras: reposo, cambio de postura, respiración controlada e hiperventilación.
Metodología
Protocolo clínico
En este protocolo se evaluaron 6 sujetos con Parkinson, 4 hombres y 2 mujeres de 68 ± 10.6 años con un tiempo de diagnóstico de EP de 8.75 ± 5.8 años. Todos los pacientes del grupo EP reciben tratamiento para su enfermedad, siendo 5 de ellos tratados con levodopa y uno con pramipexol.
El grupo de sanos estuvo conformado por siete sujetos sanos, 2 hombres y 5 mujeres, de 45.9 ± 5.2 años. Para este grupo se consideraron como criterios de exclusión enfermedades cardiovasculares crónicas. Es importante mencionar que todos los participantes del protocolo firmaron una carta de consentimiento informado.
Durante la realización del protocolo clínico se adquirieron las señales de ECG y PPG con el sistema BIOPAC MP150® configurado a una frecuencia de muestreo de 500 Hz. Para la señal de PPG se colocó el sensor en el dedo índice izquierdo, mientras que para el ECG se utilizó la configuración de electrodos CM5, la cual consiste en colocar el electrodo positivo en el quinto espacio intercostal izquierdo, el negativo en el manubrio del esternón y el electrodo de referencia en la apófisis del esternón.
El protocolo de adquisición fue realizado entre las 10:00 y las 13:00 horas. Al grupo EP se le pidió tomar su medicamento con normalidad. El protocolo estuvo constituido por las siguientes etapas:
› Reposo: En esta etapa el sujeto permanece en posición supina durante 5 minutos.
› Post Cambio de Postura (Post-CP): Consiste en un cambio de postura rápido, para el cual se tomó en cuenta las habilidades motoras del paciente, finalizando con el sujeto de pie durante 5 minutos.
› Respiración Controlada (RC): Esta etapa está conformada por 4 minutos realizando ciclos respiratorios a una frecuencia de 6 respiraciones por minuto (rpm), seguidos de un minuto de reposo (Post-RC).
› Hiperventilación (Hip.): En esta etapa el sujeto respira a una frecuencia de 35 rpm durante un minuto y posteriormente hay un periodo de reposo de cinco minutos, al cual llamaremos Post-Hip.
En la Figura 1 se observa la secuencia de las maniobras del protocolo clínico diseñado para evaluar la presencia de disautonomía.
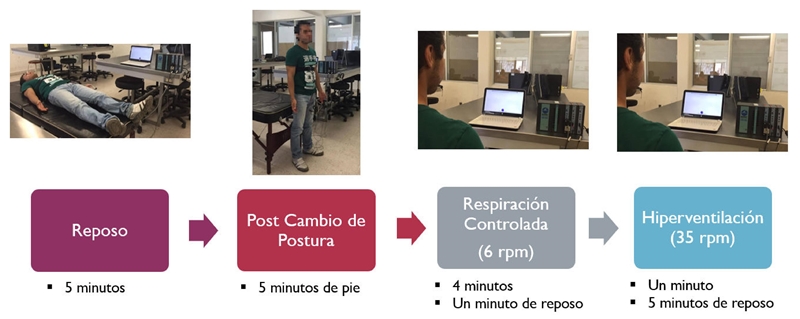
Figura 1 Protocolo clínico diseñado con las maniobras de: reposo, cambio de postura, respiración controlada e hiperventilación.
Para indicar al paciente los tiempos de inhalación y exhalación en las etapas de RC e Hip., se utilizó una interfaz diseñada en Scratch 2®, la cual consiste en una pelota que sube y baja, indicando inhalación y exhalación respectivamente, variando la velocidad del movimiento según la frecuencia respiratoria.
Procesamiento de las señales
Índices de la Variabilidad de la Frecuencia Cardiaca
El procesamiento de las señales fue implementado en el software MATLAB®. La detección de los picos R en la señal de ECG se realizó utilizando el algoritmo de Pan-Tompkins [11], el cual consiste en una serie de filtros (derivativo e integrativo) para resaltar el complejo QRS y después se realiza la búsqueda de picos R con ayuda de umbrales de tiempo y amplitud. Una vez ubicados los picos R se calculó la diferencia en tiempo entre ellos, obteniéndose así la señal de intervalos RR, el cual posteriormente fue inspeccionado de forma visual para eliminar artefactos. A partir de la señal de intervalos RR se calculó la raíz cuadrada de la media del cuadrado de las diferencias sucesivas de intervalos RR (RMSSD), utilizando la ecuación (1), índice que proporciona información a corto plazo de la VFC.
Adicionalmente, se evaluaron las gráficas de Poincaré, las cuales son una representación visual de los latidos cardiacos y se obtienen al graficar en el eje de las x el intervalo RRn y en el eje de las y el intervalo RRn+1. Con estas gráficas se obtuvieron los índices SD1, SD2 y su relación, (SD1/SD2), calculados a partir de una elipse sobrepuesta en la distribución de puntos, cuyo centro coincide con el centro de puntos y corresponde al promedio de la longitud de la señal de intervalos RR, en donde SD1 es igual a la desviación estándar de las distancias de puntos en el eje transversal de la elipse, relacionándose de esta forma con la variabilidad cardiaca a corto plazo, mientras que SD2 se calcula como la desviación estándar de los puntos en el eje longitudinal de la elipse y se relaciona con la variabilidad cardiaca a largo plazo [12]. En la figura 2 se ilustra el procedimiento realizado para calcular los índices de las gráficas de Poincaré.
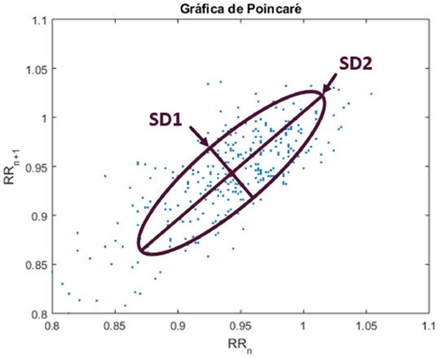
Figura 2 Cálculo de los índices SD1 y SD2 obtenidos como la desviación estándar de los ejes en la distribución de puntos de las gráficas de Poincaré.
Con la finalidad de obtener índices en el dominio de la frecuencia, el intervalo RR fue remuestreado a 1 Hz y se calculó su espectro de densidad de potencia mediante la Transformada Rápida de Fourier (FFT). Posteriormente se determinó la potencia total (TP, de 0 a 0.5 Hz), la potencia en el rango de bajas frecuencias (LF, de 0.04 a 0.15 Hz), la potencia en altas frecuencias (HF, de 0.15 a 0.4 Hz), LF y HF normalizadas y la relación entre LF/HF, como índice simpato-vagal.
Entropía aproximada
La señal de intervalos RR fue analizada por medio de la EA, el cálculo de la EA requiere tres parámetros fundamentales: N que representa la longitud de la señal, m indica la longitud del segmento a comparar y r que representa el criterio de similitud.
En la literatura se recomienda utilizar un valor de m=2 ya que la VFC presenta una dinámica lenta, mientras que el valor utilizado para r es entre 0.1-0.2 veces la desviación estándar (std) de la señal, ya que se ha reportado que este rango de valores para el parámetro r brinda resultados aceptables en aplicaciones clínicas donde la señal puede contener ruido, como en el caso de la señal de la VFC [13]. Los valores seleccionados para este análisis son m=2 y r=0.2 ∗ std.
Para el cálculo de la EA la señal de intervalos RR es dividida en segmentos de tamaño m, estos segmentos son comparados muestra a muestra para verificar que se cumpla el criterio de similitud, la diferencia entre cada uno de los segmentos debe de ser menor al valor de r, como se muestra en la ecuación (2), para ser considerados como patrones similares.
Posteriormente, se define a P m como el conjunto de segmentos de tamaño m donde n im (r) corresponde al número de segmentos en P m que son similares al segmento P m (i), dado el criterio de similitud. Se define a C im (r) como se muestra en la ecuación (3) y C m (r) se define como la media de C im (r), donde C m (r) indica la prevalencia de segmentos repetidos de tamaño m en la señal.
C im (r) nos dará una proporción de cuántos patrones comparten el criterio de similitud. Finalmente, la EA se obtiene a través de la siguiente ecuación:
En las etapas del protocolo de adquisición de 4-5 minutos de duración la EA se evaluó dividiendo la señal de intervalos RR en ventanas de 2 minutos traslapadas 1 minuto y se calculó el promedio de la EA de cada ventana, de forma que este promedio representa la EA de la maniobra con duración 4-5 minutos.
Sensibilidad del Barorreflejo
La sensibilidad del barorreflejo se evaluó de forma indirecta a través del uso de la señal de tiempo de tránsito de pulso (PTT), obtenida como la diferencia en tiempo entre el pico más alto de la señal de PPG y el pico R en la señal de ECG, anterior a éste. Esta señal fue utilizada como un subrogado de la presión sanguínea, ya que representa el tiempo que tarda la sangre en viajar del corazón a cualquier punto de la periferia. El PTT fue remuestreado a 1 Hz y se calculó su espectro en frecuencia, a través del cual se obtuvieron los índices en bajas y altas frecuencias: LF PTT y HF PTT .
Una forma de analizar la relación entre los cambios de ritmo cardiaco y presión sanguínea es evaluando la sensibilidad del barorreflejo, la cual fue calculada de forma subrogada utilizando la información de la señal de PTT, a través del índice α, considerando el contenido en frecuencia de la señal de intervalos RR y la señal de PTT. El índice α se obtuvo como la relación mostrada en la ecuación (4), en LF y HF, α LF y α HF , donde LF RR y HF RR es la potencia en bajas y altas frecuencias del intervalo RR, y tomando en cuenta una coherencia mayor a 0.5 entre ambas señales [14,15].
Análisis Estadístico
La normalidad de los datos se evaluó con la prueba Lilliefors, dicha prueba mostró que los datos provienen de una distribución normal. Las diferencias entre la etapa de Reposo y las maniobras adicionales fueron determinadas a partir de una prueba T de Student dependiente. Las diferencias entre las maniobras de los sujetos con Parkinson y el grupo de sujetos sanos fueron determinadas con una prueba T de Student de dos muestras independientes. Se consideraron diferencias estadísticamente significativas aquellas con valor p<0.05.
Resultados y discusión
La Figura 3 muestra el comportamiento de la frecuencia cardiaca (FC) y PTT a lo largo del protocolo clínico, en donde se observa que los pacientes con EP mostraron un aumento significativo de FC durante la maniobra de Post-CP con respecto al Reposo. Las diferencias en FC entre sanos y pacientes con EP fueron significativas en las maniobras de Reposo, Post-RC, Hip. y Post-Hip., donde siempre la FC de los pacientes de EP fue menor, lo cual sugiere un comportamiento cardiovascular diferente entre nuestras poblaciones de estudio.

* Prueba t-Student pareada, vs maniobra de Reposo, p<0.05.
ꝉ Prueba t-Student independiente, sanos vs pacientes con EP, p<0.05
Figura 3 Comportamiento de las señales de FC y PTT durante las maniobras de Reposo, Post-CP, RC, Post-RC, Hip. y Post- Hip. en pacientes con Parkinson y sujetos sanos.
En cuanto al PTT, se observó una disminución signif icativa en los pacientes con EP durante las maniobras de Post-CP, RC y Post-RC con respecto al Reposo. Además, los pacientes con Parkinson presentaron mayor PTT que los sujetos sanos durante la etapa de Reposo, el cual disminuyó significativamente en la maniobra Post-CP, caso contrario a los sujetos sanos en dónde no se observaron cambios perceptibles, lo que sugiere que el SNA de los pacientes con EP tiene una respuesta lenta a la maniobra ortostática.
En la Tabla 1 se muestran los índices obtenidos a partir de la señal de intervalos RR. El índice RMSSD, el cual es un indicador de la actividad vagal, mostró un aumento significativo en sujetos sanos en la etapa RC con respecto al Reposo, lo cual es un resultado esperado debido a la fuerte influencia vagal durante esta maniobra. Sin embargo, dicho cambio no se observa en los sujetos con EP, lo que sugiere una alteración en la vía parasimpática de los pacientes con EP. Por otro lado, los pacientes con EP mostraron una disminución de RMSSD durante la maniobra de Post-CP.
Tabla 1: Índices de la VFC en el dominio del tiempo y la frecuencia

* Prueba t-Student pareada, vs maniobra de Reposo, p<0.05.
ꝉ Prueba t-Student independiente, sanos vs pacientes con Parkinson, p<0.05.
Respecto a los índices obtenidos a partir de las gráficas de Poincaré, SD1 aumentó durante RC con respecto al Reposo en los sujetos sanos, mientras que los pacientes con EP mostraron una disminución durante la maniobra Post-CP con respecto al Reposo. Estos resultados concuerdan con el índice RMSSD, ambos índices han sido reportados como indicadores de la actividad parasimpática [12,16].
El índice SD2 aumentó significativamente en los sujetos sanos durante las maniobras Post-CP, RC y Post-Hip. con respecto al Reposo; también se observaron diferencias entre las poblaciones en las maniobras de Post-CP y RC, en donde SD2 fue mayor en los sujetos sanos. SD2 se ha relacionado con la modulación simpática [12], y el comportamiento diferente entre sanos y pacientes con EP sugiere una respuesta simpática alterada en los sujetos con EP principalmente durante las maniobras Post-CP y RC.
En cuanto al índice SD1/SD2 los pacientes sanos presentaron una disminución en las maniobras Post-CP, Post-RC y Post-Hip. con respecto al Reposo.
En la comparación entre sujetos sanos y pacientes con EP no se encontraron diferencias significativas, sin embargo se observó que los pacientes con EP mostraron valores mayores durante todo el protocolo.
En la Figura 4 se muestra el comportamiento de dos pacientes con edades similares de los grupos EP y sanos durante las etapas de Reposo y Post-CP, donde se puede observar como la distribución de puntos es modificada después del cambio de postura de forma importante en el sujeto con EP, mientras que en el sujeto sano el cambio es menos abrupto y gradual.
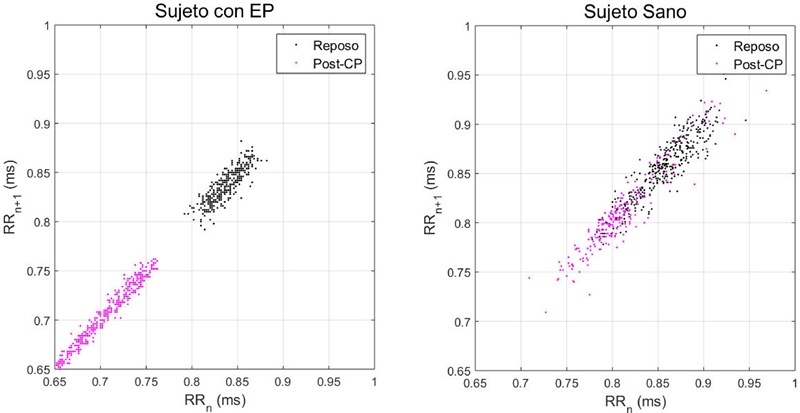
Figura 4 Gráficas de Poincaré de un sujeto con Parkinson y un sujeto sano durante las maniobras de Reposo (en negro) y Post-CP (en rosa).
El análisis de la VFC en el dominio de la frecuencia mostró menor TP en los pacientes con EP durante Post-CP y RC con respecto al Reposo. En la comparación entre las poblaciones, el grupo de sujetos sanos presento mayor TP en RC con respecto a los pacientes con EP. El índice LF resulto ser mayor durante RC con respecto al Reposo en sujetos sanos, este aumento en LF es debido en parte a la frecuencia respiratoria establecida (6rpm), cuya frecuencia (0.1 Hz) se encuentra dentro de la banda LF, sin embargo este aumento en LF no se observó en pacientes con EP. LF disminuyó durante Post-CP con respecto al Reposo en el grupo EP, lo cual puede sugerir una atenuación en la modulación simpática, esta hipótesis coincide con la diferencia entre sanos y sujetos con EP durante la misma maniobra, donde los pacientes con EP mostraron una disminución significativa. Durante la RC los sujetos sanos presentaron valores significativamente mayores en LF en comparación con los sujetos con EP.
Los resultados del índice HF mostraron valores significativamente menores durante las maniobras Post-CP y RC con respecto al Reposo en los pacientes con Parkinson, lo cual puede indicar deficiencia en el tono cardiovagal, el cambio encontrado durante Post-CP coincide con los índices RMSSD y SD1, soportando el comportamiento alterado del SNA en pacientes con EP.
El índice LF/HF, el cual refleja el balance simpato-vagal, presentó diferencias significativas tanto en el grupo EP como en el grupo de sujetos sanos durante la maniobra RC con respecto a la etapa de Reposo. A pesar de no encontrarse diferencias significativas en LF/HF entre las poblaciones, el cambio entre etapa de Reposo y Post-CP fue menor en los pacientes con EP que el cambio presente en sujetos sanos, lo cual puede sugerir que el balance entre la rama simpática y vagal se encuentra atenuado en los pacientes con EP.
La Figura 5 muestra los resultados de LF PTT y HF PTT , donde los sujetos sanos presentaron un aumento tanto en LF PTT como en HFPTT durante la maniobra de Post-Hip. con respecto al Reposo. Particularmente, durante Post-CP se encontró un aumento significativo de ambos índices, LF PTT y HF PTT , en los pacientes con EP con respecto a los sujetos sanos, este resultado soporta el comportamiento de los índices obtenidos con la señal de intervalos RR y sugiere una alteración en la respuesta del SNA por parte de los pacientes con EP, coincidiendo con resultados previos [6,17]. Además, se observó una diferencia significativa entre sanos y pacientes con EP en Post-Hip. en el caso de LF PTT , y HF PTT fue significativamente mayor en RC y Post-Hip. en sujetos con EP en comparación con los sanos.
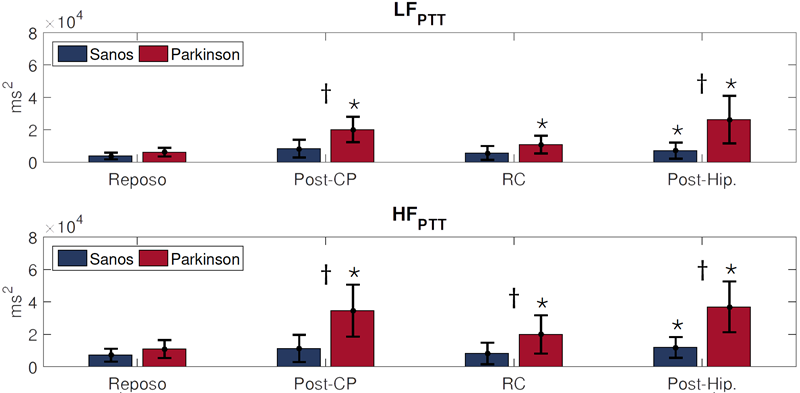
* Prueba t-Student pareada, vs maniobra de Reposo, p<0-05
ꝉ Prueba t-Student independiente, sanos vs pacientes con Parkinson, p<0.05
Figura 5 Comportamiento de LFPTT y HFPTT durante las maniobras de Reposo, Post-CP, RC y Post-Hip.en pacientes con Parkinson y sujetos sanos.
El comportamiento de la EA, calculada con m=2 y r=0.2 ∗ std, se muestra en la Figura 6, los sujetos sanos presentaron una disminución significativa en las maniobras CP, RC, Post-RC y Post-Hip. con respecto a la maniobra de Reposo. A pesar de no encontrar diferencias significativas en la etapa de Reposo, es posible apreciar que los enfermos de EP mostraron valores menores de EA, lo cual coincide con estudios previos, donde debido a procesos patológicos la señal de VFC disminuye su complejidad [18]. En la maniobra de RC se observó una diferencia significativa entre sanos y sujetos con EP, lo cual evidencía la dificultad de adaptación por parte de los pacientes de EP ante la maniobra. Durante la maniobra de RC la señal de intervalos RR de los sujetos sanos se vuelve más regular debido a la frecuencia respiratoria constante y al efecto del fenómeno de arritmia sinusal respiratoria, mientras que los pacientes con EP no muestran este comportamiento.

* Prueba t-Student pareada, vs maniobra de Reposo, p<0-05
◦ Prueba t-Student pareada, vs maniobra de Post-CP, p<0-05
ⱡ Prueba t-Student pareada, vs maniobra de Hip., p<0.05
ꝉ Prueba t-Student independiente, sanos vs pacientes con Parkinson, p<0.05
Figura 6 Comportamiento de la Entropía Aproximada en las maniobras de Reposo, Post-CP, RC, Post-RC, Hip. y Post-Hip. en sujetos sanos y pacientes con Parkinson.
La Figura 7 muestra los resultados obtenidos al calcular la sensibilidad del barorreflejo de forma indirecta, utilizando la relación entre la señal de intervalos RR y el PTT a través del índice α, donde se encontraron diferencias significativas, tanto en αLF como en αHF , en el grupo EP durante las etapas de Post-CP, RC y Post-Hip. con respecto a la maniobra de Reposo. Además, el índice αLF y αHF mostró valores significativamente menores en pacientes de EP con respecto a los sanos en las maniobras de Post-CP, RC y Post-Hip., lo cual puede indicar una respuesta atenuada del SNA en el control del barorreflejo durante las diferentes maniobras. Este comportamiento puede observarse incluso desde la etapa de Reposo, donde los pacientes de EP presentan valores menores del índice α.
Conclusiones
En este trabajo se evaluaron índices de la VFC, PTT y la sensibilidad del baroreflejo, además de considerar índices no lineales como la EA, para evaluar la respuesta del SNA de sujetos con EP ante ciertas maniobras que estimulan el funcionamiento de las ramas simpática y vagal del SNA. A partir de los índices evaluados se observa que los pacientes con EP presentan alteraciones en la respuesta simpática y vagal como resultado a los estímulos propuestos. Los cambios más relevantes ocurrieron en las maniobras de Post-CP y RC considerando los índices RMSSD, SD1, SD2, LFRR y HFRR, LFPTT , HFPTT , EA y la evaluación del índice α, relacionado con la sensibilidad del barorreflejo.
Durante el periodo Post-CP fue posible observar que los sujetos con EP presentan una alteración simpática en la respuesta a esta maniobra, como lo muestran las gráficas de Poincaré y los índices en el dominio de la frecuencia. En el caso de la maniobra de RC, la mayoría de los índices calculados mostraron una alteración en la modulación vagal incluyendo el índice RMSSD y la EA. El índice que muestra una alteración durante el protocolo completo es el índice α, siendo significativamente menor en el grupo EP con respecto a los sujetos sanos, lo cual sugiere un desequilibrio en la respuesta del barorreflejo.
Es importante mencionar que para este análisis se consideró un grupo control de sujetos sanos de una población adulta ya que en algunos estudios relacionados se compara con un grupo control de sujetos jóvenes [6] donde pueden influir los cambios en VFC afectados por la edad. Adicionalmente, debe considerarse que los sujetos con EP reciben tratamiento, la mayoría de ellos con levodopa y ha sido reportado que este fármaco puede afectar la modulación simpática [19]. Por lo tanto, sería importante que como trabajo futuro se estudiaran sujetos que no son tratados con este fármaco en particular, además de considerar una población mayor tratando de incluir pacientes con diferente grado de la enfermedad con el objetivo de tratar de determinar grados de disautonomía.











 nueva página del texto (beta)
nueva página del texto (beta)



