Introducción
En esencia, la Ingeniería de Tejidos se fundamenta en utilizar una combinación de células, señales moleculares y andamios porosos para cultivar tejidos in vitro [1]. La Ingeniería de Tejidos y la Medicina Regenerativa buscan desarrollar biomateriales que permitan, no solo el restablecimiento estructural, sino también que fomenten la regeneración funcional para evitar reemplazar órganos o tejidos[2]. Los andamios porosos para Ingeniería de Tejidos juegan un papel central al imitar la porosidad, el tamaño de poro y la interconectividad de los tejidos, para proporcionar un ambiente adecuado para la adhesión, proliferación, diferenciación celular y para mimetizar la función de los tejidos humanos nativos[3]. Incluso, éstos pueden ser fabricados de tal manera que provean guías bioquímicas y/o biomecánicas que mimeticen la matriz extracelular de tejidos humanos[3].
Algunos de los esfuerzos iniciales de la Ingeniería de Tejidos, estuvieron enfocados al uso de polímeros sintéticos como redes químicamente entrecruzadas (hidrogeles) [2], poliuretanos[4], poli(ácido láctico) [5], poli(ácido glicólico) [5], poli(glicerol sebacato) [6], entre otros. Este tipo de materiales, permiten formar andamios con características mecánicas de formas muy bien controladas. Sin embargo, éstos materiales carecen de las señales químicas, mecánicas y biológicas que posee la matriz extracelular natural. Aunque éstas señales pueden ser añadidas de manera externa para mejorar las características del andamio obtenido, parecen ser insuficientes para producir tejidos similares a los nativos[7].
Una de las estrategias que se ha empleado con éxito, incluye producir por medio de la tecnología recombinante diversas proteínas fibrilares de la matriz extracelular (ECM), tales como colágena tipo I y II, queratina, elastina y fibrina. De estas proteínas fibrilares, específicamente los diversos tipos de colágena obtenidos por la tecnología recombinante, se han usado en la fabricación de andamios, debido a su capacidad de ser producidas y modificadas con técnicas moleculares y por su biocompatibilidad[8, 9, 10]. Por lo anterior, se están convirtiendo en buenos candidatos base de materiales avanzados de gran demanda en el área biomédica[10]. Fueron los resultados reportados en el año 2000 por Ruggiero et al. usando plantas transgénicas de tabaco, donde se logró la producción exitosa de colágena recombinante, los que abrieron las puertas para la explotación de esta tecnología[11]. Sin embargo, fue hasta 2007 que Neubauer et al. presentaron un sistema que permitía su producción en cantidades aprovechables a nivel comercial de colágeno recombinante, siendo ésta investigación la que abrió las puertas a los laboratorios de materiales enfocados a la ingeniería de tejidos[12]. Por ejemplo en 2004, la compañía Fibrogen®, comenzó a distribuir comercialmente colágena recombinante potencialmente menos inmunogénica pues es idéntica a la nativa de humano, pero con características estables entre lotes de producción[13].
Debido a que este campo promete mejoras en la biocompatibilidad, biodegradabilidad y simulación de las condiciones normales de los tejidos generados al usar andamios basados en colágenas recombinantes, el presente artículo se enfoca en los recientes avances en la expresión recombinante y el uso de colágenas recombinantes humanas en Ingeniería de Tejidos.
Colágena
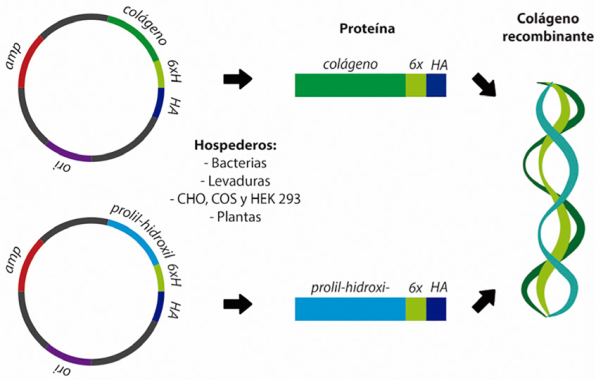
Se han descrito hasta el momento, 28 tipos de colágena y todas están formadas por tres cadenas de aminoácidos [14]. Cada una de éstas cadenas está formada por una hélice de poliprolina tipo II, que gira hacia la izquierda y que forman una superestructura de triple hélice orientada en la dirección de giro hacia la derecha. A un nivel molecular, cada cadena está formada de tres aminoácidos (GXY) en los cuales, la glicina siempre ocupa la primera posición. Las otras dos posiciones se encuentran ocupadas por el aminoácido prolina. En la posición Y, la prolina es transformada en 4-hidroxiprolina, lo cual repercute en la estabilidad de la molécula y es necesaria para soportar las temperaturas corporales sin degradarse[15]. Partiendo de este principio para obtener la expresión del colágena, se realizaron algunas modificaciones de la estructura secundaria que permitieron el entrecruzamiento y la estabilidad de la triple hélice para obtener la colágena recombinante. Por lo tanto, para este procedimiento fue necesario mimetizar la ruta biosintética que confiere la estabilidad a la molécula. En la mayoría de los sistemas esto incluye la coexpresión de 4-hidroxilasa prolina (P4H). En la Figura 1, se ilustra de manera esquemática este proceso.
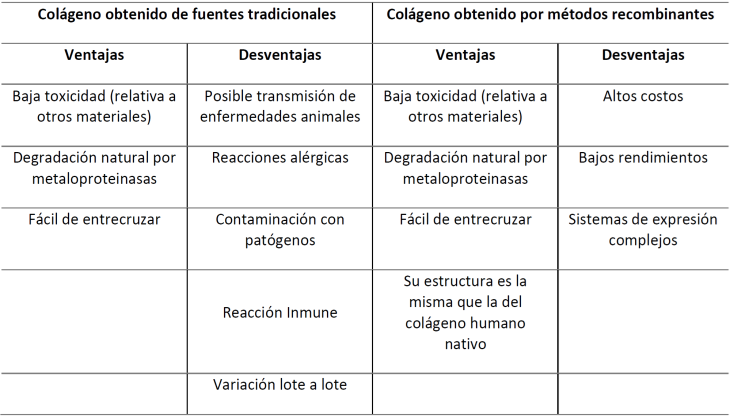
La colágena ha sido utilizada en múltiples aplicaciones médicas, farmacéuticas y productos de consumo humano por más de 100 años[16]. Uno de los mayores retos de un biomaterial es su biocompatibilidad. En el caso de las proteínas recombinantes ésta biocompatibilidad ha sido explorada en muchas ocasiones en estudios de toxicidad, inmunogenicidad y biodegradación. Por ejemplo, la biocompatibilidad de la colágena ha sido ampliamente comprobada y es muy conocida[17].
La inmunogenicidad de la colágena ha sido revisada en estudios diversos como el publicado por Ramshaw et al. [16]. En general, se puede afirmar que las colágenas obtenidas por métodos recombinantes presentan buena biocompatibilidad, permiten la proliferación celular y no interfieren con el comportamiento celular. Aun así, hay puntos a favor y en contra de las colágenas de fuentes tradicionales y las colágenas recombinantes humanas, los cuales se resumen en la Tabla 1.
Sistemas de expresión para obtener colágena recombinante
La colágena utilizada en aplicaciones biomédicas y de Ingeniería de Tejidos, es principalmente colágena tipo I que se extrae de forma abundante de huesos de bovino. Sin embargo, la colágena que se obtiene por métodos recombinantes, ofrece una serie de ventajas como la disponibilidad y la calidad controlada del producto, la ausencia de contaminantes de animales, la potencialidad de producir los tres tipos de colágena principales y la posibilidad de seleccionar dominios específicos de expresión o la producción de moléculas quiméricas.
Los sistemas que se utilizan para la expresión de colágena recombinante incluye células procariotas y células eucariotas. A continuación, se describen algunas características y retos del uso de estos dos sistemas.
Sistemas de expresión de colágena recombinante en procariotas
La bacteria Escherichia coli es la más utilizada para la expresión de proteínas, incluyendo las de la matriz extracelular como la colágena. No obstante, hay algunos problemas para este sistema de expresión, en particular para colágenas provenientes de mamíferos. En principio, se requiere la coexpresión de la enzima P4H la cual es muy problemática en bacterias. Esto ha sido resuelto al usar una cepa con un citosol particularmente oxidante[18]. Sin embargo, la producción de éstas proteínas generalmente lleva a la formación de cuerpos de inclusión no deseados en las bacterias o la producción de su versión desnaturalizada[19].
Se han publicado algunos trabajos en donde se mejora esta tecnología, sobre todo para producir colágeno humano. Entre las estrategias empleadas podemos mencionar el aumento del crecimiento y expresión por medio de variaciones del CO2 [20], aumentando la presión para mejorar la transferencia de oxígeno y la optimización de la relación carbono/nitrógeno en el cultivo[21].
Sin embargo, en ninguno de estos casos se analizó si la cantidad de proteína obtenida correspondió a colágena o a su versión desnaturalizada.
Con base en resultados obtenidos en Pichia pastoris se ha demostrado que el ensamblaje de colágenas de humano tipo I y III depende de la eficiencia de trimerización y que, por medio de la coexpresión de una secuencia de 29 aminoácidos que se localiza normalmente en el C- terminal de la secuencia de trimerización de la fibritina del bacteriófago T4, se pueden generar entre 2 y media a tres veces más colágeno[22].
Estos estudios coinciden en que la hidroxiprolina endógena en la cadena de colágena es necesaria para la estabilidad de la triple hélice. Estos materiales han sido analizados de manera extensiva por medio de técnicas de espectroscopía de dicroísmo circular (DC), dispersión dinámica de luz (DLS) y calorimetría diferencial de barrido (DSC) para estudiar su estructura y estabilidad. En todos los casos, se ha encontrado que estas colágenas presentan una transición térmica alrededor de los 36 - 37 ºC[23, 24, 25]. Estas características hacen que las proteínas sean excelentes candidatos para su uso como biomateriales en andamios para Ingeniería de Tejidos.
Sistemas de expresión de colágena recombinante en eucariotas
La falta de los sistemas de procesamiento post-traduccional en procariotas ha favorecido el desarrollo de los sistemas en células eucariotas que expresen colágena de forma recombinante. Sin embargo, como en todos los casos, cada uno de los sistemas tiene sus ventajas y desventajas. En el caso de algunas líneas celulares eucariotas como CHO (células de ovario de hámster chino), COS (células tipo fibroblasto derivadas de riñón de mono), HEK 293 (células de riñón de embrión humano) y HT1080 (células de fibrosarcoma de tejido conectivo humano), se tiene la ventaja de contar con toda la maquinaria post-transduccional de producción de colágena. Sin embargo, la desventaja suele ser el bajo rendimiento de producción, que puede ir de 0.1 a 0.5 mgL-1 [26]. Por otro lado, en el caso de las células HEK 293, se pueden alcanzar rendimientos de 80 mgL-1. Por lo que, aun cuando estos sistemas ofrecen una forma sencilla de producir colágena estable, los rendimientos no permiten su viabilidad comercial.
Debido a la limitación de la coexpresión de P4H en células de insectos y los bajos rendimientos de las células de mamífero, los sistemas basados en levaduras han sido explorados como una opción. Estos sistemas han sido optimizados para expresar cuando menos tres genes, uno para colágena y dos para P4H. Varios sistemas han sido diseñados basándose en Saccharomyces spp. integrando los tres genes[24, 27]. La producción de colágena tipo I de humano en la levadura Saccharomyces cerevisiae, reveló que los extremo N- o C- del propéptido de colágeno (procolágeno) así como la ausencia de hidroxilación en prolina, no son necesarios para la formación de la triple hélice [28]£. Otros sistemas se han basado en P. pastoris para obtener mejores rendimientos de colágenas no modificadas en sistemas recombinantes. Baez et al. en 2005, lograron mejorar los rendimientos de éstos sistemas basados en P. pastoris hasta 1.5 gL -1 para cadenas completas de colágena y 14 gL -1 para fragmentos definidos[22, 29].
La adición de P4H en microorganismos genéticamente modificados como levaduras P. pastoris, S. cerevisiae, Hansenula polymorpha y bacterias E. coli, Bacillus brevis y en células de insectos como en plantas de tabaco, para la producción de colágena recombinante de humano probó ser una tecnología escalable y rentable en la síntesis de colágena hidroxilada, con estabilidad térmica similar a colágenas nativas para su uso en muchas aplicaciones médicas como la Ingeniería de Tejidos[29-34]. Adicionalmente, se han empleado animales o plantas transgénicas en los cuales se introduce el DNA foráneo utilizando técnicas convencionales como microinyección del DNA deseado directamente en un óvulo[35]. Asimismo, un número de proteínas bacterianas similares a la colágena con Gly como cada tercer residuo y un alto contenido de Pro, como los péptidos V-CL-CL de Streptococcus pyogenes, se han observado capaces de formar estructuras de triple hélice estables a pesar de la ausencia de hidroxiprolina, y tienen el potencial de formar estructuras fibrilares, útiles para biomateriales y aplicaciones de ingeniería de tejidos[36].
Varias especies de animales transgénicos son capaces de producir proteínas recombinantes en leche, sangre, clara de huevo, semen, orina y glándulas de seda [37]. Un gran número de especies de mamífero han sido utilizadas para este fin incluyendo cerdos, cabras, vacas, conejos y ratones. Cada uno de ellos tiene ventajas y desventajas. Sin embargo, existen pocas publicaciones sobre la producción de colágenas expresadas en animales transgénicos. La expresión de colágena de humano en leche de ratón tuvo como resultado la producción de pro-colágeno sin hidroxilar, el cual era térmicamente inestable. Este resultado se atribuyó a la baja disponibilidad de P4H endógeno[38]. Con la introducción de genes que expresan el P4H, se logró obtener rendimientos de 0.2 gL -1. Sin embargo, Toman et al. lograron mejorar ésta producción hasta rendimientos de 8 gL -1 pero con un peso molecular menor a 37 kDa lo cual indica una menor longitud y estabilidad[39].
En el caso de las plantas transgénicas, se tiene un largo historial de su uso como biorreactores para productos farmacéuticos (p. ej. insulina, lactoferrina y anticuerpos), vacunas y enzimas de procesamiento (tripsina), dado que estos sistemas ofrecen una opción económica y práctica.
El primer modelo reportado para la producción de colágena en plantas fue publicado por Ruggiero et al. en el año 2000. Estas plantas fueron capaces de producir colágena humana tipo III, de triple hélice y colágena tipo I en forma de homotrímero[16].
Cabe mencionar que aun cuando éstos sistemas fueron de importancia al demostrar el concepto, la hidroxilación de la prolina en la posición Y estuvo ausente. Esto demostró que la expresión de P4H también es necesaria en plantas para obtener colágena funcional. Sin embargo, la falta de hidroxilación en moléculas de colágena recombinantes expresadas en plantas de tabaco, mostraron una mayor flexibilidad, así como una temperatura de fusión reducida en comparación con homotrímeros y heterotrímeros nativos, mientras que la distribución de aminoácidos cargados se mantuvo sin cambios. Asimismo, se demostró que la ausencia de residuos de hidroxiprolina no impide el plegamiento correcto de colágena recombinante[40]. La cebada ha sido utilizada como sistema de expresión de colágena tipo I de cadena completa utilizando tres promotores (ubiquitina de maíz, glutenina específica y alfa-amilasa). Sin embargo, los mejores rendimientos obtenidos usando el promotor de glutenina fueron de 120 mgkg -1 por semilla, lo cual es relativamente bajo. Stein et al., retomaron el trabajo con plantas de tabaco agregando la expresión de P4H y de procolágeno-lisina 4-dioxigenasa, lo cual produjo rendimientos de aproximadamente 20 gL -1 [31]. La colágena recombinante carente de hidroxiprolina expresada en plantas transgénicas, tiene una adherencia más débil a plaquetas que en el colágeno completamente hidroxilado, ofreciendo nuevas aplicaciones selectivas para aplicaciones biomédicas en Ingeniería de Tejidos[41].
Uso de la colágena recombinante en ingeniería de tejidos
Como hemos mencionado, la colágena se puede producir en una gran variedad de sistemas que difieren en facilidad, reproducibilidad, relación costo-eficiencia y rendimiento. Hemos descrito una gama de sistemas de expresión de colágenas de origen humano en bacterias, levaduras y células de mamífero, insecto y vegetales como el tabaco y el maíz (recombinantes) y colágenas de origen bacteriano (colágena no animal), como materiales de uso potencial en biomedicina[29-32, 42].
Las colágenas recombinantes de humano son una base eficiente para la formación de andamios útiles en la reparación ósea, en especial cuando se combina con una proteína morfogenética ósea recombinante en un tamaño y modo de presentación poroso, similar a una esponja. Cuando se presentan como una membrana, película o gel, pueden servir como base para la ingeniería de epitelios como piel, cartílago y ligamento periodontal, de acuerdo a los requisitos específicos de la aplicación elegida.
Durante la última década, en conjunto con el desarrollo de tecnologías para la producción a gran escala de colágenas recombinantes de humano, se ha hecho un progreso significativo en la evaluación de estas colágenas en la Ingeniería de Tejidos. Lo que ha traído como resultado, el diseño racional y a medida de proteínas similares a la colágena de humano para desarrollar biomateriales inteligentes, que mejoren la calidad de los tejidos producidos en el laboratorio.
Estudios como los realizados por Ito et al. [9] y Hu et al. [8], aportaron conocimiento sobre los dominios relevantes de la estructura de la colágena recombinante de humano, para favorecer la formación de cartílago y piel, respectivamente. La generación de proteínas similares a la colágena, como el dominio D4 de colágena de humano II, ha permitido fabricar andamios con cualidades superiores para ingeniería de cartílago[9]. Simultáneamente, Dravida et al. [46], crearon una lámina de 2 mm de colágena recombinante de humano entrecruzada para el desarrollo de tejido limbal/corneal de utilidad clínica en enfermedades de córnea. Mientras que Liu et al. y Griffith et al., han fabricado con éxito hidrogeles transparentes y sólidos como sustitutos de la córnea a partir de colágenas recombinantes de humano tipo III y tipo I, con diferentes procesos de reticulación, los cuales mostraron retención de claridad óptica, junto con la regeneración de las células de la córnea, los nervios y la película lagrimal, con potencial uso clínico[47, 48]. Por otra parte, Wang et al. [49] emplearon colágena recombinante de humano sintetizado en E. coli y combinado con hidroxiapatita/poli-ácido láctico para el desarrollo de hueso, el cual mostró algunas de las características del hueso natural tanto en el componente principal como en microestructura, resultando prometedor para ingeniería de tejido óseo. Pruebas in vitro con células pre-osteoblastos, demuestran una buena interacción célula-material sobre matrices preparadas con proteínas derivadas de colágena recombinante de humano de tipo I en presencia de Mg2+, abriendo la posibilidad de diseñar, a través de proceso de biomineralización, matrices híbridas avanzadas para la regeneración ósea[50]. Pulkkinen et al. [51], reportan la funcionalidad y la biocompatibilidad de la colágena tipo II recombinante de humano para fabricación de cartílago. Asimismo, el grupo de Wu et al. [52], reevaluaron el uso del colágena recombinante de humano e hidroxiapatita/poli-ácido láctico cargado con Proteína Morfogenética 2 (BMP-2) recombinante de humano, consiguiendo la mineralización y formación de hueso, que tiempo más tarde sería evaluado con células troncales mesenquimales modificadas genéticamente para la expresión de BMP-2 de humano, evidenciando un incremento en la formación de hueso[53]. Posteriormente, Zhu et al. [54], incursionaron en la ingeniería de tejido vascular empleando colágena recombinante de humano en E. coli combinada con quitosano en andamios tubulares, consiguiendo demostrar su biocompatibilidad y potencial uso en regeneración vascular.
Recientemente, Zhang et al. fabricaron andamios de péptidos de colágena recombinante de humano por medio de liofilización y estudiaron el efecto del tamaño de poro en el cultivo de células endoteliales de cordón umbilical de humano. Este estudio demostró lo importante de la porosidad de los materiales en la viabilidad celular[55].
La colágena tipo I obtenida de Pichia ha sido utilizada para obtener membranas para regeneración de tejidos. Asimismo, la colágena tipo II se utilizó para recubrir telas de Dacron® (DuPont, Unión Europea) para reducir la trombogénesis[56]. En otro estudio, se produjeron andamios porosos que liberaban Factor de Crecimiento Endotelial Vascular (VEGF), para generar sustitutos de tejido gingival[57].
Estas colágenas han sido utilizadas también en estudios de generación de cartílago y hueso in vitro e in vivo, como andamios cargados de condrocitos en conejos e incluso en porcinos[49, 51, 52]. En todos los estudios, se obtuvieron resultados favorables de formación de tejido, pero sólo en la última publicación mencionada, se observaron propiedades mecánicas similares al tejido natural. Muhonen et al., obtuvieron hidrogeles de ésta colágena tipo II y los utilizaron como nichos para la condrogénesis de células madre mesenquimales. Este estudio sirvió para demostrar que el proceso de formación de cartílago, se presenta de manera retardada y reafirma la necesidad de seguir explorando el uso de estos materiales[58].
La colágena recombinante tipo VII, ha sido investigada como una alternativa de terapia para úlceras de la epidermis, pero también ha presentado efectividad en el tratamiento de la Epidermólisis Bullosa Distrófica (EBS), por medio de la aplicación de geles tópicos o por inyección intravenosa. En el caso de las úlceras diabéticas, se observó una recuperación más rápida que la obtenida al utilizar geles de colágena de origen bovino o cadavérico. Incluso, hubo angiogénesis en etapas tempranas de la aplicación y menor inflamación[54, 55]. Woodley et al., demostraron que al administrar colágena por medio intravenoso, éste era atraído e incorporado a la interfaz epidermis-dermis logrando su restauración[59].
Uno de los mayores éxitos reportados de la colágena tipo VII, es su uso en el remplazo y regeneración de córneas. El grupo conformado por laboratorios de Canadá, Suecia, EUA, Japón e India, demostraron que la colágena tipo I tiene un índice de refracción de 1.35 y una transparencia similar a la de la córnea humana [60]. Asimismo, al utilizar colágena tipo III, encontraron que posee las mismas propiedades ópticas y mejores propiedades mecánicas que la colágena tipo I, lo cual atribuyeron al menor diámetro de las fibrillas[47]. En un estudio paralelo, encontraron que éstos hidrogeles eran capaces de mantener una proliferación de células endoteliales y neurales in vitro[61]. También, se comparó su desempeño in vivo en donde obtuvieron una mejor regeneración que la obtenida con un aloinjerto de cerdo y una incidencia de infecciones diez veces menor[62]. Recientemente, en un seguimiento los autores observaron que las corneas implantadas no presentaron rechazo y los pacientes no habían necesitado terapia de inmunosupresión. Por lo que estos hidrogeles de colágena presentan una excelente opción al trasplante de corneas[63]. En resumen, el avance científico y tecnológico en la obtención de colágenas recombinantes de humano, así como en su aplicación para Ingeniería de Tejidos, ha permitido explotar su potencial terapéutico clínico y ofrece grandes retos y oportunidades para este sector en amplio crecimiento.
Discusiones y conclusiones
En los últimos 20 años se han desarrollado sistemas bacterianos y eucariotas para la producción de colágenas recombinantes de humano a nivel industrial. Sin embargo, debido a los bajos rendimientos de producción, todavía son escasas las empresas que ofrecen estos materiales en condiciones adecuadas, de costo y cantidad, para potenciar su uso en investigación y medicina. Por lo tanto, uno de los retos consiste en lograr obtener rendimientos más altos y el desarrollo de nuevas tecnologías que permitan su procesamiento.
Por otro lado, estas colágenas recombinantes representan una opción muy atractiva al ser comparadas con las de origen animal, ya que presentan una mejor biocompatibilidad y menor rechazo al ser idénticos al de origen humano y ponen fin a los riesgos latentes por el uso de colágenas de origen animal. Adicionalmente, estas colágenas recombinantes eliminan la necesidad de utilizar modificaciones químicas para unir de manera covalente señales bioactivas o entrecruzamientos químicos, las cuales, pueden ocasionar la desnaturalización de la proteína o introducir residuos tóxicos. En este contexto, el desafío consiste en obtener materiales que permitan desarrollar andamios con una estructura jerárquica que mimetice la complejidad de la matriz extracelular natural. Es posible que la generación de estas micro y nanoestructuras pueda ser lograda por medio del uso de una combinación de técnicas como electrohilado, micro o nanomoldeo, microlitografía o autoensamblado. Por lo tanto, conforme la Ingeniería de Tejidos vaya avanzando y empleando andamios más complejos, las colágenas recombinantes prometen ser una buena opción para satisfacer los requerimientos biológicos, médicos y comerciales.
En conclusión, debido al avance significativo en el desarrollo y uso de colágenas recombinantes de humano en uso de Ingeniería de Tejidos y Medicina Regenerativa, es necesario continuar la investigación de laboratorio y clínica, para poder aprovechar al máximo su potencial como una herramienta en la biomedicina.











 nueva página del texto (beta)
nueva página del texto (beta)