Introducción
La piel se considera el órgano más grande en la mayoría de los organismos vertebrados, teniendo una compleja estructura de tres capas: la epidermis, la dermis y la hipodermis, las cuales en condiciones normales tienen la capacidad de auto- regeneración. Este órgano está implicado en diversos procesos biológicos, como en la regulación de la temperatura corporal, soporte a los vasos sanguíneos y nervios, prevención de la deshidratación, procesos de detección sensorial y como barrera externa del cuerpo contra patógenos y sustancias químicas. En algunas ocasiones puede ocurrir pérdida de la integridad de la piel debido a trastornos genéticos, traumas agudos, heridas crónicas, intervenciones quirúrgicas, quemaduras y escaldaduras, las cuales representan las causas más comunes de pérdida de piel, pudiendo resultar en heridas extensas y profundas [1]. Por definición, una herida es una perturbación de la estructura anatómica y fisiológica normal de un tejido, y representa un daño considerable en las barreras naturales de defensa contra agentes extraños [2].
La cicatrización de heridas es un proceso biológico específico relacionado con el fenómeno general de crecimiento y regeneración de los tejidos. Este proceso se puede resumir en cinco etapas independientes y superpuestas, incluyendo: hemostasis, inflamación, migración, proliferación y maduración. Además, la cicatrización de heridas implica una compleja serie de interacciones entre los diferentes tipos de células, moléculas mediadoras y componentes de la matriz extracelular [2], [3], [4]. En la Figura 1, se muestra un resumen en forma de esquema de las principales etapas de cicatrización y de las células involucradas en cada una de ellas.

Figura 1 Representación esquemática de las tres etapas fundamentales del proceso de curación de heridas en piel (inflamación, proliferación y remodelación) y las diferentes células involucradas en cada etapa
Aunque la cicatrización de heridas es el proceso natural del cuerpo para la regeneración de daños y/o tejidos, un apósito apropiado puede ser capaz de mejorar el proceso de curación considerablemente, mediando en la etapa correcta o en la prestación de excelentes condiciones para la cicatrización. Sabiendo esto, se puede definir que un apósito es cualquier material empleado para cubrir, proteger y curar heridas de un tejido dañado [4].
De manera general, un apósito ideal para curación de heridas debe poseer las siguientes propiedades: (1) absorber los exudados y componentes tóxicos de las heridas superficiales; (2) preservar un alto nivel de humedad en la superficie de la herida; (3) permitir el intercambio gaseoso; (4) proporcionar aislamiento térmico; (5) proteger la herida de la penetración de bacterias; (6) ser no tóxico; (7) promover la regeneración y el crecimiento del tejido nuevo y (8) ser eliminado fácilmente sin trauma de la herida. [5], [6], [7].
Lo anterior nos dice que un apósito para curación de heridas en cualquier tejido debe mantener un ambiente húmedo después de la absorción de los exudados de la herida, además de proteger la herida de las infecciones secundarias, reducir la necrosis del lecho de la herida, proporcionar el intercambio gaseoso adecuado, regular y/o mediar en la liberación de ciertos factores de crecimiento y citoquinas, y también ser elástico, biocompatible con los tejidos y la sangre, no tóxico y no antigénico. Por otra parte, un apósito eficaz debe promover una rápida cicatrización de la herida y, una vez curada, el desprendimiento del apósito no debe causarle un trauma secundario a los neo-tejidos [4]. En la Figura 2 se resumen las características principales que debe poseer un material para su aplicación como apósito en la curación de heridas.
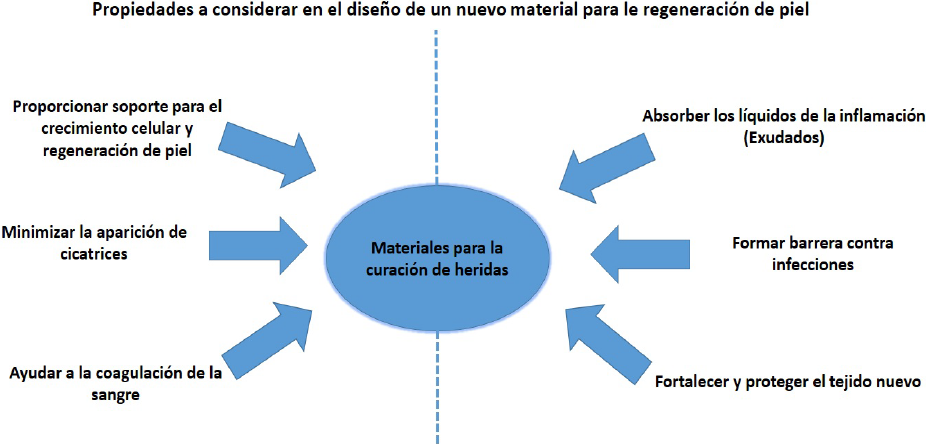
Figura 2 Representación esquemática de las propiedades requeridas de un biomaterial para su utilización en la curación de una herida de piel superficial.
Los apósitos para heridas juegan un papel importante en la gestión de la cicatrización, en particular, los apósitos elaborados con polímeros se utilizan ampliamente para heridas exudativas; ya que, por lo general estos pósitos son biodegradables, biocompatibles y no tóxicos para la piel. Además, presentan buenas propiedades de manipulación de fluidos que fomentan la curación de las heridas en un ambiente húmedo y controlado [8]. La idea típica del uso de un apósito para la curación de heridas cutáneas superficiales se basa en la presencia de un entorno húmedo alrededor de la herida, además de absorber los exudados de la superficie de la herida, ya que se sabe las heridas muestran un aparente aumento en las tasas de re- epitelización cuando se mantienen en un entorno local húmedo [9].
Los apósitos preparados con materiales naturales son elaborados principalmente de polisacáridos, proteínas y lípidos, y son generalmente biodegradables, no tóxicos y biocompatibles con los tejidos [10]. Los polisacáridos poliméricos son los componentes más importantes de estos sistemas debido a sus características de liberación de fármacos y permeabilidad, así como a sus propiedades mecánicas, químicas y biológicas, las cuales depende de la formulación de cada material [11].
Metodología
La presente investigación se realizó con base en un análisis bibliográfico mediante una revisión extensiva, consultando las bases de datos Science Direct, SciELO y PudMed Central, con una estrategia de búsqueda diseñada para obtener publicaciones relacionados con polímeros de origen natural utilizados para la elaboración de materiales, principalmente apósitos, con utilidad en la regeneración y cicatrización de piel, siendo el quitosano, la celulosa, el almidón, el alginato, el colágeno y la gelatina, los polímeros de interés durante la búsqueda. Se seleccionaron 50 artículos, todos en el idioma inglés, en los que abordaban en su contenido la elaboración o el estudio de materiales fabricados con los polímeros naturales antes mencionados, utilizando los criterios de inclusión y exclusión presentados en la Tabla 1.
Resultados
Materiales poliméricos utilizados para regeneración de piel
La producción de heridas extensas y descontroladas de piel sigue siendo uno de los retos más significativos para el ámbito clínico. Aunque los aloinjertos, que son tejidos trasplantados de una persona a otra, suponen una posible alternativa terapéutica para el tratamiento de lesiones de piel, su poca disponibilidad, una posible transmisión de enfermedades y el alto costo en el proceso han aumentado la necesidad de mejores tecnologías para el cuidado y curación de heridas. Hoy en día, existe una tendencia en desarrollar sustitutos de piel libres de células, los cuales cumplan funciones de matriz extracelular, citoquinas y factores de crecimientos, además de brindar protección y sostén durante la curación de heridas [1].
Las películas, los hidrogeles y los andamios poliméricos basados en materiales de origen natural han sido ampliamente investigados para aplicaciones biomédicas como: la administración de fármacos, la ingeniería de tejidos y la cicatrización de heridas, debido a su biocompatibilidad, biodegrabilidad y propiedades similares a los tejidos humanos [12]. Las películas poliméricas se consideran un tipo de apósitos adecuados para la curación de heridas, y son normalmente transparentes, duraderas, biocompatibles, de fácil manipulación, adhesivas, baratas, semi-permeables al oxígeno y al vapor de agua, y en algunas ocasiones impermeables al líquido y a la contaminación bacteriana. La principal desventaja de estos apósitos es que sólo se deben utilizar para las heridas con pocos exudados o como vendajes protectores en las heridas superficiales, y en aplicaciones que suelen durar entre 4 y 7 días antes de que el apósito se reemplace. Sin embargo, pueden ser utilizados directamente en la herida o en asociación con otros tipos de apósitos para mejorar sus propiedades de barrera de fluidos. También pueden ayudar con la reducción de la fricción cuando se aplica a la piel intacta en las zonas vulnerables [7], [13].
En algunas ocasiones los apósitos son cargados con fármacos para tratar la herida a nivel local, con la finalidad de controlar una infección secundaria o para el control del dolor, especialmente en las heridas crónicas [6]. Los parches se definen como sistemas terapéuticos transdérmicos, los cuales administran cantidades terapéuticas eficaces de fármacos a la circulación desde la piel lesionada; siendo este otro tipo de apósito para la curación de heridas. Los sistemas transdérmicos tienen numerosas superioridades con respecto a la dosificación oral, como la superación de metabolismo de primer paso, la mejora rápida del paciente y la reducción de los efectos secundarios gastrointestinales [11].
Por lo general, los apósitos que se colocan directo en la herida son acompañados de una capa exterior (apósito secundario), la cual está diseñada para la prevención de invasión bacteriana y para actuar como capa de control en la velocidad de permeación de vapor de agua. Mientras tanto, la capa interior (apósito primario) está diseñado para tener una unión al tejido lesionado y poder drenar los exudados de la herida. Sobre esta base, existen varios apósitos sintéticos de dos capas, como por ejemplo las membranas unidas a esponjas desarrolladas en los últimos años [8]. En la Figura 3, se observa un ejemplo de un apósito de dos capas; la capa exterior provee protección antibacteriana y ayuda a controlar la evaporación de agua de la herida (retención de la humedad); y la segunda capa, la cual provee el drenaje de exudado y el deposito del fármaco en la herida.

Figura 3 Representación esquemática de un apósito de doble capa; la capa exterior (apósito secundario) brinda protección contra la invasión y proliferación bacteriana, además de controlar la evaporación de líquidos de la herida hacia el exterior. La capa interior (apósito primario), brinda un ambiente húmedo, además de drenar los exudados y proporcionar fármacos desde la matriz de biomaterial a la herida.
Polímeros naturales para la elaboración de apósitos
En los últimos años, los profesionales de la salud enfrentan a un número creciente de pacientes que sufren de heridas y quemaduras difíciles de tratar. Como ya ha sido mencionado, durante el proceso de cicatrización de la herida, el apósito debe proteger la lesión y contribuir a la recuperación de los tejidos. Debido a su biocompatibilidad, biodegradabilidad, formación de hidrogel y similitud a las moléculas que comprenden la matriz extracelular, los biopolímeros, que son macromoléculas presentes en los seres vivos, han sido ampliamente utilizados en el campo de la ingeniería de tejidos y medicina regenerativa; siendo los polisacáridos y proteínas los más utilizados en la elaboración de materiales para el cuidado de heridas y quemaduras [14], [15].
Quitosano
El quitosano es un polímero natural derivado de la desacetilación de la quitina, la cual es insoluble en los disolventes habituales; está compuesto de dos polisacáridos distribuidos aleatoriamente, de β-(1-4) D-glucosamina y N-acetil-D-glucosamina. Es considerado el segundo polisacárido más abundante en la naturaleza y tiene como características que es biodegradable, biocompatible y antimicrobiano; propiedades que son de gran interés para su elaboración de biomateriales en la regenaración de tejidos [10]. Debido a la presencia de grupos amino e hidróxido en su estructura química, exhibe excelentes propiedades de ligandos y de formación de películas, andamios y geles, creando una matriz muy favorable para el crecimiento celular al imitar de manera eficaz la matriz extracelular de varios tejidos [16].
El uso de apósitos para heridas es una de las aplicaciones médicas más prometedoras para el quitosano, debido a su naturaleza adhesiva en conjunto con su carácter bactericida y antifúngico, y su permeabilidad al oxígeno, propiedades asociadas al tratamiento de heridas y quemaduras [17]. No obstante, aun con todas sus propiedades, la aplicación del quitasol en la ingeniería de tejidos ha sido restringida por su inherente sensibilidad al agua, su pobre estabilidad térmica y propiedades mecánicas relativamente débiles, especialmente en ambientes húmedos [18].
Se han utilizado materiales compuestos para compensar las limitaciones del quitosano, por ejemplo: la combinación del quitosano con nanopartículas de hidroxiapatita [18], quitosano con queratina [19], quitosano con fibrina de seda [20], esponjas de quitosano/gelatina [21] entre otros. Del mismo modo, se han utilizado hidrogeles de quitasol para la regeneración de la piel de cerdos [22], con nanocristales de plata y polivinil alcohol como vendajes de heridas [23].
Es importante mensionar que han tomado un rol especial en la ingeniería tisular los derivados del quitasol, como el cabroximetil quitasol, el cual muestra buena solubilidad en un amplio rango de pH. Del mismo modo, los oligosacáridos del quitasol, que son polímeros solubles en agua y de bajas cadenas moleculares, han sido investigados como agentes protectores con propiedades antibacteriales in vitro [24], [25]. En los últimos años, el quitosano y sus derivados han atraído la atención debido a sus propiedades beneficiosas en aplicaciones de curación y cicatrización de heridas. Entre los derivados más utilizados se encuentran el N, N, N-trimetil-quitosano (NTQ), O-carboximetil quitosano (OCQ), N-carboximetil quitosano (NCQ) y N, O- carboximetil quitosano (NOCQ). En general, el quitosano, sus derivados y su combinación con otros materiales han sido utilizados en la fabricación de una gran variedad de esponjas, geles, películas, andamios y polvos poliméricos para el tratamiento de heridas, los cuales se hidratan rápidamente por la absorción del exudado, formando un hidrogel en la superficie de la herida, propiedad fundamental en un apósito [26].
Celulosa
La celulosa es un material natural insoluble en agua que se encuentra en la madera, algodón y otros materiales a partir de plantas, además de ser producida por varios microorganismos. La celulosa consiste en unidades repetidas de anhidroglucosa asociadas por un enlace beta-(1,4), formando la unidad básica de la celulosa. Fue aislada por primera vez a partir de madera en 1885; sin embargo, no fue hasta 1913 que se desarrollaron películas de celulosa para su uso comercial, con las características de ser transparentes y delgadas. Aunque el uso principal de las películas de celulosa ha sido con fines de embalaje, también se ha encontrado una aplicación en el tratamiento de la insuficiencia renal, así como la evolución de las aplicaciones clínicas tales como fabricación de andamios para ingeniería tisular, sustitutos de piel temporal, agentes hemostáticos, barreras de adhesión post- operatorio, y como materiales de cultivo de hepatocitos [27], [28].
La celulosa bacteriana (BC, también conocido como celulosa microbiana, MC) es un polímero natural prometedor que se biosintétiza por algunas bacterias y tiene propiedades estructurales y mecánicas únicas en comparación con la celulosa de las plantas. Los materiales compuestos preparados mediante el uso de la BC en conjunción con otros polímeros han sido investigados recientemente, y la investigación sobre la BC para la aplicación en la ingeniería de tejidos de piel se ha incrementado. Obteniendo que, debido a sus propiedades mecánicas superiores, así como a su excelente biocompatibilidad, los biomateriales elaborados con BC, con sus derivados o acompañada con otros biopolímeros han demostrados tener un gran potencial para aplicación biomédica y un alto valor clínico para la reparación de tejido epitelial y aceleramiento del proceso de cicatrización [29], [30], [28]. Por lo anterior, este biopolímero ha sido utilizado como ingrediente en varios biomateriales, como en hidrogeles en conjunto con ácidos acrílicos para investigar sus aplicaciones en un modelo animal para curación de heridas [31], en combinación de nanopartículas de sulfadiazina de plata para el tratamiento de quemaduras [32]. También se ha mostrado la tolerancia a la BC en el tratamiento de heridas en piel, apoyada de glicerina para incrementar su maleabilidad [33].
Almidón
El almidón, que es una macromolécula de origen vegetal compuesta de amilosa y amilopectina, se ha considerado durante muchos años como un polímero con un alto potencial para la elaboración de películas delgadas debido a su bajo costo, renovabilidad y biodegradabilidad. Sin embargo, la naturaleza hidrófila de las cadenas del almidón lo hace sensible a la humedad del medio ambiente; por lo que, la mezcla de almidón termoplástico con polímeros biodegradables menos hidrófilos es una opción para la producción de películas que sean más resistentes al agua [34].
Entre los polímeros biodegradables obtenidos de forma natural, el almidón es probablemente el material más prometedor debido a su alta disponibilidad y bajo costo. Sin embargo, la utilización de la película de almidón está limitado por sus pobres propiedades mecánicas y la capacidad de barrera. Además, la retrogradación de las cadenas móviles de almidón conduce a un cambio no deseado en sus propiedades termomecánicas. Por lo que plastificantes naturales como glicerol han sido utilizados para mejorar las propiedades fisicoquímicas y mecánicas de las películas de almidón. No obstante, para superar varias desventajas, como su fuerte carácter hidrófilo, pobres propiedades mecánicas y de barrera en comparación con los polímeros sintéticos, la modificación adicional es generalmente necesaria para su utilización en la elaboración de biomateriales en la ingeniería tisular [35]. En conclusión, los polímeros biodegradables a base de almidón son de carácter económico, abundante y renovable. Además, de contar con una excelente biocompatibilidad, lo que ha conducido a utilizarlo en aplicaciones biomédicas, como andamios de tejido o implantes. Estos materiales de almidón frecuentemente sufren modificaciones químicas o físicas con el propósito de mejorar sus propiedades mecánicas, de carga y liberación del fármaco [36].
Alginatos
El alginato es un polímero natural que se obtiene principalmente a partir de las algas pardas y de la biosíntesis de algunas bacterias. Es un polisacárido lineal, compuesto de α-L-gulurónico y β- D-manurónico; cuenta con propiedades como alta hidrofilicidad, biocompatibilidad, biodegradabilidad, capacidad para formar películas e hidrogeles. Su es uso relativamente económico, por lo que ha sido ampliamente utilizado en aplicaciones biomédicas; como en vendajes de heridas, andamios y materiales de impresión dental o quirúrgicos [9], [37], [13], [6], entre muchos otros.
Los biomateriales de alginato que contienen calcio o sodio son los más utilizados en las ciencias de los biomateriales para la curación de heridas. Cuando estos materiales elaborados de alginato entran en contacto con la herida con exudado se forma un gel hidrófilo debido al intercambio entre los iones presentes en el apósito y el exudado de la herida, lo que facilita la retirada del apósito. Por lo general, los apósitos de alginato están indicados para heridas moderadas a muy exudativas y el componente de calcio dentro del apósito actúa como un agente hemostático, por lo que es útil en heridas sangrantes. Por lo cual, las cintas y vendajes de alginato que ya han sido fabricadas son particularmente útiles en la protección de la herida de piel [2], [7], [37].
Colágeno
El colágeno es una macromolécula proteica rica en prolina, lisina y glicina, y se considera como el principal ingrediente de la matriz extracelular de varios tejidos, desempeña un papel activo en la migración y adhesión celular, debido a su propiedad de reconocimiento a células específicas. El colágeno en sus diferentes composiciones es uno de los biopolímeros más utilizados para la fabricación de diversos biomateriales con aplicaciones en regeneración de piel, ya que incrementa la capacidad de fibroblastos y queratinocitos para proliferar, migrar y diferenciarse, además de poseer una estructura porosa y baja inmunogenicidad. También ha sido demostrado que ayuda en la síntesis de proteínas de la membrana extracelular de la piel, mejorando así el proceso de regeneración y cicatrización. Sin embargo, sus deficientes propiedades mecánicas y su rápida degradación, han limitado en gran medida sus aplicaciones en la ingeniería de tejido. [38], [39].
No obstante, el colágeno ha sido utilizado para la fabricación de un gran número de biomateriales para la ingeniería tisular, entre ellos se encuentran materiales compuestos como nanofibras y andamios elaborados de quitosano/colágenos que imitan la estructura de la matriz extracelular, promoviendo la propagación y migración de fibroblastos [39], [40]; geles de colágeno, los cuales mostraron resultados favorables en la curación de heridas cutáneas en ratas [41]; también se han fabricado andamios elaborados de colágeno, quitosano y sulfato de condroitina, los cuales tuvieron buenas propiedades de biocompatibilidad y la capacidad de promover la proliferación celular de fibroblastos [42]; entre muchos otros materiales a partir de colágeno que se han reportado en los últimos años con excelentes propiedades en la cicatrización de piel.
Gelatina
La gelatina es uno de los polímeros naturales más conocidos en la ciencia de los biomateriales, siendo un polipéptido que se deriva usualmente de la hidrólisis del colágeno con una estructura de triple hélice. A partir de la gelatina, se han desarrollado un gran número de biomateriales, utilizados generalmente en el campo de la medicina y en productos farmacéuticos, demostrando la eficacia de sus propiedades a través del uso clínico a largo plazo [43], [44]. En los últimos años, la gelatina ha sido ampliamente utilizada en la ingeniería tisular como ingrediente principal en varios biomateriales para regeneración de tejido de piel, debido a sus propiedades de adherencia, proliferación y propagación en fibroblastos y queratinocitos, ayudando de esta manera a mejorar la cicatrización de heridas cutáneas. [45]. Además, tiene un potencial uso en la síntesis de materiales para liberación de fármacos, moléculas orgánicas y nanopartículas [44]. Asimismo, su fácil obtención, su bajo costo, su buena solubilidad en agua y su afinidad con varios polímeros han impulsado a los investigadores a implementar la gelatina como uno de los ingredientes más utilizados en la ingeniería tisular [46].
En la actualidad, una gran variedad de biomateriales con gelatina ha arrojado buenos resultados en pruebas de proliferación de fibroblastos in vitro; entre algunos de ellos, andamios de policaprolactona/gelatina/ colágeno tipo I, [38], micro-geles de gelatina [45]; esponjas de gelatina-quitosano [44]. Además, se han fabricado otros biomateriales que favorezcan la regeneración de piel a base de gelatina; como fibras de gelatina recubiertas de poli(ácido-3-hidroxibutírico) para mimetizar a la matriz extracelular [47], compositos de pectina y gelatina acompañados con aloe vera y curcumina para apósitos con propiedad antibacterial [48], compositos de gelatina y quitosano como agente hemostático en heridas cutáneas [46], entre otros usos.
Avances en la investigación y elaboración de apósitos poliméricos para la regeneración de piel en los últimos años
Los apósitos para heridas han tenido un proceso evolutivo a partir de materiales que simplemente cubrían y ocultaban la herida, a los materiales que se centraron en la gestión de la humedad y eliminación de exudados. Sin embargo, los avances en la tecnología de apósitos en los últimos años han llevado a un nuevo desarrollo de productos tópicos que hacen más que cubrir y proteger la herida; también facilitan y promueven el proceso de curación y cicatrización de una manera activa [49].
Históricamente, los apósitos para heridas primero jugaron un papel pasivo y de protección durante el proceso de curación, siendo algodones, gasas, cremas cicatrizantes y soluciones desinfectantes las más utilizadas comercialmente. Sin embargo, en las últimas décadas el tratamiento de heridas se ha ido revolucionando por el descubrimiento de apósitos húmedos que pueden ayudar a curar las heridas de forma más rápida, ya que, un entorno húmedo en la herida es un factor importante que induce la proliferación y la migración de los fibroblastos y queratinocitos, además de mejorar la síntesis de colágeno, que conduce a la reducción de la formación de cicatrices. [13].
En la actualidad, se cuenta con una gran variedad de productos para el cuidado de heridas, incluyendo cremas, soluciones, apósitos y sustitutos de piel. Entre estos productos, los apósitos elaborados de biopolímeros representan un método eficaz para el tratamiento de heridas, presentando una buena relación entre la eficacia clínica y el coste de fabricación; remarcado las propiedades más significativas de estos biopolímeros en la Figura 4. Sin embargo, para algunos tipos de heridas, el uso de apósitos poliméricos puede no ser suficiente para promover el proceso de curación, ya que muchos de estos materiales no presentan algunas de las propiedades necesarias para la elaboración de apósitos [12]. Para solucionar algunas de estas desventajas, en los últimos años surgió un creciente interés por incorporar metales en los apósitos poliméricos o utilizarlos en combinación con otros agentes antimicrobianos para mejorar la actividad en general. En varios estudios, se encontró que los cationes divalentes como el Cu2+ y Zn2+ exhibieron actividades antimicrobianas superiores a Ca2+ y eran generalmente compatibles con agentes tópicos comunes anti-microbianos; siendo estos iones sustancias activas potenciales en los apósitos poliméricos [8].

Figura 4 Esquema comparativo de las ventajas y desventajas de la utilización de biopolímeros para la fabricación de apósitos para curación de heridas cutáneas.
Durante los últimos años, la investigación en la elaboración de biomateriales para la curación de heridas superficiales ha demostrado que las películas de polisacáridos compuestas han mejorado las propiedades físicas y mecánicas en comparación con las películas basadas en componentes individuales. Recientemente, los sistemas basados en películas de material compuesto de dos capas elaborados de diversos biopolímeros son ampliamente investigados en ingeniería de tejidos debido a sus mejores propiedades mecánicas, una mayor retención de la humedad y su fácil preparación. Sin embargo, aún se sabe poco sobre bicapas de biopolímeros en aplicaciones curativas y de suministro de fármacos en herida, por lo que el estudio de estos biomateriales aun es de interés [6], [50].
Conclusiones
De acuerdo con los resultados obtenidos en diferentes investigaciones relacionadas con la cicatrización de piel, un apósito debe de cubrir una serie de propiedades para ser beneficioso en la curación de heridas, entre las cuales se encuentran: mantener un ambiente húmedo en la interfaz de la herida, permitir el intercambio gaseoso, actuar como una barrera para los microorganismos y eliminar el exceso de exudados. Además, dicho apósito debe ser no tóxico, no alergénico, no adherente y su retiro de la herida debe ser fácil, así como poseer propiedades antimicrobianas y promover la curación de heridas mediante la administración de fármacos y/o sustancias que aceleren o regularicen la cicatrización.
Las estrategias actuales en el ámbito del diseño de apósitos bio-funcionales se centran en la aceleración de la reparación de la herida a partir de materiales elaborados con biopolímeros. Sin embargo, debido a las características de los distintos tipos de heridas y de las diferentes etapas de la cicatrización, no existe un apósito que pueda ser aplicado de manera eficiente en todas las situaciones. No obstante, es posible desarrollar y optimizar diferentes biomateriales para la elaboración de apósitos que sean biocompatibles en términos de sus propiedades químicas y físicas, con el fin de satisfacer la mayoría de las necesidades para una etapa en particular de la herida.
Las recientes investigaciones se han centrado en la exploración de biopolímeros naturales para el desarrollo de materiales amigables con el medio ambiente como alternativa de los materiales sintéticos derivados del petróleo. Esto se debe principalmente a su mayor biodegradabilidad, biocompatibilidad y sostenibilidad al ser obtenidos naturalmente; siendo los polisacáridos, proteínas, lípidos y otros materiales de origen vegetal y animal los más utilizados para este propósito. Siendo los biopolímeros particularmente atractivos debido a sus buenas propiedades de formación de película, resistencia mecánica moderada y de barrera de gas con la naturaleza única coloidal.
Se ha demostrado con las investigaciones en los últimos años que el empleo de polímeros naturales es una alternativa novedosa y ventajosa para la fabricación de apósitos para la curación de heridas cutáneas superficies y la regeneración de piel, ya que poseen varias de las propiedades deseables en la curación de heridas, por lo que los hace buenos candidatos para el remplazo de los materiales de curación tradicionales.











 nova página do texto(beta)
nova página do texto(beta)



