Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería biomédica
versión On-line ISSN 2395-9126versión impresa ISSN 0188-9532
Rev. mex. ing. bioméd vol.36 no.3 México sep./dic. 2015
https://doi.org/10.17488/RMIB.36.3.1
Artículo de investigación
Modelación y simulación de la arteria aorta a partir de datos clínicos utilizando un modelo fraccional viscoelástico y el método del elemento finito
Modeling and simulation of the aorta from clinical data using a fractional viscoelastic model and finite element method
J.E. Palomares Ruiz1, M. Rodríguez Madrigal2, J. G. Castro Lugo1, A. Ramírez Treviño1 y A. A. Rodríguez Soto2
1 Instituto Tecnológico Superior de Cajeme.
2 Instituto Superior Politécnico José Antonio Echeverría.
Correspondencia:
Juan Enrique Palomares Ruiz
Maestría en Ingeniería Mecatrónica, Instituto Tecnológico Superior de Cajeme,
Carretera Int. A Nogales Km 2, Ciudad Obregón, Sonora, México.
Correo electrónico: jepalomares@itesca.edu.mx jepalomaresruiz@gmail.com
Fecha de recepción: 26 de marzo de 2015.
Fecha de aceptación: 11 de junio de 2015.
RESUMEN
Los modelos y simulaciones de los efectos biomecánicos presentes en la arteria aorta, le proporcionan al especialista de la salud una herramienta computacional, que puede ser empleada en la prevención y el tratamiento de las enfermedades cardiovasculares. Es por esto que en la presente investigación se desarrolla un modelo matemático con la finalidad de implementarlo en simulaciones tridimensionales digitales que permitan analizar el comportamiento mecánico de arterias. Primero se describe la metodología utilizada en la construcción de la geometría de la arteria basada en imágenes provenientes de una tomografía axial computarizada, los ensayos experimentales necesarios para la obtención de los parámetros mecánicos requeridos por el modelo y por último su orden fraccional. Con lo que se obtiene una simulación mediante elementos finitos donde se identifican las zonas de mayor concentración de esfuerzos y el campo de desplazamientos. Para poder obtener estos resultados se empleó una formulación novedosa basada en modelos viscoelásticos de orden fraccional donde además se obtuvieron, a través del módulo complejo, los valores requeridos para la simulación.
Palabras Clave: biomecánica, materiales biomédicos, cálculo fraccional, arteria, método del elemento finito, imágenes medicas.
ABSTRACT
The modeling and simulation of the biomechanical effects present in the aorta, give the health specialist a computational tool that can be used in the prevention and treatment of cardiovascular diseases. For that reason on this research a mathematical model was developed in order to implement digital dimensional simulations to analyze the mechanical behavior of arteries. First, its described the methodology used in the construction of the geometry of the artery based on images from a CT scan, next the necessary experimental tests to obtain mechanical parameters required by the model and finally his fractional order. Obtaining a finite element simulation where the areas of greatest stress concentration and the displacement field are identified. To obtain these results a novel formulation based on fractional order viscoelastic models was used and the values required for simulation were obtained through the complex modulus.
Keywords: Biomechanics, Biomedical materials, Fractional calculus, Artery, Finite element method, Medical images.
INTRODUCCIÓN
El desarrollo de modelos y simulaciones biomecánicas constituyen un apoyo crucial para los profesionales de la salud, ya que los mismos facilitan el diseño de implantes hechos a la medida del paciente, logrando reducir el impacto ocasionado por un proceso de repetición de cirugías [1,2] o empleados en la prevensión neonatal de displacia de cadera [3]. Así mismo se han desarrollado métodos para la detección de condiciones patológicas, como el cáncer de próstata, basados en los cambios del comportamiento mecánico del tejido, utilizando modelos viscoelásticos fraccionales e imágenes de resonancia magnética, detectando la presencia de tejido cancerígeno en su etapa temprana [4]. En este mismo sentido en Bia, 2005 [5] se estudian los cambios de las propiedades biomecóanicas del tejido arterial y se establecen conclusiones que pueden servir para la caracterización precoz de las enfermedades arteriales degenerativas [6].
En función de caracterizar el comportamiento biomecánico de los tejidos blandos, en los últimos años la teoría del cálculo fraccional, se ha empleado ampliamente en el campo de la biomecánica [7, 8]. Los operadores diferenciales fraccionales han mostrado un gran desarrollo, utilizándose principalmente en la caracterización del comportamiento mecánico de tejidos blandos in-vivo [9], con investigaciones recientes para la caracterización del tejido cerebral [10, 11], donde existen criterios establecidos de daño por esfuerzos y deformaciones [12], aquellos relacionados con el hígado [13], o como en el caso de este estudio, para la caracterización biomecánica de las arterias [14, 15].
Debido a que las enfermedades cardiovasculares (ECV) son la primer causa de muerte en México, así como en los demás países desarrollados y en vías de desarrollo [16, 17], en la presente investigación se desarrolló una modelación y simulación de la arteria aorta, donde se analiza la distribución de esfuerzos ocasionados por el flujo sanguíneo y en la que se emplea un modelo fraccional viscoelástico. Buscando que un futuro, no muy lejano, este tipo de simulaciones puedan ser utilizadas por profesionales de la salud en la prevención y tratamiento de las ECV, por ejemplo identificando las zonas críticas de tensiones en las paredes arteriales.
METODOLOGÍA
Inicialmente se obtiene una representación geométrica de la arteria basada en imágenes médicas, por lo que se inicia describiendo su composición interna a grandes rasgos, después se desarrolla el proceso de construcción de la geometría. Se continua definiendo las propiedades de la viscoelasticidad, comportamiento material que describe la biomecánica de la arteria, y los ensayos de material que permiten la obtención de los parámetros mecánicos. Por último se describe de forma breve el modelo fraccional y se puntualizan las ventajas del mismo.
Composición de la arteria
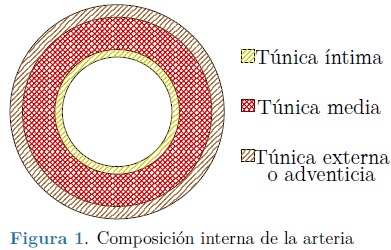
El sistema circulatorio se compone básicamente por el corazón y los vasos sanguíneos, a su vez los vasos sanguíneos se componen de arterias, arterias menores y venas. Las arterias se encuentran constituidas por tres capas internas, conocidas como la Túnica Intima, Túnica Media y Túnica Externa o Adventicia, estas tienen una forma de cilindro semicircular y básicamente se componen de redes de colágeno, elastina y tejido muscular liso [18], Figura 1. En los humanos jovenes la capa íntima es un capa extremadamente delgada de aproximadamente 80nm, como una membrana separada de la media por una fina capa de elastina, la media esta conformada de células musculares lisas sumergidas en una matriz celular de colágeno y elastina, finalmente la externa es una gruesa capa compuesta de colágeno y fibroblastos [19]. Esta composición de múltiples capas le proporciona a la arteria un comportamiento material compuesto, además como Fung lo describe en su tratado clásico, los tejidos blandos presentan una característica mecánica conocida como viscoelasticidad [20].
Construcción de la geometría
A continuación se describe el proceso de construcción geométrica. Las imágenes DICOM (Digital Imaging and Communication in Medicine), se obtuvieron mediante un escáner TAC Philips Brilliance® y fueron proporcionadas por el Centro Médico Diagnósticos México Americano, las mismas se efectuaron en un paciente vivo de sexo masculino, de 37 años de edad y con una estatura de 1.78m, el resto de los datos personales del paciente se mantienen anónimos. La tomografía se realizó mediante cortes axiales con una separación de 5 mm. La zona de interés consiste en la arteria aorta, precisamente donde presenta una zona de curvatura. Un conjunto de imágenes DICOM se muestran en la Figura 2, donde se identifica dicha zona y se pueden apreciar los tres cortes.

Una vez obtenidas las imágenes éstas son manipuladas en el software Onis 2.2®. Utilizando la escala de Hounsfield adecuada, para los tejidos blandos se encuentra en el rango de +10UH a +90UH, se identifican la zonas de interés y se delimitan cada una de las fronteras de las capas de la arteria. Esto se puede lograr ya que entre las capas se tienen distintos tipos de elementos constituyentes, principalmente entre la media y las dos restantes. Un ejemplo de la visualización de una imágen DICOM y el establecimiento de cotas se muestra en la Figura 3.

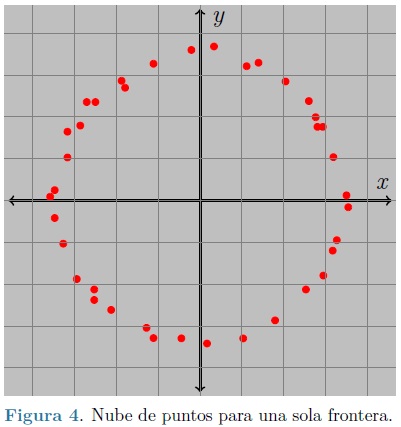
Cada una de las fronteras de las capas arteriales es exportada como una nube de puntos al software Rhinoceros®, Figura 4. Con estas nubes de puntos se genera un conjunto de splines formando una curva cerrada y suave para cada una de las fronteras y cada corte realizado, utilizando la vista axial.
Ya con el conjunto de curvas en cada uno de los cortes se utiliza un proceso de interpolación entre cada una de las capas con el objetivo de formar una superficie tubular que recorre el conjunto de cortes axiales. Este proceso se visualiza en la Figura 5, donde se crea una de las superficies, el conjunto de splines que generan la superficie que se muestra a la derecha se resaltan en color amarillo.

Tomando en cuenta que las curvas generadas son básicamente superficies sin espesor definido, es necesario generar una especie de tapa en los extremos con la finalidad de construir un objeto tridimensional sólido.
Por último la geometría tridimensional se exporta a un software de cálculo mediante el método del elementos finitos (MEF), en el caso de esta investigación Abaqus®, donde se analiza la geometría cuidando que la misma no presente ningún tipo de discontinuidad debido a que le haría perder su condición de sólido, lo que imposibilita el proceso de mallado. Una vez realizado este proceso se establecen las condiciones de frontera, se simula el proceso de presión arterial de 120/80 mmHg y se analiza la convergencia de la malla, esta se aseguró utilizando más de 600,000 elementos del tipo brick hexaédrico de 8 nodos.
Modelado de la arteria
Como se describió anteriormente la arteria posee un comportamiento material viscoelástico, este tipo de comportamiento consiste básicamente en una combinación de dos clases de materiales.
El primer comportamiento material es el del sólido elástico el cual se caracteriza con la ecuación:

Donde σ(t) es el esfuerzo, E es el modulo de Young y Є(t) es la deformación. Sus características intrínsecas consisten en que al momento de aplicar una fuerza al material la deformación le es directamente proporcional y al momento de retirar esta fuerza el material regresa a su configuración inicial. El material almacena la energía durante el proceso de deformación y la libera en su totalidad cuando esta es retirada. El comportamiento material del sólido elástico suele representarse mediante un resorte.
El segundo tipo de comportamiento se conoce como fluido viscoso Newtoniano, cuya ecuación constitutiva tiene la forma:
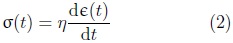
Con η conocido como el coeficiente de viscosidad. En este tipo de materiales si un esfuerzo es aplicado el material se deforma con una relación directamente proporcional a la velocidad de deformación, sin embargo al final de la aplicación de la fuerza el material no recupera nada de su forma original, este tipo de material disipa gradualmente toda la energía del proceso de deformación. El mismo suele representarse mecánicamente mediante un amortiguador viscoso.
La teoría de la viscoelasticidad lineal se basa en un comportamiento que se encuentra entre el elástico y el viscoso, suele representarse mediante arreglos de resortes y amortiguadores en serie o paralelo y combinaciones de éstos. Por lo que esta relación es descrita mediante una ecuación diferencial con coeficientes constantes. Para este tipo de materiales la relación esfuerzo-deformación, también puede ser definida utilizando el principio de superposición de Maxwell-Boltzmann, por la ecuación constitutiva:
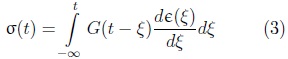
o
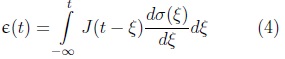
Donde G(t) y J (t) son los módulos de relajación a los esfuerzos y el de fluencia o creep respectivamente.
A continuación se describen la relación del módulo de relajación a los esfuerzos y el módulo de fluencia, con los ensayos de obtención de parámetros mecánicos, a su vez se describen los experimentos oscilatorios de donde se obtienen los coeficientes de viscoelasticidad que regirán el comportamiento material de la arteria.
Ensayos de fluencia y relajación a los esfuerzos
El ensayo de fluencia o creep, consiste en aplicar instantáneamente un esfuerzo de magnitud σ0 y mantenerlo constante después, mientras se mide la deformación como una función del tiempo, la deformación resultante es conocida como fluencia. En el caso de los ensayos de relajación de esfuerzos, una deformación instantánea de magnitud Є0 es impuesta a una muestra del material y esta se mantiene mientras se registra el esfuerzo como una función dependiente del tiempo, el decremento en los valores del esfuerzo durante la duración del ensayo, es conocido como la relajación a los esfuerzos. Estos tipos de ensayos se realizan de forma uniaxial, biaxial y volumétrica, en el caso de esta investigación se tomaron los datos de ensayos de relajación de esfuerzos uniaxial realizados en un segmento de arteria tomada de un donador fallecido por causas no relacionadas con enfermedades cardiovasculares, del sexo masculino de 45 años de edad. [21]
Ensayos oscilatorios
El comportamiento de los materiales viscoelásticos cuando se encuentran sujetos a un estado de esfuerzos en forma de una función armónica, es decir una función continua y periódica, es una de las propiedades más importantes de la teoría de la viscoelasticidad y soporta una parte fundamental de esta investigación. Considérese la respuesta del material cuando este se sujeta a una deformación de frecuencia ω como:
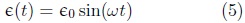
A su vez el estado de esfuerzos cambia con respecto a la frecuencia ω con una traslacion ø con respecto al esfuerzo inicial,

Este fenómeno básicamente se visualiza de la siguiente manera: al someter una muestra de material a una deformación armónica (oscilación), la respuesta es nuevamente una función armónica con una traslación. Reemplazando la ecuación (6) en la ecuación (3), se puede obtener la ecuación constitutiva en la forma:

con
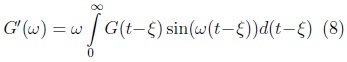
y
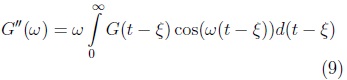
donde G'(ω), G"(ω) son conocidas como el módulo de almacenamiento y el de pérdidas respectivamente. Expresando las funciones armónicas en el plano complejo se obtiene:
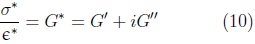
Donde G* es definida como el modulo complejo y es simplemente la norma del vector formado por las contribuciones del módulo de almacenamiento y el de pérdidas.
Modelos fraccionales viscoelásticos
Los modelos fraccionales viscoelásticos proporcionan una transición suave, continua y gradual entre el estado sólido y del fluido viscoso. Introduciendo un nuevo elemento fraccional conocido como spring-pot, por la unión de los nombres en inglés del resorte (spring) y el amortiguador (dashpot), mostrando desde su nombre que este nuevo elemento se encuentra oscilando entre el estado sólido y el fluido viscoso, la representación del nuevo elemento, junto con los tradicionales se ilustra en la Figura 6.

La ecuación constitutiva relacionada con el elemento fraccional  contiene a la derivada fraccional de Caputo [22], donde α es el orden fraccional de la derivada, definida como:
contiene a la derivada fraccional de Caputo [22], donde α es el orden fraccional de la derivada, definida como:
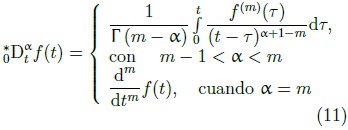
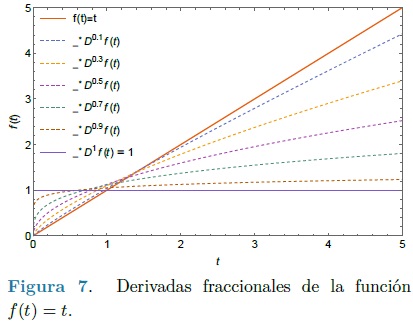
En el caso de que α no sea un número entero la definición de Caputo requiere que la m-ésima derivada de la función sea integrable. El motivo de la elección de la definición de Caputo, se realiza debido a que ésta presenta ciertas ventajas de simplificación cuando se emplea en el análisis y solución de problemas donde las condiciones iniciales se definen en términos de derivadas de orden entero, como lo son la deformación inicial y la velocidad. En la Figura 7 se ilustra el proceso de transición que brinda la definición de la derivada fraccional de Caputo, aquí se puede observar una serie de 5 derivadas entre la función lineal f (t) = t y su derivada f '(t) = 1.
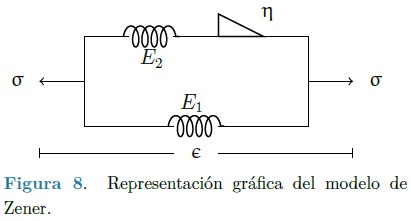
El modelo empleado en la caracterización del comportamiento material de la aorta es el del sólido lineal estándar, también conocido como modelo de Zener en el caso fraccional. El arreglo se muestra en la Figura 8.
La ecuación diferencial fraccional del modelo de Zener, tiene la forma:
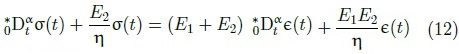
Donde E1 y E2 de elasticidad y η es la constante relacionada con la viscosidad, de los resortes y el amortiguador respectivamente. El procedimiento de solución de la ecuación diferencial fraccionaria utilizando transformadas de Laplace puede ser consultada en [23]. Como parte final de la sección de metodología, se incluye un diagrama de flujo (Figura 9) donde se representa de forma resumida los procedimientos realizados en el proceso de reconstrucción geométrica y su exportación al software MEF donde se realiza el análisis y se obtiene la simulación tridimensional del comportamiento mecánico de la arteria.

RESULTADOS
El primer resultado obtenido es en el que se sustenta principalmente la investigación, y consiste en la obtención de una representación geométrica de un segmento de la aorta con sus tres capas constituyentes, la misma puede ser manipulada y analizada en un software de MEF considerándola un sólido bien definido y continuo, donde además cada una de las capas puede ser utilizada de forma independiente. En la Figura 10 se muestra el segmento de arteria construido y la ubicación que esta ocupa en el cuerpo humano.

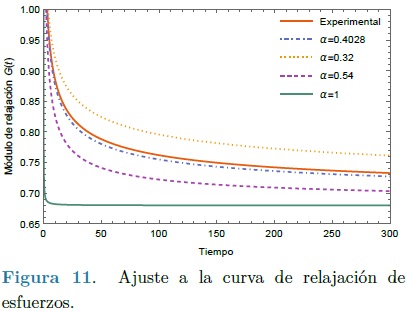
Además de contar con la geometría es necesario determinar los parámetros mecánicos del modelo de comportamiento material, con esta finalidad, primero se determinó el orden del modelo fraccional de Zener. Esto se realizó mediante un ajuste de curvas de los datos experimentales de relajación a los esfuerzos utilizando el método numérico de Levenberg-Marquardt. En este método a diferencia del de mínimos cuadrados, es posible determinar los coeficientes de la función a minimizar y el orden de la misma. Sin embargo, como se mencionó anteriormente, en esta investigación se utilizarón los valores obtenidos para un segmento de arteria extraída de un paciente fallecido cuyos parámetros son: E1 = 0.68MPa, E2 = 0.39MPa y η = 2.14MPa, y que fueron obtenidos por Craiem et al [14] por lo que se ajustó solamente el orden del modelo. En la Figura 11 se muestra la convergencia de la función de relajación, donde se determinó el orden fraccional del modelo diferencial, obteniendo el valor de α = 0. 4028, con un coeficiente de correlación del 99.8%.
Una vez determinados los parámetros del modelo fue posible determinar el comportamiento material del tejido de la arteria. En la Figura 12, se muestra la relación de esfuerzos para el modelo fraccional de Zener, donde una fuerza tipo escalón unitario es aplicada durante 5 segundos y después es retirada. Inicialmente se observa un estado de incremento de tensión no lineal y a partir de que la fuerza se retira el material cae en un estado de relajación.

Por último se procedió a determinar los módulos de almacenamiento y los de pérdidas para un rango de valores de frecuencia, ya que el software de MEF Abaqus® cuenta con la posibilidad de caracterizar el comportamiento material viscoelástico a través de una tabla de coeficientes obtenidos mediante experimentos oscilatorios. Aplicando el método numérico de Gauss-Kronrod para el cálculo de integrales numéricas basado en puntos de control [24] fue posible obtener los datos requeridos a partir de la descomposición en una parte real y otra imaginaria del módulo complejo, el cual tiene la forma:

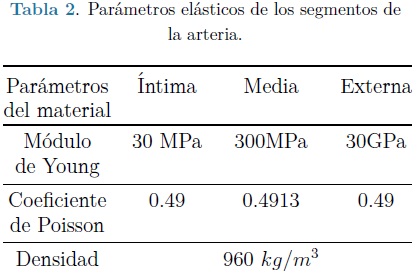
La tabla 1, contiene una muestra de los valores resultantes obtenidos para distintos rangos de frecuencia. Estos valores se introdujeron para cada una de las capas de la arteria junto con su respectivo módulo de Young, coeficiente de Poisson y densidad del material, estos últimos se muestran en la tabla 2.

Ya que se cuenta con todos los parámetros requeridos y la geometría, se procedió a introducir la información en el software Abaqus.
A continuación se muestran los resultados de la simulación tridimensional. En la Figura 13, se muestra un conjunto de cortes axiales de los patrones de las geometrías deformadas y en escalas de colores la distribución de los esfuerzos. Se debe de considerar que en estas figuras se muestra una tendencia de la deformación y de los patrones de esfuerzo, que pueden distar ligeramente del comportamiento real debido a que se muestra un factor de escala que en este caso es del 140% para la deformación y a que el modelo simplifica de cierta forma el comportamiento real del material. Las zonas de esfuerzo máximo se indican en color rojo y tienen un valor de 0.204MPa, las zonas mínimas se indican en azul y son del orden de los 0.16MPa. En la gama del verde al amarillo se muestran los valores de esfuerzos que están dentro de este rango.

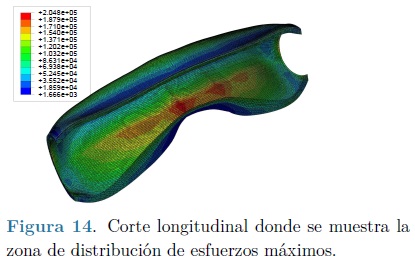
Con la finalidad de apreciar de forma más precisa el área donde se localizan los esfuerzos máximos, según el criterio de von Mises, se muestra un corte longitudinal de una arteria en la Figura 14.
DISCUSIÓN
Se logró obtener una representación geométrica del segmento de arteria a partir de imágenes obtenidas mediante un TAC. Se efectuó la simulación tridimensional mediante MEF del segmento de arteria, basada en datos clínicos, utilizando el modelo viscoelástico fraccional de Zener. Se comprobó que los modelos fraccionales brindan un efecto transitorio suave y continuo entre los sólidos elásticos y los fluidos viscosos, que es en el espectro donde se encuentra el comportamiento biomecánico de los tejidos biológicos blandos y en particular las paredes arteriales. Se determinó la distribución de esfuerzos y la tendencia de deformación de la arteria donde el rango de esfuerzos máximos, bajo el criterio de von Mises, concuerda con los obtenidos por Balzani para tejidos formados principalmente por colágeno [25] y los de Holzapfel & Sommer, utilizando el modelo de hiperelasticidad y ensayos biaxiales [26, 27]. Por otra parte, se identificó el lugar geométrico donde este segmento de arteria presenta la concentración de esfuerzos máximos, este sitio es el mismo que se reporta en las investigaciones de Richardson [28], quien relaciona la zona de curvatura de la arteria con la de mayor formación de placa ateroesclerosa y con la de Hoi [29] donde se analizan los efectos de los cambios en la geometría de la arteria con la aparición de aneurismas. Por consiguiente se demuestra la importancia de basar las simulaciones digitales en las geometrías reales de las arterias. A su vez se comprueba las funciones de las capas [19], donde se reconoce principalmente la función de la media, la cual disipa de manera continua la presión hacia la capa externa, este fenómeno se observa en la distribución uniforme de los esfuerzos en la misma.
LIMITACIONES
Como es bien conocido la arteria al igual que la mayoría de los tejidos blandos presenta una condición de anisotropía, es decir que tiene direcciones preferenciales de deformación debido a la configuración del tejido muscular. Por lo que es necesario desarrollar modelos fraccionales del material que contemplen este fenómeno y la heterogeneidad de los materiales que constituyen estos tejidos.
Este tipo de materiales biológicos tienden a autorepararse, reorganizarse, cambiar sus propiedades mecánicas, su longitud, etc. Lo que constituye una limitante en la adquisición de parámetros mecánicos in-vivo.
Otra limitante de este trabajo es que el procedimiento seguido para la obtención de la geometría se dificulta en la presencia de bifurcaciones, ya que las superficies no pueden generarse siguiendo el proceso descrito.
AGRADECIMIENTOS & CONFLICTOS DE INTERÉS
Los autores deseamos agradecer a las instituciones que han hecho posible la presente investigación. El Instituto Tecnológico Superior de Cajeme, Tecnológico Nacional de México y el grupo de investigaciones biomecánicas del Instituto Superior Politécnico José Antonio Echeverría, La Habana, Cuba. A su vez declaramos no tener ningún tipo de conflicto de interés.
REFERENCIAS
[1] J. O'Connor-Blanco, M. Rodríguez-Madrigal, H. Calas, E. Moreno, et al. Modelación y simulación de sistemas biomecánicos acoplados utilizando el método de los elementos finitos. aplicaciones en ortopedia. In V Latin American Congress on Biomedical Engineering CLAIB 2011 May 16-21, 2011, Habana, Cuba, volume 33 of IFMBE Proceedings, pages 619-622. Springer Berlin Heidelberg, 2013. [ Links ]
[2] V. Domínguez, M. Carbajal, G. Urriolagoitia, L. Hernández, et al. Biomecánica de un fémur sometido a carga. desarrollo de un modelo tridimensional por medio del método del elemento finito. Rev. Mex. Ortop. Traumatol, 13(6):633-8, 1999. [ Links ]
[3] V. Huayamave, C. Rose, S. Serra, B. Jones, et al. A patient-specific model of the biomechanics of hip reduction for neonatal developmental dysplasia of the hip: Investigation of strategies for low to severe grades of ddh. Journal of Biomechanics, 2015. [ Links ]
[4] J. Palacio, S. Hammer, D. Good, S. McNeill, et al. Quantitative diagnostic soft tissue through viscoelastic characterization using time-based instrumented palpation. Journal of the Mechanical Behavior of Biomedical Materials, 12(41):149-160, 2015. [ Links ]
[5] D. Bia, I. Aguirre, Y. Zócalo, L. Devera, et al. Diferencias regionales en viscosidad, elasticidad y amortiguamiento parietal de arterias sistémicas: análisis isopulsátil de la relación presión-diámetro arterial. Revista Española de Cardiología, 58(2):167-174, 2005. [ Links ]
[6] J. Goicolea. Factores biomecánicos y su influencia en la función cardiovascular. Revista Española de Cardiología, 58(2):121-125, 2005. [ Links ]
[7] R. Magin. Fractional calculus models of complex dynamics in biological tissues. Computers and Mathematics with Applications, 12(59):1586-1593, 2010. [ Links ]
[8] J. Kauffman and C. Drapaca. A fractional pressure-volume model of cerebrospinal fluid dynamics in hydrocephalus. In Mechanics of Biological Systems and Materials, Volume 4: Proceedings of the 2013 Annual Conference on Experimental and Applied Mechanics, page 179. Springer Science & Business Media, 2013. [ Links ]
[9] D. Nagehan and T. Ergin. Non-integer viscoelastic constitutive law to model soft biological tissues to in-vivo indentation. Acta of Bioengineering and Biomechanics, (4):13-21, 2014. [ Links ]
[10] G. Davis, M. Kohandel, S. Sivaloganathan, and G. Tenti. The constitutive properties of the brain paraenchyma: Part 2. fractional derivative approach. Medical Engineering & Physics, 28(5):455-459, 2006. [ Links ]
[11] S. Bentil and R. Dupaix. Exploring the mechanical behavior of degrading swine neural tissue at low strain rates via the fractional zener constitutive model. Journal of the Mechanical Behavior of Biomedical Materials, 30:83-90, 2014. [ Links ]
[12] B. Rashid, M. Destrade, and M. Gilchrist. Hyperelastic and viscoelastic properties of brain tissue in tension. In Proceedings of the ASME 2012 International Mechanical Engineering Congress & Exposition IMECE 2012 Nov 9-15, 2012, Houston, Texas, USA, pages 619-622. ASME, 2012. [ Links ]
[13] C. Wex, C. Bruns, and A. Stoll. Fractional kelvin-voight model for liver tissue in the frequency and time domain. Scottish Journal of Arts, Social Sciences and Scientific Studies, 11(2):69-78, 2014. [ Links ]
[14] D. Craiem, F. Rojo, J. Atienza, R. Armentano, et al. Fractional-order viscoelasticity applied to describe uniaxial stress relaxation of human arteries. Physics in Medicine and Biology, 12(53):4543-4554, 2008. [ Links ]
[15] D. Craiem and R. Armentano. A fractional derivative model to describe arterial viscoelasticity. Biorheology, 12(44):251-263, 2007. [ Links ]
[16] J. Córdova-Villalobos, J. Barriguete-Meléndez, A. Lara-Esqueda, S. Barquera, et al. Las enfermedades crónicas no transmisibles en México: sinopsis epidemiológica y prevención integral. Salud publica de México, 50(5):419-427, 2008. [ Links ]
[17] J. Muller, S. Binting, S. Roll, and S. Willich. An update on regional variation in cardiovascular mortality within europe. European Heart Journal, 29(10):1316-1326, 2008. [ Links ]
[18] C. Martin, W. Sun, T. Pham, and J. Elefteriades. Predictive biomechanical analysis of ascending aortic aneurysm rupture potential. Acta Biomaterialia, 9(12):9392-9400, 2013. [ Links ]
[19] A. Tsamis, J. Krawiec, and D. Vorp. Elastin and collagen fibre microstructure of the human aorta in ageing and disease: A review. Journal of The Royal Society Interface, 10(83), 2013. [ Links ]
[20] Y. Fung. Biomechanics: Motion, Flow, Stress, and Growth. Springer, 2nd edition, 1990. [ Links ]
[21] D. Craiem, F. Rojo, J. Atienza, G. Guinea, et al. Fractional calculus applied to model arterial viscoelasticity. Latin American Applied Research, 12(38):141-145, 2008. [ Links ]
[22] M. Caputo. Diffusion with space memory modelled with distributed order space fractional differential equations. Annals of Geophysics, 46(2):121-130, 2003. [ Links ]
[23] J.E. Palomares-Ruiz, M. Rodriguez-Madrigal, J.G. Castro-Lugo, and A.A. Rodriguez-Soto. Fractional viscoelastic models applied to biomechanical constitutive equations. Revista Mexicana de Física, 61(4):261-267, 2015. [ Links ]
[24] Giovanni Monegato. Kronrod and other quadratures. In Walter Gautschi, Volume 2, pages 27-33. Springer, 2014. [ Links ]
[25] D. Balzani, S. Brinkhues, and G. Holzapfel. Constitutive framework for the modeling of damage in collagenous soft tissues with application to arterial walls. Computer Methods in Applied Mechanics Engineering, 11(15):139-151, 2012. [ Links ]
[26] G. Holzapfel, G. Sommer, C. Gasser, and P. Regitnig. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology -Heart and Circulatory Physiology, 289(5):H2048-H2058, 2005. [ Links ]
[27] G. Sommer and G. Holzapfel. 3d constitutive modeling of the biaxial mechanical response of intact and layer-dissected human carotid arteries. Journal of the Mechanical Behavior of Biomedical Materials, 5:116-128, 2012. [ Links ]
[28] P. Richardson. Biomechanics of plaque rupture: Progress, problems, and new frontiers. Annals of Biomedical Engineering, 30(4):524-536, 2002. [ Links ]
[29] Y. Hoi, H. Meng, S. Woodward, B. Bendok, et al. Effects of arterial geometry on aneurysm growth: three-dimensional computational fluid dynamics study. Journal of Neurosurgery, 101(4):676-681, 2004. [ Links ]














