INTRODUCCIÓN
En general las microalgas son organismos acuáticos de unas cuantas micras; en su mayoría fotoautótrofos, aunque algunas especies pueden presentar un metabolismo mixótrofo o heterótrofo (Brennan & Owende, 2010; Ruiz, 2011; Jbari, 2012).
Cuentan con una alta eficiencia en la fijación del CO2, incluso hasta cuatro veces superior a la de las plantas terrestres (Bermeo, 2011), de igual forma colaboran en la liberación de oxígeno, el cual es vital para la mayoría de los seres vivos (Martínez, 2015; Jbari, 2012). Las microalgas no son exclusivas de ambientes acuáticos, por lo que existen especies que pueden vivir en ambientes terrestres y aéreos y en condiciones extremas como: cavernas, suelos desérticos, hielos o nieves, lagos hipersalinos, ácidos, alcalinos y con elevadas temperaturas (Gómez, 2007).
Las microalgas tienen gran importancia en el tratamiento de aguas residuales provenientes de zonas urbanas, industriales o agrícolas, este tipo de aguas son ricas en carbono, nitrógeno y fósforo, los cuales son aprovechados por estos organismos para su crecimiento (González et al., 1992; Jbari, 2012), por lo que a través de su consumo, reducen la concentración de nutrientes, lo que contribuyen a la depuración del agua y a la liberación de oxígeno que es aprovechado por otros organismos acuáticos y terrestres (Méndez et al., 2010; Codina et al., 2012). Además, la biomasa resultante puede tener una gran variedad de usos, como biofertilizantes, suplementos alimenticios, productos farmacéuticos y cosméticos; (AST Ingeniería S. L, 2013; Hernández & Labbé, 2014).
Sobre el estudio florístico de las microalgas de Xochimilco, existen varios trabajos que dan información sobre su diversidad en ese cuerpo de agua y sirven de referencia como indicadores biológicos a través de conocer el nivel de estabilidad o cambio en su estructura comunitaria a lo largo del tiempo y del espacio, asociada a cambios ambientales y climáticos. Los grupos algales predominantes en este sitio son: Bacillariophyta, Chlorophyta, Cyanoprocaryota, Pyrrophyta, Euglenophyta y Chrysophyta (Sámano-Bishop, 1933; Flores, 1980; Reynoso, 1986; Santos, 2004; Velasco, 2004; Hernández, 2007; Figueroa et al., 2008 y 2015; López et al., 2015 y Tavera et al., 2018). Considerando la importancia de las microalgas, el objetivo planteado en este trabajo fue, conocer la composición y distribución de la ficoflora asociada a un vertedero proveniente de PTAR Cerro de la Estrella, sobre un canal de la zona chinampera de Xochimilco, Ciudad de México y su relación con algunas variables físicas y químicas.
MATERIALES Y MÉTODOS
El sistema lacustre de Xochimilco se encuentra al sur de la Ciudad de México, entre las coordenadas geográficas: 19° 00’ y 19° 20’ Latitud Norte; 99° 00’ y 99° 16’ Longitud Oeste, con una superficie aproximada de 2 657 ha, y una altitud de entre 2240 a 2500 msnm (Arcos et al., 2002; Abeja, 2011; GDF, 2013). El clima es templado subhúmedo, con lluvias en verano y con una temperatura media anual que varía entre 8 a 18ºC. La precipitación pluvial promedio es de 620 mm/año, las lluvias más abundantes se presentan entre los meses de junio y septiembre y las mínimas de diciembre a febrero (Molina, 2009).
Xochimilco tiene una longitud aproximada de 203 km de canales interconectados, entre los más importantes se encuentran el de Cuemanco, el Nacional, Chalco, del Bordo, Apatlaco, San Sebastián, Apampilco, Texhuilo y Japón. Las principales lagunas son Tlilac, del Toro, Huetzalin, Apampilco, Texhuilo, además del Lago de conservación de flora y fauna de San Gregorio Atlapulco (GDF, 2006).
El área de estudio se localiza en el antiguo canal de Cuemanco, donde en el efluente proveniente de la Planta de tratamiento de agua residual (PTAR) Cerro de la Estrella se establecieron seis puntos de muestreo: 1) en el efluente de la PTAR, 2) en la caída de agua de este sitio que conecta a un canal, los siguientes puntos se colocaron a distancias conocidas; 3) 10 m, 4) 20 m 5) 40 m y 6) 60 m (Fig. 1).
Para conocer la composición de las microalgas se tomaron dos tipos de muestras, las primeras para análisis cuantitativo, se tomaron con ayuda de una botella Van Dorn, se guardaron en frascos de 500 mL y se les añadió lugol al 1% final; en cuanto a las segundas, para análisis cualitativo se empleó una red de arrastre con abertura de malla de 54 µm, estas muestras se depositaron en frascos ámbar de 30 mL y se les agregó formalina al 4% final. De cada punto se registraron datos de pH mediante un potenciómetro marca HANNA, temperatura y conductividad con una sonda YSI, profundidad y turbidez con un disco de Secchi. Además, se tomaron 100 mL de agua para determinar en el laboratorio los nutrientes: nitritos (NO2), nitratos (NO3-), amonio (NH4+) y ortofosfatos (PO43-) a partir de las técnicas basadas en APHA (1989), utilizando un Fotómetro Multiparamétrico HANNA, modelo HI 83200.
La revisión de muestras de microalgas se llevó a cabo en el laboratorio de Ficología y Fitofarmacología de la UAM Xochimilco, utilizando un microscopio óptico marca Zeiss modelo Axiostar. Se tomaron alícuotas de 0.1 mL y se revisaron con la técnica de barrido propuesta por Schwöerbel (1975), la cual consiste en localizar un punto de inicio y hacer la revisión en forma de “transectos”, de cada muestra se revisaron las alícuotas necesarias hasta que no se observó ningún organismo nuevo. Se tomaron fotomicrografías de las distintas especies observadas y se les realizó conteos celulares con la misma técnica con el fin de conocer su distribución y abundancia.
Para la identificación taxonómica de las especies se utilizaron las descripciones y claves de Bourrelly (1966, 1968, 1970), Whitford & Schumancher (1969), Ortega (1972, 1984), Figueroa & Moreno (2003), Figueroa et al. (2008), Valadez et al. (2010) y Guiry & Guiry (2022).
Para analizar las diferencias en los valores de las concentraciones de nutrientes y parámetros tomados in situ y los analizados en el laboratorio, de los puntos de muestreo, se obtuvo el coeficiente de variación; por otra parte, se realizó un análisis de correlación lineal para conocer que parámetros tomados en campo influyeron en la riqueza y abundancia de especies en cada punto de muestreo, ambos análisis se realizaron utilizando el programa Excel versión 2013.
RESULTADOS
Se encontró un total de 88 especies (Figs. 2-4) pertenecientes a siete Phylum, 25 Órdenes, 36 Familias y 56 Géneros (Tablas 1, 2 y 3), siendo Bacillariophyta el Phylum más diverso con 35 especies, seguido de Chlorophyta con 26, mientras que los Phylum Euglenozoa, Cyanobacteria y Miozoa tuvieron 16, 6 especies respectivamente, por otra parte, los Phylum Ochophyta y Cryptista solo presentaron una especie.

Figura 2 Achnanthidium minutissimum, 2. Halamphora montana, 3. Amphora ovalis, 4. Aulacoseira granulata, 5. Aulacoseira granulata var. angustissima, 6. Brebissonia lanceolata, 7. Caloneis bacillum, 8. Cocconeis placentula, 9. Stephanocyclus meneghinianus, 10. Denticula elegans, 11. Encyonema minutum, 12. Epithemia adnata, 13. Epithemia cf. muelleri, 14. Epithemia turgida, 15. Eunotia metamonodon, 16. Eunotia minor, 17. Ulnaria acus, 18. Staurosira cf. construens, 19. Staurosira venter, 20. Fragilaria dorsiventralis, 21. Gomphonema affine, 22. Gomphonema exilissimum, 23. Gomphonema lagenula, 24. Gomphonema sp 1, 25. Gomphonema sp 2, 26. Lemnicola hungarica, 27. Navicula sp 1, 28. Navicula sp 2, 29. Placoneis elginensis, 30. Rhoicosphenia abbreviata, 31. Rhopalodia gibberula, 32. Sellaphora pupula, 33. Staurosira construens, 34. Tabularia fasciculata, 35. Ulnaria ulna. Barras = 10µm.

Figura 3 Ankistrodesmus falcatus, 2. Chlorella sp, 3. cf. Coelastrum microporum, 4. Coelastrum pseudomicroporum, 5. Comasiella arcuata var. platydisca, 6. Desmodesmus abundans, 7. Desmodesmus armatus var. bicaudatus, 8. Desmodesmus armatus var. longispina, 9. Desmodesmus communis, 10. Desmodesmus denticulatus, 11. Desmodesmus opoliensis, 12. Desmodesmus protuberans, 13. Monoraphidium griffithii, 14. Oocystis borgei, 15. Pectinodesmus javanensis, 16. Pectinodesmus pectinatus f. tortuosus, 17. Pediastrum duplex, 18. Pseudopediastrum boryanum var. longicorne, 19. Pteromonas aculeata, 20. Comasiella cf arcuata, 21. Scenedesmus ellipticus, 22. Staurastrum sp, 23. Stauridium tetras, 24. Tetradesmus dimorphus, 25. Tetraëdriella regularis, 26. cf. Tetraselmis cordiformis, 27. Tetrastrum staurogeniiforme. Barras = 10µm.

Figura 4 Euglenaformis proxima, 2. Lepocinclis acus, 3. Lepocinclis caudata, 4. Lepocinclis fusiformis, 5. Lepocinclis teres, 6. Monomorphina aenigmatica, 7. Monomorphina pyrum, 8. Phacus acuminatus, 9. Phacus cf. inflexus, 10. Phacus cf. raciborskii, 11. Phacus orbicularis, 12. Trachelomonas abrupta, 13. Trachelomonas sp, 14. Trachelomonas verrucosa, 15. Trachelomonas volvocina, 16. Trachelomonas volvocinopsis, 17. Chroococcus turgidus18. Microcystis aeruginosa, 19. Oscillatoria ornata, 20. Phormidium sp, 21. Planktothrix agardhii, 22. Romeria victoriae, 23. Cryptomonas sp, 24. Gymnodinium sp, 25. Glochidinium penardiforme, 26. Peridinium cf. volzii. Barras = 10µm.
Tabla 1 Microalgas del Phylum Bacillariophyta del vertedero Cerro de la Estrella.
| Orden | Familia | Género | Especie |
|---|---|---|---|
| Achnanthales | Cocconeidaceae | Cocconeis | Cocconeis placentula Ehrenberg |
| Aulacoseirales | Aulacoseiraceae | Aulacoseira | Aulacoseira granulata (Ehrenberg) Simonsen |
| Aulacoseira granulata var. angustissima (Otto Müller) Simonsen | |||
| Bacillariales | Bacillariaceae | Denticula | Denticula elegans Kützing |
| Cocconeidales | Achnanthidiaceae | Achnanthidium | Achnanthidium minutissimum (Kützing) Czarnecki |
| Lemnicola | Lemnicola hungarica (Grunow) Round & Basson | ||
| Cymbellales | Cymbellaceae | Brebissonia | Brebissonia lanceolata (C.Agardh) R.K.Mahoney & Reimer |
| Gomphonemataceae | Encyonema | Encyonema minutum (Hilse) D.G.Mann | |
| Gomphonema | Gomphonema lagenula Kützing | ||
| Gomphonema affine Kützing | |||
| Gomphonema exilissimum (Grunow) Lange-Bertalot & E.Reichardt | |||
| Gomphonema sp 1 Ehrenberg | |||
| Gomphonema sp 2 Ehrenberg | |||
| Placoneis | Placoneis elginensis (W.Gregory) E.J.Cox | ||
| Rhoicospheniaceae | Rhoicosphenia | Rhoicosphenia abbreviata (C. Agardh) Lange-Bertalot | |
| Eunotiales | Eunotiaceae | Eunotia | Eunotia metamonodon Lange-Bertalot |
| Eunotia minor (Kützing) Grunow | |||
| Fragilariales | Fragilariaceae | Fragilaria | Fragilaria dorsiventralis (Otto Müller) Lange-Bertalot |
| Staurosiraceae | Staurosira | Staurosira construens Ehrenberg | |
| Staurosira cf. construens Ehrenberg | |||
| Staurosira venter (Ehrenberg) Cleve & J.D. Möller | |||
| Licmophorales | Ulnariaceae | Ulnaria | Ulnaria ulna (Nitzsch) Compère |
| Ulnaria acus (Kützing) Aboal | |||
| Tabularia | Tabularia fasciculata (C.Agardh) D.M Williams & Round | ||
| Naviculales | Naviculaceae | Caloneis | Caloneis bacillum (Grunow) Cleve |
| Navicula | Navicula sp 1 Ehrenberg | ||
| Navicula sp 2 Ehrenberg | |||
| Sellaphoraceae | Sellaphora | Sellaphora pupula (Kützing) Mereschkovsky | |
| Amphipleuraceae | Halamphora | Halamphora montana (Krasske) Levkov | |
| Rhopalodiales | Rhopalodiaceae | Epithemia | Epithemia adnata (Kützing) Brébisson |
| Epithemia cf. muelleri Fricke | |||
| Epithemia turgida (Ehrenberg) Kützing | |||
| Rhopalodia | Rhopalodia gibberula (Ehrenberg) Otto Müller | ||
| Thalassiosirales | Thalassiosiraceae | Stephanocyclus | Stephanocyclus meneghinianus (Kützing) Kulikovskiy, Genkal & Kociolek |
| Thalassiophysales | Catenulaceae | Amphora | Amphora ovalis (Kützing) Kützing |
Tabla 2 Microalgas del Phylum Chlorophyta del vertedero Cerro de la Estrella.
| Orden | Familia | Género | Especie |
| Chlamydomonadales | Phacotaceae | Pteromonas | Pteromonas aculeata Lemmermann |
| Chlorellales | Chlorellaceae | Chlorella | Chlorella sp Beyerinck [Beijerinck] |
| Oocystaceae | Oocystis | Oocystis borgei J.W.Snow | |
| Chlorodendrales | Chlorodendraceae | Tetraselmis | cf. Tetraselmis cordiformis (H.J.Carter) F.Stein |
| Desmidiales | Desmidiaceae | Staurastrum | Staurastrum sp Meyen ex Ralfs |
| Sphaeropleales | Pediastrum | Pediastrum duplex Meyen | |
| Hydrodictyaceae | Pseudopediastrum | Pseudopediastrum boryanum var. longicorne (Reinsch) Tsarenko | |
| Scenedesmaceae | Stauridium | Stauridium tetras (Ehrenberg) E.Hegewald | |
| Coelastrum | cf. Coelastrum microporum Nägeli | ||
| Coelastrum pseudomicroporum Korshikov | |||
| Comasiella | Comasiella arcuata var. platydisca (G.M.Smith) E.Hegewald & M.Wolf | ||
| Comasiella cf. arcuata (Lemmermann) E.Hegewald, M.Wolf, Al.Keller, Friedl & Krienitz | |||
| Desmodesmus | Demodesmus abundans (Kirchner) E.H.Hegewald | ||
| Desmodesmus armatus var. bicaudatus (Guglielmetti) E.H.Hegewald | |||
| Desmodesmus armatus var. longispina (Chodat) E.Hegewald | |||
| Desmodesmus communis (E.Hegewald) E.Hegewald | |||
| Desmodesmus denticulatus (Lagerheim) S.S.An, T.Friedl & E.Hegewald | |||
| Desmodesmus opoliensis (P.G.Richter) E.Hegewald | |||
| Desmodesmus protuberans (F.E.Fritsch & M.F.Rich) E.Hegewald | |||
| Pectinodesmus | Pectinodesmus pectinatus f. tortuosus (Skuja) E.Hegewald | ||
| Pectinodesmus javanensis (Chodat) E.Hegewald, C.Bock & Krienitz | |||
| Scenedesmus | Scenedesmus ellipticus Corda | ||
| Tetradesmus | Tetradesmus dimorphus (Turpin) M.J.Wynne | ||
| Tetrastrum | Tetrastrum staurogeniiforme (Schröder) Lemmermann | ||
| Selenastraceae | Ankistrodesmus | Ankistrodesmus falcatus (Corda) Ralfs | |
| Monoraphidium | Monoraphidium griffithii (Berkeley) Komárková-Legnerová |
Tabla 3 Microalgas de los Phylum Euglenozoa, Cyanobacteria, Miozoa, Cryptista y Ochrophyta del vertedero Cerro de la Estrella.
| Phylum | Orden | Familia | Género | Especie |
|---|---|---|---|---|
| Euglenozoa | Euglenales | Euglenaceae | Euglenaformis | Euglenaformis proxima (P.A.Dangeard) M.S.Bennett & Triemer |
| Monomorphina | Monomorphina aenigmatica (Drezepolski) Nudelman & Triemer | |||
| Monomorphina pyrum (Ehrenberg) Mereschkowsky | ||||
| Trachelomonas | Trachelomonas abrupta Svirenko [Swirenko] | |||
| Trachelomonas sp Ehrenberg | ||||
| Trachelomonas verrucosa A.C.Stokes | ||||
| Trachelomonas volvocina (Ehrenberg) Ehrenberg | ||||
| Trachelomonas volvocinopsis Svirenko | ||||
| Phacaceae | Lepocinclis | Lepocinclis acus (O.F.Müller) B.Marin & Melkonian | ||
| Lepocinclis caudata (A.M. da Cunha) Pascher | ||||
| Lepocinclis fusiformis (H.J.Carter) Lemmermann | ||||
| Lepocinclis teres (F.Schmitz) Francé | ||||
| Phacus | Phacus acuminatus Stokes | |||
| Phacus cf. inflexus (I.Kisselev) Pochmann | ||||
| Phacus cf. raciborskii Drezepolski | ||||
| Phacus orbicularis K.Hübner | ||||
| Cyanobacteria | Chroococcales | Chroococcaceae | Chroococcus | Chroococcus turgidus (Kützing) Nägeli |
| Microcystaceae | Microcystis | Microcystis aeruginosa (Kützing) Kützing | ||
| Oscillatoriales | Oscillatoriaceae | Oscillatoria | Oscillatoria ornata Kützing ex Gomont | |
| Phormidium | Phormidium sp Kützing ex Gomont | |||
| Microcoleaceae | Planktothrix | Planktothrix agardhii (Gomont) Anagnostidis & Komárek | ||
| Synechococaales | Romeriaceae | Romeria | Romeria victoriae Komárek & Cronberg | |
| Miozoa | Gymnodiniales | Gymnodiniaceae | Gymnodinium | Gymnodinium sp F.Stein |
| Peridiniales | Peridiniaceae | Glochidinium | Glochidinium penardiforme (Er.Lemmermann) Boltovskoy | |
| Peridinium | Peridinium cf. volzii Lemmermann | |||
| Cryptista | Cryptomonadales | Cryptomonadaceae | Cryptomonas | Cryptomonas sp Ehrenberg |
| Ochrophyta | Goniochloridales | Goniochloridaceae | Tetraëdriella | Tetraëdriella regularis (Kützing) Fott |
Del total de especies, las más frecuentes fueron las clorofitas Chlorella sp. Beyerinck [Beijerinck] y Desmodesmus protuberans (F.E.Fritsch & M.F.Rich) E.Hegewald y las diatomeas Stephanocyclus meneghinianus (Kützing) Kulikovskiy, Genkal & Kociolek y Gomphonema sp. Ehrenberg, encontrándose en los seis puntos muestreados.
En cuanto al número de organismos, las especies más abundantes fueron: Aulacoseira granulata var. angustissima (Otto Müller) Simonsen con 1120 cél/mL, S. meneghinianus y Aulacoseira granulata (Ehrenberg) Simonsen con 960 y 625 cél/mL respectivamente, pertenecientes al phylum Bacillariophyta y la Cyanobacteria: Microcystis aeruginosa (Kützing) Kützing con 490 cél/mL.
De los puntos muestreados, donde se registró la menor cantidad de especies fue el tomado directamente del vertedero con 16 (Fig. 5) mientras que el punto que presentó la mayor riqueza específica fue el ubicado a los 20 m de distancia del vertedero con 56 taxa.
Parámetros físicos y químicos
Los valores de los parámetros físicos y químicos tomados en campo se muestran en la Tabla 4. Se incluye el coeficiente de variación, el cual mostró que los parámetros fisicoquímicos monitoreados presentaron una proporción de variación baja en la mayoría de ellos (2-18%), a excepción del valor de la profundidad donde se obtuvo 37%.
Tabla 4 Valores de los factores físicos y químicos en el vertedero Cerro de la Estrella y en los diferentes puntos de muestreo.
| Turbidez (cm) | Profundidad (cm) | Temperatura (°C) | Conductividad (µS/cm) | pH | |
|---|---|---|---|---|---|
| Directa | ND | ND | 21.5 | 711 | 8.3 |
| Caída | 70 | 70 | 21.7 | 772 | 8 |
| 10m | 70 | 150 | 21.6 | 772 | 7.8 |
| 20m | 85 | 95 | 21.8 | 775 | 8 |
| 40m | 72 | 92 | 22.1 | 784 | 7.9 |
| 60m | 50 | 60 | 22.5 | 787 | 7.7 |
| Desviación estándar | 12.52 | 34.89 | 0.37 | 28.06 | 0.20 |
| Media aritmética | 69.4 | 93.4 | 21.86 | 766.83 | 7.95 |
| Coeficiente de Variación | 0.18 | 0.37 | 0.02 | 0.04 | 0.03 |
| CV expresado en porcentaje (%) | 18 | 37 | 2 | 4 | 3 |
La concentración de nitritos fue más alta en la muestra tomada directamente abajo del vertedero con 0.751 mg/L y la más baja a los 20 m con 0.621 mg/. Los nitratos variaron de 6.9 y 14 mg/L, encontrándose de igual forma el valor más alto en la muestra directa debajo del vertedero y el más bajo a los 20 m; por el contrario, la concentración más baja de amonio se encontró en la muestra directa debajo del vertedero con 0.0129 mg/L y la más alta en la muestra a los 20 m con 0.0174 mg/L. Por otra parte, las concentraciones de ortofosfatos variaron entre 5.4 y 7.1 mg/L, encontrándose el valor más bajo en la muestra tomada a los 40 m y la concentración más alta se registró en la muestra de 10 m (Fig. 6).
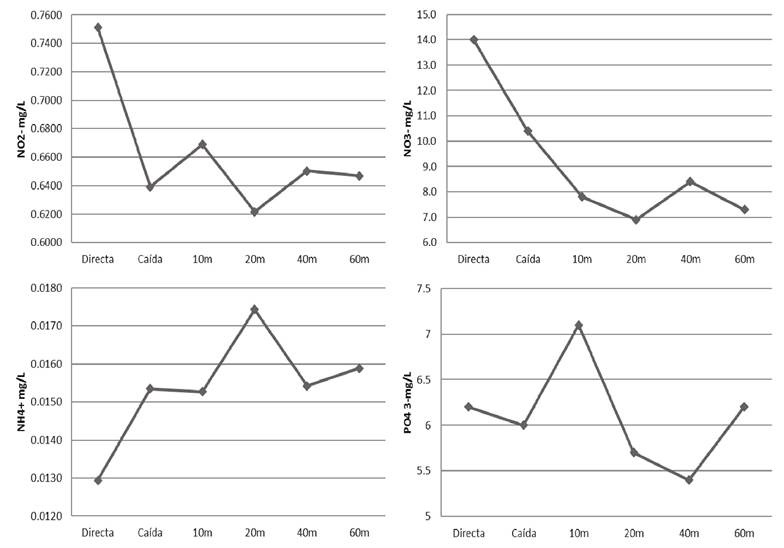
Figura 6 Concentraciones de nitritos (NO2-), nitratos (NO3-), amonio (NH4+) y ortofosfatos (PO43-) en los diferentes puntos de muestreo.
Con respecto a los valores de nitritos, nitratos y ortofosfatos obtenidos en las muestras se puede observar que al alejarse del vertedero estos disminuyen paulatinamente, a diferencia del amonio que muestra un comportamiento inverso.
Por otra parte, en cuanto a los valores del análisis de correlación lineal de la riqueza de especies, con respecto a los nitritos, nitratos y amonio tienen un valor más alto en comparación de la riqueza de especies con los parámetros físicos. En cambio, en cuanto a la abundancia, se observa que ésta tiene una correlación más alta con los nitritos y el amonio, así como con la conductividad (Tabla 5).
Tabla 5 Análisis de correlación lineal de parámetros físicos y químicos sobre la riqueza y abundancia de especies.
| Parámetro | Correlación con la riqueza de especies | Correlación con la abundancia de organismos |
|---|---|---|
| NO2 (mg/L) | 0.7584 | 0.6497 |
| NO3 (mg/L) | 0.8485 | 0.5187 |
| NH4 (mg/L) | 0.9059 | 0.7887 |
| PO4-3 (mg/L) | 0.0009 | 0.0704 |
| Temperatura (°C) | 0.1295 | 0.00001 |
| Conductividad (µS/cm-1) | 0.6184 | 0.3647 |
| pH | 0.4663 | 0.0848 |
| Turbidez (cm) | 0.6920 | 0.7997 |
| Profundidad (cm) | 0.4803 | 0.4484 |
DISCUSIÓN
Según los resultados, se determinó un total de 88 especies de microalgas, de las cuales 55 han sido reportadas previamente por diversos autores, en distintos sitios de los canales de Xochimilco y en diferentes temporadas; 33 son nuevos registros para la zona de estudio, lo que indica que aún no se conoce la totalidad de las especies en este lugar, lo cual puede deberse a que con el tiempo las condiciones del ambiente van cambiando, propiciando cambios en la composición, distribución y abundancia de las especies microalgales y a la introducción de nuevas especies provenientes de otros sitios como es el caso de los efluentes de aguas tratadas.
El phylum Bacillariophyta fue el que presentó mayor riqueza con 35 especies, de las cuales 25 han sido reportadas anteriormente en los canales de Xochimilco. La riqueza de especies de este phylum fue alta en comparación con los estudios realizados por Flores (1980), Reynoso (1986), Orozco (2011), Buendía et al. (2015), López et al. (2015) y Tavera et al. (2018), quienes registraron entre seis y 20 especies. Por su parte, es similar a lo indicado por Santos (2004), quien encontró 39 especies e inferior a lo encontrado por Figueroa et al. (2008), quienes reportaron 56 especies. Al comparar las especies encontradas con lo reportado por otros autores se observó que: Cocconeis placentula Ehrenberg, Aulacoseira granulata (Ehrenberg) Simonsen, Gomphonema affine Kützing, Rhoicosphenia abbreviata (C. Agardh) Lange-Bertalot, Ulnaria ulna (Nitzsch) Compère, Epithemia turgida (Ehrenberg) Kützing, Stephanocyclus meneghinianus (Kützing) Kulikovskiy, Genkal & Kociolek y Amphora ovalis (Kützing) Kützing, son frecuentes y han sido reportadas anteriormente en diferentes estudios realizados en Xochimilco (Flores, 1980; Reynoso, 1986; Figueroa et al., 2008; Orozco, 2011; Buendía et al., 2015; López et al., 2015; Tavera et al., 2018). Lo anterior permite señalar que estas diatomeas son euribiontes, ya que han podido crecer en sistemas de depuración de aguas residuales como en ambientes naturales donde las condiciones limnologicas son diferentes.
En cuanto al phylum Chlorophyta se registraron 26 especies, de las cuales 22 han sido reportadas anteriormente para los canales de Xochimilco, se comparó la riqueza de especies con lo reportado por Reynoso (1986), González (1991) y López et al. (2015), observando que la riqueza encontrada en este trabajo es mayor, dichos autores encontraron 10, 19 y siete especies respectivamente; sin embargo, es inferior a lo que reportan Sámano-Bishop (1933), Flores (1980), Velasco (2004) y Figueroa et al. (2008), quienes encontraron entre 34 y 48 especies. El género Desmodesmus es el que predominó en este estudio con siete especies, lo cual se explica por tratarse de ambientes lénticos someros con alta cantidad de nutrimentos (Comas et al., 2007). Cabe mencionar que se encontraron cuatro nuevos registros para la zona de estudio (Staurastrum sp. Meyen ex Ralfs, Comasiella arcuata var. platydisca (G.M.Smith) E.Hegewald & M.Wolf, Pectinodesmus pectinatus f. tortuosus (Skuja) E.Hegewald y Scenedesmus ellipticus Corda) haciendo una contribución al conocimiento de la ficoflora de este lugar.
Para el phylum Euglenozoa se encontraron 16 especies, mayor a lo reportado en ambientes lóticos de Oaxaca (Moreno, 2009) y en la laguna de Chignahuapan, Estado de México (Valadez et al., 2010). De las 16 especies encontradas, seis fueron reportadas previamente en los canales de Xochimilco por Salas (1963), López (1972), Pérez & Salas (1961) y Figueroa et al. (2015); las 10 especies restantes son nuevos registros para la zona de estudio (Euglena próxima (P.A.Dangeard) M.S.Bennett & Triemer, Monomorphyna aenigmatica (Drezepolski) Nudelman & Triemer, M. pyrum (Ehrenberg) Mereschkowsky, Trachelomonas abrupta Svirenko [Swirenko], T. verrucosa A.C.Stokes, T. volvocinopsis Svirenko, Trachelomonas sp. Ehrenberg, Lepocinclis acus (O.F.Müller) B.Marin & Melkonian, Phacus cf raciborskii Drezepolski, P. orbicularis K.Hübner). Además, se pudo observar que este phylum estuvo dominado por los géneros Trachelomonas, Lepocinclis y Phacus, lo cual corresponde a reservorios eutróficos previamente estudiados en México (Garduño et al., 2011); así como los resultados de Figueroa et al. (2015) para los canales de Xochimilco.
En el phylum Cyanobacteria se encontraron seis especies, al respecto Murguía (1965) encontró dos, Reynoso (1986) reportó tres, Sámano-Bishop (1933) encontró siete; mientras que Flores (1980) y González (1991), encontraron 29 y 19 especies respectivamente, lo cual es mayor a lo reportado en este trabajo. Cabe mencionar que una de las especies determinadas en este estudio fue M. aeruginosa, la cual suele producir microcistina (substancia hepatotóxica) y es indicadora de ambientes con alta concentración de nutrimentos, como sucede en hábitat eutróficos (Carvalho et al., 2013); sin embargo, solo se encontró en dos puntos de muestreo, con valores de hasta 490 cél/mL, es decir que deberá de llevarse un control de estas condiciones ya que constituye un peligro potencial para la vida acuática y para los habitantes de la zona por lo metabolitos que producen este tipo de organismos (Crettaz, 2018).
En el phylum Miozoa solo se registraron tres especies, las cuales han sido reportadas con anterioridad en los canales de Xochimilco (Figueroa & Moreno (2003), Hernández (2007) y Figueroa (2009).
Para el Phylum Ochrophyta solo se encontró una especie, Tetraëdriella regularis (Kützing) Fott, la cual se reubicó taxonómicamente por lo que se incluía anteriormente en el Phylum Chlorophyta, además esta especie ha sido reportada previamente en los canales de Xochimilco (Figueroa et al., 2008); por su parte, el Phylum Cryptista igualmente solo presentó una especie, Cryptomonas sp. Ehrenberg la cual no ha tenido reportes para los canales de Xochimilco, sin embargo, López et al. (2015), reportan una especie para este Phylum, Cryptomonas ovata Ehrenberg.
Con respecto a la distribución de las especies, en la muestra de la salida del vertedero se registraron pocas especies, lo que podría deberse a que estas aguas provienen directamente de la PTAR Cerro de la Estrella y han sido cloradas previamente debido al tratamiento terciario que se les da a este tipo de aguas, lo cual impide el crecimiento de varios organismos entre ellos las microalgas (Barrado, 2016). Por el contrario, a los 20 m de distancia del vertedero se observó la mayor diversidad de especies, lo que se puede atribuir a que en este punto las condiciones ambientales tanto físicas como químicas se estabilizan, además de ser apropiadas para el desarrollo de estos organismos.
Del total de especies 23 fueron raras lo que significa que solo se les encontró en un solo sitio y con muy pocos organismos entre, esto puede deberse a que solo en esos sitios existieron las condiciones ambientales adecuadas para su desarrollo. Otro factor para considerar se refiere a que este tipo de especies pueden ser estacionales, por lo que se recomienda hacer muestreos en distintas épocas del año para observar su dinámica espacio-temporal, así como de las condiciones ambientales que favorecen su establecimiento.
En cuanto a los parámetros tomados en campo, se pudo observar que la mayoría de ellos no varió significativamente, únicamente la profundidad tuvo una variación mayor al 30%, la cual fue disminuyendo conforme a la distancia, una de las razones puede ser el movimiento que genera la caída del agua en el lago, ya que a mayor distancia el movimiento del agua es menor, lo que favorece un mayor depósito de sedimentos.
Sobre el comportamiento de los compuestos nitrogenados en el sistema, se pudo observar una mayor concentración de nitratos (NO3-) en el sitio del Vertedero (14 mg/L), y una disminución conforme los sitios estaban más alejados de la caída de agua, esto pudo deberse a la mayor densidad de microalgas encontradas en estos sitios, las cuales pudieron estar aprovechando este nutriente, ya que los nitratos es una de las principales formas de nitrógeno que absorben las microalgas (Grobbelaar, 2004).
Sin embargo, en el punto tomado a los 40 m se presentó un ligero aumento en la concentración de nitratos, lo cual pudo deberse a algún factor externo entre ellos alguna descarga clandestina de aguas residuales o el escurrimiento de tierras agrícolas debido a que en ciertas ocasiones se utilizan fertilizantes agrícolas con compuestos nitrogenados, alterando las concentraciones de este nutriente (Vázquez & Ríos, 2004; Pedrozo & Ramírez, 2020).
Lo anterior se complementa con el análisis de correlación lineal, debido a que los valores de correlación más altos se presentaron entre los nitratos y el amonio sobre la riqueza de especies, lo cual hace notar que la presencia y concentración de estos compuestos favorece el desarrollo de varias especies, ya que las microalgas los absorben y utilizan de manera directa (Tam & Wong, 1996).
Con base en lo anterior se puede concluir lo siguiente:
La comunidad algal estuvo compuesta por un total de 88 especies correspondientes a los phylum Bacillariophyta, Clorophyta, Euglenozoa, Cyanobacteria, Miozoa, Ochrophyta y Cryptista.
Se determinaron 25 nuevos registros para la zona de estudio.
La comunidad de microalgas se compone principalmente por especies de los phylum Bacillariophyta y Chlorophyta.
Las especies más frecuentes fueron Stephanocyclus meneghinianus, Gomphonema sp., Chlorella sp. y Desmodesmus protuberans.
Las especies más abundantes fueron las diatomeas Aulacoseira granulata var. angustissima, Stephanocyclus meneghinianus, Aulacoseira granulata y la cianoprocariota Microcystis aeruginosa.
Los parámetros físicos y químicos tomados en campo no variaron significativamente a lo largo de los puntos muestreados.
Los nitratos y el amonio son los nutrientes que mayor correlación tuvieron sobre la riqueza de especies.











 nueva página del texto (beta)
nueva página del texto (beta)





