INTRODUCCIÓN
A nivel mundial, se han realizado diversos estudios sobre diatomeas epizóicas adheridas en diferentes tipos de animales acuáticos como copépodos (Fee & Drum, 1965; Hiromi et al., 1985; Winemiller & Winsborough, 1990; Gárate-Lizárraga & Muñetón-Gómez, 2009), cladóceros (Gaiser & Bachmann, 1993), hidrozoos (Round et al., 1990; Romagnoli et al., 2007), krill (McClatchie et al., 1990), mamíferos marinos (Hart, 1935; Holmes, 1985; Frankovich et al., 2015, 2018; Violante-Huerta et al., 2018), aves buceadoras (Croll & Holmes, 1982; Holmes & Croll, 1984), cocodrilos (Cupul-Magaña & Cortés-Lara, 2005), entre otros. En México son pocos los estudios que se han realizado sobre epibiosis, como la presencia de la diatomea Pseudohimantidium pacificum Hustedt & Krasske sobre copépodos (Gárate-Lizárraga & Muñetón-Gómez, 2009; Gárate-Lizárraga & Esqueda-Escárcega, 2018), así como una proliferación de dos diatomeas epizóicas: Cylindrotheca closterium (Ehrenberg) Reimann & J. Lewin en el copépodo Paracalanus sp. y Falcula hyalina Takano adherida al copépodo Acartia tonsa Dana (Gárate-Lizárraga & Esqueda-Escárcega, 2016). Asimismo, López-Fuerte et al. (2015) reportan 27 especies de diatomeas epizóicas adheridas a gasterópodos Megastraea undosa Wood en el norte de México. Sin embargo, son pocos los estudios enfocados en las diatomeas epizóicas en larvas de gasterópodos, como en el caso de Aliger gigas (Linnaeus, 1758) (= Strombus gigas Linnaeus, 1758; Mollusca: Gastropoda: Strombidae). El objetivo de este trabajo fue determinar la composición de diatomeas epizóicas sobre larvas de esta especie en el Caribe mexicano.
MATERIAL Y MÉTODOS
En la caleta Xel-há se localiza en la costa este de la península de Yucatán en el Caribe mexicano, 15 km al norte del poblado de Tulum y 48.3 km al sur de Playa del Carmen, en el Estado de Quintana Roo, México (20°18’51’’N-20°19’00’’N y 87°21’20’’W-87°21’25’’O). Se recolectó una masa de huevos de A. gigas se obtuvo al momento de la ovoposición en el medio natural, ya que los huevos son fecundados al momento de atravesar el conducto ovígero. De esta manera se aseguró la fecha de realización de los huevos se conoce la fecha de su eclosión, y se asegura que correspondan a la especie de molusco, sujeto de la presente investigación.
Las larvas recién eclosionadas se cultivaron en contenedores, compuestos de una estructura triangular fabricada a base de fibra de vidrio, que dispone de 3 cilindros de 1 m de largo y 50 cm de diámetro. Cada cilindro tiene tres ventanas de malla a los costados, de 55 cm de largo por 25 cm de ancho con una abertura de malla de 50 µm que permite el paso de fitoplancton como alimento natural. Con flujo constante de agua marina proveniente directamente del ecosistema natural, sin aireación, ni filtración o esterilización alguna, con una temperatura ambiente de verano de trópico (29-30°C), utilizando un termohalino-conductivímetro YSI 85 (Yellow Springs, Ohio, U.S.A.) durante 42 días. Las larvas fueron alimentadas con la eustigmatoficea Nannochloropsis oculata (Droop) Hibberd a una concentración de 1000 células por mililitro.
Se procesaron 60 larvas planctónicas de edades entre 2 y 42 días. Primero, se realizó el proceso de relajación y fijación rápida, se agregaron 3 gotas al 2% de glutaraldehído durante 1 min. y posteriormente se eliminó este fijador. Después se realizó el proceso de fijación. Para ello, se colocaron las larvas con glutaraldehído (2.5%) y cacodilato (0.1 M: 1,100 mOsM; pH 7.2) durante 2 h a 4°C. Transcurrido este tiempo, se realizaron 3 lavados en una solución de cacodilato (0.1 M), cada uno en un intervalo de 30 min., después se eliminó el cacodilato. Por último, se realizó el proceso de deshidratación: se lavaron a las larvas a 30, 50, 70 y 100% de acetona. Cada lavado duró 10 min., y después del último lavado las muestras se conservaron a 4°C.
Para la identificación y cuantificación de diatomeas epizóicas sobre las conchas de las larvas se observaron bajo magnificación hasta 3040× en un microscopio electrónico de barrido de emisión de campo JEOL JSM-7600F (voltaje 30.0 kV y distancia de trabajo de 13.5 a 18.0 mm) del Laboratorio Nacional de Nano y Biomateriales del Centro de Investigación y de Estudios Avanzados (CINVESTAV), Unidad Mérida, del Instituto Politécnico Nacional (IPN). Previamente, la superficie de conchas fue cubierta con Au/Pd utilizando el equipo Polaron SC7640 (Quorum Technologies, Newhaven, East Sussex, U.K.). Se midió la longitud sifonal (µm) de las larvas.
Para la identificación de las diatomeas epizóicas se consultaron las obras de Cox (1999), Siqueiros-Beltrones & Argumedo-Hernández (2005) y Ashworth et al. (2012). Se consultó el sitio web AlgaeBase para verificar los nombres taxonómicos aceptados (Guiry & Guiry, 2022). Para la cuantificación de las diatomeas epizóicas se expresó la proporción del número de organismos de cada especie con relación a la abundancia total de las células contadas en cada larva de diferentes edades (Sullivan, 1982).
Las diatomeas se clasificaron en tres tipos de acuerdo con su forma de crecimiento diferenciado para colonizar un sustrato: sésiles adnadas o erectas y móviles (Round et al., 1990; D’Alelio et al., 2011; Tiffany, 2011).
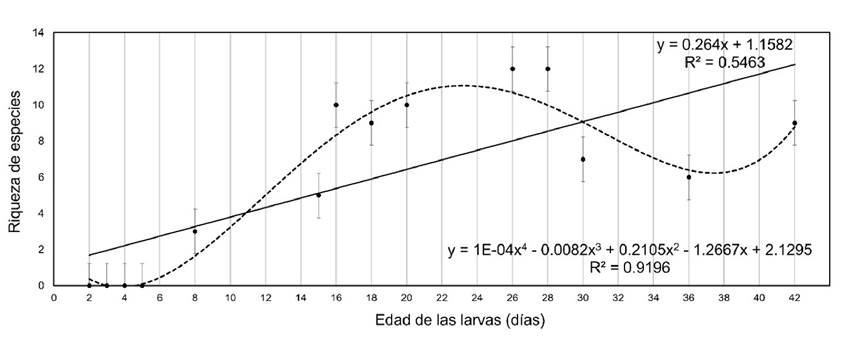
Para analizar la relación entre las edades de las larvas y el número de especies de diatomeas epizóicas se realizaron modelos de regresión lineal y polinomial buscando el mejor ajuste con ayuda del programa R. Las regresiones polinomiales permiten ofrecer un modelo de regresión con mejor ajuste, asociado al comportamiento de las variaciones individuales de las variables involucradas (Kerns, 2010).
RESULTADOS
Característica de las larvas de Aliger gigas
La edad de la larva se estableció a partir del momento de su eclosión. Las larvas de 2 a 5 días de edad poseen una concha formada por dos vueltas en la espira, presentando pequeños gránulos en su ápice, con un velum que se caracteriza por tener dos lóbulos y el desarrollo de un tentáculo derecho (Figs. 1A, B y F). Tienen una longitud entre 290 y 400 µm.

Figura 1 Larvas del gasterópodo Aliger gigas de diferentes edades: A y B) larva de 4 días, C) de 8 días, D) de 28 días, E) detalle de la corona del velum de una larva de 28 días, F) concha de una larva de 42 días. Escala: 100 µm.
En las larvas veliger jóvenes de 8 días de edad la concha se caracteriza por tener tres espiras, presentando líneas de ornamentación bien definidas. El velum presenta cuatro lóbulos, se observa el tentáculo derecho y la formación del tentáculo izquierdo (Fig. 1C). Tienen una longitud promedio de 450 µm.
Las larvas de 15 a 18 días de edad tienen una concha con tres y media vueltas en la espira, el cuerpo presenta cuatro líneas paralelas concluyendo al final en un canal sifonal. El velum tiene seis lóbulos, además de tentáculos y probóscide. Muestran un intervalo de longitud de 600 a 689 µm.
En las larvas de 20 a 28 días de desarrollo, la concha tiene 3.5 vueltas, con una banda uniforme de estrías. Se forma la rádula y comienza el proceso de reabsorción del velum, por lo que la larva empieza a tener una conducta más asociada al fondo marino (Figs. 1D y F). La longitud varía de 705 a 997 (m.
En las larvas de 30 a 42 días de edad, la concha se caracteriza por presentar cuatro vueltas, con una banda de estrías; la probóscide y rádula están presentes y activas y el velum ha sido reabsorbido, con un opérculo (Fig. 1E). La longitud va de 1 a 1.3 mm.
Estructura de la taxocenosis de diatomeas epizóicas
Se encontraron diatomeas epizóicas en el 83% de las larvas de A. gigas analizadas, se presentaron 24 taxa a nivel especie o taxa infraespecífico (Tabla 1).
Tabla 1 Taxa de diatomeas epizóicas encontradas sobre las conchas de larvas del molusco gasterópodo Aliger gigas. FdeC: Formas de crecimiento: A adnadas, E erectas, M móviles.
| Edad (días) de larvas | 8 | 15 | 16 | 18 | 20 | 26 | 28 | 30 | 36 | 42 | FdeC |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de larvas examinadas | 4 | 3 | 7 | 4 | 3 | 3 | 7 | 3 | 5 | 5 | |
| Bacillariophyta | |||||||||||
| Amphora sp. | - | - | - | - | - | - | - | X | - | - | E |
| Cocconeis lineata Ehrenberg | - | - | - | - | X | X | - | X | - | - | A |
| C. scutellum Ehrenberg | - | - | - | - | X | X | X | - | - | - | A |
| Craspedostauros sp. | - | X | - | - | - | - | X | - | X | - | M |
| Cyclophora sp. | - | X | X | X | X | X | X | X | X | X | E |
| Cylindrotheca closterium (Ehrenberg) Reimann & J.C.Lewin | X | X | X | X | X | X | X | - | - | - | M |
| Entomoneis cf. paludosa (W.Smith) Reimer | - | - | X | X | X | X | X | X | X | X | M |
| Halamphora coffeaeformis (C. Agardh) Mereschkowsky | - | - | - | - | - | - | - | - | X | X | E |
| Halamphora sp. | - | X | X | X | X | X | X | - | - | - | E |
| Hippodonta cf. pseudacceptata | - | - | - | - | X | - | - | - | - | - | M |
| Hyalosynedra sp. | - | - | - | - | - | X | X | - | - | X | E |
| Licmophora sp. | - | - | - | X | - | - | - | - | - | - | E |
| Navicula tsukamotoi (Sterrenburg & Hinz) Yuhang Li & Kuidong Xi | - | - | - | - | - | X | X | X | - | X | M |
| Navicula sp. | - | - | - | X | - | X | X | X | - | - | M |
| Nitzschia dissipata (Kützing) Rabenhorst | - | - | - | - | X | - | X | - | - | - | M |
| N. inconspicua Grunow | - | - | - | - | - | X | - | - | - | X | M |
| N. linearis W.Smith | - | - | - | - | - | - | - | - | - | X | M |
| N. microcephala Grunow | - | - | X | - | - | - | X | - | - | - | M |
| Nitzschia sp. | - | - | X | X | X | - | - | - | - | - | M |
| Pleurosigma sp. | X | - | - | X | - | - | - | - | - | - | M |
| Psammodictyon panduriforme (W.Gregory) D.G.Mann var. panduriforme | - | - | X | - | - | - | - | - | - | - | M |
| P. panduriforme var. minor (Grunow) E.Y.Haworth & M.G.Kelly | X | X | X | X | X | X | X | X | X | X | M |
| Pseudachnanthidium sp. | - | - | - | - | - | X | - | - | - | - | M |
| Scalariella sp. | - | - | X | - | - | - | - | - | X | X | M |
| Stephanodiscus minutulus (Kützing) Cleve & Möller | - | - | X | - | - | - | - | - | - | - | E |
Características morfológicas de diatomeas epizóicas y su hábitat
De las especies registradas, el 68% fueron móviles, seguido de especies con formas erectas con 24%, y el 8% restante fueron especies formas adnadas (Tabla 1, Fig. 2).

Figura 2 Tipos de diatomeas de acuerdo con su forma de crecimiento diferenciado para colonizar un sustrato. Adnadas: A) Cocconeis scutellum, B) Cocconeis lineata. Erectas: C) Halamphora sp. adherida a Haloleptolyngbya sp., D) colonia de Halamphora sp., E) Amphora sp., F) Halamphora coffeaeformis, G) Licmophora sp., H) Stephanodiscus minutullus. Móviles: I) Psammodictyon panduriforme var. minor adheridos a Haloleptolyngbya sp., J) células de Psammodictyon panduriforme var. minor, K) células de Cylindrotheca closterium, L) células de Cylindrotheca closterium adheridas en el velum, M) Entomoneis cf. paludosa, N) Nitzschia inconspicua, Ñ) Haslea tsukamotoi, O) Navicula sp. Escala: 5 µm.
Diatomeas adnadas. Solo se encontraron dos especies de diatomeas con formas de crecimiento adnata, Cocconeis lineata y C. scutellum (Tabla 1, Figs. 2A y B). Estas especies presentan valvas elípticas ligeramente convexas. La valva superior de ambas posee estrías dispuestas en filas y costillas gruesas radiales hacia el margen, con un rafe lineal en la hipovalva y un pseudorafe en la epivalva. A través del rafe y de los nódulos polares y centrales secretan mucílago con el que se adhiere firmemente al sustrato.
Diatomeas erectas. De diatomeas erectas se encontraron seis especies arráfidas, birráfidas, o monorráfidas. Estas algas se adhieren a diferentes sustratos por medio de almohadillas de mucílago o por pedicelos. Algunas especies pueden desarrollar pedicelos después de una fase móvil (Figs. 2C, H y 3), dentro de este grupo se encuentra Cyclophora sp. que tiene frústulas tabuladas-rectangulares. Las células se unen en los vértices por medio de almohadillas de mucílago, formando cadenas en zigzag (Figs. 3B-D). Las células tienen un tamaño de 26-98 μm de largo y 2.5-3.5 μm de ancho, con presencia de pseudosepto. Las valvas son más o menos lineales, ligeramente constreñidas debajo del ápice. El campo del poro apical posee numerosas hendiduras pervalvares, en donde se secretan las almohadillas de mucílago (Figs. 3D y E). Individuos de Psammodictyon panduriforme var. minor estaban encima de las colonias de Cyclophora sp. (Fig. 3B). Se observaron células de Cyclophora sp. adheridas al velum de las larvas (Fig. 3C) junto con P. panduriforme var. minor. También se encontraron frústulas de Halamphora sp. (Fig. 2C), caracterizada por poseer células semi-lanceoladas con las terminaciones truncadas, con un margen dorsal arqueado y un margen ventral cóncavo. Los extremos de las valvas son poco prolongados, con valvas de 9.5-11 μm de largo y 2.0-2.5 μm de ancho. Tiene numerosas costillas dorsales y estrías transapicales gruesas y radiales. Las células se unen de dos en dos, extendiéndose a lo largo de las conchas de las larvas para formar las colonias (Fig. 2D). Además, se encontraron Halamphora sp. adheridas a cianobacterias Haloleptolyngbya sp. por medio de pedicelos, siendo ésta otra estrategia observada para colonizar al sustrato (Fig. 2C).
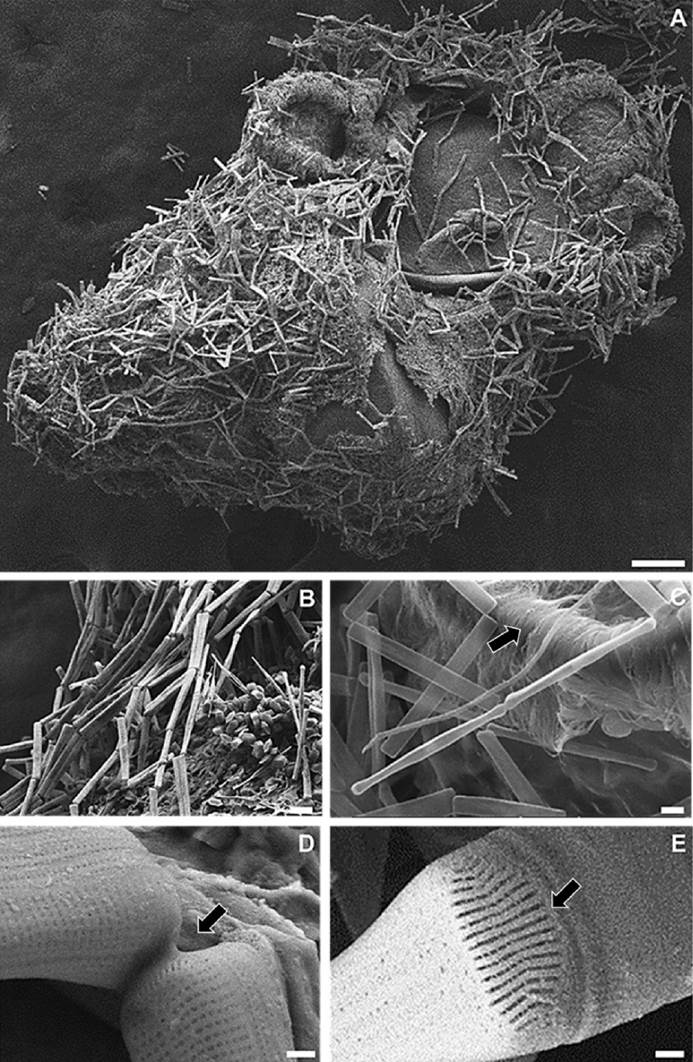
Figura 3 Diatomeas epizóicas sobre las conchas de larvas de Aliger gigas. A) Cyclophora sp. cubriendo una larva de 42 días; B) cadenas en zigzag arriba de Psammodictyon panduriforme var. minor; C) células adheridas en el velum; D) formación de almohadillas de mucílago; E) hendiduras pervalvares. Escala: A) 100 µm, B-D) 5 µm.
Junto con las especies anteriores, se observaron unas células solitarias de Stephanodiscus minutullus (Fig. 2H) de forma discoide, con estrías radiales y espinas en el borde de las valvas. Las valvas planas con el centro convexo o cóncavo, de 3.5 a 12 µm de diámetro.
Diatomeas móviles. Entre las formas móviles de diatomeas, se encontraron 17 taxa (Tabla 1, Figs. 2I-O y 4), algunas birráfidas y otras monorráfidas, dominadas por Hippodonta cf. pseudacceptata, de valvas pequeñas con forma rómbica a rómbica-lanceolada y con el ápice redondeado. Las estrías se arreglan de manera suavemente radial en la mitad de la valva, volviéndose paralelas, convergentes cerca de los vértices. El área axial es estrecha, y el rafe es filiforme (Fig. 4D). El tamaño de las células fue de 11.0-14.5 µm de largo y 3.0-3.8 µm de ancho. Estas células se extendieron sobre las conchas del gasterópodo hasta colonizar todo el sustrato (Fig. 4A), y algunas células se observaron en el velum de las larvas (Fig. 4B).

Figura 4 Hippodonta cf. pseudacceptata cubriendo extensas áreas de la concha en fase larval de A. gigas de 20 días. A) células sobre la concha; B) las flechas muestran las células adheridas en el velum; C) un conjunto de células; D) células mostrando las estructuras de la frústula; E) células cubiertas de mucílago. Escala: A) 100 µm, B-E) 5 µm.
Psammodictyon panduriforme var. minor muestra valvas en forma de pandora, longitudinalmente onduladas, con una ligera constricción media y ápices ampliamente redondeados, con estrías transapicales compuestas por areolas hexagonales, con una estructura de poros en la superficie de la valva y en la banda lateral; la matriz de poros es habitual en la valva. El borde de la banda está lleno de estructuras de mesoporos; las células con una longitud de 96-135 μm y 33-36 μm de ancho (Fig. 2I). Las frústulas se encontraron adheridas sobre Haloleptolyngbya sp. y sobre la concha del gasterópodo por medio de la valva del rafe (Figs. 2I-J).
Otra especie abundante fue la diatomea plancto-bentónica Cylindrotheca closterium. Sus células son puntiagudas sin torsión, forman agregados de mucílago, las valvas están débilmente silicificadas de 30 hasta 400 µm de largo y 2.5-8.0 µm de ancho y el rafe posee series de orificios transversales. Las células se encuentran adheridas tanto en la superficie de la concha (Fig. 2H), como en el velum de las larvas (Fig. 2I).
También, se encontró Entomoneis cf. paludosa de 85 a 101 µm largo, con frústulas comprimidas, con la superficie valvar estriada, radial y un cíngulo compuesto de varias bandas estrechas y estriadas (Fig. 2M).
Colonización de diatomeas epizóicas en las conchas de las larvas de Aliger gigas
Se observa que la colonización por diatomeas inició en larvas de 8 días con una longitud de 450 µm, con tres especies de diatomeas (Tabla 1). Luego se incrementa la riqueza de especies sobre las conchas de las larvas. En larvas de 28 días, cuando tienen una longitud de 997 µm, se presentan 12 especies de diatomeas. Sin embargo, se observó menor cantidad de taxa, de 5 a 7 especies sobre larvas de 30 a 36 días con una longitud de 1 mm. En larvas de 42 días con una longitud de 1.3 mm, se notó mayor riqueza de especies de diatomeas (Fig. 5).
Relación entre edad larval y riqueza de especies epizóicas
El modelo lineal muestra una correlación positiva moderada (r2 = 0.5). Los datos ajustados a un modelo polinomial de cuarto grado presentaron un mejor ajuste entre la riqueza de especies de diatomeas epizóicas y la edad de las larvas, presentando una correlación positiva alta (r2 = 0.9) (Fig. 6).
DISCUSIÓN
En este estudio se observó que las conchas examinadas de larvas de A. gigas provenientes de cultivos en condiciones de laboratorio proporcionan un sustrato adecuado para el asentamiento y colonización de diatomeas epizóicas. En este sentido, Wahl et al. (2012) mencionan que la primera fase de la colonización de un sustrato se da principalmente por bacterias en conjunto con diatomeas, hongos y protozoarios, las cuales generan una película delgada sobre la superficie del basibionte.
Los resultados evidencian que las primeras especies que colonizaron las conchas de las larvas fueron las especies de diatomeas móviles. Con el paso de los días se detectan especies erectas y solo dos especies adnadas. Los taxa más frecuentes que pertenecen a las formas móviles estuvieron representadas por Hippodonta cf. pseudacceptata, P. panduriforme var. minor y Cylindrotheca closterium, y las erectas por Cyclophora sp. y Halamphora sp. P. panduriforme var. minor se observó en larvas de 8 días de edad. Halamphora sp. estuvo presente en larvas de 16 días. Hippodonta cf. pseudacceptata en larvas de 20 días y Cyclophora sp. en larvas de 36 y 42 días.
Una de las posibles causas de porque las diatomeas epizóicas no permanecieron en las larvas en las diferentes edades, se debe a sus estrategias para colonizar el sustrato. Las diatomeas de formas móviles están parcialmente adheridas, se extienden sobre el sustrato, pero son menos estables, por lo que pueden desprenderse con los movimientos del agua. Las diatomeas de formas erectas al adherirse por una superficie pequeña son menos estables; en cambio, las diatomeas de formas adnadas se adhieren fuertemente al sustrato y son más estables (Round et al., 1990; D’Alelio et al., 2011). De éstas últimas, solo se encontraron dos especies del género Cocconeis Ehrenberg, las cuales han sido reportadas como especies abundantes como epífitas sobre macroalgas bentónicas, pastos marinos, manglar, formando biofilm y adheridos en placas de fibra de vidrio (Siqueiros-Beltrones, 2002; López-Fuerte et al., 2015; Martínez et al., 2019) y en este trabajo como epizóicas en larvas de Aliger gigas.
En un estudio realizado por D’Alelio et al. (2011), quienes trabajaron con siete especies de gasterópodos adultos (Alvania lineata Risso, Bittium reticulatum (da Costa), Clanculus cruciatus (Linnaeus), Columbella rustica (Linnaeus), Gibbula adansonii (Payraudeau), Nassarius incrassatus (Strøm) y Jujubinus striatus (Linnaeus), reportan taxocenosis de diatomeas epizóicas bien estructuradas con dominio de las formas adnadas, seguido de las erectas y con menor abundancia de las formas móviles en las conchas de C. cruciatus, G. adansoni y J. striatus. D’Alelio et al. (2011) mencionan que el tamaño de las conchas de los gasterópodos bentónicos no influye en la colonización de las microalgas epizóicas, observando que las conchas más grandes (B. reticulatum, G. adansoni, C. rustica y C. cruciatus) presentaban una mayor abundancia y las conchas más pequeñas (A. lineata, N. incrassatus y J. striatus) una mayor riqueza de especies.
Durante los 42 días de este estudio se observó que la edad de las larvas podría influir en la colonización de las diatomeas epizóicas. El tamaño y la estructura (sobre todo, el relieve de la superficie) de la concha de las larvas de Aliger gigas en los diferentes días de desarrollo va cambiando. Las larvas de dos a cinco días no presentaron microalgas epizóicas, ya que la concha tiene una longitud de 290 a 400 µm, es delgada, lisa y se va formando a través de un carbonato de calcio amorfo transitorio que actúa como un precursor en la secuencia de la cristalización de aragonita (Brito-Manzano et al., 2006; Chávez-Villegas et al., 2017).
En larvas de 26, 28 y 42 días se observó un número mayor de especies de diatomeas, lo que puede deberse a que la concha de los 26 a 28 días presentaban una longitud de 705 a 997 µm y las de 42 días un tamaño aproximado de 1.3 mm y con mayor ornamentación, sobre todo, en las larvas de 42 días, en donde se presenta un periostraco, capa más externa de la concha compuesta de una matriz orgánica (Enríquez-Diaz et al., 2015; Chávez-Villegas et al., 2017). Esta característica puede constituir un mejor sustrato para el crecimiento de las microalgas epizóicas.
En las larvas de 30 a 36 días con una longitud de 1 mm, se observó una disminución en la presencia de diatomeas, lo que se asocia al predominio de Cyclophora sp. Esta diatomea forma colonias en zigzag, ocupando todo el caparazón de la larva, impidiendo que se adhieran otras microalgas, lo cual ocasiona una disminución en la riqueza de especies. También es conocido que algunas especies de diatomeas colonizan un sustrato al producir sustancias alelopáticas que inhiben el crecimiento de otras microalgas (Tanaka & Asakawa, 1988).
Cylindrotheca closterium es una especie oportunista que forma florecimientos algales; se le considera una especie planctónica, bentónica o epizóica (Gárate-Lizárraga & Esqueda-Escárcega, 2016; Merino-Virgilio et al., 2019; Poot-Delgado & Okolodkov, 2020). En la bahía de La Paz se reportó a C. closterium, formando por primera vez una proliferación sobre un basibionte, como fue el caso del copépodo Paracalanus sp., aparentemente, sin causarle daño alguno (Gárate-Lizárraga & Esqueda-Escárcega, 2016). En el presente estudio C. closterium fue una especie abundante. No se registraron otras diatomeas adheridas o a su alrededor. Tampoco se observó ningún daño en las larvas debido a su presencia.
Siqueiros-Beltrones (2002) menciona que las diatomeas son especies oportunistas y aparecen desde temprano en los sustratos naturales o artificiales. Martínez-Hernández (2014) y Martínez-Hernández et al. (2019) realizaron un estudio sobre la colonización de diatomeas bentónicas sobre placas de fibra de vidrio a una profundidad de 10 m en un periodo de 16 semanas en Telchac, Yucatán. En las primeras semanas observaron que los primeros géneros presentes en las placas fueron Amphora Ehrenberg ex Kützing, Biddulphia S.F.Gray, Cocconeis, Cyclotella (Kützing) Brébisson, Fragilaria Lyngbye, Grammatophora Ehrenberg, Gyrosigma Hassall, Mastogloia Thwaites ex W.Smith, Petroneis A.J.Stickle & D.G.Mann, Plagiotropis Pfitzer, Pleurosigma W.Smith, Rhabdonema Kützing, Shionodiscus A.J.Alverson, S.H.Kang & E.C.Theriot, Trachyneis P.T.Cleve y Triceratium Ehrenberg. En la octava semana las abundancias comenzaron a bajar debido a la colonización de moluscos, poliquetos tubícolas y macroalgas. La última semana registraron la llegada de otras especies de los géneros Achnanthes Bory, Auliscus Ehrenberg, Campylodiscus Ehrenberg ex Kützing, Diploneis Ehrenberg ex Cleve, Ehrenbergia A.Witkowski, Lange-Bertalot & Metzeltin, Lyrella Karayeva, Navicula Bory, Nitzschia Hassall, Podosira Ehrenberg, Surirella Turpin y Terpsinoë Ehrenberg.
En este estudio, P. panduriforme var. minor y Cyclophora sp. estuvieron presentes desde el inicio hasta el final de la colonización. Así mismo, Stephanodiscus minutulus, Pleurosigma sp., Nitzschia sp. y Licmophora sp. se observaron en los primeros días de la colonización y no volvieron aparecer. Amphora sp. y Halamphora coffeaeformis estuvieron presentes solo en los últimos días de la colonización.
Se observó una mayor riqueza y abundancia de especies en las conchas de mayor tamaño debido a que forman sustratos más amplios y estables para las microalgas. Comparando nuestros resultados obtenidos con lo reportado por Martínez-Hernández (2014) y Martínez-Hernández et al. (2019) sobre placas de fibra de vidrio que son más grandes (10x5x0.4 cm), donde se encontraron de 66 a 75 especies, el área superficial del sustrato parece ser uno de los factores que influye en la colonización de diatomeas epizóicas.
Otro factor importante es la estrategia para colonizar el sustrato donde habitan las diatomeas epizóicas. Las especies de diatomeas que estuvieron presentes en las larvas de 8 a 42 días de edad presentaron diferentes estrategias para colonizar el sustrato. Unas especies formaron colonias en forma de zigzag verticales, otras células se adherían horizontalmente al sustrato o formaban almohadillas de mucílago para adherirse al sustrato. Asimismo, también se observaron especies que se adhirieron a otras microalgas. Esta diferencia en las estrategias de colonización permite explicar por qué algunas larvas presentaban menos microalgas epizóicas que otras.
Teniendo en consideración las condiciones y los métodos empleados para evaluar la colonización de diatomeas epizóicas en larvas de A. gigas, se puede arribar a la siguiente conclusión: la mayor riqueza y abundancia de especies de diatomeas epizóicas en larvas de A. gigas se presentó en las conchas más grandes, lo cual se asocia a una mayor área de colonización disponible y constituye un sustrato más estable. En el proceso intervienen otros factores como la competencia por el espacio y sucesión en la colonización, posiblemente relacionadas con la producción de substancias alelopáticas por parte de algunas especies y la respuesta a estas por parte de otras (Band-Schmidt et al., 2011).
Dada la poca información científica sobre la colonización de diatomeas epizóicas en fase larval planctónica de moluscos marinos, es recomendable profundizar en el estudio de microalgas epizóicas, así como en sus interacciones ecológicas.











 nueva página del texto (beta)
nueva página del texto (beta)