INTRODUCCIÓN
La Laguna Chichancanab es un ecosistema de agua dulce localizado en el centro-sur de la península de Yucatán (territorio de Quintana Roo) y ha sido objeto de estudio de varios trabajos de investigación, entre ellos los de tipo geológicos, hidrológicos y biológicos (Barrientos et al., 2015; Covich, 2010; Gill et al., 2007; Hodell et al., 2005; Pérez et al., 2011). Dada la particularidad del suelo de Chichancanab (Hodell et al., 2012), la presencia de estromatolitos (Bayona-Miramontes, 2012) y especies endémicas de peces del género Cyprinodon (Humphries, 1984; Strecker, 2005), es considerada nacionalmente como una ecorregión hidrológica prioritaria (Lara-Lara et al., 2008) y mundialmente como sitio RAMSAR bajo el esquema de conservación manejado por la comunidad. A pesar de su importancia, este sitio carece de inventarios bióticos completos y mucho menos a los que de algas de agua dulce se refiere.
Los trabajos que realizan inventarios para estimar la diversidad de estos organismos en un sitio o región son denominados ficoflorísticos, donde los enfocados en ambientes dulceacuícolas en México han ido en creciente avance. Esto ha permitido que, para el caso de las cianobacterias, los esfuerzos estimen una riqueza nacional que alcanza a las 799 especies considerando los nombres específicos e infraespecíficos (Novelo & Tavera, 2022). Pese a esto, en la porción mexicana de la Península de Yucatán, el registro entre los tres estados que corresponden a esta región del país apenas alcanza a las 373 especies, teniendo para el estado de Quintana Roo un estimado de 47 a 83 registros válidos distribuidos en tan solo unas cuantas localidades (Arana et al., 2019; Novelo & Tavera, 2022), donde se incluye Chichancanab.
Muchos de los registros de algas de aguas continentales en la laguna son apenas menciones dentro de la caracterización del sitio (Bayona-Miramontes, 2012; López-Adrián, 2017a; Smirnov & Elías-Gutiérrez, 2011; Strecker, 2006), mismas que omiten descripciones o fotografías. Estos reportes incluyen a Charophyta, Chlorophyta, Bacillariophyta, Miozoa y Cyanobacteria, donde en este último filo se incluyen especies sin determinar de Stigonema, Gomphosphaeria, Anabaena, Chroococcus y Oscillatoria. Por su parte, López-Adrián et al. (2017a) enlistan especies de algas (cianobacterias principalmente) que indican un estado saprobiótico de la laguna.
Aunque estos reportes brindan un panorama general de la riqueza de estos organismos en la laguna, no existen inventarios completos ni mucho menos trabajos en donde se profundice acerca de un grupo en particular de algas. Por tal motivo, este trabajo se enfoca en Cyanobacteria, un grupo potencialmente indicador de cambios ambientales, como los procesos eutróficos, y cuyo inventario proyecta ser pauta para futuros trabajos en el sitio, considerando que la vegetación circundante a la laguna ha sufrido deforestación y el cuerpo de agua ha estado sujeto a incrementos de materia orgánica por los núcleos urbanos y actividad económica periféricas a esta (Arriaga-Cabrera et al., 2000). Así mismo, la revisión de la diversidad de estos organismos permitirá ampliar el conocimiento sobre este grupo en el estado de Quintana Roo, así como de la Península de Yucatán.
MATERIALES Y MÉTODOS
Sitio de estudio
La laguna Chichancanab se encuentra a 5 km de la localidad de Dziuché, en el municipio José María Morelos del estado de Quintana Roo, México (Figura 1). El sitio comprende una longitud aproximada de 30 km y consiste en un cuerpo de agua estacionario con zonas inundables en las temporadas de lluvia (junio a noviembre). El clima es cálido sub-húmedo con lluvias en verano (Aw2), con temperaturas promedio de 26-28 °C al año y precipitación anual promedio de 1,268 mm. La vegetación predominante es selva mediana subperennifolia y pastizal (Arriaga-Cabrera et al., 2000; Hodell et al., 2012).
Trabajo de campo
El material ficológico se recolectó mediante muestreos directos con apoyo de botellas muestreadoras de 1 L (marca LaMotte), en dos puntos principales de acceso al balneario de la laguna y alrededor de los mismos (en un intervalo no mayor a 40 m), siendo estos en los meses de mayo (secas; dos visitas, incluyendo un muestreo prospectivo) y agosto (lluvias) del 2013, así como en enero (nortes) del 2014, obteniendo un total de 24 muestras colectadas, considerando toda la cobertura espacial y temporal. Todas las muestras fueron fijadas con formaldehído al 2%.
Se recabaron las variables fisicoquímicas asociadas al cuerpo de agua con apoyo de una sonda multiparamétrica YSI-85, los cuales fueron temperatura (°C), salinidad (ppt), conductividad (µS cm-1), sólidos totales disueltos (mg/L), pH y oxígeno disuelto (mgO2/L). Así mismo, se recabó agua para análisis de nutrientes, los cuales fueron nitratos (µmol/L NO3-), fosfatos (µmol/L PO43-), así como para determinar los sulfatos (mgSO42-/L), mismos que se cuantificaron mediante técnicas colorimétricas. Una vez obtenidos los datos se calcularon las medias aritméticas para cada caso. Todas las variables fueron tomados a nivel superficial.
Las muestras fueron depositadas en la colección de Microalgas Marinas y de Agua Dulce (FICOYUC) del Herbario “Alfredo Barrera Marín” de la Universidad Autónoma de Yucatán, bajo los números de catálogo 1275-1291 (mayo; 17 muestras), 1292-1294; 1296 (agosto; cuatro muestras) y 1295; 1297-1298 (enero; tres muestras). De forma complementaria, se realizaron preparaciones permanentes sobre portaobjetos de vidrio, mismas que fueron incluidas a la colección.
Trabajo de laboratorio y gabinete
Las observaciones se realizaron con apoyo de un microscopio óptico Olympus CX-31. Se tomaron características diagnósticas de los taxones de cianobacterias, partiendo de la organización celular y estructuras. También, se obtuvieron datos morfométricos. Los ejemplares se fotografiaron con apoyo de una cámara Nikon (modelo D3300).
La identificación de las especies se realizó mediante guías y claves especializadas de algas dulceacuícolas (principalmente Komárek & Anagnostidis, 1999; Komárek & Anagnostidis, 2005; Komárek & Komárková-Legnerová, 2007; Nava-Ruiz & Valadez, 2012; Tavera et al., 2013; Wehr & Sheath, 2003). Una vez reconocidas, se recurrió a las bases de datos AlgaeBase (Guiry y Guiry, 2022) y bdLACET (Novelo & Tavera, 2022) para verificar el estado nomenclatural y su distribución, dando prioridad a la región de la Península de Yucatán. Para la presentación de la composición taxonómica, los taxones se organizaron de manera supragenérica (órdenes y familias) de acuerdo con la clasificación de Komárek et al. (2014), mientras que los géneros y especies se ordenaron alfabéticamente.
Análisis de datos
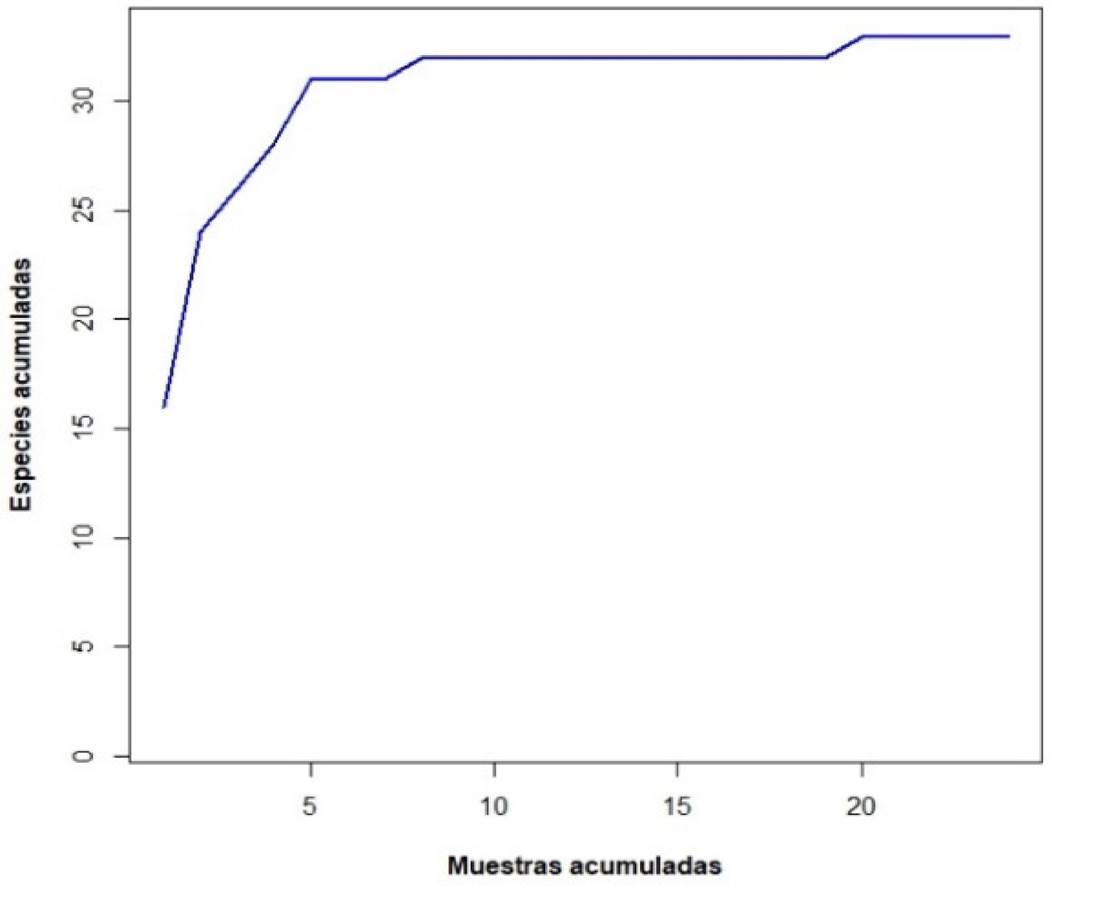
Para evaluar la representatividad del muestreo, se realizó una curva de acumulación de especies tipo colector, en donde el esfuerzo de muestreo se midió con las muestras acumuladas, considerando la cobertura espacial y temporal de las recolectas. Los cálculos pertinentes se efectuaron con el paquete vegan (Oksanen et al., 2022), implementado en el lenguaje de programación R (R Core Team, 2022), versión 4.2.0.
RESULTADOS
Variables fisicoquímicas y nutrientes
Los valores obtenidos de las variables fisicoquímicas, así como de los nutrientes y sulfatos, se pueden observar en la Tabla 1. La temperatura, conductividad, oxígeno disuelto y los nutrientes sufrieron cambios a través del muestreo, con los valores más altos en la temporada de secas en contraste con nortes, cuando se presentan más bajos.
Tabla 1 Medias aritméticas de las variables fisicoquímicas registradas durante el período de muestreo.
| Variable | Unidad | Secas (mayo) | Lluvias (agosto) | Nortes (enero) |
|---|---|---|---|---|
| Temperatura | °C | 29.4 | 30.9 | 25.9 |
| Salinidad | ppt | 2.5 | 2.4 | 2.1 |
| Conductividad | µS cm-1 | 4749.3 | 4434.0 | 4102.5 |
| Sólidos totales disueltos | mg/L | 3084.4 | 2818.8 | 2668.0 |
| pH | 8.2 | 8.2 | 7.8 | |
| Oxígeno disuelto | mgO2/L | 7.2 | 6.0 | 6.2 |
| Nitratos | µmol/L NO3- | 93.5 | 3.2 | 1.6 |
| Fosfatos | µmol/L PO43- | 9.4 | - | 9.4 |
| Sulfatos | mgSO42-/L | 2980.1 | 1941.8 | 2309.2 |
Composición taxonómica
En relación con la representatividad del muestreo, se obtuvo una curva de acumulación de especies a través de la observación de las muestras (Figura 2). La mayoría de las especies se registraron en las primeras cinco muestras revisadas (que corresponden a la temporada de secas).
Respecto a la composición taxonómica de cianobacterias durante el período de muestreo, se determinaron 29 especies pertenecientes a 21 géneros, 14 familias y cuatro órdenes. En la Tabla 2 se encuentra la lista taxonómica de estos organismos, así como la presencia/ausencia por temporada climática.
Tabla 2 Listado florístico de cianobacterias durante el período muestreado, ordenado alfabéticamente. Se señala con negritas los nuevos registros para México.
| Especie | Temporada climática | ||
|---|---|---|---|
| Secas | Lluvias | Nortes | |
| Aphanocapsa incerta | X | X | X |
| Aphanothece comasii | X | ||
| A. stagnina | X | X | X |
| Chroococcus minimus | X | X | X |
| C. minutus | X | ||
| C. turgidus | X | X | X |
| Eucapsis aphanocapsoides | X | X | |
| E. parallelepipedon | X | ||
| Geitlerinema splendidum | X | ||
| Gloeothece cf. interspersa | X | ||
| Gomphosphaeria aponina | X | ||
| Jaaginema subtilissimum | X | ||
| Johannesbaptistia pellucida | X | X | |
| Komvophoron minutum | X | ||
| Limnothrix borgertii | X | ||
| Lyngbya martensiana | X | ||
| Merismopedia glauca | X | ||
| Microcystis flos-aquae | X | X | |
| Oscillatoria ornata | X | ||
| O. princeps | X | ||
| Phormidium californicum | X | ||
| P. lucidum | X | X | |
| Planktolyngbya limnetica | X | X | X |
| Romeria hieroglyphica | X | X | X |
| Schizothrix tenuis | X | ||
| Spirulina nordstedtii | X | ||
| S. subsalsa | X | ||
| Synechococcus ambiguus | X | X | X |
| Synechocystis pevalekii | X | ||
El orden Synechococcales fue el más representado en riqueza de especies (41.3%), seguido de Chroococcales (31.3%), Oscillatoriales (20.6%), Spirulinales (6.8%). Las familias mejor representadas en especies son Merismopediaceae y Oscillatoriaceae (17.2% cada una), seguido de Aphanothecaceae, Chroococcaceae y Pseudanabaenaceae (10.3% para cada caso) y Spirulinaceae (6.9%). Las restantes solo tuvieron una especie como representante.
Por otra parte, el género Chroococcus fue el que tuvo la mayor riqueza de especies (tres), seguido de Aphanothece, Eucapsis, Spirulina, Phormidium y Oscillatoria (dos para cada uno).
A continuación, se presentan las descripciones morfológicas detalladas de las especies identificadas. Se señala la distribución regional en los estados de Quintana Roo, Yucatán y Campeche (por municipio) y en México (estado), así como de los nuevos registros para Quintana Roo y/o el país. Se especifica el número de depósito en el Herbario Alfredo Barrera Marín UADY-UADY.
Familia Synechococcaceae
1. Synechococcus ambiguus Skuja 1937 (Figura 3)

Figuras 3-16 3. Synechococcus ambiguus, 4. Aphanocapsa incerta, 5. Eucapsis aphanocapsoides, 6. E. parallelepipedon, 7. Merismopedia glauca, 8. Synechocystis pevalekii, 9. Romeria hieroglyphica, 10. Jaaginema subtilissimum, 11. Komvophoron minutum, 12. Limnothrix borgertii, 13. Planktolyngbya limnetica, 14. Schizothrix tenuis, 15. Spirulina nordstedtii, 16. S. subsalsa. Barra de escala= 10 µm. Fotografías de los autores.
Células de vida libre agregadas en pequeños grupos. Células elipsoidales, con contenido granular; algunas células muestran una división binaria. Células de 5.6-6.8 µm de largo por 2.5-3.1 µm de ancho.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) menciona que es una especie metafítica en pantanos y estanques con plantas acuáticas, así como en el litoral de lagos. Presente en cuerpos de agua subtropicales, oligotróficos a altamente eutróficos.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Tabasco (Novelo & Tavera, 2022).
UADY-UADY: 1278, 1282, 1283, 1285, 1287, 1289, 1290, 1293-1295, 1297.
Familia Merismopediaceae
2. Aphanocapsa incerta (Lemmermann) Cromberg & Komárek 1994 (Figura 4)
Colonias irregulares a más o menos esféricas, con mucílago difluente, de (25)35-37.5 µm de diámetro. Células esféricas, separadas ampliamente entre sí dentro de la colonia, de 2.5-3.1 µm de diámetro.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) menciona que es una especie planctónica en cuerpos de agua eutróficos; cosmopolita.
Distribución regional: Primer registro para Quintana Roo. Yucatán: Mérida (Tavera et al., 2013). Península de Yucatán: No especifica (Schmitter-Soto et al., 2002). Otros registros en México: Ciudad de México, Michoacán, Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1276-1279, 1283-1286, 1288, 1292, 1297, 1298.
3. Eucapsis aphanocapsoides (Skuja) Komárek & Hindák 2016 (Figura 5)
Colonias de células dentro de un mucílago general, de forma esférica a subesférica, con bordes más o menos irregulares, de 23-32(50) µm de diámetro. Células de 1.5-2.5 µm de diámetro, con forma subesférica a esférica; algunas aparentan tener forma hemisférica. Agrupadas en pares y en tétradas.
Hábitat: Presente en el plancton. Komárek & Hindák (2015) mencionan que es una especie que crece en lagos oligotróficos a mesotróficos.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Veracruz (como Chroococcus aphanocapsoides) (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1279, 1298.
4. Eucapsis parallelepipedon (Schmidle) Komárek & Hindák 1989 (Figura 6)
Colonias formando agrupaciones de cuatro células, percibiéndose al microscopio hasta tres capas; sin capa general de mucílago o si la presenta es muy difusa. Células esféricas a hemisféricas, de 1.8-3.1 μm de diámetro.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) mencionan que es una especie de agua dulce en ambientes tropicales y en áreas cálidas de zonas templadas.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1276, 1282, 1284.
5. Merismopedia glauca (Ehrenberg) Kützing 1845 (Figura 7)
Colonias de células formando grupos de 4, que a su vez forman grupos de 16; planas, más o menos rectangulares. Células esféricas a hemisféricas de 2.5-3.1 µm de ancho por 3.1-4.3(5) µm de largo, sin aparente capa de mucílago individual o si la presenta es marginal y muy fina; contenido celular granular fino.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) mencionan que es una especie metafítica y bentónica en pantanos, agua estancada, en el litoral de cuerpos de agua o en lagos y estanques no contaminados; también se presenta planctónica. Especie cosmopolita.
Distribución regional: Quintana Roo: José María Morelos (López-Adrián et al., 2017a). Yucatán: Homún (Catzim, 2009) y Mérida (López-Adrián et al., 2017b). Otros registros en México: Campeche, Ciudad de México, Estado de México, Guanajuato, Jalisco, Michoacán, Morelos, Oaxaca, Puebla, San Luis Potosí, Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1277, 1278, 1280.
6. Synechocystis pevalekii Ercegovic 1925 (Figura 8)
Colonias de vida libre o en un mucílago muy difluente. Células con forma esférica a hemisférica, con un lado complanado. Células de 2.5-3.1 µm de diámetro. Algunas células aparentan tener una fina capa de mucílago.
Hábitat: Presente en el plancton. Ortega-Murillo et al. (2015) y Moreno et al. (2008) mencionan a la especie en hábitat planctónico y perifítico.
Distribución regional: Quintana Roo: Reserva de la Biósfera de Sian Ka’an (Valadez et al., 2015). Península de Yucatán: Sin localidad específica (Schmitter-Soto et al., 2002). Otros registros en México: Chiapas, Michoacán, Morelos y Oaxaca (Novelo & Tavera, 2022).
UADY-UADY: 1282, 1284, 1286, 1289, 1290, 1291.
Familia Romeriaceae
7. Romeria hieroglyphicaKomárek & Komárková-Legnerová 2007 (Figura 9)
Tricomas solitarios con 6-10 células, de hasta 65.6 µm de longitud, más o menos rectos. Células no envueltas por mucílago general, dispuestas en fila de forma no estricta. Células de 3.12-7.5 µm de largo por 0.75-1.87 µm de ancho. Separación entre células marcada y algunas se disponen de izquierda a derecha a través del desarrollo de los tricomas.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) mencionan que también se puede encontrar de forma metafítica.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Ciudad de México (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1282, 1284, 1288, 1292-1294, 1297, 1298.
Familia Pseudanabaenaceae
8. Jaaginema subtilissimum (Kützing ex Forti) Anagnostidis & Komárek 1988 (Figura 10)
Filamentos muy largos, solitarios, de 75-108(131.2) µm de longitud, curveándose cuando se prolongan; isopolares. Célula apical con polo levemente obtuso, de 2.5-5 µm de largo por (1.2)1.5-1.8 µm de ancho. Células vegetativas cilíndricas, más largas que anchas, de (3)4.3-5 µm de largo por (1)1.2-2.5 µm de ancho.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que es una especie bentónica en aguas lodosas; encontradas en aguas contaminadas y estancadas, aunque también ocurren en aguas con corrientes. Se puede presentar en cuerpos de agua dulce, salobre y salada.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Ciudad de México (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1276, 1278, 1279, 1285.
9. Komvophoron minutum (N. Carter) Anagnostidis 2001 (Figura 11)
Tricomas solitarios, de 26-40 µm de longitud, por lo general recto o ligeramente curvo, sin vaina. Células sub-esféricas, de 1.2-3 µm de largo por (1.7)2-3.1 µm de ancho; célula apical redondeada, aunque algunas se atenúan levemente, de 1.5-2 µm de largo por ±2 µm de ancho; presenta un espacio entre células a través del filamento, poco notorio.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) mencionan que la especie es bentónica, pero puede encontrarse de forma ticoplanctónica.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Michoacán y Puebla (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1276, 1280.
10. Limnothrix borgertii (Lemmermann) Anagnostidis 2001 (Figura 12)
Filamentos no muy numerosos en fascículos, rectos o haciendo curvas levemente pronunciadas, de 60-565 µm de longitud. Vaina delgada de 2-2.5 µm de ancho. Células más o menos isodiamétricas, con aerotopos dispuestos alrededor del centro de cada una, de 1.87-2.5 µm de largo por 1.87-2.5 µm de ancho. Célula apical truncada a redondeada.
Hábitat: Presente en el plancton. Tavera et al. (2013) mencionan que se trata de una especie planctónica.
Distribución regional: Primer registro para Quintana Roo. Yucatán: Mérida (Tavera et al., 2013). Otros registros en México: Oaxaca (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1278, 1279, 1291.
Familia Leptolyngbyaceae
11. Planktolyngbya limnetica (Lemmermann) Komárková-Legnerová & Cronberg 1992 (Figura 13)
Filamentos rectos, no rígidos, formando ondulaciones laxas; variable en tamaño, de 63.7-430 µm de longitud, isopolares, con ápices redondeados; ancho de la vaina de 1.8-2.5 µm. Células más o menos isodiamétricas, de 1.8-3.1 µm de largo por 1.8-2.5 µm de ancho.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que es una especie planctónica en lagos de agua dulce con agua estancada, raramente en agua salada.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Estado de México, Jalisco, Morelos, Tabasco, Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1275-1280, 1285, 1286, 1289, 1291, 1293, 1296, 1298.
Familia Schizothrichaceae
12. Schizothrix tenuis Woronichin 1923 (Figura 14)
Talos mucilaginosos que envuelven a 1-3 tricomas dentro de una cubierta de mucílago, con borde ligeramente irregular y adelgazándose hacia los ápices, de 4-6 µm de ancho. Células de los tricomas de 2-4 µm de largo por 0.8-1 µm de ancho. La célula apical con borde redondeado a ligeramente agudo.
Hábitat: Presente en el plancton; creciendo junto a otras especies que forman matas en las orillas como P. californicum, P. redekei y L. borgertii. Komárek & Anagnostidis (2005) menciona que es una especie que se da en el metafiton de arroyos con sustratos de madera.
Distribución regional: Primer registro para Quintana Roo y México.
UADY-UADY: 1275, 1278, 1291.
Familia Spirulinaceae
13. Spirulina nordstedtii Gomont 1892 (Figura 15)
Tricomas solitarios, formando giros de 5-6 µm de separación entre las crestas. Tricomas de 0.7-1 µm de ancho. Isopolares, con ápice redondeado. Contenido celular homogéneo.
Hábitat: Presente en el plancton. (Komárek & Anagnostidis (2005) mencionan que la especie puede darse en aguas continentales, así como aguas con diferentes niveles de salinidad.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Estado de México y Puebla (Novelo & Tavera, 2022).
UADY-UADY: 1279, 1291.
14. Spirulina subsalsa Oersted ex Gomont 1892 (Figura 16)
Tricomas solitarios, formando giros que se tocan entre sí, con una distancia entre crestas de 0.8-1 µm y un diámetro de ±1.5 µm, de color verde-azul. Tricomas de 0.8-1 µm de ancho. Isopolares, con ápice redondeado. Contenido celular homogéneo.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que es una especie cosmopolita distribuida en diferentes tipos de hábitat.
Distribución regional: Primer registro para Quintana Roo. Yucatán: No especifica (López-Adrián, 2017b). Otros registros en México: Baja California, Ciudad de México, Estado de México, Guanajuato, Hidalgo, Jalisco, Sonora, Tabasco y Tamaulipas (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1280, 1281.
Familia Microcystaceae
15. Microcystis flos-aquae (Wittrock) Kirchner 1898 (Figura 17)

Figuras 17-31 17. Microcystis flos-aquae, 18. Aphanothece comasii, 19. A. stagnina, 20. Gloeothece cf. interspersa, 21. Johannesbaptistia pellucida, 22. Gomphosphaeria aponina, 23. Chroococcus minutus, 24. C. minimus, 25. C. turgidus, 26. Geitlerinema splendidum, 27. Lyngbya martensiana, 28. Oscillatoria ornata, 29. O. princeps, 30. Phormidium californicum, 31. P. lucidum. Barra de escala= 10 µm. Fotografías de los autores.
Colonias esféricas a más o menos irregulares, sin margen visible, de 77.5-100 µm de diámetro. Células esféricas a hemisféricas, de (2.5)3.1-5 µm de diámetro, arregladas de manera densa dentro de la matriz. Aerotopos presentes.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) menciona que se trata de una especie planctónica que está presente en ambientes mesotróficos y eutróficos.
Distribución regional: Primer registro para Quintana Roo. Yucatán: Mérida (López-Adrián et al., 2017b). Otros registros en México: Ciudad de México, Colima, Estado de México, Hidalgo, Jalisco, Oaxaca, Michoacán, Morelos, Querétaro, Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1278, 1294.
Familia Aphanothecaceae
16. Aphanothece comasii Komárková-Legnerová & Tavera 1996 (Figura 18)
Colonias esféricas a ovales, con mucílago delimitado y firme, de 15-32.5 µm de diámetro. Células de forma subesférica a ampliamente ovales, distribuidas de forma irregular dentro del mucílago, de 3.7-5 µm de largo por 2.3-3.1 µm de ancho.
Hábitat: Presente en el plancton. Tavera et al. (2013) mencionan que se trata de una especie planctónica y metafítica.
Distribución regional: Primer registro para Quintana Roo. Yucatán: Mérida (Tavera et al., 2013). Otros registros para México: Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1277, 1280.
17. Aphanothece stagnina (Sprengel) A.Braun in Rabenhorst 1863 (Figura 19)
Colonias esféricas, de 27.5-50 µm de diámetro, mucílago envolviendo a las colonias de forma delimitada. Células elipsoidales o bacilares, con ápices redondeados, de 1.8-2.4 µm de ancho por 3.75-5(5.6) µm de largo; sin mucílago individual.
Hábitat: Presente en el plancton. Bentónicas, epipélicas; en ocasiones arraigadas a plantas sumergidas. En la superficie del agua flotando en masas. Presente en sitios eutróficos (Komárek & Anagnostidis, 1999).
Distribución regional: Primer registro para Quintana Roo. Yucatán: Motul (Ortega, 1984), Mérida (López-Adrián et al., 2017b; Tavera et al., 2013). Otros registros en México: Chiapas, Jalisco, Michoacán, Nuevo León, Sonora, Tabasco, Tlaxcala y Veracruz.
UADY-UADY: 1275, 1276, 1278-1280, 1282, 1283, 1285, 1286, 1288-1294, 1296-1298.
18. Gloeothece cf. interspersa N.L. Gardner 1927 (Figura 20)
Colonia con forma ovalada, de 10-13.7 µm de ancho por 10-15 µm de largo, formando agrupaciones numerosas. Células ovaladas más o menos más largas que anchas, de (3.1)3.7-4.3(5) µm de largo por 2.5-3.1 µm de ancho, con mucílago individual lamelado (de dos a tres capas), en ocasiones con coloración verde olivo, de 1-2 por sub-colonia.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) mencionan que la especie tipo es de ambientes aerofíticos. Komárek & Komárková-Legnerová (2007) reportan una posible población en el metafiton.
Nota taxonómica: Especie que se asemeja a G. interspersa, pues concuerda en lo general con las características morfológicas mencionadas en Komárek & Komárková-Legnerová (2007) reportado en Belice. No obstante, la condición del hábitat es diferente al igual que los reportes previos; la presencia de nuestros ejemplares en el plancton podría deberse al posible movimiento del agua en el litoral.
UADY-UADY: 1277, 1278.
Familia Cyanothrichaceae
19. Johannesbaptistia pellucida (Dickie) W.R. Taylor & Drouet in Drouet 1938 (Figura 21)
Talo pseudofilamentoso, con mucílago tubular, no estrictamente rígido, formando leves ondulaciones, de 16.2-17.5 µm de ancho. Células de forma discoidal, formando agrupaciones de 2 después de la división, de (2.5)4.3-5 µm de largo por 10-11.2 µm de ancho. Muchos necridios presentes.
Hábitat: Presente junto a otras especies que forman filamentos en la orilla de la laguna; también se observó en el plancton. Komárek & Anagnostidis (1999) mencionan que se ha reportado a la especie en hábitats bénticos y metafíticos en aguas dulces, heliotermales, mesohalinas o salinas. También se presenta ticoplanctónica en lagos.
Distribución regional: Quintana Roo: Tulúm (López-Adrián & Barrientos-Medina, 2005; Nava-Ruiz & Valadez, 2012). Yucatán: Huhí (Díaz, 1999). Otros registros en México: Estado de México y Nuevo León (Novelo & Tavera, 2022).
UADY-UADY: 1294, 1297.
Familia Gomphosphaeriaceae
20. Gomphosphaeria aponina Kützing 1836 (Figura 22)
Colonias de vida libre con forma esférica, de 50-82.5 µm de diámetro, de color verde olivo, con mucílago común difluente. Células con forma obovada y posteriormente a forma de clava, de 11.2-12.5 µm de largo por 5-6.2 µm de ancho; cuando las células presentan forma de corazón el ancho es de 11.2-12.5 µm. Presenta contenido granular.
Hábitat: Presente junto a otras especies que forman filamentos en la orilla en la laguna; también se observó en el plancton. Komárek & Anagnostidis (1999) mencionan que es una especie metafítica en pantanos oligotróficos y mesotróficos, así como en el litoral de lagos de agua dulce; se puede presentar de manera ticoplanctónica y planctónica.
Distribución regional: Quintana Roo: Tulúm (López-Adrián & Barrientos-Medina, 2005). Yucatán: Chocholá y Sacalum (López-Adrián & Barrientos-Medina, 2005), Mérida (López-Adrián et al., 2017b). Península de Yucatán: No especifica (Schmitter-Soto et al., 2002). Otros registros en México: Chiapas, Ciudad de México, Guanajuato, Hidalgo, Jalisco, Michoacán, Oaxaca, Puebla, Tabasco y Tamaulipas (Novelo & Tavera, 2022).
UADY-UADY: 1279, 1280, 1281.
Familia Chroococcaceae
21. Chroococcus minutus (Kützing) Nägeli 1849 (Figura 23)
Colonias esféricas con 2-4 células, con una capa de mucílago de 10.6-35 µm de diámetro; engrosada. Células hemisféricas, de 9.3-10.6 µm de ancho y 11.2-13.7 µm de largo, de color verde-azul; con contenido granular fino a levemente pronunciado; capa de mucílago individual lamelado, hasta dos capas.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) menciona que suele ser una especie planctónica, ticoplanctónica o metafítica en ambientes oligotróficos a levemente eutróficos.
Distribución regional: Quintana Roo: Tulum (Nava-Ruiz & Valadez, 2012). Yucatán: Hunucmá (Catzim, 2009). Otros registros en México: Chiapas, Ciudad de México, Estado de México, Guanajuato, Hidalgo, Jalisco, Michoacán, Morelos, Nayarit, Oaxaca, Puebla, Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1285, 1289.
22. Chroococcus minimus (Keissler) Lemmermann 1904 (Figura 24)
Colonias con forma ovalada a sub-ovalada, con generalmente 2-4(-16) células, de (5)8.1-12.5 µm de diámetro, con mucílago hialino. Células con forma esférica a sub-esféricas, algunas se observan hemisféricas, de 1.2-2.5 µm de diámetro. Algunos ejemplares presentan subgrupos de dos células que se agrupan dentro colonia de cuatro. Se observó una gran incidencia en lluvias en las poblaciones de Chichancanab.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) mencionan que la especie se da en ambientes oligotróficos a mesotróficos en cuerpos de agua dulce.
Distribución regional: Quintana Roo: Tulúm (Sánchez et al., 2002). Yucatán: Mérida (Catzim, 2009). Otros registros en México: Ciudad de México, Estado de México, Michoacán, Tabasco y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1278, 1280, 1282-1284, 1286-1294, 1296, 1297.
23. Chroococcus turgidus (Kützing) Nägeli 1849 (Figura 25)
Colonias más o menos ovaladas, de 57.5-70 µm de diámetro, con mucílago blanquecino, de 2-8(-16) células por colonia. Células triangulares-redondeadas a hemisféricas, de 20-26.2 µm de ancho y 30-31.2(32.5) µm de largo, de color verde intenso a verde oliváceo; contenido granular homogéneo; capa de mucílago pegado al margen de la célula, en algunos ejemplares es muy notorio.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (1999) comenta que es una especie que se da comúnmente en el detritus de rocas mojadas, en pantanos, aguas oligotróficas con vegetación sumergida, en el litoral de agua con poca corriente, estanques y lagos. Probablemente con distribución cosmopolita.
Distribución regional: Quintana Roo: Tulúm (López-Adrián & Barrientos-Medina, 2005; Nava-Ruiz & Valadez, 2012). Campeche: Campeche, Campeche (López-Adrián & Barrientos-Medina, 2005). Yucatán: Mérida (Catzim, 2009; López-Adrián et al., 2017b), Hunucmá y Homún (Catzim, 2009). Otros registros en México: Chiapas, Ciudad de México, Colima, Estado de México, Jalisco, Michoacán, Morelos, Oaxaca, Querétaro, Puebla, Tabasco, Tamaulipas, San Luis Potosí y Veracruz (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1278, 1280, 1281.
Familia Coelofasciculaceae
24. Geitlerinema splendidum (Greville ex Gomont) Anagnostidis 1989 (Figura 26)
Filamentos solitarios sin vaina, de 15-17 µm de longitud. Ápice elongado con una ligera desviación en la parte más apical, en donde también se redondea levemente. Tricomas de (3.7)5-6.2 µm de ancho. Células cilíndricas de 10-11.2 µm de largo, con 2 gránulos entre cada extremo de las células por lado.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que además puede darse de forma bentónica.
Distribución regional: Quintana Roo: Tulum (Nava-Ruiz & Valadez, 2012). Otros registros en México: Ciudad de México, Hidalgo, Michoacán y Puebla (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1278, 1280, 1281.
Familia Oscillatoriaceae
25. Lyngbya martensiana Meneghini ex Gomont 1892 (Figura 27)
Filamentos rectos, en fascículos moderadamente numerosos, mayor a 165 µm de longitud, con vaina firme y delgada, de 7.5-8.7 µm de ancho. Tricomas de 5.6-6.2 µm de ancho. Células de 1.2-1.8 µm de largo. Ápice engrosado con forma redondeada. Contenido granular presente.
Hábitat: Presente junto a otras especies filamentosas en la orilla en la laguna; también se registró en el plancton. Komárek & Anagnostidis (2005) menciona que esta especie suele crecer en el metafiton y perifiton de aguas tanto estancadas como con corriente.
Distribución regional: Quintana Roo: Tulúm (Nava-Ruiz & Valadez, 2012) (como Porphyrosiphon martensianus). Otros registros en México: Ciudad de México, Estado de México, Jalisco, Michoacán, Morelos, Oaxaca, Puebla, San Luis Potosí (Novelo & Tavera, 2022).
UADY-UADY: 1279.
26. Oscillatoria ornata Kützing ex Gomont 1892 (Figura 28)
Filamentos ligeramente ondulados, más o menos de manera irregular, de color verde-azul a verde-azul oscuro, isopolares, constreñidos en los septos. Células más anchas que largas, de 1.8-3.7(5) µm de largo por 10-11.2 µm de ancho; célula apical redondeada, sin caliptra, de 3.7-5 µm de largo por 10-11.2 µm de ancho. Contenido granular muy marcado.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que crece en el litoral de aguas sin mucha corriente, usualmente en grandes lagos; así mismo se observa en sustrato rocoso o bentónica cerca de la orilla.
Distribución regional: Primer registro para Quintana Roo. Yucatán: Homún (Catzim, 2009). Otros registros en México: Estado de México, Michoacán, Oaxaca, Puebla, Querétaro, San Luis Potosí y Tabasco (Novelo & Tavera, 2022).
UADY-UADY: 1276, 1278, 1284.
27. Oscillatoria princeps Vaucher ex Gomont 1892 (Figura 29)
Filamentos solitarios, alcanzando hasta 2 mm de longitud. Tricomas grisáceos, con bordes ligeramente aserrados, rectos, con bordes engrosados. Células más anchas que largas, de 2.5-3.7(7.5) µm de largo por 12.5-18.5 µm de ancho; ápice rectangular con borde redondeado amplio, con la célula apical con forma de cazo, de 12.5-17.5 µm de ancho. Contenido granular ligeramente marcado.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que se trata de una especie béntónica en lodo o rocas en aguas sin corrientes y en aguas con poca corriente, en arroyos o charcos, marismas, en el fondo de lagos; también puede darse de forma ticoplánctónica.
Distribución regional: Quintana Roo: Tulum (Nava-Ruiz & Valadez, 2012). Yucatán: Izamal (Ortega, 1984); Hunucmá y Homún (Catzim, 2009). Otros registros en México: Chiapas, Chihuahua, Ciudad de México, Coahuila, Estado de México, Hidalgo, Morelos, Puebla, Querétaro y San Luis Potosí (Novelo & Tavera, 2022).
UADY-UADY: 1275, 1278.
28. Phormidium californicum Drouet 1942 (Figura 30)
Talos finos y delgados, con apariencia mucilaginosa cartilaginosa, solitarios. Vaina ausente. Tricoma recto y cilíndrico, isopolar, de 212-231.8 µm de longitud, constreñido muy leve en septos. Células más largas que anchas, de 10-11.2 µm de largo por 4.3-5 µm de ancho; células apicales se agudizan. Contenido granular muy fino.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que se trata de una especie que habita suelos húmedos y aguas de baja profundidad.
Distribución regional: Primer registro para Quintana Roo. Otros registros en México: Sonora (Novelo & Tavera, 2022).
UADY-UADY: 1275.
29. Phormidium lucidum Kützing ex Gomont 1892 (Figura 31)
Talos ligeramente engrosados, con apariencia membranácea, flotando en masas formando grandes agrupaciones. Filamento recto a ligeramente curvo, alcanzando los 550 µm de longitud. Vaina firme, de 7.5-8.1 µm de ancho. Células con forma discal, más anchas que largas, de 1.8-2.5 µm de largo por 5-5.6 µm de ancho; con gránulos dentro de cada célula. Necridios presentes en todo el tricoma.
Hábitat: Presente en el plancton. Komárek & Anagnostidis (2005) menciona que esta especie suele crecer en aguas termales (creciendo en lodo húmedo o en zonas de vapor); también se ha reportado para aguas salobres y salinas.
Distribución regional: Primer registro para Quintana Roo y México.
UADY-UADY: 1275, 1276, 1279, 1297.
DISCUSIÓN
Los resultados de las variables fisicoquímicas señalan que la laguna no sufrió grandes cambios en relación con años anteriores (Hodell et al., 2012; Pérez et al., 2011), teniendo variables como la temperatura, pH y oxígeno disuelto que se sitúan en el intervalo de lo reportado en este trabajo. Es importante notar que la dierencia entre la conductividad eléctrica y los sólidos disueltos totales con la reportada en la literatura puede deberse a la toma de datos en diferentes temporadas climáticas, donde la precipitación pudo jugar un papel importante; no obstante, los altos valores pueden deberse a las altas concentraciones de sulfato. Por otro lado, se confirma que el cuerpo de agua presenta una salinidad baja (Strecker, 2006), manteniéndose en el intervalo de agua dulce. La mayor concentración de nitratos se presenta durante la época de secas, lo que podría explicar la mayor presencia de especies en la temporada al estar este nutriente biodisponible, mientras que durante lluvias tanto los nitratos como los fosfatos se mantienen en concentraciones bajas, lo que podría indicar limitación por nutrientes y por ende la poca presencia de diversidad.
Las características de la laguna son afines a las de otros cuerpos de agua presentes en el Caribe (Rejmánková et al., 2004), compartiendo también al menos 31.4% de especies de cianobacterias que se reportan en otros cuerpos de agua de esta región tropical, tales como Florida (Marshall, 1981), Belice (Komárek & Komárková-Legnerová, 2007; Turicchia et al., 2009; Komárek et al., 2017) y Cuba (Komárek, 1984, 1989, 1995; Comas-González, 2008, 2009). En la porción mexicana de la península de Yucatán, existe afinidad de taxones en cuerpos de agua predominantes de la región (cenotes y aguadas; Tavera et al., 2013) similares a lo reportado, y la diferencia a destacar es que la familia Synechococcaceae fue de las más representadas en este trabajo. Enfatizando en la laguna Chichancanab, esta investigación difiere con los reportes de la poca presencia de fitoplancton (Strecker, 2006; Bayona-Miramontes, 2012), y se acerca a una mención prospectiva de 83 especies de microalgas, de las cuales 33 corresponden a cianobacterias (López-Adrián et al., 2017a), aun considerando el hecho de que cuatro taxones inicialmente considerados tuvieron que eliminarse del recuento por determinaciones problemáticas.
De acuerdo con Novelo & Tavera (2022), el consenso del registro de cianobacterias en trabajos ficoflorísticos en la Península de Yucatán estima la presencia de 373 especies correctas. De este modo, este trabajo representa un incremento de 11 especies (en un aumento de 2.9%) al conocimiento de este grupo en la región, alcanzando a 384. Para Quintana Roo, la contribución es de 18 especies (aumento de 21.6%), alcanzando los 101 registros para el estado. Por otro lado, este trabajo aporta dos nuevos registros para México, por lo que este dato incrementa a 801 especies.
Los órdenes predominantes en la laguna fueron Synechococcales, Chroococcales y Oscillatoriales, destacándose las especies Chroococcus minutus, Johannesbaptistia pellucida, Geitlerinema splendidum y Oscillatoria princeps, considerados en la literatura como especies cosmopolitas (Komárek & Anagnostidis, 1999; 2005). La presencia de la familia Entophysalidaceae y mucha riqueza de Chroococcaceae está atribuida a su restricción a la subregión del Caribe (Tavera et al., 2013). Otro género a destacar es Microcystis, que se caracteriza por responder rápidamente a las altas concentraciones de nutrientes y cuya presencia debe considerarse en trabajos ecológicos futuros (Jensen et al., 1994).
Dada las limitaciones de las herramientas morfológicas para identificación de cianobacterias, algunos ejemplares sólo pudieron reconocerse a nivel de género, por lo que la sugerencia de estudios que integren taxonomía polifásica para este grupo, contemplando datos moleculares, citológicos y ecológicos, tal como lo sugiere Komárek et al. (2014) y Komárek (2020) debe considerarse para una mayor profundización sobre el conocimiento de este grupo en Chichancanab, más aún cuando se ha sugerido que este sitio ha pasado por procesos de aislamiento geográfico (Hodell et al., 2005, 2012). En adición a lo anterior, el conocimiento generado de Cyanobacteria en la laguna es apenas una parte parcial de la diversidad presente de algas de agua dulce, por lo que se sugiere la exploración de otros grupos como Chlorophyta, Charophyta y Bacillariophyta.
Finalmente, el depósito de la información en herbario representa una parte sustancial para seguir conociendo y ampliando el conocimiento de la flora de cianobacterias y otras algas en la región, puesto que este trabajo es uno de los pocos en la península de Yucatán en este tópico que alude a material perteneciente a una colección biológica. Ciertamente, la colección de muestras de este tipo con su correcta caracterización representa a la comunidad tal como fue muestreada el día que se realizó, por lo que se convierte en un referente futuro para cualquier tipo de investigación.
CONCLUSIONES
Se determinaron 29 especies pertenecientes a 21 géneros, 14 familias y cuatro órdenes. El orden mejor representado fue el de Synechococcales. Las familias mejores representadas fueron Merismopediaceae y Oscillatoriaceae. El registro en la porción mexicana de la península de Yucatán incrementó a 384, mientras que para Quintana Roo incrementó a 101. La laguna comparte características ambientales con otros cuerpos de agua tropicales presentes en países del Caribe, por lo que se reconocieron especies similares y taxones afines.











 nueva página del texto (beta)
nueva página del texto (beta)