INTRODUCCIÓN
Dentro de los recursos hídricos más importantes porque brindan diferentes servicios ambientales están las aguas superficiales en los que encontramos los ríos y arroyos (Wetzel, 2001; Tarbuck et al., 2005; Fang & Jawitz, 2019). El hombre los ha utilizado desde la antigüedad para realizar diversas actividades sociales, económicas y recreativas. Sin embargo, por su complejidad en ocasiones no se han planificado adecuadamente lo que genera un deterioro y contaminación de los cuerpos de agua (Tarbuck et al., 2005; Berger et al., 2017). Además de los impactos ambientales locales se incluyen los regionales a nivel de cuenca, donde se encuentra el cambio de uso del suelo por el establecimiento de zonas urbanas en sus inmediaciones, y las actividades agrícolas y ganaderas, así como los cambios climáticos globales, y otros aspectos que han recibido una atención creciente por parte de la comunidad científica (Behmel et al., 2016; Ruiz-Picos et al., 2017).
Para la evaluación de la degradación de los ecosistemas acuáticos se han desarrollado herramientas como los índices de calidad del agua (Gitau et al., 2016; Sutadian et al., 2016). Estos tienen la cualidad de derivar de manera efectiva un solo valor, a partir de numerosas varaibles fisicoquímicas, que refleja el nivel de calidad del agua, eliminando así las diferencias entre las variables utilizadas individualmente (Wu et al., 2017). Además, los índices de calidad del agua se han aplicado ampliamente para evaluar aguas superficies en diferentes lugares (e.g., Şener et al., 2017) y algunos de ellos se han establecido en las normas oficiales de diferentes países (AENOR-UNE, 2007; EPA, 2019).
Otros indicadores que permiten caracterizar el ecosistema y determinar la magnitud de los impactos son las comunidades bióticas acuáticas, particularmente los macroinvertebrados bentónicos (Roldán-Pérez, 1999, 2016; Laini et al., 2018). Estos organismos son de fácil muestreo y no se necesita de una alta inversión económica, presentan parte o todo su ciclo de vida dentro del cuerpo de agua y son organismos centinelas con escasa capacidad de movimiento (Cotler et al., 2006; Keke et al., 2017). En general, los macroinvertebrados responden de diferente manera a los agentes contaminantes favoreciendo la detección de las alteraciones en tiempo hábil y abarcando diferentes hábitats (Cotler et al., 2006; Oscoz et al., 2011). Se han empleado algunos índices ecológicos tradicionales aplicados a los macroinvertebrados, como respuesta integral en un solo valor acerca de la condición del sitio (Ruiz-Picos et al., 2016).
En el presente estudio se toma como ejemplo el río Cupatitzio y tributarios, donde se llevan a cabo diferentes actividades antropogénicas que ocasionan un deterioro del cuerpo de agua (Pureco, 2016). Dentro de las más importantes son el desarrollo de varias zonas urbanas, la generación de energía eléctrica que promueve la alteración hidrológica, la producción industrial y agropecuaria que vierten sus aguas residuales sin tratamiento y el turismo (Ortega et al., 2013: 2015; Ruiz-Picos et al., 2017). Esto genera un mosaico de usos de suelo cuya influencia en el río se puede describir a través del impacto en la calidad del agua y la comunidad de macroinvertebrados. El objetivo es determinar el nivel de degradación ecológica de un río subtropical y sus afluentes considerando la interrelación entre las variables abióticas y bióticas a través del tiempo y el espacio.
MATERIALES Y MÉTODOS
Área de estudio. La Subcuenca del río Cupatitzio se encuentra dentro de la región hidrológica del río Balsas y de la cuenca del río Tepalcatepec-Infiernillo (Ortega et al., 2015). Se sitúa en la parte occidental y central del estado de Michoacán (19° 25’ 01.97’’ norte y -102° 03’ 01.30’’ oeste; Fig. 1) con una superficie de 2,815 km2. Está localizada en la pendiente sur de la Sierra de Uruapan, dentro de los municipios de Uruapan, Gabriel Zamora, Lombardía y Nueva Italia (Ortega et al., 2015; Pureco, 2016). El río Cupatitzio tiene una longitud de 52 km lineales, nace a 1,640 msnm en el Parque Nacional Barranca del Cupatitzio y termina a los 443 msnm cuando se une al río El Márquez el cual desemboca en la presa El Infernillo.
Uso de suelo y vegetación. Se emplearon los datos vectoriales de capa de uso de suelo y vegetación de la serie VI (INEGI, 2017). Se identificaron ocho diferentes tipos de uso de suelo que incluyeron: Asentamientos humanos (AH); vegetación secundaria arbustiva de bosque de pino-encino (VSa/BPE); agricultura de temporal (AT); pastizal inducido (PI); agricultura de riego (AR); bosque de pino-encino (BPE); cuerpo de agua (CA) y vegetación secundaria arbustiva de selva baja caducifolia y de bosque de pino-encino (VSSBC/VSSBPE). Se aplicó la metodología de Barbour et al. (1999) para determinar el porcentaje de influencia del tipo de vegetación en el cauce del río.
Sitios de muestreo, análisis de campo y laboratorio. Se establecieron 20 sitios de muestreo distribuidos a lo largo del río, ubicados de acuerdo con los impactos que recibe y las actividades que se realizan en sus inmediaciones (11.6 m2 área de captura) (Anexo 1). Los sitios comprenden la cabecera del río y aquellos lugares donde nace agua de manantiales, seguido del recorrido por la zona urbana, hasta su desembocadura. Los muestreos se realizaron de manera cuatrimestral, cubriendo la temporada de estiaje, lluvias y después de lluvias (mayo y septiembre 2016, y enero 2017, respectivamente). En cada sitio se registraron 16 variables fisicoquímicas (Tabla 2), nueve se determinaron en campo con un multisensor Hydrolab DS5 (temperatura, conductividad eléctrica, pH, cloruros, sólidos totales disueltos, turbiedad, oxígeno disuelto y salinidad) y con un flujómetro (flujo). Siete se analizaron en laboratorio, para lo cual se recolectaron 2.5 L de agua en frascos ámbar de plástico para determinar demanda bioquímica de oxígeno (BOD5; NMX-AA-028-SCFI-2001), demanda química de oxígeno (COD; NMX-AA-030-1-SCFI-2012), Amonio (NH4; NMX-AA-026-SCFI-2010), Nitratos (NO3; NMX-AA-079-SCFI-2001) y fósforo total (TP NMX-AA-029-SCFI-2001). Así como 500 mL de agua en frascos de vidrio esterilizados previamente, a partir de los que se determinaron coliformes totales y fecales (TotC y FecC; NMX-AA-042-SCFI-2015). Las muestras fueron conservadas a 4°C para su posterior análisis en el laboratorio de acuerdo con los criterios de Rice et al. (2017). Las muestras biológicas se tomaron con una red manual tipo Surber (marco rectangular de 25.4 x 45.7 cm, con un área de boca 1,160.7 cm2 y abertura de malla de 365 µm) por arrastre durante 5 a 10 minutos, se lavaron para eliminar el exceso de arcillas en una cubeta con fondo de tamiz de 420 µm y se conservaron en alcohol al 70% en frascos de plástico con capacidad de dos litros. Los organismos se identificaron por medio de diferentes claves taxonómicas (Pennak, 1978; Merritt et al., 2008; Thorp & Covich, 2009).
Índices biológicos e índices de calidad del agua. Se determinó la
dominancia global de las especies por temporada por medio del Índice de Valor
Biológico propuesto por Sanders (Loya-Salinas &
Escofet, 1990). BVSIi =
La calidad del agua se calculó de acuerdo con el índice propuesto por la National Sanitation Foundation (1978, índice
NSF-WQI) por medio de la fórmula:
Análisis estadísticos. Se exploró las variables fisicoquímicas agua del río y el uso del suelo en los diferentes sitios por medio de un análisis de componentes principales (PCA). Se realizaron análisis de varianza, (ANOVA) de una vía con los datos de las variables fisicoquímicas para identificar diferencias estadísticamente significativas de cada una de ellas entre temporadas (α=0.05). Se implementó un Procedimiento de Permutación Multirespuesta (MRPP) que representa una aproximación no paramétrica para determinar si no hay diferencias en la abundancia de las familias entre meses y sitios. Para el análisis se utilizaron matrices de similitud Relativas de Sorensen con la distancia en intervalos y probando la significancia estadística con 5000 permutaciones. Además, se hizo un Análisis de Especies Indicadoras (ISA) que es un indicador simétrico de la ocurrencia y la abundancia, para determinar cuáles son las familias responsables de la diferencia entre sitios (Dufrêne & Legendre, 1997). Para determinar la relación de las variables abióticas (variables fisicoquímicas) con las bióticas (abundancia de macroivertebrados) se realizaron análisis de escalamiento multidimensional no métrico (NMDS). Previo al análisis se implementaron correlaciones entre las variables y componentes principales para identificar posibles redundancias en los valores. El PCA se desarrolló por medio de la función prcomp y el NMDS con la función metaMDS en el paquete vegan del programa R (R Core Team, 2019), el análisis MRPP e ISA se obtuvieron con el programa PC-ORD (v.6; McCune & Mefford, 2006).
RESULTADOS
Uso del suelo. Seis de los veinte sitios presentaron valores de porcentaje de cobertura de los asentamientos urbanos arriba del 95%, principalmente en el inicio del río. La agricultura de temporal fue el siguiente uso del suelo más representativo donde cinco sitios tuvieron coberturas arriba del 55%. Posteriormente, la categoría vegetación secundaria arbustiva de bosque de pino-encino presentó en tres sitios una cobertura arriba del 70%. Los que menores valores de cobertura presentaron fueron el bosque de pino-encino (dos sitios con menos del 17%) y cuerpo de agua (dos sitios con menos del 50%) (Tabla 1).
Tabla 1 Cálculo de las áreas de cobertura en porcentaje de los diferentes usos del suelo identificados en los sitios de muestreo dentro de la cuenca del río Cupatitzio.
| Sitios | AH | VSa/BPE | AT | PI | AR | BPE | CA | VSSBC/VSBPE |
| 1 | 99.06 | 0.94 | SC | SC | SC | SC | SC | SC |
| 2 | 100 | SC | SC | SC | SC | SC | SC | SC |
| 3 | 100 | SC | SC | SC | SC | SC | SC | SC |
| 4 | 100 | SC | SC | SC | SC | SC | SC | SC |
| 5 | 42.63 | 9.76 | 47.61 | SC | SC | SC | SC | SC |
| 6 | 51.99 | SC | 48.01 | SC | SC | SC | SC | SC |
| 7 | SC | 40.77 | 59.23 | SC | SC | SC | SC | SC |
| 8 | SC | 33.23 | 66.77 | SC | SC | SC | SC | SC |
| 9 | 95.91 | SC | 4.09 | SC | SC | SC | SC | SC |
| 10 | 99.15 | SC | 0.85 | SC | SC | SC | SC | SC |
| 11 | 58.58 | 10.93 | 2.43 | 2.59 | 25.48 | SC | SC | SC |
| 12 | 74.24 | 0.31 | SC | 5.14 | 20.31 | SC | SC | SC |
| 13 | 36.13 | SC | 63.12 | SC | SC | 0.75 | SC | SC |
| 14 | SC | 71.32 | 22.5 | SC | SC | SC | 6.18 | SC |
| 15 | 4.92 | SC | 78.54 | SC | SC | 16.54 | SC | SC |
| 16 | SC | 78.61 | 5.84 | 15.55 | SC | SC | SC | SC |
| 17 | SC | 83.51 | 6.01 | 10.17 | SC | SC | SC | 0.32 |
| 18 | SC | 36.58 | 63.42 | SC | SC | SC | SC | SC |
| 19 | SC | SC | SC | SC | 50.94 | SC | SC | 49.06 |
| 20 | SC | SC | SC | 19.81 | 36.3 | SC | SC | 43.9 |
AH = Asentamientos humanos; VSa/BPE = vegetación secundaria arbustiva de bosque de pino-encino; AT = agricultura de temporal; PI = pastizal inducido; AR = agricultura de riego; BPE = bosque de pino-encino; CA = cuerpos de agua; VSSBC/VSSBPE = vegetación secundaria arbustiva de selva baja caducifolia y de bosque de pino-encino y SC= sin cambio.
Variables fisicoquímicas del agua y su interacción con el uso del suelo. Los valores promedio de las variables fisicoquímicas en los 20 sitios para cada período de monitoreo se muestran en la Tabla 2. A pesar de que en algunas variables no se presenta diferencia estadística, lo cual está relacionado a los valores de cada uno de los sitios dentro de cada periodo, sí se identifica una tendencia clara en la media. Algunos ejemplos que muestran mayor variabilidad son demanda química de oxígeno, nitratos, cloruros, turbiedad, coliformes fecales y totales y flujo de agua. (Anexo 2).
Tabla 2 Valores medios de los variables fisicoquímicos en los tres períodos de muestreo.
| Variables | Mayo | Septiembre | Enero | P | EF | R2 |
| Temp (°C) | 20.77 | 18.96 | 18.39 | 31e-6 | 29.34 | 0.78 |
| DO(mg/L) | 8.65 | 9.28 | 9.43 | 17e-11 | 148.8 | 0.95 |
| BOD5(mg/L) | 22.82 | 17.49 | 14.36 | 13 e-2 | 10.03 | 0.54 |
| COD(mg/L) | 71.44 | 144.58 | 43.37 | 0.27 | 1.411 | 0.14 |
| EC (mS/cm) | 219.73 | 148.54 | 218.10 | 53e-7 | 37.99 | 0.82 |
| NH4 (mg/L) | 7.31 | 0.96 | 2.65 | 35e-4 | 13.14 | 0.61 |
| NO3 (mg/L) | 5.88 | 4.88 | 12.39 | 0.48 | 3.64 | 0.30 |
| pH (units) | 7.36 | 7.46 | 7.64 | 26e-2 | 8.61 | 0.50 |
| Cl (mg/L) | 15.23 | 5.40 | 6.53 | 0.23 | 1.579 | 0.16 |
| TDS (ppm) | 0.1597 | 0.1389 | 0.1494 | 92e-4 | 10.83 | 0.56 |
| Turb (ntu) | 460.62 | 118.51 | 114.88 | 0.085 | 2.859 | 0.25 |
| TotC (UFC/100 mL) | 34x106 | 22x106 | 23x107 | 0.693 | 0.3747 | 0.042 |
| FecC (UFC/100 mL) | 39x104 | 41x105 | 23x106 | 0.078 | 2.963 | 0.26 |
| TP (mg/L) | 1.36 | 0.34 | 0.88 | 0.025 | 4.621 | 0.35 |
| Fl (m3/s) | 3.39 | 5.19 | 3.52 | 0.084 | 2.879 | 0.25 |
| Sal (‰) | 0.103 | 0.06 | 0.11 | 9e-8 | 48.8 | 0.85 |
Incluimos el EF= Estadistico F con 17 grados de libertad, las diferencias significativas (P<0.05), y la R2. Temp=Temperatura del agua, DO=Oxígeno disuelto, BOD5=-D Demanda bioquímica de oxígeno, COD=Demanda química de oxígeno, EC=Conductividad eléctrica, NH4=Amonio, NO3=Nitratos, Cl-=Cloruros, TDS=Sólidos disueltos totales, Turb=Turbiedad, TotC=Coliformes totales, FecC=Coliformes fecales, TP=Fósforo total, Fl=Flujo de agua y Sal=Salinidad.
Los resultados del PCA muestran un gradiente ambiental relacionado con el primer componente (29% de la varianza explicada) (Fig. 2). Mayores valores en la concentración de oxígeno disuelto y menores valores de la BDO5 y coliformes fecales hacia la derecha, donde se presenta el inicio o cerca del inicio del río (sitios 1 al 6 en zonas de manantiales). En contraste, hacia la izquierda del mismo componente, hay mayores valores de concentración de amonio y BOD5 y se relacionan con drenajes de zonas urbanas y la agricultura de riego (sitios 9, 11 y 12). El segundo componente se relaciona más con el uso del suelo (15% de la varianza explicada). Hacia arriba se tienen los sitios más cercanos o inmersos en la zona urbana (i.e., Parque Nacional Barranca del Cupatitzio en la ciudad de Uruapan, donde se origina el río). Siguiendo hacia abajo en el mismo eje, donde están los sitios inmersos en zonas de vegetación secundaria, tanto de selva baja caducifolia como de bosque de pino-encino (sitios 16, 17 y 20).
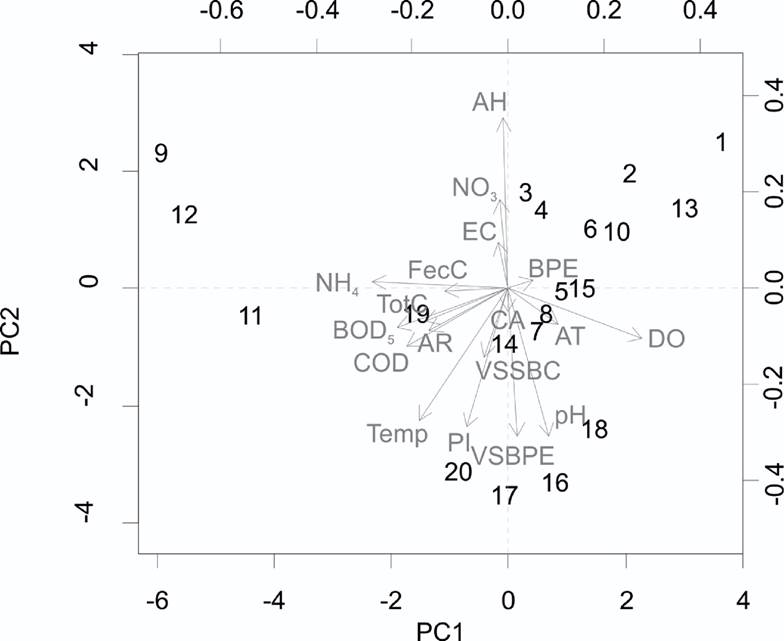
Figura 2 Análisis de componentes principales de las variables fisicoquímicas y de la cubierta del suelo relacionadas con los sitios de muestreo. Los números representan los sitios de muestreo. Temp = Temperatura del agua, DO = Oxígeno disuelto, BOD5 = Demanda bioquímica de oxígeno, COD = Demanda química de oxígeno, EC = Conductividad eléctrica, NH4 = Amonio, NO3 = Nitratos, TotC = Coliformes totales y FecC = Coliformes fecales. AH = Asentamientos humanos; VSa/BPE = vegetación secundaria arbustiva de bosque de pino-encino; AT = agricultura de temporal; PI = pastizal inducido; AR = agricultura de riego; BPE = bosque de pino-encino; CA = cuerpos de agua y VSSBC/VSSBPE = vegetación secundaria arbustiva de selva baja caducifolia y de bosque de pino-encino.
Índice de calidad del agua. Las variables fisicoquímicas mostraron una variación temporal, lo cual se ve reflejado en el índice de calidad del agua (NSF-WQI) con valores entre 51 a 70 (Fig. 3). La mayor parte de los sitios caen en una clasificación del agua media con 70% en estiaje, 80% en lluvias y 70% después de lluvias. Entre un 15 a 20% presentó calidad buena (sitios 1 al 3 y 13) y 15% de calidad mala. Solo el sitio nueve presentó una calidad mala en las tres temporadas, seguido de los sitios 11 y 12 con calidad mala en dos temporadas (Fig. 3). El sitio uno en la temporada de estiaje (mayo) fue el único que obtuvo calidad excelente en todo el estudio y el sitio 13 tuvo buena calidad en las tres temporadas. Con respecto a los tributarios (manantiales, canales, arroyos y ríos), algunos promovieron una mejor calidad del recurso por su entrada al río. Tal es el caso del arroyo Tarecho con calidad media (sitio 3), el río Infiernillo con una calidad media (sitio 5), manantial y río Los Conejos con una calidad buena (sitio 13), la presa Caltzontzin en el balneario Villa Paraíso con calidad buena (sitio 9) y el río Jicalán Viejo con calidad media (17). En contraste, otros deterioraron la calidad del agua como el canal de la hidroeléctrica Zumpimito con calidad media (sitio 12), canal San Francisco con calidad mala por presentarse las descargas del rastro municipal (sitio 11), el arroyo La Cofradía con calidad mala (sitio 8) y el canal de la hidroeléctrica Cupatitzio con calidad media (sitio 16) al cual se une el canal de lixiviados del relleno sanitario municipal.

Figura 3 Valores del índice de calidad del agua obtenidos en las tres estaciones para cada sitio. Estiaje (mayo), temporada de lluvias (septiembre), y estiaje frío (enero). Rectángulos destacan los valores más altos y más bajos del índice.
Dominancia y diversidad de macroinvertebrados. Un total de 81,806 macroinvertebrados bentónicos se colectaron en este estudio, con un 56.15% para el primer periodo (mayo 2016) clasificados en 21 órdenes, 9 clases y 56 familias, un 13.38% para el segundo periodo (septiembre 2016) clasificados en 20 órdenes, 9 clases y 54 familias, y un 30.47% para el tercer periodo (enero 2017) clasificados en 20 órdenes, 9 clases y 57 familias. (Anexo 3). Los valores de abundancia mostraron diferencias significativas entre los meses (A=0.061, P=0.0007) y sitios (A=0.247, P=0.000008). Particularmente, se diferenció la época de secas de las lluvias (A=0.075, P=0.0005) y el periodo intermedio con las lluvias (A=0.036, P=0.014). Por su parte, los sitios que más difirieron de otros fueron los que se encuentran hacia la cuenca baja y son el 18 (con 14 sitios), el 19 (con 13 sitios) y el 16 (con 11 sitios; Tabla 5).
En términos de dominancia, el índice biológico de Sanders (BVIS) destacó como las familias más importantes a Chironomidae y Lumbriculidae en ese orden durante las tres temporadas. Otras familias que también dominaron fueron Ostracoda, Gammaridae Baetidae e Hydracarina (Hydrachnidiae). Por su parte, la familia Ceratopogonidae en mayo, Tanypodinae en septiembre y Gomphidae en enero tuvieron los valores más bajos (Fig. 4). En el análisis de las especies indicadoras, solo 6 de 77 familias son indicadores significativos (Tabla 4). El máximo número de familias por sitio fue de 29 y el mínimo fue de una familia. Los valores de los índices biológicos variaron de acuerdo con la temporada, siendo mayor el valor promedio para las lluvias (septiembre), mientras que el menor se presentó en el estiaje (mayo). La mayor diversidad H’ se presentó en el sitio uno en septiembre (3.48), la mayor equidad J en el sitio cinco en el mes de enero (0.96; Tabla 3).
Tabla 3 Valores de los índices biológicos de riqueza.
| Periodo | Mayo | Septiembre | Enero | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Sitios | S | H’ | J | S | H’ | J | S | H’ | J |
| 1 | 14 | 2.26 | 0.89 | 18 | 3.48 | 0.94 | 10 | 2.15 | 0.92 |
| 2 | 20 | 2.32 | 0.93 | 15 | 2.78 | 0.93 | 15 | 2.23 | 0.91 |
| 3 | 10 | 0.74 | 0.89 | 13 | 2.18 | 0.95 | 13 | 1.19 | 0.92 |
| 4 | 23 | 0.48 | 0.86 | 11 | 1.97 | 0.89 | 17 | 2.12 | 0.9 |
| 5 | 29 | 2.74 | 0.94 | 24 | 2.51 | 0.94 | 17 | 1.76 | 0.96 |
| 6 | 13 | 0.38 | 0.9 | 19 | 2.56 | 0.91 | 13 | 1.88 | 0.94 |
| 7 | 10 | 2.21 | 0.92 | 18 | 2.59 | 0.92 | 23 | 2.76 | 0.93 |
| 8 | 18 | 0.82 | 0.87 | 13 | 2.87 | 0.94 | 6 | 0.7 | 0.85 |
| 9 | 9 | 0.95 | 0.87 | 26 | 2.02 | 0.88 | 25 | 1.8 | 0.92 |
| 10 | 23 | 2.51 | 0.95 | 17 | 2.36 | 0.93 | 18 | 3 | 0.94 |
| 11 | 12 | 2.55 | 0.93 | 16 | 3.1 | 0.95 | 8 | 2.1 | 0.9 |
| 12 | 14 | 2.18 | 0.92 | 15 | 2.22 | 0.91 | 1 | 0 | 1 |
| 13 | 16 | 2.78 | 0.91 | 17 | 2.6 | 0.94 | 10 | 1.47 | 0.87 |
| 14 | 14 | 0.88 | 0.86 | 12 | 2.42 | 0.93 | 10 | 1.67 | 0.85 |
| 15 | 0 | 0 | 0 | 11 | 2.65 | 0.91 | 13 | 1.09 | 0.94 |
| 16 | 18 | 2.66 | 0.93 | 17 | 2.76 | 0.92 | 22 | 1.94 | 0.91 |
| 17 | 19 | 2.21 | 0.92 | 15 | 2.95 | 0.94 | 29 | 2.04 | 0.94 |
| 18 | 25 | 2.25 | 0.94 | 8 | 2.15 | 0.91 | 21 | 3.32 | 0.94 |
| 19 | 8 | 0.39 | 0.78 | 13 | 2.19 | 0.91 | 10 | 0.86 | 0.87 |
| 20 | 20 | 2.94 | 0.92 | 19 | 2.83 | 0.94 | 15 | 2.13 | 0.94 |
S= número de especies; índices H’ = Shannon y J = Pielou.
Tabla 4 Familias de indicadores significativos a partir del análisis de las especies indicadoras.
| Familia | IV | Media | S.Dev | p |
|---|---|---|---|---|
| Glossiphoniidae | 32.4 | 14.3 | 5.21 | 0.0052 |
| Planorbidae | 46.6 | 16.9 | 9.95 | 0.0126 |
| Naucoridae | 52.9 | 20.5 | 9.45 | 0.0224 |
| Polycentropodidae | 38.9 | 16.5 | 7.93 | 0.0224 |
| Cambaridae | 66.7 | 20.1 | 9.13 | 0.0372 |
| Gomphidae | 36.3 | 17.5 | 8.59 | 0.0418 |
V= valor del indicador, S.Dev= desviación estándar p= probabilidad.
Tabla 5 Resultados de la comparación entre pares de sitios del análisis MRPP.
| Comparación | T | A | p | |
|---|---|---|---|---|
| 19 | 1 | -1.86 | 0.30 | 0.03 |
| 19 | 2 | -2.17 | 0.21 | 0.02 |
| 19 | 3 | -2.83 | 0.43 | 0.02 |
| 19 | 4 | -2.96 | 0.43 | 0.02 |
| 19 | 6 | -2.39 | 0.32 | 0.03 |
| 19 | 7 | -2.85 | 0.37 | 0.02 |
| 19 | 8 | -2.84 | 0.27 | 0.02 |
| 19 | 10 | -2.50 | 0.40 | 0.02 |
| 19 | 11 | -2.94 | 0.43 | 0.02 |
| 19 | 12 | -1.95 | 0.16 | 0.04 |
| 19 | 13 | -2.75 | 0.43 | 0.02 |
| 19 | 15 | -2.07 | 0.32 | 0.03 |
| 18 | 19 | -2.88 | 0.43 | 0.02 |
| 18 | 1 | -2.70 | 0.41 | 0.02 |
| 18 | 2 | -2.05 | 0.21 | 0.03 |
| 18 | 3 | -2.83 | 0.32 | 0.02 |
| 18 | 4 | -2.89 | 0.43 | 0.02 |
| 18 | 5 | -2.44 | 0.30 | 0.03 |
| 18 | 6 | -2.58 | 0.22 | 0.02 |
| 18 | 7 | -2.35 | 0.35 | 0.03 |
| 18 | 9 | -2.19 | 0.25 | 0.03 |
| 18 | 10 | -2.32 | 0.27 | 0.03 |
| 18 | 11 | -2.74 | 0.40 | 0.02 |
| 18 | 15 | -2.62 | 0.35 | 0.02 |
| 18 | 16 | -2.75 | 0.37 | 0.02 |
| 18 | 17 | -2.01 | 0.21 | 0.03 |
| 16 | 2 | -1.97 | 0.25 | 0.04 |
| 16 | 3 | -2.52 | 0.35 | 0.03 |
| 16 | 4 | -2.94 | 0.43 | 0.02 |
| 16 | 5 | -2.27 | 0.22 | 0.03 |
| 16 | 6 | -2.87 | 0.33 | 0.02 |
| 16 | 7 | -2.71 | 0.33 | 0.02 |
| 16 | 8 | -2.01 | 0.19 | 0.03 |
| 16 | 10 | -2.02 | 0.21 | 0.03 |
| 16 | 11 | -2.84 | 0.43 | 0.02 |
| 16 | 13 | -2.39 | 0.32 | 0.03 |
| 11 | 17 | -1.86 | 0.17 | 0.03 |
| 11 | 13 | -1.81 | 0.24 | 0.04 |
| 11 | 1 | -2.69 | 0.38 | 0.02 |
| 11 | 2 | -2.32 | 0.27 | 0.03 |
| 11 | 5 | -1.84 | 0.24 | 0.04 |
| 11 | 10 | -2.31 | 0.32 | 0.02 |
| 15 | 4 | -2.17 | 0.27 | 0.03 |
| 15 | 6 | -2.17 | 0.21 | 0.03 |
| 1 | 13 | -2.43 | 0.29 | 0.03 |
| 13 | 9 | -1.96 | 0.17 | 0.03 |
| 9 | 3 | -2.01 | 0.16 | 0.03 |
| 9 | 4 | -2.17 | 0.19 | 0.03 |
| 9 | 6 | -1.61 | 0.14 | 0.04 |
| 8 | 1 | -2.60 | 0.25 | 0.02 |
| 8 | 5 | -1.89 | 0.16 | 0.03 |
| 1 | 7 | -2.53 | 0.32 | 0.02 |
| 1 | 6 | -2.63 | 0.29 | 0.02 |
| 1 | 4 | -2.83 | 0.43 | 0.02 |
| 4 | 2 | -2.23 | 0.19 | 0.03 |
| 1 | 3 | -2.72 | 0.37 | 0.02 |
Se muestran los estadísticos T, A y la probabilidad p.
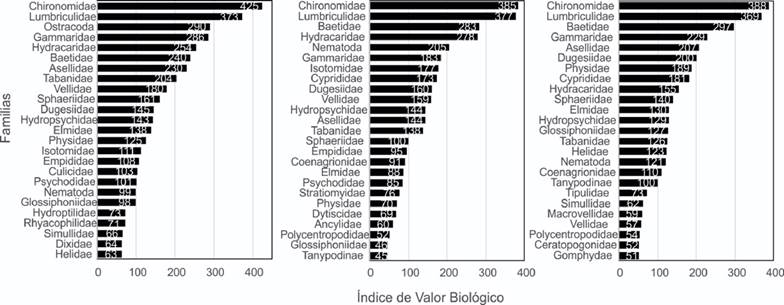
Figura 4 Índice biológico de Sanders (BVSI) para cada familia de macroinvertebrados según los diferentes eventos de muestreo. De izquierda a derecha: mayo, septiembre y enero.
Relación de variables fisicoquímicas y macroinvertebrados bentónicos. En la Figura 5a para el mes de mayo se muestra la relación entre las variables fisicoquímicas y la presencia de los macroinvertebrados (varianza acumulada de 33.37%). El primer eje se diferencia en la izquierda por la concentración de oxígeno disuelto, temperatura del agua y pH, encontrándose familias sensibles (indicadoras de buena calidad) como Polycentropodidae, Hydropsychidae, Libellulidae, Heptageniidae y Gomphidae. Por su parte, hacia la derecha, en donde se encuentran los compuestos nitrogenados, cloruros, fosfatos, BOD5 y COD, coliformes totales y fecales se encontraron familias tolerantes a resistentes (indicadoras de calidad mediana a mala) como Chironomidae, Lumbriculidae, Culicidae y Gammaridae debido a que se relacionan con la presencia de materia orgánica.
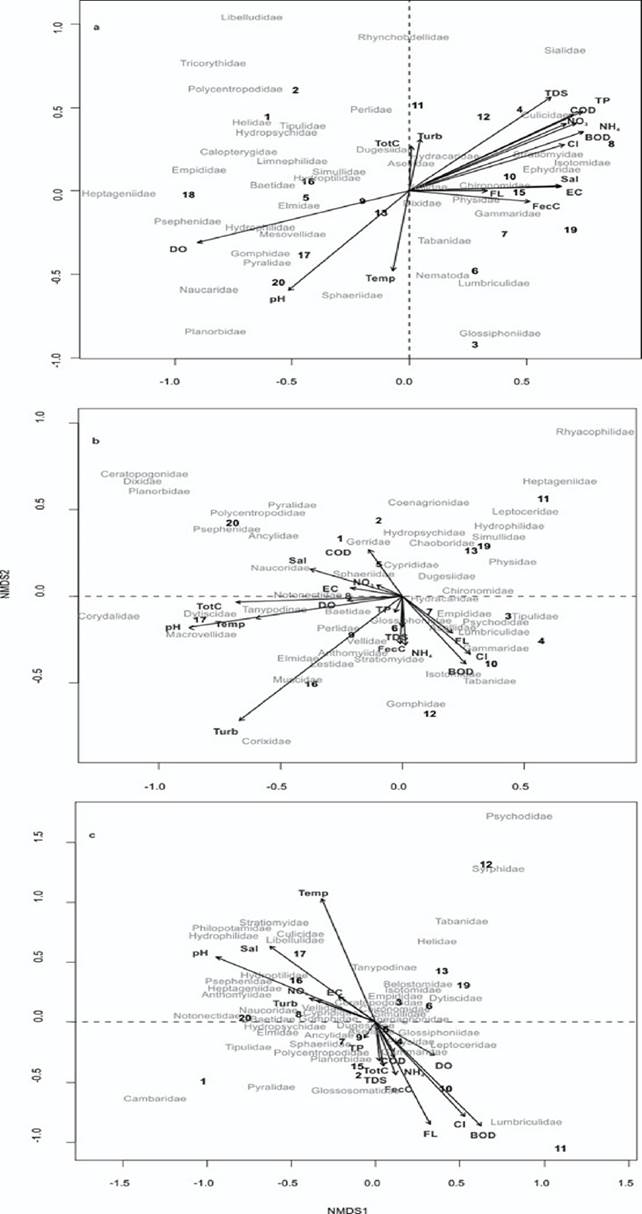
Figura 5 Análisis NMDS para los diferentes sitios y variables ambientales en las distintas estaciones (a = mayo, b = septiembre, c = enero) en el río Cupatitzio. BOD5 = Demanda bioquímica de oxígeno, COD = Demanda química de oxígeno, DO = Oxígeno disuelto, EC = Conductividad eléctrica, FecC = Coliformes fecales, FL = Flujo de agua, Cl = Cloruros, NH4 = Amonio, NO3 = Nitratos, pH, Sal = Salinidad, TDS = Sólidos disueltos totales, Temp = Temperatura del agua, TotC = Coliformes totales, TP = Fósforo total, y Turb = Turbiedad.
En el mes de septiembre, no existe una tendencia clara de relación entre variables fisicoquímicas y macroinvertebrados de acuerdo con su sensibilidad, tolerancia o resistencia (Fig. 5b, varianza acumulada de 29.98%). Mientras que algunos ejemplos de familias se distribuyen entre sensibles (cuadrante superior) y más tolerantes (cuadrante inferior) en el eje dos. Por su parte, la diferencia entre variables ambientales sigue más el eje uno con diferentes calidades ambientales como en el caso del mes de mayo. Esto se puede atribuir al efecto de dilución por el temporal de lluvias, lo que ocasiona un aumento del volumen y la velocidad del agua. Sin embargo, con la escorrentía se espera un aumento de la turbiedad, sólidos totales disueltos y compuestos nitrogenados. Algunas familias se relacionan con la presencia de materia orgánica como Gammaridae, Lumbriculidae, Tipulidae, Psychodidae y Glossiphoniidae, además de los que se encuentran en condiciones más lénticas y turbias como Corixidae.
En el mes de enero no se tiene una separación clara de los sitios con respecto a las variables ambientales y a las familias. Sin embargo, en el eje dos y hacia el cuadrante superior se tiene a la temperatura y el pH, como fue el caso del muestreo de mayo y hacia el cuadrante inferior diferentes variables relacionadas con mala calidad del agua. Además, se tiene una gran congregación de las familias en la parte central del gráfico y las que se encuentran más separadas, presentan sensibilidades diferentes. Por ejemplo, Psychodidae se relaciona con buena calidad mientras que Syrphidae es tolerante, aspecto que no la limita a presentarse en diferentes sitios (Fig. 5c, varianza acumulada de 38.40%).
La correlación entre el índice de calidad del agua (NSF-WQI) y los índices biológicos Shannon, Simpson y Peolou es una relación débil con valores menores del 35% (Tabla 6) e incluso resultados negativos lo que nos indica que no tienen relación alguna y esto se debe a que los índices son calculados con variables de diferentes valores y dimensiones (la correlación puede ser directa si los valores muestran un 95% de correlación).
DISCUSIÓN
Análisis fisicoquímico. La calidad del agua depende de los impactos directos e indirectos que se presentan en torno al ecosistema acuático y se relacionan al nivel de desarrollo y dinámica de los asentamientos humanos (Fang & Jawitz, 2019). A diferencia de otros estudios donde la presencia de zonas urbanas se relaciona con contaminación (e.g., Tu, 2013) en el río Cupatitzio, en los sitios 1 y 2, se tiene un comportamiento inverso. Esto se debe a que, si bien el nacimiento del río se encuentra dentro de la ciudad de Uruapan, está inmerso y protegido en un parque nacional (Parque Nacional Barranca del Cupatitzio). Sin embargo, en otros sitios (9, 11 y 12) donde se tiene la combinación de zonas urbanas, actividades ganaderas y sitios agrícolas, resultaron de los más contaminados con valores de demanda bioquímica de oxígeno de hasta dos órdenes de magnitud (NFS-WQI categoría mala). Con esto se establece una importante contaminación orgánica del río que está correlacionada con contaminación microbiológica y la reducción en la disponibilidad de oxígeno (Vigiak et al., 2019). Esta contaminación implica una amenaza importante en países en desarrollo, debido al incremento en las descargas sin tratamiento y la reducción en la capacidad de dilución de los ríos por la extracción y uso excesivo del agua y el cambio climático (Wen et al., 2017). Los nutrientes nitrogenados también presentaron valores muy elevados en los sitios más contaminados (9, 11, 12), llegando a obtener para los nitratos concentraciones siete veces arriba de la máxima permitida (>45 mg/L). El problema es que su impacto no solo afecta al cuerpo de agua través de la eutrofización, sino que afecta a la salud pública (Zhang et al., 2019).
Los índices de calidad del agua son herramientas útiles, porque incorporan una cantidad importante de información (diferentes variables fisicoquímicas) en un solo valor, que expresa de manera simplificada el impacto que se tiene en los ecosistemas acuáticos (Tyagi et al., 2013). A lo largo del río se mantiene principalmente una calidad regular del agua y solo en pocos sitios o es buena (1 al 3 y 13) o mala (9, 11 y 12). Esto se refleja con altas concentraciones de oxígeno disuelto y bajos registros de temperaturas o con altos valores de BOD5 y bacterias coliformes por las descargas de aguas sin tratamiento, respectivamente (Ruiz-Picos et al., 2016; Ruiz-Picos et al., 2017). Temporalmente, sucede que en época de lluvias no siempre disminuye la cantidad de contaminantes que se vierten en el río, pero tiende a aumentar los valores del NSF-WQI por la dilución al llevar más agua el cauce (Saraswati et al., 2019). Sin embargo, puede haber un aumento de sólidos suspendidos y la turbiedad, aspecto relacionado al cambio de uso del suelo (Mosley, 2015).
Macroinvertebrados acuáticos. La manera como se distribuyen los macroinvertebrados acuáticos en el espacio y tiempo depende de la calidad del agua, la estacionalidad y las características del hábitat, de ahí su importancia como bioindicadores (Fierro et al., 2017). En términos generales se espera una relación entre la calidad del agua, siendo en este caso reflejada por el NSF-WQI y algunos rasgos ecológicos de los organismos (Singh & Saxena, 2018). En las comunidades de macroinvertebrados del río Cupatitzio se tuvo la dominancia (BVSI) de familias tolerantes y/o detritívoras (Fig. 4). Destacaron las familias Chironomidae, Lumbriculidae y Asellidae, las cuales se encuentran entre los valores más bajos asignados por algunos índices biológicos (p.ej., BMWP; Hawkes, 1998). Estas se presentan en ríos con alto impacto a partir de efluentes mixtos (urbanos e industriales) que depositan grandes cantidades de materia orgánica (Roldán-Pérez, 2016; Ruiz-Picos et al., 2016). Se ha demostrado que diferentes especies de las familias Asellidae y Chironomidae presentan un incremento hasta de tipo exponencial conforme aumenta la concentración de BOD5 (Friberg et al., 2010).
Entre las otras familias que se presentaron en los primeros lugares de dominancia para los diferentes eventos de muestreo fueron Baetidae y Gammaridae. Baetidae, también es tolerante y característica de aguas más lénticas relacionadas a algunos sustratos como piedras y desechos como basura (Forsin & Falcao, 2007; Ruiz-Picos et al., 2016). La familia Gammaridae se presenta abundantemente en diferentes tipos de sustratos (rocas, piedras, vegetación) de ahí que sean dominantes (Kunz et al., 2010), y también está relacionada a actividades agrícolas aledañas a los ríos. Ambas tienen un amplio espectro trófico como herbívoros, detritívoros y depredadores y son funcionalmente importantes por su sensibilidad a estresores químicos (Chaumot et al., 2015).
El intervalo de los valores del índice de diversidad es similar a los de otros estudios con macroinvertebrados que se hicieron tanto en el Cupatitzio en los sitios pertenecientes a la cabecera del río (2.7- 3.4, Pérez et al., 2006) como en otros ríos considerando todo el cauce (0.38-3.48, Barton & Metcalfe-Smith, 1992; Ginebreda et al., 2010). Algunos estudios han encontrado que, debido a los procesos de contaminación de la calidad del agua (descargas de aguas negras y fuentes difusas) y la degradación del hábitat (reducción del tamaño de substrato), la riqueza y diversidad disminuyen a manera de gradiente de donde inicia el río hacia su desembocadura y que organismos oportunistas aumentan su población (Ruaro et al., 2016; Nautiyal et al., 2017). Al analizar los resultados del presente estudio, la diversidad solo es mayor en tiempo de lluvias en los primeros sitios comparado con el resto. Dos razones pueden explicar esta diferencia: (1) la modificación del hábitat, dado que la calidad del agua llega a ser hasta excelente de acuerdo con el NSF-WQI y (2) la presencia de otras zonas poco alteradas a lo largo del río. Labajo-Villantes & Nuñeza (2015) describen que en las aguas limpias se espera encontrar la relación de familias que indican buena calidad como Polycentropodidae, Libellulidae, Gomphidae y Heptageniidae. Esta información coincide con los resultados del ISA y la ordenación donde se mencionan a las familias Polycentropodidae y Gomphidae como indicadoras, y en época de secas se presentan dichas familias en mayores concentraciones (Fig. 5) de oxígeno disuelto y menores valores de nutrientes como fosfatos y compuestos nitrogenados (Lynch et al., 2018).
Otros aspectos que también se deben tomar en cuenta en el estudio de la variación espaciotemporal de los macroinvertebrados en los ríos es el ciclo de vida de los organismos bentónicos, las alteraciones hidromorfológicas y el aumento del flujo de agua (Pond et al., 2016; Lynch et al., 2018). Esto, lo menciona Feld (2014) como un desequilibrio en el proceso de Continuum en los ríos, afectando desde el primer nivel de la red trófica (Massicotte, 2017). La agricultura afecta la cantidad y calidad del agua tanto por el uso directo del recurso y los agroquímicos, así como por promover la modificación, erosión y sedimentación, modificando el Continuum del ecosistema acuático. Algunos sitios que presentaron calidad media del recurso y macroinvertebrados detritívoros y resistentes, estuvieron asociados a zonas con presencia de cultivos de aguacate (sitio 15) o bien con zonas de agricultura de riego (17 al 20), donde se tiene además modificación del cauce del río. Esto es importante porque en estudios de cambio de uso del suelo en la cuenca se ha identificado una reducción de los bosques templados de coníferas y los bosques tropicales de hoja caducifolia de 1,001 ha/año y una expansión de la superficie de tierras de cultivo de 553 ha/año en tres décadas (Bravo-Espinosa et al., 2014).
El monitoreo con variables ambientales traducidas en índices de calidad del agua y los macroinvertebrados bentónicos nos proporciona una información más precisa y es una herramienta integrativa que puede ser implementada antes de realizar otros estudios o análisis más complejos sobre el estado de salud o nivel de deterioro de ríos y tributarios. Un siguiente paso importante es la estructuración de índices bióticos (e.g., BMWP), ya que muestran otra aproximación en comparación con las métricas basadas en las variables fisicoquímicas y los índices ecológicos clásicos. Además, que permiten monitorear continuamente, si se cuenta con la participación ciudadana. Sin embargo, para implementar mejor el uso de los índices bióticos es necesario adaptarlos a la región de estudio por medio de su calibración y validación (Ruiz-Picos et al., 2017). Los cambios de uso de suelo modifican la estructura de las comunidades acuáticas y es importante destacar que, en este estudio, a pesar de ser zonas con nulas descargas al inicio del río, se presentan impactos porque se modifica la hidrología del cauce y el hábitat.
CONCLUSIONES
Los resultados mostraron como algunas características del uso de suelo a lo largo del curso del río afectan de manera importante las características tanto de la calidad del agua, así como a la composición de los macroinvertebrados. El río presentó un gradiente de buena a mala calidad del agua desde al origen hacia la desembocadura. La principal fuente de contaminación es de tipo orgánica. Las familias relacionadas a sitios sanos, como fue el Parque Nacional Río Cupatitzio (Coenagrionidae, Aphelocheiridae e Hydropsychidae), se consideran sensibles. En contraste, otras familias consideradas tolerantes y detritívoras (Chironomidae, Baetidae y Gammaridae) se presentaron en ambientes degradados por aguas residuales o adyacentes a zonas agrícolas. Algunos de los tributarios que ayudaron a la recuperación de la calidad del agua en el río, son el arroyo Tarecho y El Platanillo, ambos con calidad regular, río Infiernillo calidad buena y el manantial y río Los Conejos calidad buena. En contraste, otros tributarios afectaron la calidad fisicoquímica e hidromorfológica, como los canales CFE Zumpimito (que recibe el canal de lixiviados del relleno sanitario de calidad mala) y CFE Cupatitzio con calidad regular. Cabe señalar que en todo el recorrido del río se presentan modificaciones físicas principalmente por las plantas hidroeléctricas, canales para riego para el cultivo de aguacate, las zonas urbanas y rurales.











 nova página do texto(beta)
nova página do texto(beta)




