INTRODUCCIÓN
Entre los parásitos más importantes que se han reportado en moluscos bivalvos del Golfo de California destacan el virus OsHV-1 y los protozoarios Marteilia refringens (Grizel, Comps, Bonami, Cousserans, Duthoit & Le Pennec, 1974) y Perkinsus marinus [(Mackin, Owen & Collier) Levine, 1978], los cuales, han sido encontrados en las almejas Ruditapes philippinarum (Adams & Reeve, 1850) (Renault et al., 2001) y Scapharca broughtonii (Adams & Reeve, 1850) (Xin et al., 2018), y en los ostiones Magallana (≈Crassostrea) gigas (Thunberg, 1973) y Crassostrea corteziensis (Hertlein, 1951) (Cáceres-Martínez et al., 2008; Grijalva-Chon et al., 2013, 2015; Enríquez-Espinoza et al., 2015). Específicamente para P. marinus, desde que se comprobó su transfaunación de las costas del Océano Atlántico (Bushek & Allen, 1996; Reece et al., 2008; Cáceres-Martínez et al., 2016) y, posteriormente, se confirmó su presencia en las costas del Pacífico Mexicano (Cáceres-Martínez et al., 2008; Ek-Huchim et al., 2017), este protozoario ha sido detectado en ostiones cultivados, fuera (Cáceres-Martínez et al., 2008) y dentro (Cáceres-Martínez et al., 2018) del Golfo de California, sin afectar su producción (Villanueva-Fonseca & Escobedo-Bonilla, 2013; Martínez-García et al., 2017; Villanueva-Fonseca et al., 2020); aunque también, se ha reportado asociado a mortalidades de ostreidos (Enríquez-Espinoza et al., 2010). Debido a la fácil dispersión de este parásito y el riesgo que implica su potencial de infección en otras especies de moluscos (Villalba et al., 2004), el Laboratorio de Malacología del Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional (CIIDIR-Unidad Sinaloa) del Instituto Politécnico Nacional (IPN), desde hace una década, realiza un registro de la ocurrencia de P. marinus y organismos parecidos a Perkinsus spp., en diferentes especies de bivalvos de poblaciones silvestres y cultivadas que habitan en algunas lagunas de la costa sureste del Golfo de California.
Mediante la tinción con tioglicolato, se han detectado presuntas hipnosporas de Perkinsus sp. en un banco natural del callo de hacha Atrina maura (Sowerby, 1835) (Góngora-Gómez et al., 2016) y en dos poblaciones de la almeja chocolata Megapitaria squalida (Sowerby, 1835) siendo una silvestre (Góngora-Gómez et al., 2020) y otra protegida dentro de un refugio pesquero (Góngora-Gómez et al., 2019a), ambos bivalvos habitando en la misma laguna. En otro complejo lagunar costero, a 250 km al norte de los reportes anteriormente mencionados, Góngora-Gómez et al. (2019b) confirmaron la presencia de hipnosporas de Perkinsus sp. en especímenes silvestres de M. squalida, mientras que Navarro-Chávez (2021) detectó tales corpúsculos oscuros y esféricos característicos para las hipnosporas de Perkinsus sp. (OIE, 2019) en la almeja arenera Chionista fluctifraga (Sowerby, 1853) cultivada en una zona intermareal. En algunas granjas del ostión C. gigas de la zona del sureste del Golfo de California, Góngora-Gómez et al. (2019c) evidenciaron hipnosporas de este protozoario sin poner en riesgo la salud de los organismos, coincidiendo con las observaciones de Villanueva-Fonseca & Escobedo-Bonilla (2013) para la misma especie. Solo Villanueva-Fonseca et al. (2020) confirmaron el registro de P. marinus mediante análisis molecular (PCR), en el ostión de placer C. corteziensis de granjas experimentales. Todos los estudios anteriores han sido reportados en poblaciones silvestres o de cultivo de la costa noreste del Golfo de California. La detección de Perkinsus spp. en moluscos bivalvos del sureste de la península de California es escasa. Cáceres-Martínez et al. (2018) documentaron el posible efecto de P. marinus en la mortalidad de C. gigas cultivado en Bahía de La Paz, Baja California Sur, sin obtener evidencias de que este protozoario fuera el causante de dicho evento.
El mejillón “choro”, Modiolus capax (Conrad, 1837) es un bivalvo que habita en el Océano Pacífico, desde la costa de California, EU, hasta Perú e Islas Galápagos (Coan & Valentich-Scott, 2012). En México, existen bancos importantes de este mejillón a lo largo de la costa suroccidental de la península de California (Olguín-Quiñones, 1976; Muñoz-Barbosa & Huerta-Díaz, 2013; García-Corona et al., 2018), sin embargo, no es explotado comercialmente y su consumo es limitado (García-Corona et al., 2018). Son pocos los estudios disponibles de M. capax en la región. Por ejemplo, Garza-Aguirre & Bückle-Ramírez (1989) y García-Corona et al. (2018) analizaron su biología reproductiva, mientras que García-Domínguez et al. (2018) describieron su ciclo reproductivo. Con relación a su uso como bioindicador, Muñoz-Barbosa & Huerta-Díaz (2013) reportaron el estado ambiental de la costa este del Golfo de California en función de metales pesados derivados de la minería, depositados en sedimentos y acumulados en M. capax.
Los estudios acerca de la presencia de Perkinsus spp. en especies de mejillón son limitados. Por ejemplo, Itoh et al. (2019) por primera vez, detectaron a Perkinsus beihaiensis (Moss, Xiao, Dungan & Reece, 2008) en el mejillón Mytilus galloprovincialis Lamarck, 1819, en Bahía Tokio, Japón, usando la técnica histológica, observando hipnosporas mediante la tinción de tioglicolato y confirmando la presencia de la especie con análisis de PCR. Con el mismo procedimiento, además de la secuenciación genética, Dantas-Neto et al. (2020) detectaron a P. beihaiensis en tres moluscos de importancia comercial en el estero Jaguaribe, Brasil, incluyendo al mejillón Mytella falcata (d’Orbigny, 1846). Hasta ahora, no existen investigaciones del protozoario en el mejillón M. capax. El objetivo de este estudio es reportar por primera vez, la presencia de P. marinus en una población de M. capax de la costa suroeste del Golfo de California, en un periodo anual.
MATERIALES Y MÉTODOS
El sitio de muestreo (El puerto minero de Santa Rosalía, SR, 27°20’20” N; 112°16’01” W) se localiza en la línea costera de Baja California Sur, dentro del Golfo de California (Fig. 1).
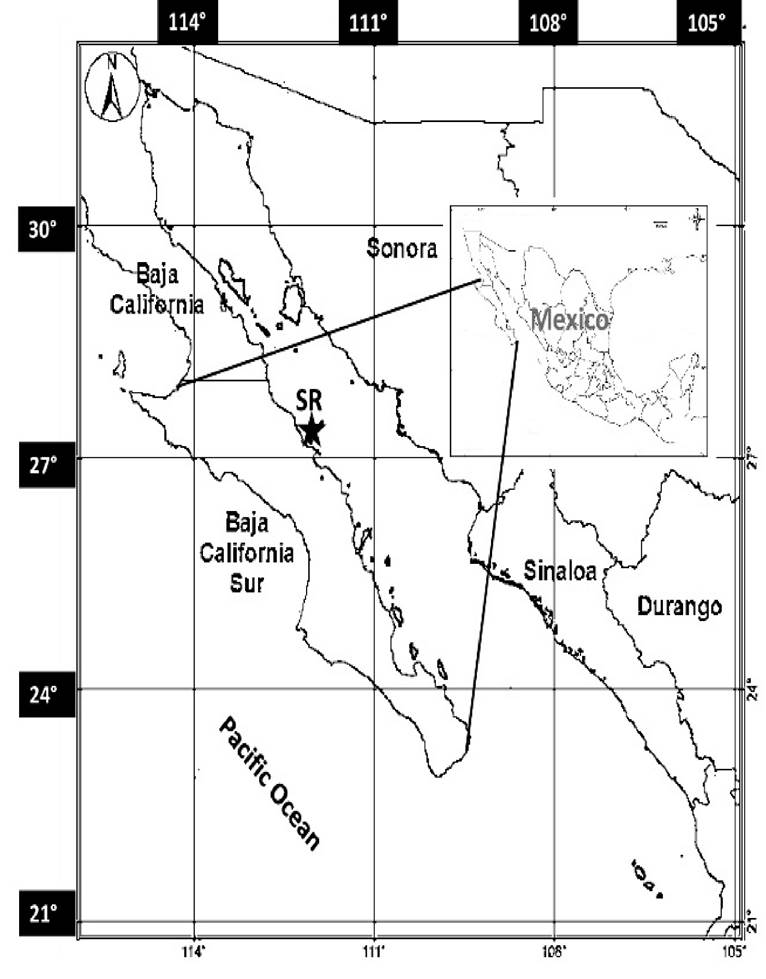
Figura 1 Localización geográfica del sitio de muestreo (SR ), Santa Rosalía, Baja California Sur, México.
El primer mes de cada estación del año (verano, otoño e invierno 2019-primavera 2020), se colectaron 60 mejillones (n = 240) mediante buceo asistido y/o buceo autónomo. Los mejillones fueron colectados y transportados al laboratorio en una hielera con agua de mar para ser separados individualmente y eliminar los organismos epibiontes de sus conchas (NOM, 1993). Se obtuvieron la altura de la concha (96.76 ± 24.90 mm) y el peso corporal (92.66 ± 35.37 g) de cada espécimen. En cada muestreo se registraron los siguientes parámetros ambientales del agua: temperatura y oxígeno disuelto (YSY 55/12FT Oxímetro, Ohio, USA), salinidad (ATAGO, S/Mill refractómetro), pH (Hanna, HI 8314 pHmetro, USA), profundidad y transparencia (disco Secchi).
En el laboratorio, los mejillones fueron sacrificados en hielo, abiertos y despegados de las conchas de acuerdo al Manual de buenas prácticas de manejo para el cultivo de moluscos bivalvos propuesto por Cáceres-Martínez & Vázquez-Yeomans (2014). De cada espécimen, se separaron los tejidos y se formaron dos grupos conteniendo cada uno: glándula digestiva, branquias, músculo aductor, gónada y manto. Para la detección de presuntas hipnosporas de P. marinus, un conjunto de tejidos (A) de cada mejillón fue incubado en el medio fluido de tioglicolato de Ray (RFTM, Ray, 1966), de acuerdo con los estándares de la OIE (2019); el otro grupo de tejidos (B) se almacenó a -70 °C para el análisis confirmatorio con PCR.
Se añadieron 25 mL de RFTM en tubos de 50 mL estériles junto con las muestras de tejido (A) de cada mejillón para ser incubados en oscuridad a 22-24 °C durante 4-7 días. Después, los tubos fueron centrifugados a 2000 g por 10 min y el precipitado se digirió (60 °C durante 2-6 h) con 20 ml de NaOH 2M por g de tejido. Posteriormente, las muestras se lavaron con agua desionizada. Para observar y contar las presuntas hipnosporas de P. marinus, se agregó 1 ml de lugol en cada tubo. Las hipnosporas se observaron al microscopio (10X y 40X) como células esféricas de color oscuro o negro azulado (20-70 µm de diámetro) (Bushek et al., 1994; OIE, 2019). La prevalencia [(número de organismos con evidencia de hipnosporas/total de organismos)X100, Thrusfield, 1995)], carga parasitaria (hipnosporas/g de tejido) e intensidad de infección (negativa = sin hipnosporas, ligera = <1X104 hipnosporas/g, moderada = 1X104-5X105 hipnosporas/g, intensa = >5X105 hipnosporas/g, de acuerdo con Bushek et al., 1994) de P. marinus, se obtuvieron en cada muestreo.
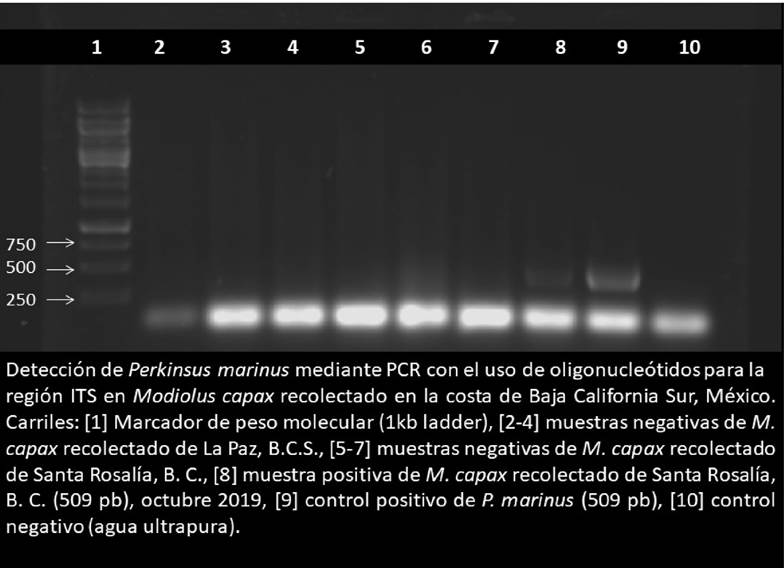
Los mejillones que fueron positivos a la presencia de presuntas hipnosporas con RFTM fueron analizadas con la prueba PCR. La extracción de DNA se realizó de las muestras de tejidos almacenadas (B) con reporte de presuntas hipnosporas del conjunto de tejidos (A). Este procedimiento se realizó con DNAzol® y proteinasa K, a 0.1 g de tejido de branquia, incubándolas a 55 °C durante 24 horas (Pinho-Ferreira et al., 2015; Escobedo-Fregoso et al., 2017); la extracción de DNA se resuspendió con 50 µL de agua ultrapura y se almacenaron a -20 °C hasta su uso. La amplificación de DNA se realizó usando la reacción en cadena de polimerasa (PCR) (OIE, 2019) con los primers PmarITS-70F (5´-CTT-TTG-YTW-GAG-WGT-TGC-GAG-ATG -3´ ) y primer inverso PmarITS600R (5’-CGA-GTT-TGC-GAG-TAC-CTC-KAG-AG-3´) para P. marinus (Auderman et al., 2004) con un volumen de reacción de 20 µL con 1 µL de DNA: Buffer 10X, MgCl2 (50Mm), 1 U Taq DNApolimerasa (Invitrogen®); dDNT´s (10mM), 1 µL de cada primers y H2O ultrapura. Las condiciones de amplificación fueron: desnaturalización inicial (95 °C por 3 min), 35 ciclos de amplificación (95 °C por 1 min, 60 °C por 1 min y 72 °C por 1 min) y extensión final a 72 ºC por 5 min. En todas las reacciones se incluyó un control positivo de ADN genómico de C. corteziensis infectado por P. marinus y un control negativo, consistente en la mezcla de reacción de la PCR sustituyendo el ADN por agua ultrapura estéril. Los productos de PCR fueron analizados por electroforesis en un gel de agarosa al 1% con bromuro de etidio; como referencia, se utilizó un marcador de peso molecular de 0.1 a 1 Kb. Se aplicó una carga de 80 volts por 45 min y se visualizó en el equipo BIO-Rad-Chemidoc-XRS con luz UV.
Se realizó una prueba de normalidad (Kolmogorov-Smirnov) a todos los datos obtenidos. Los datos que no mostraron una distribución normal fueron transformados (raíz cuadrada) antes de analizarlos estadísticamente. Se obtuvo el coeficiente de correlación (r) entre la prevalencia y carga parasitaria con los parámetros del sitio de muestreo usando el programa Statgraphics, con un nivel de confianza de 95% (p ≤ 0.05).
RESULTADOS
Los intervalos de la temperatura, salinidad, pH y oxígeno disuelto de las cuatro estaciones del año, fueron 16-27 °C, 35-36 ups, 7.85-8.21, 5.75-8.75 mg L-1, respectivamente. La transparencia y profundidad fluctuaron desde 1.5 a 4 m. Del total de mejillones analizados con RFTM (N = 120), 23 (19.16%) resultaron positivos para presuntas hipnosporas, detectándose como esferas oscuras de 5-70 µm de diámetro (Fig. 2).
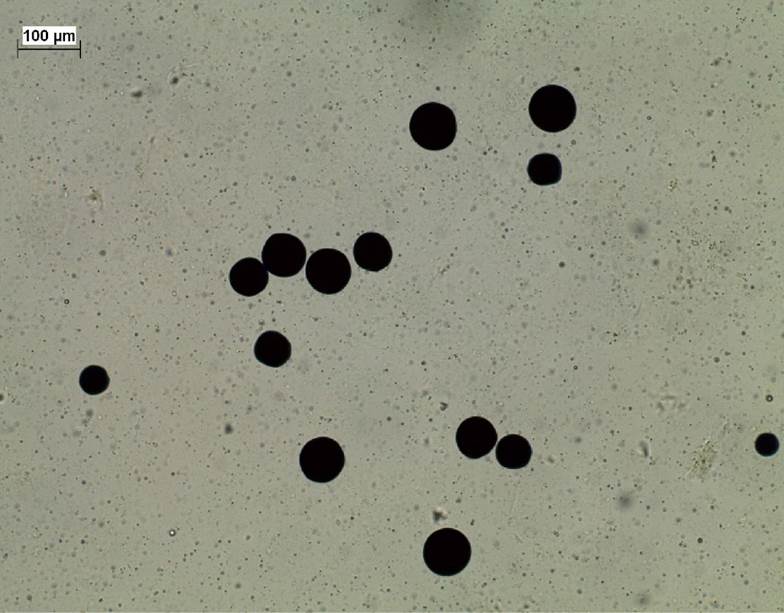
Figura 2 Presuntas hipnosporas de Perkinsus marinus en tejido de Modiolus capax (tinción de tioglicolato, 40X). Intensidad de infección nivel negativa a ligera (˂104 hipnosporas/g, Bushek et al., 1994). Escala de la barra = 100 µm.
Los promedios estacionales de prevalencia y carga parasitaria obtenidos mediante la detección de presuntas hipnosporas de P. marinus con MFTR en tejidos de M. capax, no mostraron una tendencia a aumentar con el tiempo. La prevalencia presentó un intervalo de 6.66% en otoño 2019 a 33.33% en invierno 2019. La carga parasitaria no sobrepasó 2.75 hipnosporas/g de tejido; la intensidad de infección estacional fue de negativa a ligera. Con excepción de la salinidad que mostró correlación con la carga parasitaria (r = 0.99, p = 0.002), el resto de los parámetros físicos y químicos del agua no ejercieron influencia en los indicadores infecciosos (Fig. 3).
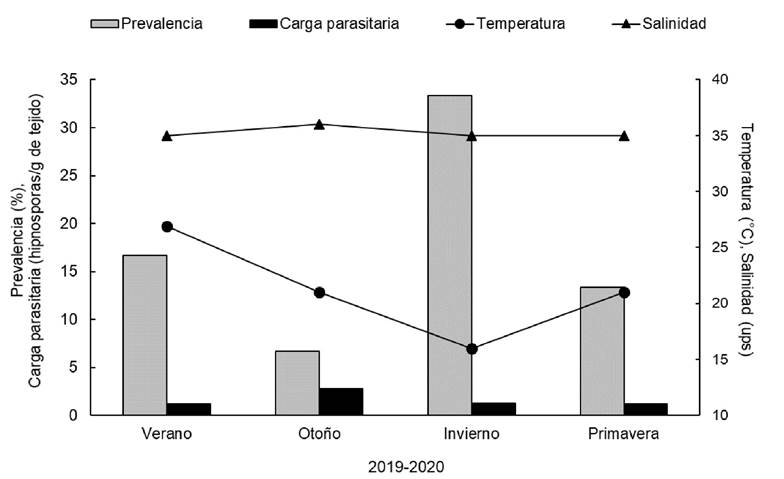
Figura 3 Variación estacional de la prevalencia (%) y carga parasitaria (hipnosporas/g de tejido) obtenidos mediante la detección de presuntas hipnosporas (MFTR) de P. marinus en tejidos de M. capax, y temperatura (°C) y salinidad (ups) en Santa Rosalía (SR), Baja California Sur, México.
La confirmación de P. marinus por medio de la técnica de PCR (Fig. 4), se realizó con el porcentaje de mejillones que dieron positivo al MFTR (5%).
DISCUSIÓN
Por los diversos reportes que previamente han documentado la presencia de Perkinsus marinus en el Golfo de California (GC), es posible afirmar que este protozoario se ha distribuido y adaptado a las condiciones de la zona habitando en diferentes especies de moluscos bivalvos (Góngora-Gómez et al., 2016, 2020), principalmente de importancia comercial (Enríquez-Espinoza et al., 2010, 2015; Cáceres-Martínez et al., 2012), ubicados en la costa este del GC. En este trabajo, se detectaron corpúsculos esféricos oscuros, característicos con la descripción de las hipnosporas de este parásito (OIE, 2019), en casi el 20% del total de mejillones recolectados en un año, los cuales, presentaron una prevalencia y carga parasitaria por debajo de 35% y 3 hipnosporas/g, respectivamente. Esta baja prevalencia es similar a las documentadas por Cáceres-Martínez et al. (2012) para una población silvestre del “ostión perro”, Saccostrea palmula (Carpenter, 1857) y por Navarro-Chávez (2021), quien trabajó con la almeja arenera, Chionista fluctifraga, cultivada en una zona intermareal. Sin embargo, es menor a la reportada en varios estudios realizados con diversas especies de bivalvos en la costa este del Golfo de California (Tabla 1), independientemente de haberse tratado de poblaciones naturales (Góngora-Gómez et al., 2019b, 2020) o de producción controlada (Enríquez-Espinoza et al., 2010, 2015; Villanueva-Fonseca & Escobedo-Bonilla, 2013; Villanueva-Fonseca et al., 2020). Por otro lado, la carga parasitaria promedio del mejillón, Modiolus capax, en Santa Rosalía, B. C. S., fue tan baja como la encontrada en una población silvestre de Atrina maura (Góngora-Gómez et al., 2016) y para la almeja chocolata, Megapitaria squalida, y el ostión japonés, Magallana (≈Crassostrea) gigas, bajo condiciones de cultivo (Góngora-Gómez et al., 2019a, 2019c). Lo anterior sugiere que, por la baja prevalencia y carga parasitaria encontradas, no es posible determinar una tendencia específica con relación al origen de cada especie de bivalvo (silvestre o cultivo) estudiada en la costa este de Baja California, lo cual, estaría más bien sujeto a la susceptibilidad de cada una de ellas hacia la presencia del patógeno en sus tejidos (Villalba et al., 2004). Además, el intervalo de la intensidad de infección (negativa a moderada), indica que el estado de salud de las poblaciones silvestres o de cultivo reportadas (Tabla 1) no se encontraría amenazada por P. marinus. Lo mismo puede deducirse para la población de M. capax en Santa Rosalía, BCS, ya que la intensidad de infección fue de negativa a ligera en todo el año.
Tabla 1 Reportes de Perkinsus marinus y especies similares de Perkinsus spp. en diferentes especies de moluscos bivalvos en el Golfo de California.
| Parásito | Hospedero | Silvestre o cultivo (estado) | Prevalencia (%) | Intensidad de infección | Carga Parasitaria | T °C | Salinidad | PCR | Referencia |
| P. marinus | Crassostrea gigas | Cultivo (Sonora) | 100 | - | 3,558-165,112*** | - | - | Si | 1 |
| P. marinus | Saccostrea palmula | Silvestre (Sinaloa) | 6.7 - 20 | - | - | - | - | Si | 2 |
| Perkinsus sp. | Crassostrea gigas | Cultivo (Sinaloa) | 3.3 - 40 | 1-2* | - | 29-32 | - | Si | 3 |
| P. marinus | Crassostrea gigas | Cultivo (Sonora) | 3.3-60 | Ligera* | - | - | - | Si | 4 |
| Chionista fluctifraga | |||||||||
| Perkinsus sp. | Atrina maura | Silvestre (Sinaloa) | 40-90 | Negativa a moderada* | 1.9-2.3**** | - | - | Si | 5 |
| Perkinsus sp. | Megapitaria squalida | Cultivo (Sinaloa) | 0-43.33 | Leve* | 0-2.2**** | 20-32.5 | 29.8-35 | No | 6 |
| Perkinsus sp. | Megapitaria squalida | Silvestre (Sinaloa) | 0-70 | Negativa a ligera** | 2-2,150*** | 26.68±5.55 | 35.16±2.97 | No | 7 |
| Perkinsus sp. | Crassostrea gigas | Cultivo (Sinaloa) | 26.66-83.33 | Muy ligera a ligera* | 0.13-1.2*** | 19.7-30.8 | 30-38.6 | No | 8 |
| P. marinus | Crassostrea corteziensis | Cultivo (Sinaloa) | 0-100 | Ligera** | 3,226-9,242*** | 27.8±4.5 | 39.45 | Si | 9 |
| Perkinsus sp. | Megapitaria squalida | Silvestre (Sinaloa) | 0-43.33 | Negativa a moderada* | 0-34**** | 16.9-37 | 29-40 | No | 10 |
| Perkinsus sp. | Chionista fluctifraga | Cultivo (Sinaloa) | 3.3-13.3 | Negativa a ligera** | 2-1,286*** | 15.9-32.1 | 25-40 | No | 11 |
| P. marinus | Modiolus capax | Silvestre (BCS) | 0-33.33 | Ligera** | ˂3*** | 16-27 | 35-36 | Si | 12 |
*Mackin (1962); **Bushek et al. (1994); ***hipnosporas/g; ****hipnosporas/preparación. 1 = Enríquez-Espinoza et al., 2010; 2 = Cáceres-Martínez et al., 2012; 3 = Villanueva-Fonseca & Escobedo-Bonilla, 2013; 4 = Enríquez-Espinoza et al., 2015; 5 = Góngora-Gómez et al., 2016; 6 = Góngora-Gómez et al., 2019a; 7 = Góngora-Gómez et al., 2019b; 8 = Góngora-Gómez et al., 2019c; 9 = Villanueva-Fonseca et al., 2020; 10 = Góngora-Gómez et al., 2020; 11 = Navarro-Chávez, 2021; 12 = Este estudio.
La relación entre la expresión infecciosa de P. marinus y algunos parámetros está bien documentada. La temperatura y la salinidad son los dos factores más reconocidos por inducir la infección de P. marinus en bivalvos (Villalba et al., 2004; Cáceres-Martínez & Vázquez-Yeomans, 2013; Smits et al., 2020). El mayor nivel de infección -asociado también a mortalidades-, se relaciona con el final del verano, cuando la temperatura del agua se mantiene por encima de 25 °C; y/o al aumento en la concentración de la salinidad (>25 g L-1) (Ramos-Queiroga et al., 2016), sin embargo, ambos parámetros pueden actuar separadamente en el proceso infeccioso. Por ejemplo, Gignoux-Wolfsohn et al. (2020) observaron que la temperatura tuvo un fuerte e inmediato efecto en el número de células infecciosas de P. marinus liberadas a la columna de agua por ostiones infectados, mientras que la influencia de la salinidad en la intensidad de infección estuvo asociada a la exposición de los ostiones a altas concentraciones durante varios meses. En el presente estudio, solo la salinidad mostró correlación positiva con la cantidad de hipnosporas del patógeno detectadas por gramo de tejido analizado, lo cual, pudiera explicarse por el registro de altos valores para este parámetro en los cuatro muestreos, manteniéndose por encima de 35 g L-1 de salinidad. La Peyre et al. (2006) mencionan que altas concentraciones de salinidad en el agua promueven la proliferación de P. marinus en algunos ostiones. Lo anterior coincide con las observaciones de Marshall et al. (2021), quienes obtuvieron el mayor grado de infección en el ostión del Atlántico, Crassostrea virginica (Gmelin, 1791) para un sitio de cultivo que registró elevadas concentraciones de salinidad dentro del Golfo de México. Sin embargo, no existen reportes que describan el comportamiento infeccioso de este protozoario en el mejillón “choro” M. capax, por lo que no es posible establecer comparaciones específicas.
De manera general, cuando se obtienen bajos valores en la carga parasitaria, que indica una afectación ligera por parte del parásito, el diagnóstico de la enfermedad y la confirmación de la especie de Perkinsus sp. suele dificultarse, y el uso de la tinción con tioglicolato puede no arrojar evidencia patológica suficiente (Petty, 2010), por lo que deben aplicarse otras técnicas con alta sensibilidad y especificidad -moleculares y/o genéticas- como la reacción en cadena de la polimerasa (PCR). En este estudio, la mayor prevalencia del parásito por PCR fue de 5%, siendo menor al obtenido por MFTR; sin embargo, la cantidad de material de ácidos nucleicos fue suficiente para que P. marinus fuera detectado, coincidiendo con lo documentado por Villanueva-Fonseca & Escobedo-Bonilla (2013) para el ostión japonés en cultivo. Dungan & Reece (2020) y Vivanco et al. (2020) recomiendan recolectar especímenes moribundos en el entorno del sitio de muestreo para evaluar con mayor seguridad mediante estas dos técnicas, el daño infeccioso que pueda provocar este protozoario.
De particular interés, resulta la posible influencia que ejercería la actividad antropogénica en la interacción P. marinus/M. capax de la zona de muestreo. Específicamente, en la costa este de Baja California Sur, se desarrollan diversas actividades antropogénicas (urbanización, turismo, pesquería y minería, Romero-Gil, 1991) distintas a las que se realizan a lo largo de la costa este del Golfo de California, donde predomina la agricultura intensiva, acuacultura y manufactura, entre otras (Frías-Espericueta et al., 2011; Muñoz-Sevilla et al., 2017) y cuyos efectos en algunas especies de moluscos han sido reportados. Por ejemplo, Yee-Duarte et al. (2017, 2018, 2020) revelaron desórdenes fisiológicos reproductivos en la almeja chocolata M. squalida asociados a compuestos tóxicos en la zona de nuestro muestreo. Similares conclusiones fueron reportadas por Roldán-Wong et al. (2018), Cadena-Cárdenas et al. (2009) y Muñoz-Barbosa & Huerta-Díaz (2013) para el cefalópodo Octopus hubbsorum (Berry, 1953) y algunos mejillones como Mytillus edulis (Linnaeus, 1758) y M. capax en esta zona minera. De manera puntual, el puerto minero de Santa Rosalía es considerado un “hot spot” debido a los altos niveles de metales depositados en el sedimento costero (Shumilin et al., 2013). Lo anterior advierte de posibles efectos asociados entre la contaminación local con el grado de infección del protozoario en el mejillón, como lo sugiere Morley (2010) para otras especies de moluscos. Aunque este estudio no generó evidencia al respecto, es recomendable la realización de estudios patológicos futuros considerando ambos aspectos.
Se concluye que: 1) P. marinus es reportado por primera vez hospedado en M. capax, 2) el haber encontradoa este protozoario en una especie sin valor comercial en la costa oeste del GC, indica que P. marinus amplió su abanico de distribución, por lo que será necesario monitorear su presencia en aquellas especies de moluscos comercialmente importantes mediante la aplicación de programas sanitarios constantes, 3) la prevalencia, carga parasitaria e intensidad infecciosa del protozoario sugieren que M. capax presenta baja susceptibilidad a su infección, por lo que la salud del mejillón no se encuentra comprometida ante la presencia de P. marinus en sus tejidos.











 nueva página del texto (beta)
nueva página del texto (beta)