INTRODUCCIÓN
Los recursos pesqueros son vulnerables a la sobrexplotación, así como a la creciente contaminación y destrucción de sus hábitats (Allison et al., 2009; Barrientos et al., 2018; Sumaila et al., 2011). Es el caso de la pesca de pequeña escala, en especial aquellas realizadas en agua dulce, donde la sobrepesca y su efecto en la biodiversidad suelen pasar desapercibidos (Arlinghaus et al., 2002; Soria-Barreto et al., 2018). Esto sucede incluso a pesar de que la actividad pesquera en ambientes dulceacuícolas provee trabajo y alimento para el sustento de millares de asentamientos humanos que circundan estos cuerpos de agua (Mendoza-Carranza et al., 2018a; Soria-Barreto et al., 2018).
Las pesquerías en ambientes de agua dulce se caracterizan por factores socioeconómicos (e.g. múltiples comunidades involucradas, diferente aprovechamiento de recursos con relación a usos y costumbres, diferentes objetivos de aprovechamiento) y ambientales complejos (e.g. múltiples hábitats, difícil acceso a las zonas de pesca y recepción de productos pesqueros, múltiples puntos de entrega, cadenas de distribución y mercadeo diversas), lo que las hace difíciles de evaluar y monitorear (Smith et al., 2005). Esta complejidad socioecológica, dificulta su estudio y a pesar de que en América Latina la pesca de pequeña escala es usualmente ejercida y tiene una alta relevancia social especialmente para las comunidades de zonas rurales, esta ha sido poco estudiada (Cetra & Petrere, 2001; Arreguín-Sánchez & Arcos-Huitrón, 2011; Barrientos et al., 2018). La aportación de la pesca de agua dulce a la seguridad alimentaria se ha ignorado en gran medida y las prioridades de investigación, subsidios e inversión se destinan a otros sectores como a la agricultura, la ganadería y la acuacultura de especies exóticas (Béné & Friend, 2011).
Las pesquerías de pequeña escala de agua dulce son consideradas como sistemas socioecológicos (Basurto et al., 2013), donde existen problemas de sistemas adaptativos, además de aspectos conductuales complicados e impredecibles y las causas, aunque a veces simples, son difíciles de describir y predecir (Martin & Pope, 2011). Todos estos factores, son de entorno no lineal en tiempo y espacio, y tienen un carácter muy cambiante, lo cual hace difícil analizar y predecir sus patrones (Smith & Basurto, 2019). El entorno socioecológico y las complejas relaciones entre las diversos componentes (sociales, pesqueros y ambientales) que integran la pesca de pequeña escala, plantea desafíos en cuanto al manejo, análisis e interpretación de datos se refiere. Herramientas estadísticas intensivas como la estadística multivariada, redes neuronales y los árboles de inferencia condicional, pueden ayudar a comprender el funcionamiento de estos sistemas (e.g. Mendoza-Carranza et al., 2018b; Mendoza-Carranza et al., 2013).
El río Usumacinta el más caudaloso de México, posee la mayor riqueza de especies endémicas de peces en la región sur de México (Elías et al., 2020; Mendoza-Carranza et al., 2018a; Rodiles-Hernández et al., 2018; Soria-Barreto et al., 2018). La cuenca del Usumacinta desemboca en el Golfo de México, y sustenta a una gran diversidad de hábitats dulceacuícolas y estuarinos (Instituto Nacional de Ecología, 2000) donde la pesca es una de las principales actividades económicas (Inda-Díaz et al., 2009; Mendoza-Carranza et al., 2013). Como en otros territorios continentales y marino-costeros de México, la pesca de pequeña escala provee la mayor parte de la producción pesquera y es una fuente de alimento directa para las poblaciones locales, por lo que esta actividad tiene una alta importancia socioeconómica (Arreguín-Sánchez & Arcos-Huitrón, 2011; Smith et al., 2005).
Estudios previos describen que la pesca varia a lo largo de la cuenca baja del Usumacinta (Mendoza-Carranza et al., 2013), pero esta variación en los patrones de pesca no ha sido relacionada con la dimensión socioeconómica, por lo que el conocimiento de la posible influencia que estos factores tienen sobre la pesca es limitado. Por la amplitud de áreas por las cuales atraviesa el río Usumacinta, sus recursos pesqueros son sometidos a diversas formas de explotación (Inda-Díaz et al., 2009; Mendoza-Carranza et al., 2013). Los patrones de explotación de estos recursos pueden variar en función del hábitat y a factores socioeconómicos y culturales de las comunidades por las que el río Usumacinta atraviesa (e.g. Lynch et al., 2017; Puc-Alcocer et al., 2019). Estas condiciones hacen que esta zona sea un buen modelo para analizar como diversos factores socioecológicos están relacionados con los patrones de pesca en escalas geográficas locales, especialmente a nivel de comunidades.
Dentro del contexto de la explotación y manejo de recursos pesqueros, reconocer e integrar la influencia e interacción de factores socioeconómicos locales dentro de los modelos pesqueros, permitirá una gestión detallada que considere las particularidades socioecológicas que tiene cada región o comunidad. El objetivo de este trabajo es inferir cuales son los principales factores socioeconómicos y pesqueros que explican las similitudes y diferencias en las pesquerías de pequeña escala de agua dulce en escalas geográficas locales, tomando como modelo cuatro comunidades asociadas al río Usumacinta, México.
MATERIALES Y MÉTODOS
Área de estudio. La cuenca del río Usumacinta tiene un área de 73,195.22 km2 compartida entre México (42%) y Guatemala (58%), comienza en la zona alta de la serranía de los Cuchumatanes en Guatemala y desemboca en el Golfo de México. El río Usumacinta tiene una longitud total de 560 km, con precipitación promedio anual de 2,700 mm en la zona costera y hasta 4,000 mm en la sierra, su caudal promedio es de 1,700 m3 por segundo (Nooren et al., 2017; Yáñez-Arancibia et al., 2009). Debido a su gran extensión, en este estudio, la cuenca del Usumacinta fue dividida en dos zonas dentro del territorio mexicano: Chiapas y Tabasco denominadas arbitrariamente como selva y planicie costera (Mendoza-Carranza et al., 2018b; Soria-Barreto et al., 2018).
En Chiapas predomina la selva tropical media y alta, donde el principal tributario de la cuenca del Usumacinta es el río Lacantún. Este afluente recorre áreas protegidas como la Reserva de la Biosfera Lacantún, Reserva de la Biosfera de Montes Azules y el monumento natural Yaxchilán. Las localidades incluidas fueron: Benemérito de las Américas y Frontera Corozal en el municipio de Ocosingo, ambas comunidades se encuentran más de 400 km de la capital del estado de Chiapas por vía terrestre (Fig. 1). En Tabasco el ambiente se caracteriza por la presencia de lagunas asociadas a la planicie de inundación del río Usumacinta y río San Pedro en Balancán, Tabasco, donde predomina los pastizales (Palma et al., 2007). En esta área se incluyeron dos sitios de muestreo, uno en el municipio de Balancán, en la cooperativa llamada “Pescadores ribereños del río San Pedro” y el otro en el municipio y cuidad de Tenosique, en la cooperativa “Tenosique el grande” que opera sobre el río Usumacinta; estas comunidades se encuentran aproximadamente a 200 km de la capital del estado de Tabasco por vía terrestre (Fig. 1). Además de los contrastes ambientales entre las regiones donde se encuentran ubicados los sitios de muestreo, estas localidades fueron elegidas por ser comunidades ubicadas en las márgenes del río Usumacinta, donde la pesca representa una de las principales actividades.
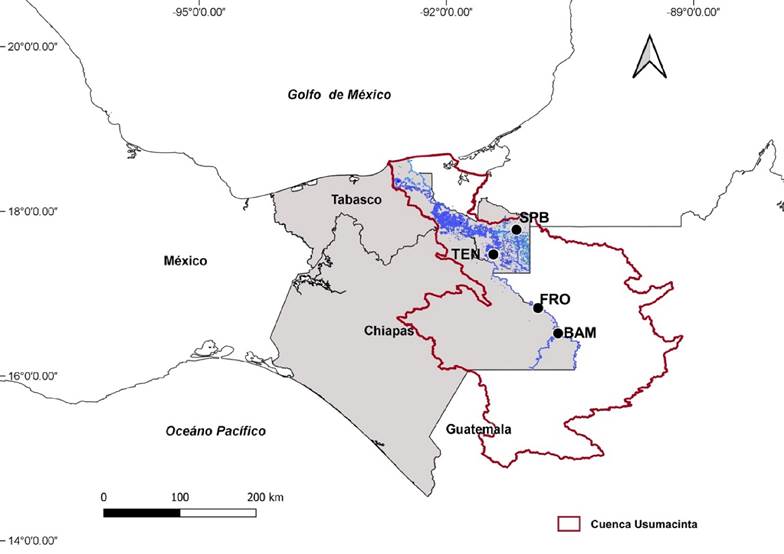
Figura 1 Cuenca del Río Usumacinta, México, Zona de muestreo: Frontera Corozal (FRO), Beneméritos de las Américas (BAM), Tenosique (TEN) y San Pedro Balancán (SPB)
Recolecta de datos. La información utilizada en este estudio se obtuvo de las bases de datos generadas en dos proyectos para las cuatro comunidades seleccionadas, el primero financiado por la Comisión Federal de Electricidad (CFE) “La pesca en la cuenca del Rio Usumacinta” (2015), y el segundo financiado por el Fomento Regional para el Desarrollo Científico, Tecnológico y de Innovación (FORDECyT, 2017-2018) “Cambio global y sustentabilidad en la cuenca del río Usumacinta y zona marina de influencia. Bases para la adaptación al cambio climático desde la ciencia y la gestión del territorio”.
Los datos recolectados en cada proyecto fueron por medio de encuestas dirigidas a presidentes de cooperativas y pescadores, con el fin de obtener información socioeconómica y pesquera sobre las condiciones en las que se realiza la pesca en la cuenca. Estas encuestas se aplicaron una sola vez durante los primeros tres meses de la ejecución de cada proyecto (2015, 2017 y 2018). Fueron realizadas 59 encuestas en Chiapas (9 en 2015 y 50 en 2017-18) y 94 en Tabasco (31 en 2015 y 63 en 2017-18). Los datos obtenidos fueron: edad, estado civil, escolaridad, destino de las capturas (venta o autoconsumo), número de dependientes económicos y tiempo viviendo en la comunidad. Adicionalmente al instrumento ya mencionado (entrevistas), también fueron realizadas entrevistas no estructuradas a pescadores, así como observaciones de campo (participante), que fueron incorporadas en bitácora (Díaz-Bravo et al., 2013; Bonilla & Rodríguez, 2005). La información obtenida a partir de esta metodología no fue relatada en resultados, desde que el enfoque de este trabajo es de índole cuantitativo. Sin embargo, algunas de estas observaciones son discutidas.
Para la recolecta de datos de la actividad pesquera como infraestructura para conservación y manejo de productos pesqueros, tipo de embarcación, artes de pesca, composición de especies capturadas y peso de la captura en kilogramos y estructura de tallas (longitud total en cm), se capacitaron a pescadores de cada comunidad para el llenado de formatos pesqueros (tipo de embarcación, artes de pesca, tiempo de pesca, especies capturadas) y para la toma de datos biométricos de crustáceos y peces (Longitud total en cm - LT) (Mendoza-Carranza et al., 2018a). Se registraron 94 eventos de pesca en Tabasco y 160 en Chiapas durante 2015 y 84 eventos de pesca en Tabasco y 126 en Chiapas durante 2017-18. La recolecta de datos fue irregular a lo largo del periodo de muestreo. Sin embargo, fueron cubiertos todos los meses que abarcaron los periodos anuales.
Análisis estadísticos. Con el fin de determinar diferencias entre las frecuencias del estado civil de los pescadores, edad, grado académico y dependientes económicos entre las localidades estudiadas (Benemérito de las Américas (BAM), Frontera Corozal (FRO), San Pedro Balancán (SPB) y Tenosique (TEN)) se utilizó un análisis de Chi cuadrada (Zar, 2010). Así mismo, también se realizaron análisis de Chi cuadrada para detectar diferencias significativas en el uso de artes de artes de pesca entre localidades. Para determinar las diferencias en la tasa y talla de captura de las especies entre las comunidades, se utilizó el análisis no paramétrico de varianza de Kruskal-Wallis, debido a la falta de normalidad y homocedasticidad en los datos (Sokal & Rohlf, 1995). Se realizaron tablas comparativas de la tasa y talla de captura para poder distinguir e identificar similitudes y diferencias entre las comunidades muestreadas. Asimismo, se realizó un listado de artes de pesca que se utilizan para las capturas de peces y crustáceos en cada comunidad.
Con el objetivo de identificar el grado de importancia de las variables elegidas en el estudio y detectar posibles diferencias entre las comunidades muestreadas, se realizaron árboles de inferencia condicional (AIC) con el paquete partykit del programa R (Hothorn et al., 2010). El AIC socioeconómico, se aplicó con el objetivo de saber qué variables socioeconómicas pueden distinguir y caracterizar a las diversas comunidades de pescadores muestreadas. Los factores para el análisis fueron: el año (2015, 2017 y 2018), la edad de los pescadores, estado civil, número de dependientes, tiempo radicando en la comunidad y el destino de la captura (autoconsumo o venta).
Para el AIC pesquero, se escogieron las variables que pudieran influir sobre la tasa de captura (kg/día especie) (Mendoza-Carranza et al., 2018b; Tsehaye et al., 2007; Winker et al., 2013). Los factores para el análisis fueron: año (2015, 2017 y 2018), estaciones del año (lluvias y secas) localidad, infraestructura asociada a la pesca, especies, artes de pesca. El AIC identifica los mejores predictores para las variables respuesta con divisiones significativas (p ≤ 0.05), por lo que las variables no significativas son descartadas por el mismo. Este análisis se basa en una prueba de significancia basada en permutaciones para seleccionar factores que influyen sobre cierta variable. Tanto factores como variables respuesta pueden ser todo tipo, incluidas variables de respuesta nominales, ordinales, numéricas y multivariadas, por lo cual es ideal en situaciones donde los datos son de naturaleza múltiple o escasos (Hothorn et al., 2006).
RESULTADOS
Componente socioeconómico. Respecto al perfil demográfico de los pescadores encuestados, en Chiapas el 62.71 % fueron pescadores jóvenes que estuvieron con edad entre los 21-40 años. Por el contrario, en Tabasco con 42.55% los pescadores fueron mayores de 41 años (Tabla 1). A pesar de esto, la distribución de edades en las comunidades fue homogénea (X2= 1.80 p > 0.05). Respecto al estado civil, más del 80% de los pescadores encuestados en todas las localidades están casados o en unión libre (Tabla 1). La prueba de X2 indicó una relación significativa entre el tipo de estado civil y las comunidades (X2=60.02, p < 0.001).
Tabla 1 Proporción (%) de pescadores con respecto a grupos de edad, escolaridad, estado civil y dependientes económicos. Benemérito de las Américas (BAM), Frontera Corozal (FRO), San Pedro Balancán (SPB) y Tenosique (TEN), (n) número de encuestados.
| Características (personas) | TEN (56) | SPB (38) | FRO (22) | BAM (38) | Tabasco (94) | Chiapas (60) |
|---|---|---|---|---|---|---|
| Edad del pescador | ||||||
| Menor de 20 años | 3.57 | 2.63 | 4.55 | 5.41 | 3.19 | 5.09 |
| Entre 21 y 40 años | 25.00 | 52.63 | 95.45 | 43.24 | 36.17 | 62.71 |
| Entre 41 y 50 años | 17.86 | 18.42 | 0 | 24.32 | 18.09 | 15.25 |
| Mayor de 51 años | 53.57 | 26.32 | 0 | 27.03 | 42.55 | 16.95 |
| Estado civil del pescador | ||||||
| Soltero | 16.07 | 7.89 | 9.09 | 10.71 | 12.77 | 10.00 |
| Casado/Unión libre | 82.14 | 81.58 | 90.91 | 85.71 | 81.91 | 88.00 |
| Viudo | 1.79 | 5.26 | 0 | 0 | 3.19 | 0 |
| Divorciado | 0 | 5.26 | 0 | 3.57 | 2.13 | 2.00 |
| Nivel educativo del pescador | ||||||
| Sin estudios | 12.73 | 7.89 | 0 | 25.00 | 10.75 | 14.00 |
| Primaria | 56.36 | 57.89 | 50.00 | 46.43 | 56.99 | 48.00 |
| Secundaria | 23.64 | 21.05 | 27.27 | 25.00 | 22.58 | 26.00 |
| Preparatoria | 3.63 | 13.16 | 18.18 | 3.57 | 7.53 | 10.00 |
| Universidad | 3.64 | 0 | 4.55 | 0 | 2.15 | 2.00 |
| Dependientes económicos | ||||||
| Menor de 2 | 46.43 | 28.95 | 43.75 | 44.44 | 39.36 | 44.19 |
| Entre 3 y 6 | 48.21 | 68.42 | 56.25 | 55.56 | 56.38 | 55.81 |
| Mas de 7 | 5.36 | 2.63 | 0 | 0 | 4.26 | 0 |
Respecto al grado de estudio, el nivel básico fue el más común en todas las comunidades. La primaria alcanzó 56.99 % en Tabasco y 48.00 % en Chiapas de los pescadores entrevistados, seguida de la educación secundaria con 22.58 % en Tabasco y 26.06 % en Chiapas; el 10.75 % y 14.00 % de los pescadores no tuvieron estudios en Tabasco y Chiapas respectivamente. La distribución del grado de estudios y las localidades de residencia estuvieron relacionados (X2=19.60, p = 0.07).
El 76.0 % de los encuestados cuenta con casa propia, y el número de dependientes económicos reportados por los pescadores en ambas localidades estuvieron en un rango de 3 a 6 personas, en Tabasco con el 56.38 % y en Chiapas con el 55.81 % (Tabla 1. La prueba e X2 indicó una relación significativa entre el número de dependientes y las comunidades (X2=97.81, p < 0.05).
Árbol de inferencia condicional. El destino de la captura (venta-autoconsumo) fue la variable socioeconómica de división más importante entre los pescadores de las comunidades muestreadas (nodo 1, p < 0.001); indicando que en Benemérito de las Américas (BAM) la mayor parte de las capturas son destinadas al autoconsumo (Fig. 2). Los siguientes nodos que separan a los pescadores de las comunidades analizadas fueron: edad (Edad, p < 0.001), estado civil (Civil, p < 0.028) y escolaridad (Escol, p < 0.023), donde los solteros y casados que comercializan las capturas se localizan en su mayoría en Frontera Corozal (FRO, nodo 5), mientras que, los que están en unión libre en su mayoría se localizan en San Pedro Balancán (SPB, nodo 6).

Figura 2 Árbol de inferencia condicional de las principales variables sociales y que influyen en las comunidades estudiadas de la cuenca del Usumacinta, México. Benemérito de las Américas (BAM), Frontera Corozal (FRO), San Pedro Balancán (SPB) y Tenosique (TEN)
La precisión de salida del AIC para discriminar los diversos elementos (pescadores/localidad), de acuerdo con sus características socioeconómicas fue de 61.0±7.0% IC (intervalo de confianza al 95%). La matriz de confusión indicó que, del total de pescadores de Benemérito de las Américas, el árbol clasificó correctamente el 81%, en Frontera Corozal el 100% fue clasificado correctamente y el 55% en Tenosique. San Pedro Balancán presentó el mayor porcentaje de clasificados erróneamente con el 82 % (Tabla 2).
Tabla 2 Matriz de confusión de la función del árbol de inferencia condicional basada en atributos sociales obtenidos de las diferentes comunidades Tenosique (TEN), San Pedro Balancán (SPB), Benemérito de las Américas (BAM) y Frontera Corozal (FRO).
| Valores | |||||
|---|---|---|---|---|---|
| TEN | BAM | FRO | SPB | ||
| TEN | 36 | 2 | 0 | 14 | |
| Predicción | BAM | 14 | 39 | 0 | 3 |
| FRO | 13 | 3 | 22 | 14 | |
| SPB | 3 | 4 | 0 | 7 | |
| Valores positivos (%) | 55 | 81 | 100 | 18 | |
| Valores negativos (%) | 45 | 19 | 0 | 82 | |
Componente pesquero. Una diferencia fundamental entre los puntos de recepción de Chiapas y Tabasco es que, en el primer caso, no existe infraestructura consolidada para la conservación y manejo de productos pesqueros, caso contrario ocurre en Tabasco donde en ambos puntos de muestreo existe una infraestructura básica para conservación (hielo) y manejo de productos pesqueros. Con respecto al tipo de embarcación, todas las comunidades utilizan solamente dos tipos: los cayucos, en su mayoría fabricados de fibra de vidrio, con medidas entre 6 y 9 m de eslora, y las lanchas de fibra de vidrio con »7 m de eslora. En las cuatro comunidades se contabilizaron siete diferentes tipos de artes de pesca, y el más utilizado en todas las localidades fue la red agallera, en Tabasco con el 85.0% y 82.0% en Chiapas. La comunidad que presentó mayor diversidad de artes de pesca fue Frontera Corozal, con seis artes de pesca. El análisis de X2 indicó que existe una relación significativa entre las comunidades y el uso de arte de pesca (X2 = 195.47, p < 0.001, Fig. 3).
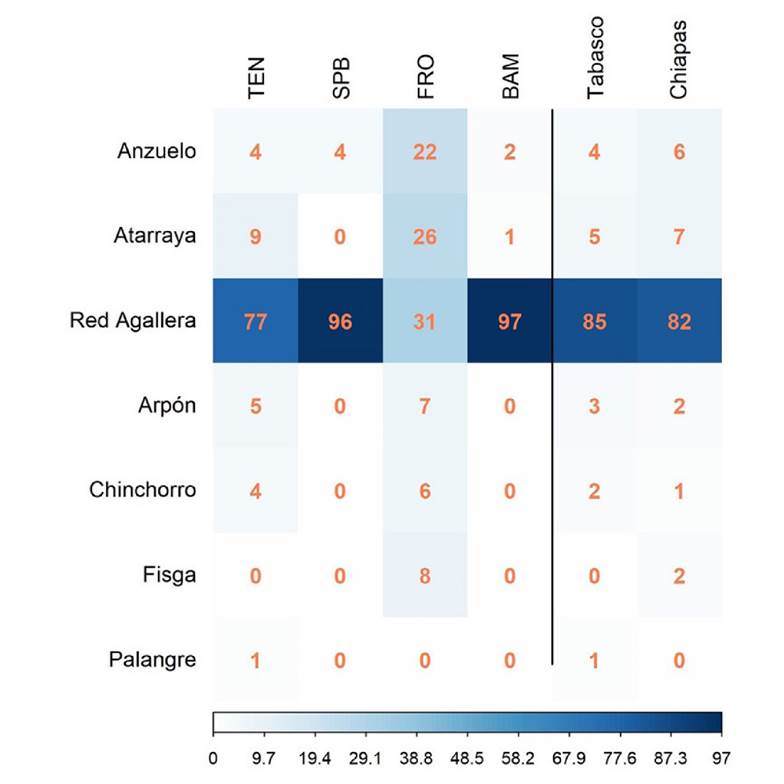
Figura 3 Porcentaje de uso de artes de pesca en las comunidades de la cuenca del Usumacinta, México. Benemérito de las Américas (BAM), Frontera Corozal (FRO), San Pedro Balancán (SPB) y Tenosique (TEN)
En total se explotan dos especies de crustáceos: la acamaya (Macrobrachium acanthurus, Wiegmann, 1836) y la pigua (M. carcinus, Linnaeus, 1758) y 23 especies de peces (Tabla 3). Las dos especies de peces con mayor tasa de captura fueron la carpa herbívora (Ctenopharyngodon idella, Valenciennes, 1844) (44±96.2 kg/día de pesca) y la carpa común (Cyprinus carpio, Linnaeus, 1758) (26±25.5 kg/día de pesca) ambas especies introducidas (Tabla 3). La mojarra castarrica (Mayaheros urophthalmus, Günther, 1862) fue la especie con menor tasa de captura (0.2±0.1 kg/día de pesca); las demás especies no alcanzaron la decena de kg/día de pesca (Tabla 3).
Tabla 3 Tasa de captura de especies de crustáceos y peces en kg/día de pesca (media±desviación estándar) en las comunidades muestreadas, Tenosique (TEN), San Pedro Balancán (SPB), Benemérito de las Américas (BAM) y Frontera Corozal (FRO). Letras distintas (TN= Tenosique BL=Balancán BA=Benemérito de las Américas y FC= Frontera corozal) sobre cada una de las determinaciones indican diferencia estadísticamente significativa entre las medias (α=0.05).
| Nombre científico | Nombre común | Tasa de captura (kg) | |||||
|---|---|---|---|---|---|---|---|
| TEN | SPB | BAM | FRO | Tabasco | Chiapas | ||
| CRUSTACEA | |||||||
| Macrobrachium acanthurus (Wiegmann, 1836) | Acamaya | 0.6±0.4 | 0.3 | 0.6±0.4 | 0.3 | ||
| Macrobrachium carcinus (Linnaeus, 1758) | Pigua | 0.6±0.3 | 5.6±6.3 | 0.6±0.3 | 5.6±6.3 | ||
| ACTINOPTERYGII | |||||||
| Aplodinotus grunniens Rafinesque, 1819 | Topuche | 1.5±2.4FC | 0.9±0.8FC | 9.5±10.4BL, TN | 1.3±2 | 9.5±10.4 | |
| Cathorops aguadulce (Meek, 1904) | Curuco | 7.6±2.1FC | 1.6±2TN | 7.6±2.1 | 1.6±2 | ||
| Atractosteus tropicus Gill, 1863 | Pejelagarto | 3.7±4.2 | 3.4±2.7 | 3.5±3.3 | |||
| Brycon guatemalensis Regan, 1908 | Macabil | 0.8±0.3BA | 20.8±13.2FC, TN | 2±1BA | 0.8±0.3 | 15±14 | |
| Centropomus poeyi Chávez, 1961 | Robalo prieto | 2.0±4.2 | 2±4.20 | ||||
| Centropomus undecimalis (Bloch, 1792) | Robalo | 5.2±5.8BA | 4.1±5BA | 2.5±3.1BL,TN | 4.6±5.3 | 2.5±3.1 | |
| Cincelichthys pearsei (Hubbs, 1936) | Zacatera | 0.7±3.2FC, BL | 0.5±0.2TN | 1±1.1TN | 0.7±2.9 | 1±1.1 | |
| Ctenopharyngodon idella (Valenciennes, 1844) | Carpa herbívora** | 8.5±16.6 | 61±110.5 | 3.7±1.2 | 8.5±16.6 | 44±96.2 | |
| Cyprinus carpio Linnaeus, 1758 | Carpa común** | 16.7 | 26±25.5 | 16.7 | 26±25.5 | ||
| Eugerres mexicanus (Steindachner, 1863) | Mojarra blanca | 3.8±3.9 | 0.8±0.6 | 0.4 | 3.8±3.9 | 0.6±0.5 | |
| Gobiomorus dormitor Lacepède, 1800 | Guabina | 0.7±0.6 | 0.8±0.5 | 5.4±6.6 | 0.9±0.4 | 0.8±0.5 | 1.9±3.1 |
| Ictalurus meridionalis (Günther, 1864) | Bobo liso | 2.8±4.9 BA, C | 1.5±1.5 BA,FC | 4.3±8.3FC, BL, TN | 9.8±8.3BA, TN, BL | 2.5±4.3 | 4.6±8.4 |
| Ictiobus meridionalis (Günther, 1868) | Pejepuerco | 3.6±3 | 3.2±1 | 1.7±1.6 | 3.6±3 | 3.1±1 | |
| Maskaheros argenteus (Allgayer, 1991) | Pozolera | 0.5±0.2 | 0.5±0.2 | ||||
| Mayaheros urophthalmus (Günther, 1862) | Castarrica | 0.2±0.03 | 0.2±0.1 | 0.2±0.1 | |||
| Megalops atlanticus Valenciennes, 1847 | Sábalo | 4±1.6 | 2.0 | 4±1.6 | 2 | ||
| Mugil cephalus Linnaeus, 1758 | Lisa | 0.7 | 0.7 | ||||
| Oreochromis niloticus (Linnaeus, 1758) | Tilapia** | 5.6±8.2BA | 2.3±2.1BA | 1.6±6.2BL, TN | 3.1±2.8 | 3.9±6.2 | 1.6±6.1 |
| Vieja melanurus (Hubbs, 1936) | Paleta | 8±2 | 8±2 | ||||
| Parachromis managuensis (Günther, 1867) | Pinta** | 0.2±0.02FC | 0.5±0.5 | 0.3±0.03 | 1.5±1.3TN | 0.3±0.3 | 1.2±1.2 |
| Petenia splendida Günther, 1862 | Tenhuayaca | 4.7±6.9 | 1.3±1.2 | 0.6±0.5 | 3.3±5.6 | 0.6±0.5 | |
| Potamarius nelsoni (Evermann & Goldsborough, 1902) | Cabeza de Fierro | 4±2.6 | 4±2.6 | ||||
| Vieja bifasciata (Steindachner, 1864) | Colorada | 4.9±8.6 | 0.3±0.2FC | 0.3 | 1.4±1.8BL | 1.6±4.7 | 1.3±1.7 |
** especie introducida
Respecto a las tallas de los organismos capturados, las especies con mayor talla promedio de captura fueron: el robalo blanco (Centropomus undecimalis, Bloch, 1792) con 89±18 cm LT y el robalo prieto (C. poeyi Chávez, 1961) con 74±11 cm LT. Las menores tallas registradas fueron: la mojarra blanca Eugerres mexicanus (Steindachner, 1863) y la mojarra castarrica (M. urophthalmus) con 22±1 cm LT para ambas especies (Tabla 4).
Tabla 4 Longitud total promedio±desviación estándar en centímetros y (n) número de individuos capturados en Tenosique (TEN), San Pedro Balancán (SPB), Benemérito de las Américas (BAM) y Frontera Corozal (FRO). Letras distintas (TN= Tenosique BL=Balancán BA=Benemérito de las Américas y FC= Frontera corozal) sobre cada una de las determinaciones indican diferencia estadísticamente significativa entre las medias (α=0.05).
| Nombre científico | Nombre común | Talla de captura (cm) | |||||
|---|---|---|---|---|---|---|---|
| TEN | SPB | BAM | FRO | Tabasco | Chiapas | ||
| CRUSTACEA | |||||||
| Macrobrachium acanthurus (Wiegmann, 1836) | Acamaya | 26±4 (6) | 28 (1) | 26±4 (6) | 28 (1) | ||
| Macrobrachium carcinus (Linnaeus, 1758) | Pigua | 24±5 (19) | 24±5 (19) | ||||
| ACTINOPTERYGII | |||||||
| Aplodinotus grunniens Rafinesque, 1819 | Topuche | 31±3 (85) BL | 32±2(111) TN | 27 (1) | 32±3(196) | 27±1 (1) | |
| Cathorops aguadulce (Meek, 1904) | Curuco | 61±16 (5) | 61±16 (5) | ||||
| Atractosteus tropicus Gill, 1863 | Pejelagarto | 54±9(10) | 54±10 (72) | 54±10 (82) | |||
| Brycon guatemalensis Regan, 1908 | Macabil | 42±16 (99) | 40±0 (4) | 42±16 (103) | |||
| Centropomus poeyi Chávez, 1961 | Robalo prieto | 74±11(9) | 74±11(9) | ||||
| Centropomus undecimalis (Bloch, 1792) | Robalo blanco | 57±19 (124) BL, BA | 68±14 (269) BA, TN | 89±18 (209) BL, TN | 64±16 (393) | 89±18 (209) | |
| Cincelichthys pearsei (Hubbs, 1936 | Zacatera | 24±3 (10) | 24±2 (18) BL | 27±2 (44) | 29±6 (48) BA, BL, TN | 24±2 (28) | 28±4 (92) |
| Ctenopharyngodon idella (Valenciennes, 1844 | Carpa herbívora** | 54±10 (81) | 67±9 (32) | 54±10 (81) | 67±9 (32) | ||
| Cyprinus carpio Linnaeus, 1758 | Carpa común** | 50±6(8) | 50±6(8) | ||||
| Eugerres mexicanus (Steindachner, 1863) | Mojarra blanca | 22±1 (33) | 22±1 (33) | ||||
| Gobiomorus dormitor Lacepède, 1800 | Guabina | 36±8 (5) | 45±3 (7) | 40 (1) | 41±7 (12) | 40 (1) | |
| Ictalurus meridionalis (Günther, 1864) | Bobo liso | 48±16 (142) BL, BA | 40±10 (76) TN | 37±13 (239) FC, TN | 79±1 (2) BA | 45±14 (218) | 38±13 (241) |
| Ictiobus meridionalis (Günther, 1868) | Pejepuerco | 52±7 (9) BA | 76±13 (248) FC, TN | 33±4 (2) BA | 52±7 (9) | 75±14 (250) | |
| Maskaheros argenteus (Allgayer, 1991) | Pozolera | 27±7 (10) FC | 29±1 (8) BA | 28±6 (18) | |||
| Mayaheros urophthalmus (Günther, 1862) | Castarrica | 22±1 (4) | 22±1 (4) | ||||
| Megalops atlanticus Valenciennes, 1847 | Sábalo | 47±5 (4) | 47±5 (4) | ||||
| Mugil cephalus Linnaeus, 1758 | Lisa | 66±5 (5) | 66±5 (5) | ||||
| Oreochromis niloticus (Linnaeus, 1758) | Tilapia** | 30±6 (293) BA, FC, BL | 27±3 (933) TN | 27±7 (778) TN | 24±4 (8) TN | 28±5 (1226) | 27±7 (786) |
| Parachromis managuensis (Günther, 1867) | Pinta** | 28±4 (14) | 32±2 (3) | 29±1 (4) | 28±4 (14) | 30±2 (7) | |
| Petenia splendida Günther, 1862 | Tenhuayaca | 29±10 (96) BL | 34±6 (78) TN, BA | 28±4 (105) BL | 34±5 (4) | 31±9 (174) | 28±4 (109) |
| Potamarius nelsoni (Evermann & Goldsborough, 1902) | Cabeza de Fierro | 23±6(3) | 23±6(3) | ||||
| Vieja bifasciata (Steindachner, 1864) | Colorada | 21±1 (11) FC, BL | 25±3 (14) TN | 28±6 (11) TN | 23±3 (25) | 28±6 (11) | |
** especie introducida
La mayoría de las especies reportadas, fueron capturadas en los cuatro sitios de muestreo. Sin embargo, M. acanturus, el bagre boca chica (Ariopsis felis (Linnaeus, 1766)), el pejelagarto (Atractosteus tropicus Gill, 1863), C. poeyi, C. carpio, la mojarra blanca (E. mexicanus) y la castarica M. urophthalmus, solo se pescaron en Tabasco, en tanto que el macabil (Brycon guatemalensis Regan, 1908), la mojarra pozolera (Maskaeros argenteus (Allgayer, 1991)), el sabálo (Megalops atlanticus Valenciennes, 1847), la lisa (Mugil cephalus Linnaeus, 1758) y el bagre lacandón (Potamarius nelsoni (Evermann & Goldsborough, 1902)) solo en Chiapas (Tabla 4).
En las localidades muestreadas los organismos capturados con más de cinco diferentes artes de pesca fueron el topuche (Aplodinotus grunniens Rafinesque, 1819), B. guatemalensis y C. undecimalis. Por otra parte, los organismos capturados con solo un arte de pesca fueron M. acanthurus, M. atlanticus y M. cephalus (Tabla 5).
Tabla 5 Lista de peces y crustáceos capturados por las diferentes artes de pesca de la cuenca del Usumacinta, México.
| Nombre común | Arte de pesca | ||||||
|---|---|---|---|---|---|---|---|
| Anzuelo | Arpón | Atarraya | Chinchorro | Fisga | Palangre | Red Agallera | |
| Acamaya | X | ||||||
| Pigua | X | X | X | ||||
| Topuche | X | X | X | X | X | X | |
| Curuco | X | X | X | X | |||
| pejelagarto | X | X | |||||
| Macabil | X | X | X | X | X | ||
| Robalo prieto | X | X | |||||
| Robalo | X | X | X | X | X | ||
| Zacatera | X | X | X | X | X | X | |
| Carpa herbívora | X | X | X | X | X | X | |
| Mojarra blanca | X | X | |||||
| Guabina | X | X | X | X | |||
| Bobo liso | X | X | X | X | X | X | |
| Pejepuerco | X | X | X | X | |||
| Pozolera | X | X | |||||
| Castarrica | X | X | |||||
| Sábalo | X | ||||||
| Lisa | X | ||||||
| Tilapia | X | X | X | X | X | X | |
| Pinta | X | X | X | X | X | ||
| Tenhuayaca | X | X | X | X | X | ||
| Cabeza de Fierro | X | X | |||||
| Colorada | X | X | X | X | |||
Árbol de inferencia condicional. La principal división que explica el comportamiento de la tasa de captura fue la localidad (Local, nodo 1, p < 0.001) que separa a Benemérito de las Américas de las demás comunidades (Fig. 4). En esta localidad se observó una subdivisión (nodo 2, p < 0.01), donde el año 2015, sin distinción de especies, se asoció al mayor promedio de tasa de captura (61.76±95.83 kg/día de pesca). Posteriormente, los años 2017 y 2018 se dividieron en valores más bajos de tasa de captura especialmente por especies, donde Ictalurus meridionalis (Günther, 1864) (B) y Gobiomorus dormitor Lacepède, 1800 (I) alcanzaron los valores promedio más altos (9.84±8.44 kg/día de pesca, nodo 12). Finalmente, Frontera Corozal y San Pedro Balancán no presentaron diferencias en sus tasas de captura (4.92±7.09 kg/día de pesca), mientras que en Tenosique se observó una tasa de captura del 9.51±13.15 kg/día de pesca (nodo 15, Fig. 4).
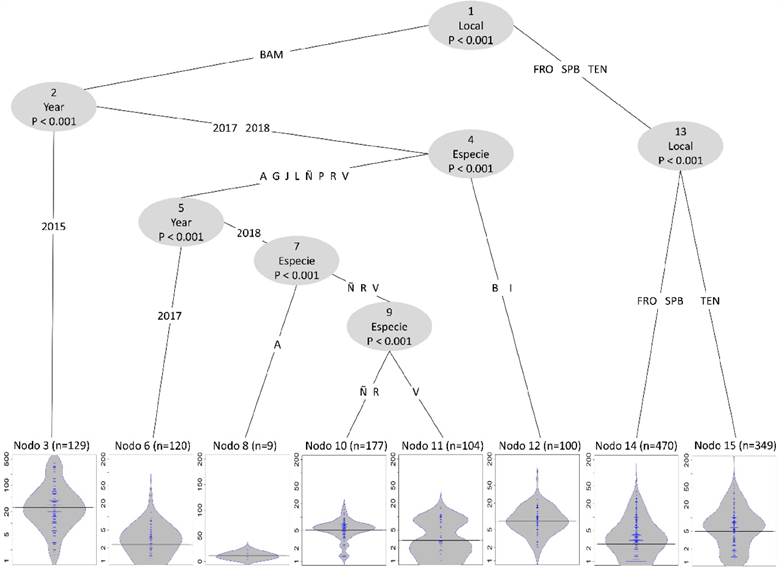
Figura 4 Árbol de inferencia condicional de tasa de captura de las comunidades estudiadas de la cuenca del Usumacinta, México. Los nodos en forma de gráficos de beanplot están a una escala de 1-200 kg a excepción del nodo tres donde hubo mayor cantidad de captura y fue necesario poner una escala mayor de 1-500 kg. Benemérito de las Américas (BAM), Frontera Corozal (FRO), San Pedro Balancán (SPB) y Tenosique (TEN). (A) Ctenopharyngodon idella, (B) Ictalurus meridionalis (G) Vieja bifasciata, (I) Gobiomorus dormitor (J) Mugil cephalus, (L) Eugerres mexicanus, (Ñ) Ictiobus meridionalis, (P) Parachromis managuensis, (R) Centropomus undecimalis, (V) Oreochromis niloticus.
DISCUSIÓN
Componente socioeconómico. Los enfoques para las políticas y el manejo pesquero de la pesca continental se basan en elementos provenientes de la pesca marina, por lo tanto, son limitados en su alcance integral (Nguyen et al., 2016). Rara vez se utilizan enfoques holísticos que tomen en cuenta la interacción que existe entre los seres humanos y los recursos pesqueros (e.g. Jentoft & Chuenpagdee, 2015; Said & Chuenpagdee, 2019; Zeller et al., 2006). Debido al tipo de problemas que se presentan en las pesquerías de pequeña escala, es de gran importancia tratar de incluir los factores socioeconómicos y ambientales, ya que con ellos se puede tener un mejor entendimiento de esta actividad, la cual es considerada como un sistema socioecológico integrado, adaptativo y complejo (Andrew et al., 2007; Basurto et al., 2013).
El estudio de la pesca continental de pequeña escala suele ser complicado, debido a que los factores que la integran (socioeconómicos, pesqueros y ambientales) interactúan en forma dinámica produciéndose una alta diversidad de respuestas (Caddy & Seijo, 2005; Salas et al., 2004). Debido al carácter descriptivo de la mayoría de los estudios sociales en la pesca, se favorece una desvinculación entre estos factores y los procesos propiamente pesqueros, lo que se traduce en una pérdida de información que podrían proveer en su conjunto (Hilborn, 2007). Por lo anterior, en este trabajo se aplicó una metodología que organiza y relaciona algunos de los factores socioeconómicos más importantes, de acuerdo con su relevancia para encontrar descriptores que indiquen diferencias en la estructura socioeconómica de las cuatro comunidades y que a simple vista parecen ser muy semejantes (Arlinghaus et al., 2002; Béné, 2006).
Se observó que Benemérito de las Américas es diferente a las demás localidades, debido a que sus productos pesqueros son poco comercializados y los utilizan mayormente para el autoconsumo. Esto coincide con lo reportado por Inda-Díaz et al. (2009) donde encontraron que en comunidades de Chiapas las capturas son destinadas para subsistencia y venta local. Otros factores para tomar en cuenta y que ayudarían a explicar estas diferencias son: la falta de servicios relacionados con energía eléctrica y en especial infraestructura para el manejo, conservación y transporte de las especies capturadas en las comunidades de Chiapas y que en su conjunto limitan la comercialización de cualquier tipo de productos, lo cual genera el autoconsumo y apoya el comercio local (Inteligencia Pública & EDF de México, 2019). Siendo este ultimo factor coincidente con la localidad, figurando como un factor diferencial en el AIC socioeconómico (venta).
Un factor cultural que influye en que la pesca sea principalmente para autoconsumo en las comunidades de Chiapas es la existencia de la cacería como medio para obtener proteínas de alta calidad (Garcia-Alaniz et al., 2010; Rodas-Trejo et al., 2014). Según las personas entrevistadas, con la disminución de las presas de caza, la pesca se constituyo una fuente de proteínas de alta calidad con un acceso menos limitado y que de cierta forma se mantiene ligado a un componente cultural de uso de recursos (Arce-Ibarra & Charles, 2008; Brashares et al., 2004; Cury & Cayré, 2001).
A pesar de que fueron incluidos varios factores socioeconómicos que podrían influir en la dinámica de la pesca, muchos otros no pudieron ser considerados dentro de los análisis, pero si fueron mencionados en entrevistas informales o bien observados durante el transcurso de la investigación. Algunos factores culturales y su influencia en el aprovechamiento de recursos mencionados fueron: la dinámica de los flujos de mercado y su relación con la urbanización y el impacto de las organizaciones sociales. sin embargo, estos factores, a pesar de ser mencionados, quedaron fuera del alcance de esta investigación. Por lo anterior, es importante discutir y considerar su posible efecto sobre el uso de recursos pesqueros en futuras investigaciones.
En las comunidades Chiapanecas, Benemérito de las Américas y Frontera Corozal, no existen flujos de mercado consolidados hacia el exterior y los pescadores generalmente se adaptan a las condiciones económicas locales para su venta (Cetra & Petrere, 2001). Por el contrario, las comunidades de Tabasco (Tenosique y San Pedro Balancán), son localidades con una mayor cercanía a grandes centros urbanos como Villahermosa entre otros, lo que diversifica los canales de mercado, siendo estos locales, estatales y naturales (Palma et al., 2007).
Otro factor que influye en estas diferencias es que las comunidades de Tabasco históricamente han tenido facilidades para constituir sociedades cooperativas organizadas (Cano-Salgado et al., 2012), lo cual genera condiciones para la obtención de subsidios, apoyos gubernamentales y permisos de pesca (Bennett, 2017). Además, se habilitan las ventas en volumen, se pueden alcanzar de diversos canales de mercado y créditos a bajo interés (Finkbeiner & Basurto, 2015; Ünal et al., 2009). Por el contrario, en las comunidades de Chiapas este tipo de organización prácticamente es inexistente, a pesar de que se encuentra una cooperativa reportada en la comunidad de Benemérito de las Américas, la cual, a lo largo de esta investigación, no reportó captura alguna, siendo las capturas observadas provenientes de pescadores libres. Estos factores se vieron reflejados directamente en AIC socioeconómico, especialmente en el nodo “venta” donde las comunidades de Tabasco venden mayormente sus recursos pesqueros, mientras que en Chiapas el autoconsumo es predominante.
Dentro de los factores sociales que pueden influir en el comportamiento local de la pesca, está el nivel educativo (Barclay et al., 2017). Si bien el nivel educativo de los pescadores cambia de comunidad en comunidad (Cooke et al., 2016; Inteligencia Pública & EDF de México, 2019), el nivel educativo de los pescadores de las comunidades pesqueras de la cuenca del río Usumacinta es bajo, siendo predominante de nivel primaria. Hecho semejante se presenta en la región pesquera de Guasave, Sinaloa, México donde el grado máximo de escolaridad no supera los ocho años, esto es, hasta el nivel secundaria (Inteligencia Pública & EDF de México, 2019); lo mismo ocurre en la región norte de Vietnam donde la mayor parte de los pescadores de pequeña escala tienen un nivel educativo de secundaria (Phan-Hai et al., 2020). El bajo nivel educativo se puede deber a la falta de infraestructura (pocas escuelas y maestros), incluso, debido a la marginación de algunas comunidades y especialmente a la situación económica de las familias de pescadores. Este ultimo factor, obliga a los jóvenes a abandonar sus estudios para dedicarse a la pesca y ayudar al ingreso familiar, lo que conlleva que los jóvenes adopten un estilo de vida diferente de los que sí continúan con sus estudios académicos (Chen & DesJardins, 2008).
Asociaciones entre la deserción escolar y la actividad sexual temprana, el embarazo y el matrimonio son bien reconocidas en sociedades rurales y suburbanas (Glynn et al., 2018), lo que provoca que las personas se casen o vivan en unión libre a una corta edad ocasionando una urgente necesidad de ingresos económicos (Singh & Vennam, 2016). Lo anterior puede ser una de las causas por lo que la mayor parte de los pescadores encuestados se encuentran casados o en unión libre, siendo dueños de su vivienda, pero también obligados a ejercer oficios como la pesca desde muy temprana edad para sostener su estilo de vida. Este hecho, concuerda con el estudio realizado por Keleş & Yılmaz, (2020) donde caracterizaron aspectos sociales de pescadores dueños de lanchas en la región del Mar Negro de Turquía donde reportaron que la mayor parte de los pescadores están casados.
Componente pesquero. Como se observó en el AIC se encontraron diferencias significativas en las tasas de captura de las especies capturadas dentro y entre las comunidades de Tabasco y Chiapas. Parte de las diferencias observadas se pueden atribuir a la percepción que cada comunidad tiene de la naturaleza y al consiguiente uso de los recursos pesqueros (Kalikoski et al., 2006; Puc-Alcocer et al., 2019).
El uso de las artes de pesca estuvo se relacionaron con las comunidades. Estas diferencias están posiblemente relacionadas a que Frontera Corozal es una comunidad más aislada y por tanto los pescadores están más apegados al uso tradicional de los recursos naturales, dando una importancia mínima a su comercialización (López-Feldman et al., 2007). A pesar de las diferencias entre usos de artes en las comunidades estudiadas, todas pueden clasificarse como rudimentarias (Shester & Micheli, 2011).
La tasa de captura puede variar entre especies y por múltiples factores (e.g. tecnológico-pesqueros, socioeconómicos, comerciales, entre otros). Un ejemplo de esta variabilidad es la tasa de captura de la carpa herbívora (C. idella) donde factores socioeconómicos y ecológicos influyen en sus tasas de captura. En particular, Tabasco tiene menor tasa de captura de esta especie, posiblemente derivado de la alta presión de pesca derivada de su comercialización. Por el contrario, en Chiapas la captura de esta especie es más selectiva y los pescadores prefirieren capturar organismos más grandes para su consumo (Inda-Díaz et al., 2009). Otro ejemplo es la drástica disminución en las tasas de captura de la pigua (M. carcinus), especie de crustáceo altamente valorada en la cuenca media del río Usumacinta, principalmente en Tenosique y que había sido unos de los recursos pesqueros más importantes desde el punto de vista cultural y económico. Los pescadores mencionan que la tasa de captura disminuyó desde 2016 al grado que ya no era comercialmente rentable su captura (Mercado-Salas et al., 2013, obs. pers. Hernández-Gómez) lo que concuerda con lo reportado en este estudio, donde se reportaron capturas mínimas de esta especie.
Adicionalmente, la variabilidad en las tasas de captura puede estar relacionada a la variación climática e hidrológica y la diversidad de especies y hábitats (Strayer & Dudgeon, 2010), pero también depende de la experiencia de cada pescador o de las condiciones de cada viaje de pesca, lo que origina incertidumbre en todos los modelos de predicción (Branch et al., 2006; Moreau & Coomes, 2008; Salas & Gaertner, 2004).
Durante 2015 la tasa de captura de los recursos pesqueros se observó superior a los años 2017 y 2018, esta disminución y composición de especies podría deberse a múltiples factores, por ejemplo: el incremento del esfuerzo, incremento de la abundancia de otras especies invasoras, especialmente el bagre armado (Loricariidae), pérdida de hábitats, alteraciones ecológicas (Ballesteros & Rodríguez-Rodríguez, 2018; Ibáñez, 2019). No obstante, es importante notar que la tasa de captura de muchos recursos pesqueros presenta marcadas fluctuaciones a lo largo de los años, por lo que es importante realizar estudios a corto y mediano plazo.
La introducción de peces exóticos en México se realizó con el objetivo de incrementar la producción pesquera y acuícolas (Benítez & Ponce, 2014; Dávila-Camacho et al., 2019). Sin embargo, investigaciones en los últimos años, han expuesto resultados dañinos para los ecosistemas naturales, donde no se han tomado en cuenta que hay especies de importancia pesquera en México, así como especies idóneas para ser cultivadas con la finalidad de abastecer la demanda de alimentos (Wakida-Kusonoki, 2007; Amador-del Ángel & Wakida-Kusonoki, 2014).
Actualmente las capturas en las pesquerías de las comunidades estudiadas están conformadas en gran parte por especies introducidas, como la mojarra tilapia (Oreochromis niloticus (Linnaeus, 1758)) y la carpa herbívora (Ctenopharyngodon idella (Valenciennes, 1844)), las cuales han desplazado a especies nativas ocupando y modificando su hábitat (Velázquez et al., 2014), pero a la vez han generado beneficios económicos y cambios en la percepción social de estos recursos, siendo identificadas por los pescadores como especies “nativas”, pasando a ser por su abundancia, recursos pesqueros de gran importancia (Mendoza-Carranza et al., 2018a; Meiners-Mandujano et al., 2019). La importancia de estas especies introducidas es tal que se encuentran incorporadas en la norma oficial mexicana NOM-037-PESC-2004 (Secretaría de Agricultura, Ganadería, Desarrollo Rural, 2007).
El impacto que puede ocasionar este grupo de especies introducidas sobre las especies nativas es difícil de predecir y evaluar, debido a la facilidad de adaptación y agresividad que poseen las especies introducidas, eso hace que las especies locales estén en desventaja y sean desplazadas a mediano plazo. Si no se toman medidas urgentes para recuperar las poblaciones de peces nativos, éstas estarían en peligro de desaparecer como recurso pesquero de alto valor alimenticio y comercial (Velazquez et al., 2014).
A pesar de la relevante presencia de las especies introducidas, se observa que la pesca de ambos estados también esta compuesta de especies nativas, muchas de estas compartidas entre regiones y otras, al menos en esta investigación, parecieron ser exclusivas de un estado u otro. Sin embargo, algunas de estas especies han sido reportadas tanto en Tabaco como en Chiapas. El pejelagarto (A. tropicus), la carpa herbívora (C. carpio), la castarica (M. uropthalmus), el sábalo (M. atlanticus) y la lisa (M. cephalus) (Inda-Díaz et al., 2009; Mendoza-Carranza et al., 2018a; Mendoza-Carranza et al., 2013). Estas diferencias pueden responder a cambios en los métodos de muestreo o bien a cambios de mediano plazo en la estructura de las comunidades de peces (Biswas et al., 2017; Fujiwara et al., 2019).
De acuerdo con los resultados, se puede concluir que la pesca sigue siendo una actividad relevante dentro del entramado económico de las comunidades analizadas en Tabasco, a pesar de la disminución en la tasa de captura. En contraste, en Chiapas la pesca es muy relevante como fuente de proteínas y escasamente sostiene un comercio local muy variable en el tiempo.
De acuerdo con las encuestas informales realizadas, es posible plantear la hipótesis de que los patrones de uso y manejo de los recursos pesqueros son influidos por la percepción hacia la naturaleza de los pescadores y que a su vez esta relacionada con la cultura y costumbres de cada región. Las comunidades de Chiapas tienen un mayor grado de aislamiento, lo que influye en sus percepciones de uso y manejo de recursos pesqueros, siendo diferentes a las de las comunidades pesqueras de Tabasco, donde el acceso a vías de comunicación y otras actividades económicas es más amplio, induciendo procesos de comercialización de productos pesqueros (DataMexico, 2020; Gonzalvo et al., 2015).
En este estudio se resalta el alto grado de incertidumbre que tiene la pesca de pequeña escala, lo que dificulta la comprensión de cómo interactúan todos los factores que están involucrados, no siendo posible distinguir, clasificar y mesurar fácilmente todos los factores involucrados Por ello, herramientas estadísticas intensivas como el AIC ayudan a comprender mejor la interacción de las variables socioeconómicas y pesqueras, permitiendo reconocer el comportamiento interno de las comunidades pesqueras, y entender las variaciones en la tasa de captura, los cuales varían de forma relevante en escalas espaciales y temporales pequeñas.
Los resultados de esta investigación permitieron explicar la estructura socioeconómica de las comunidades pesqueras. Se destaca a la pesca como una actividad emergente donde participan personas jóvenes que asumen roles de jefes de familia a edades tempranas. Se observó que la variación de la tasa de captura esta relacionada a múltiples factores, cambiantes en escalas de tiempo, donde la diversidad de artes de pesca y los objetivos de cada comunidad y pescador juegan un papel relevante. Es importante mencionar que a pesar de que esta investigación tuvo un abordaje múltiple, pero es necesario realizar estudios holísticos y transdiciplinarios que evalúen la condición biológica, ecológica, socoeconómica en una forma conjunta, reconociendo que la diversidad de patrones puede variar en escalas muy pequeñas de tiempo y espacio.











 nueva página del texto (beta)
nueva página del texto (beta)



