INTRODUCCIÓN
El fitoplancton es un grupo complejo de microorganismos con diferentes orígenes filogenéticos que viven en la columna de agua de ecosistemas acuáticos continentales, estuarinos y marinos. Su diversidad es tan amplia que dentro del grupo se pueden encontrar organismos tanto procariontes como eucariontes; fotosintéticos y heterótrofos e incluso mixótrofos, por lo que ocupa diferentes nichos ecológicos (Finkel et al., 2010; Litchman et al., 2012). La presencia y distribución de sus especies depende de parámetros físicos, químicos y biológicos como la temperatura, la salinidad, la presencia de nutrientes, pastoreo, entre otros (Finkel et al., 2010). En ecosistemas acuáticos como los estuarios, la composición de sus especies está relacionada con la tolerancia a las variaciones espaciales y temporales de los parámetros fisicoquímicos en diferentes escalas vinculadas con la hidrodinámica generada por la mezcla de agua marina y limnética, así como de la geomorfología del ecosistema (Reyes-Ramírez et al., 2017; Kumar et al., 2020). Por lo que el fitoplancton es considerado un indicador importante de los procesos naturales y antropogénicos (Calvo-Trujillo et al., 2018; Van Meerssche et al., 2018) que se desarrollan en las cuencas y en los ambientes costeros (Longhurst, 1981; Troccoli-Ghinaglia et al., 2004; Álvarez-Góngora et al., 2012).
Los ecosistemas costeros, principalmente tropicales, presentan una alta productividad y diversidad biológica; además proporcionan servicios ecosistémicos bien reconocidos (Herrera-Silveira & Morales-Ojeda, 2010). Un ejemplo de estos sistemas es el conformado por las lagunas El Carmen, Pajonal y La Machona, en las cuales hay una intensa actividad pesquera y de ostricultura (Tepetlan & Aldana-Aranda, 2008), así como, actividades agrícolas, extracción petrolera y forestal a sus alrededores (Bello et al., 2009). Sin embargo, este sistema lagunar ha sido fuertemente impactado desde 1975 por la apertura de la Boca de Panteones, que intensifica el efecto de las corrientes de marea en las lagunas que componen este sistema (López-Hernández et al., 1997).
Los resultados publicados en el sistema lagunar Carmen Pajonal Machona son escasos y la mayoría desactualizados (Antolí & García-Cubas, 1985; Gutiérrez-Estrada & Galaviz-Solis, 1993; Tepetlan & Aldana-Aranda, 2008; Flores-Coto et al., 2010; Campos-Campos et al., 2017). Incluso la información limitada sobre la composición y distribución de las comunidades de fitoplancton en este complejo lagunar y en los demás ecosistemas estuarinos del sur del Golfo de México (Herrera-Silveira et al., 1998; Barreiro-Güemes & Aguirre-León, 1999; Barón-Campis et al., 2005; Campos-Campos et al., 2012; Muciño-Márquez et al., 2014; Poot-Delgado et al., 2015; Muciño-Márquez et al., 2017; Ulloa et al., 2017; Herrera-Silveira et al., 2019), no aborda aspectos claves como el hecho de que es un sistema altamente productivo, con presencia de especies fitoplanctónicas potencialmente tóxicas que estén generando problemas de salud pública por el consumo de especies acuáticas. Por lo que el presente trabajo tuvo la finalidad de identificar las especies fitoplanctónicas, con especial énfasis en las potencialmente tóxicas y nocivas, su distribución en el sistema y diferencias entre dos temporadas, nortes (2015) y lluvias (2016), así como reportar los valores de las variables fisicoquímicas en los que se recolectaron las especies durante dichas temporadas. Esto permitió detectar diferencias significativas entre temporadas, tanto en la comunidad fitoplanctónica como en las variables fisicoquímicas, excepto en el oxígeno disuelto.
MATERIALES Y MÉTODOS
El sistema fluvial lagunar deltaico Carmen Pajonal Machona (CPM) está ubicado en la planicie costera de la cuenca del río Grijalva, entre los 18° 14´ y 18° 18´ N y los 93° 24´ y 93° 53´ O. El sistema recibe la descarga permanente de los ríos San Felipe y Santana y está comunicado permanentemente al sur del Golfo de México mediante dos bocas, al este la boca artificial de Panteones y al oeste el canal de Santana (Gutiérrez-Estrada & Galaviz, 1993). Para conocer las especies de fitoplancton presentes en el sistema durante la temporada de nortes del 2015 y lluvias del 2016, se establecieron tres estaciones dentro de la laguna El Carmen, tres en La Machona y una dentro de Pajonal, que conecta ambas lagunas, lo que suma siete estaciones muestreadas en diciembre en 2015 y en octubre de 2016 (Fig. 1).
Con el fin de estimar la variabilidad de los parámetros fisicoquímicos se midieron in situ, a nivel de superficie y fondo, la temperatura del agua, la salinidad, el pH y el oxígeno disuelto (OD) con una sonda multiparamétrica EXO 2 marca YSI así como una sonda YSI DO-200, un potenciómetro digital HM PH-200 HM y un refractómetro. Todo el equipo fue calibrado un día antes de los muestreos según lo indicado por los fabricantes.
Las muestras se realizaron mediante una red con luz de malla de 20 µm, a una profundidad que varió de acuerdo con la profundidad de cada estación. Las muestras una vez recolectadas se fijaron con formol al 4%. En el laboratorio, las muestras fueron analizadas con un microscopio compuesto Carl Zeiss con los objetivos 20X, 40X y 63X, en campo claro, campo oscuro y contraste de fase. Para la identificación de las especies se utilizó literatura especializada (Cupp, 1943; Rampi & Bernhard, 1980; Balech, 1988; Tomas, 1997; Komárek & Anagnostidis, 1999; Sivone & Jones, 1999; Komárek & Anagnostidis, 2005; Esqueda-Lara & Hernández-Becerril, 2010). Los primeros 300 organismos se contabilizaron para obtener las abundancias relativas. La riqueza específica y el índice de diversidad de Shannon H (Log2) se calcularon para cada estación.
Para identificar diferencias entre las dos épocas climáticas se realizó un análisis no paramétrico con la prueba U de Mann-Whitney, puesto que tres de las cuatro variables fisicoquímicas, a pesar de la transformación logarítmica (x+1), no cumplieron con los supuestos de normalidad de acuerdo con la prueba Shapiro-Wilk, W= ≈1, p<0.05 (Zar, 1997). La variación entre niveles y épocas climáticas fue representada con diagramas de caja y bigote Salgado-Ugarte et al., 2005). . Con el fin de determinar la importancia de las variables fisicoquímicas sobre la distribución del fitoplancton se realizó un procedimiento sobre la distribución del fitoplancton se realizó un procedimiento BEST (BIO-ENV Stepwise; Clarke & Gorley, 2006) para identificar aquellas más correlacionadas. Además, se realizó un análisis de redundancia basado en distancias (dbRDA) para explorar la relación entre la matriz de riqueza de especies (variables respuesta) con las variables fisicoquímicas como variables predictivas (Muylaert et al., 2009). Estos análisis se realizaron en los programas STATISTICA 13 y PERMANOVA + for PRIMER-e V.6 (TIBCO-Software 2017; Anderson et al., 2008).
RESULTADOS
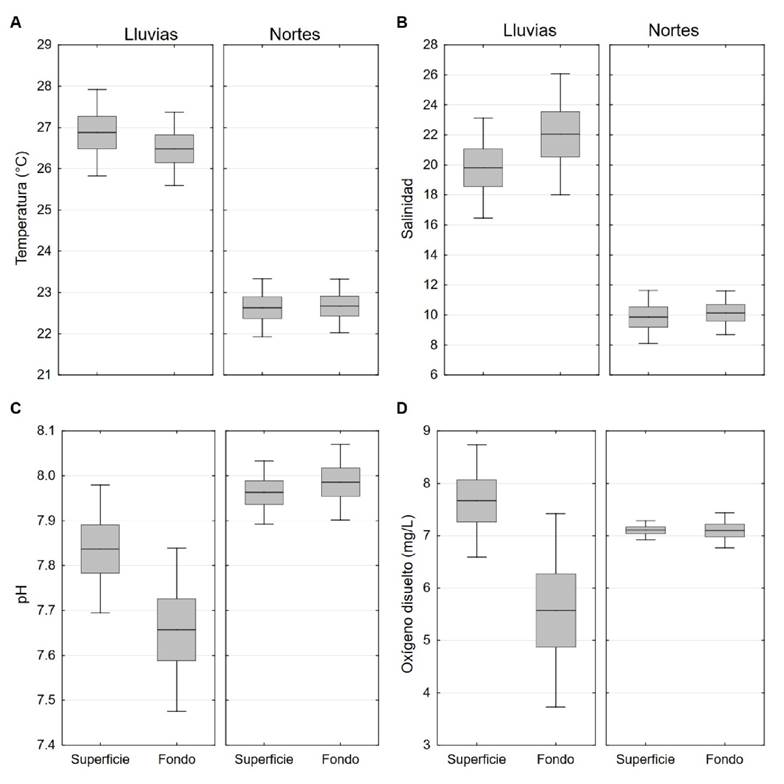
Variación ambiental. Los valores de la temperatura, la salinidad y el pH resultaron significativamente diferentes (U = 0; p = 0.00001; U = 25.5, p = 0.00094) entre las temporadas de nortes y lluvias (Tabla 1 y 2, Fig. 2). La temperatura presentó valores desde 22 hasta 23.8 °C durante nortes y máximos durante lluvias, 25.2 hasta 28.6 °C. La salinidad mínima se registró en nortes (desde 7 a 12) y máxima en lluvias (15.36 a 26.79). El pH fluctuó de 7.41 a 8 en lluvias a 7.9 a 8 en nortes. En contraste, la variación del oxígeno disuelto (OD) que fue de 6.9 a 7.8 mg L-1 en nortes y de 2.86 a 9.77 mg L-1 en lluvias, no fue significativamente diferente (U = 87, p = 0.63) entre temporadas, mientras que el pH resultó al igual que la temperatura y la salinidad estadísticamente diferente entre las dos temporadas (U = 25.5, p = 0.00094) con un intervalo de 7.9 a 8.11 en nortes y 7.41 a 8 en lluvias (Tabla 1 y 2).
Tabla 1 Resumen estadístico de las variables fisicoquímicas durante nortes (2016) y lluvias (2015).
| Época/Nivel | Temperatura (°C) | Salinidad (ups) | Oxígeno (mg/L) | pH | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Media | DE | Min | Max | Media | DE | Min | Max | Media | DE | Min | Max | Media | DE | Min | Max | ||||
| Nortes | 22.65 | 0.7 | 22 | 24 | 10 | 1.6 | 7 | 12 | 7.1 | 0.3 | 6.9 | 7.8 | 7.97 | 0.1 | 7.9 | 8.1 | |||
| Superficie | 22.63 | 0.7 | 22 | 24 | 9.86 | 1.8 | 7 | 12 | 7.1 | 0.2 | 6.9 | 7.3 | 7.96 | 0.1 | 7.9 | 8.1 | |||
| Fondo | 22.67 | 0.6 | 22 | 23 | 10.14 | 1.5 | 8 | 12 | 7.1 | 0.3 | 6.9 | 7.8 | 7.99 | 0.1 | 7.9 | 8.1 | |||
| Lluvias | 26.68 | 1 | 25 | 29 | 20.92 | 3.7 | 15 | 27 | 6.62 | 1.8 | 2.9 | 9.8 | 7.75 | 0.2 | 7.4 | 8.1 | |||
| Superficie | 26.88 | 1.1 | 25 | 29 | 19.8 | 3.3 | 15 | 25 | 7.66 | 1.1 | 6.6 | 9.8 | 7.84 | 0.1 | 7.7 | 8.1 | |||
| Fondo | 26.48 | 0.9 | 26 | 28 | 22.05 | 4 | 16 | 27 | 5.57 | 1.8 | 2.9 | 7.6 | 7.66 | 0.2 | 7.4 | 8 | |||
Tabla 2 Test U de Mann-Whitney sobre las variables físico químicas entre épocas climáticas.
| Variable | Suma de rangos | U | p-value | Z | |
|---|---|---|---|---|---|
| Diciembre 2015 | Octubre 2016 | ajustado | |||
| Temp | 105 | 301 | 0 | 0.00001 | 4.5 |
| Sal | 105 | 301 | 0 | 0.00001 | 4.5 |
| OD | 214 | 192 | 87 | 0.63 | -0.48 |
| pH | 275.5 | 130.5 | 25.5 | 0.00094 | -3.33 |
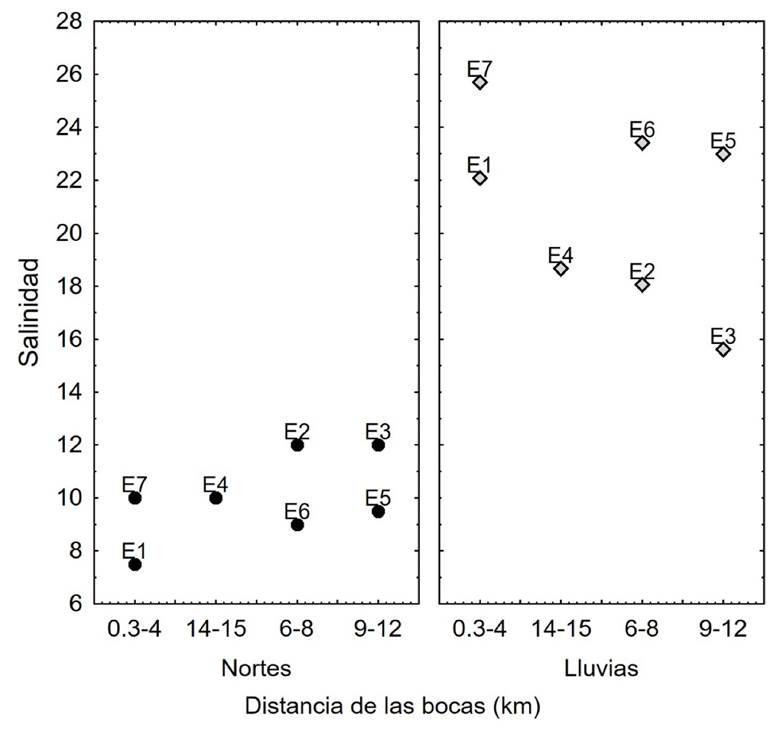
La temperatura varió máximo 3.4 °C en lluvias sin alguna tendencia espacial, mientras que el pH mostró valores máximos cercanos a las dos bocas. El máximo valor de salinidad se presentó cerca de la boca de Santana en nortes y en ambas bocas en lluvias, a 4 (E1, boca de Santana) y 0.3 km (E7, boca Panteones), respectivamente. El oxígeno disuelto resultó similar en todas las estaciones en nortes, pero en lluvias el valor mínimo se registró en la estación ubicada en Boca de Santana (2.86 mg L-1) (Tabla 2, Fig. 2).
Fitoplancton. Las especies registradas fueron en total 86, pertenecientes a 39 géneros y cuatro grupos taxonómicos: Bacillariophyta (diatomeas), Cyanoprokaryota (cianobacterias), Chlorophyta (clorofitas) y Dinophyta (Dinoflagellata) (Tabla 3). De éstos, el grupo más representativo fue el de Bacillariophyta con 55 especies, seguido por Dinoflagellata con 17, Cyanoprokaryota con 11 especies y por último las Chlorophyta con tres especies. De las 86 especies registradas diez son nuevos registros y 11 son potencialmente tóxicas y cinco potencialmente nocivas por su capacidad de producir Florecimientos Algales Nocivos (FANs).
Tabla 3 Distribución de especies en el sistema lagunar Carmen, Pajonal Machona, Tabasco. 1) Carmen, 2) Carmen Centro, 3) Carmen Pajonal, 4) Pajonal Centro, 5) Pajonal Machona, 6) Machona Centro y 7) Boca Panteones. * Géneros y especies potencialmente tóxicos, ° nocivo, ● Nuevo registro.M marina, D dulceacuícola, P planctónica, B bentónica, s estuarina.
| Estaciones | Estaciones | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diciembre 2015 | Octubre 2016 | ||||||||||||||
| Bacillariophyta | E2 | E3 | E4 | E5 | E6 | E7 | E1 | E2 | E3 | E4 | E5 | E6 | E7 | ||
| M PActinocyclus normanii(W.Gregory ex Greville) Hustedt | X | ||||||||||||||
| M BActinocyclus senarius Ehrenberg | X | X | X | X | |||||||||||
| D M BAmphorasp. 1 | X | ||||||||||||||
| M PBacteriastrum delicatulum Cleve | X | X | |||||||||||||
| M PBacteriastrum hyalinum Lauder | X | ||||||||||||||
| S BCaloneis permagna(Bailey) Cleve | X | ||||||||||||||
| M PCerataulina pelagica Cleve | X | X | |||||||||||||
| M PChaetoceros affinis Lauder | X | ||||||||||||||
| M PChaetoceros diversus Ehrenberg | X | ||||||||||||||
| M PChaetoceros lorenzianus Grunow | X | ||||||||||||||
| M PChaetoceros subtilis Cleve | X | X | |||||||||||||
| M PCoscinodiscus asteromphalus Ehrenberg | X | ||||||||||||||
| °M PCoscinodiscus centralis Ehrenberg | X | X | X | X | X | X | |||||||||
| M PCoscinodiscus granii L.F.Gough | X | ||||||||||||||
| M PCoscinodiscus radiatus Ehrenberg | X | X | X | X | X | X | X | ||||||||
| M PCoscinodiscus wailesii Gran & Angst | X | ||||||||||||||
| D B Cyclotella sp. | X | ||||||||||||||
| °M P Cylindrotheca closterium (Ehrenberg) Reimann & J. C. Lewin | X | X | |||||||||||||
| D P Diatoma cf.elongatum (Lyngbye) C.Agardh | X | ||||||||||||||
| M B Diploneis cabro (Ehrenberg) Ehrenberg | X | X | X | X | |||||||||||
| M B Diploneis gruendleri (A. W. F. Schmidt) Cleve | X | ||||||||||||||
| D M B Diploneis sp. | X | X | X | X | |||||||||||
| M P Ditylum brightwellii (T.West) Grunow | X | X | X | X | X | ||||||||||
| M P Entomoneis alata(Ehrenberg) Ehrenberg | X | X | |||||||||||||
| M P Entomoneis sp. | X | ||||||||||||||
| M B Fragillaria sp. | X | ||||||||||||||
| ●M B Gramatophora marina (Lyngbye) Kützing | X | ||||||||||||||
| M B Gyrosigma balticum (Ehrenberg) Rabenhorst | X | X | X | X | X | X | X | ||||||||
| M B Gyrosigma fasciola (Ehrenberg) J.W.Griffith & Henfrey | X | X | |||||||||||||
| M B Gyrosigma sp. | X | X | X | X | X | ||||||||||
| M B Lyrella lyra (Ehrenberg) Karayeva | X | X | X | ||||||||||||
| M B Navicula distans (W.Smith) Brébisson | X | X | |||||||||||||
| B Navicula sp. | X | ||||||||||||||
| D B Nitzschia linearis W.Smith | X | ||||||||||||||
| °D B Nitzschia sigmoidea (Nitzsch) W.Smith | X | X | X | X | X | ||||||||||
| D B Nitzschia sp. | X | ||||||||||||||
| M B Odontella aurita (Lyngbye) C.Agardh | X | X | X | ||||||||||||
| M B Paralia sulcata(Ehrenberg) Cleve | X | ||||||||||||||
| D P Pinullaria nobilis(Ehrenberg) Ehrenberg | X | X | X | X | |||||||||||
| M B Plagiogrammopsis vanheurckii (Grunow) Hasle, Stosch & Syvertsen | X | X | X | ||||||||||||
| ●M B Plagiotropis arizonica Czarnecki & Blinn | X | ||||||||||||||
| M B Pleurosigma aestuarii (Brébisson ex Kützing) W.Smith | X | X | X | X | |||||||||||
| M B Pleurosigma angulata (J.T.Quekett) W.Smith | X | ||||||||||||||
| ●M P Rhizosolenia imbricata Brightwell | X | ||||||||||||||
| M P Skeletonema costatum (Greville) Cleve | X | X | X | X | |||||||||||
| D B Surirella ovalis Brébisson | X | X | |||||||||||||
| D B Tabellaria sp. | X | X | X | ||||||||||||
| M P Thalassionema frauenfeldii (Grunow) Tempère & Peragallo | X | X | |||||||||||||
| M P Thalassionema nitzschioides (Grunow) Mereschkowsky | X | X | |||||||||||||
| M P Thalassiosira eccentrica (Ehrenberg) Cleve | X | X | X | X | X | X | X | ||||||||
| M P Thalassiosira lineata Jousé | X | ||||||||||||||
| M P Thalassiosira sp. | X | X | X | X | |||||||||||
| M B Trachyneis aspera(Ehrenberg) Cleve | X | X | |||||||||||||
| M P Trieres mobiliensis (Bailey) Ashworth & E. C. Theriot | X | ||||||||||||||
| D B Ulnaria ulna (Nitzsch) Compère | X | X | |||||||||||||
| Chlorophyta | |||||||||||||||
| D B Closterium ehrenbergii Meneghini ex Ralfs | X | ||||||||||||||
| D P Closterium lineatum Ehrenberg ex Ralfs | X | ||||||||||||||
| D B Eudorina elegans Ehrenberg | X | ||||||||||||||
| Dinophyta (Dinoflagellata) | |||||||||||||||
| *●M P Alexandrium monilatum (J.F.Howell) Balech | X | X | X | X | X | X | |||||||||
| *M P Dinophysis caudata W.S.Kent | X | X | X | ||||||||||||
| °●M P Gonyaulax diegensis Kofoid | X | X | X | ||||||||||||
| °M P Gonyaulax polygramma F.Stein | X | ||||||||||||||
| *M P Gonyaulax spinifera (Claparède & Lachmann) Diesing | X | X | X | ||||||||||||
| °●M P Gonyaulax turbynei Murray & Whitting | X | X | |||||||||||||
| M P Gonyaulax sp. | X | ||||||||||||||
| M P Prorocentrum micans Ehrenberg | X | X | |||||||||||||
| ● M P Prorocentrum scutellum B.Schröder | X | X | X | X | X | ||||||||||
| *M P Protoperidinium crassipes (Kofoid) Balech | X | X | |||||||||||||
| M P Protoperidinium pentagonum (Gran) Balech | X | X | |||||||||||||
| *M P Pyrodinium bahamenseL.Plate | X | X | |||||||||||||
| M P Pyrophacus horlogium F.Stein | X | X | X | X | |||||||||||
| M P Scrippsiella sp. | X | ||||||||||||||
| M P Tripos hircus (Schröder) F.Gómez | X | X | X | X | X | X | X | X | X | X | X | X | |||
| M P Tripos macroceros (Ehrenberg) Hallegraeff & Huisman | X | X | |||||||||||||
| M P Tripos muelleri Bory | X | ||||||||||||||
| Cyanoprocaryota | |||||||||||||||
| ●D P Dolichospermum smithii (Komárek) Wacklin, L.Hoffmann & Komárek | X | ||||||||||||||
| D P Dolichospermum sp. | X | X | |||||||||||||
| D B Komvophorum schmidlei K.Anagnostidis & J.Komárek | X | ||||||||||||||
| *D P Limnospirafusiformis (Voronichin) Nowicka-Krawczyk, Mühlsteinová & Hauer | X | X | |||||||||||||
| D B Merismopedia glauca (Ehrenberg) Kützing | X | ||||||||||||||
| D B Merismopedia elegans A.Braun ex Kützing | X | ||||||||||||||
| *D B Oscillatoria princeps Vaucher ex Gomont | X | ||||||||||||||
| *D B Oscillatoria limosaC.Agardh ex Gomont | X | ||||||||||||||
| *D B Phormidium sp. | X | X | X | ||||||||||||
| *●D P Plankthotrix rubescens (De Candolle ex Gomont) Anagnostidis & Komárek | X | ||||||||||||||
| *●D P Sphaerospermopsis aphanizomenoides (Forti) Zapomelová, Jezberová, Hrouzek, Hisem, Reháková & Komárková | X | ||||||||||||||
Durante la temporada de nortes 60 especies estuvieron presentes y durante las lluvias fueron 39. Las diatomeas presentaron 44 especies en nortes y 21 en lluvias, mientras que los dinoflagelados se registraron con más especies en lluvias (16) que en nortes (3). En contraste, las Cyanoprokaryota estuvieron mejor representadas en nortes con 10 especies y en lluvias solo se encontraron tres, mientras que, las Chlorophyta (3) solamente se presentaron en nortes. Esta riqueza específica encontrada presentó diferencias significativas, por lo que la temporada de nortes tuvo significativamente mayor riqueza.
La máxima diversidad total se presentó durante nortes y la mínima en lluvias en todas las estaciones excepto, en la estación cercana a la Boca de Santana (E1) (Fig. 4 B). Las Bacillariophyta fueron las más diversas en ambas temporadas alcanzando valores de hasta 2.57 bits/ind en nortes y 2.85 bits/ind en lluvias. En cambio, los Dinoflagellata solo presentaron una especie Tripos hircus (Schröder) F. Gómez con abundancia, por lo que el índice de diversidad fue cero en nortes. En lluvias los dinoflagelados registraron hasta 1.44 bits/ind (Tabla 4).

Figura 4 Riqueza de especies (A) e Índice de diversidad de Shannon H´ (B) por estación de muestreo en cada temporada climática para CPM.
Tabla 4 Índice de diversidad de Shannon H(Log2) por grupo taxonómico en cada estación de muestreo y temporada climática para CPM.
| Diciembre 2015 | Octubre 2016 | |||||
|---|---|---|---|---|---|---|
| Estaciones | Diatomeas | Dinoflagelados | Cianobacterias | Diatomeas | Dinoflagelados | Cianobacterias |
| E1 | 2.52 | 0 | 0.99 | 1.86 | 1.49 | 0 |
| E2 | 2.08 | 0 | 0 | 0 | 0.72 | 0 |
| E3 | 2.18 | 0 | 0 | 1.09 | 0.97 | 0 |
| E4 | 1.44 | 0 | 0 | 0.76 | 0.32 | 0 |
| E5 | 1.98 | 0 | 0 | 1.92 | 0.57 | 0 |
| E6 | 2.57 | 0 | 0 | 0.95 | 0.62 | 0 |
| E7 | 2.44 | 0 | 0 | 1.68 | 0.61 | 0 |
En nortes sobresalieron seis especies (las Cyanoprokaryota: Limnospira fusiformis (Voronichin) Nowicka-Krawczyk, Mühlsteinová & Hauer, Dolichospermum smithii (Komárek) Wacklin, L. Hoffmann & Komáreky Phormidium sp.; las Bacillariophyta: Coscinodiscus sp.,Gyrosigma balticum (Ehrenberg) Rabenhorst, Thalassiosira eccentrica (Ehrenberg) Cleve por sus mayores abundancias relativas, mientras que en lluvias solamente fueron dos especies, T. hircus y Alexandrium monilatum (J. F. Howell) Balech. Por lo que la composición específica y abundancia de los principales grupos fitoplanctónicos variaron de un muestreo a otro, en función de las variables ambientales estudiadas (Fig. 5 A).
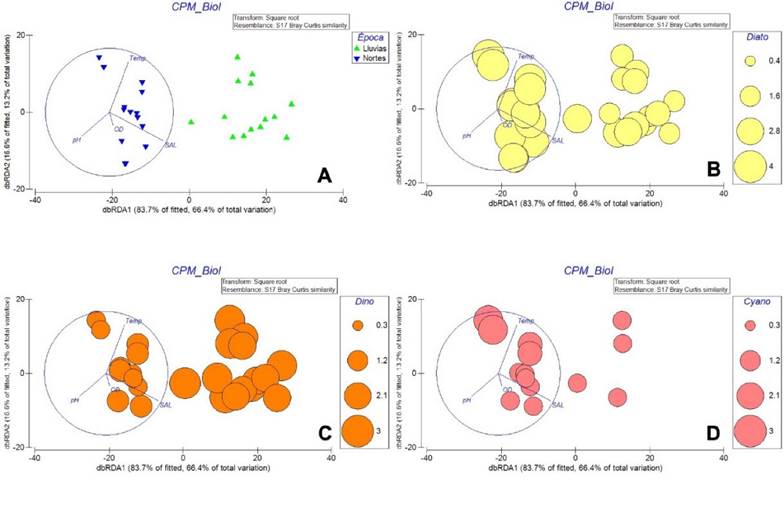
Figura 5 Análisis de redundancia dbRDA sobre la riqueza específica del fitoplancton y las variables físico químicas en el sistema CPM. Las imágenes son originales de este trabajo y sus autores.
Cabe mencionar que en ambas temporadas el mayor número de especies se presentó en las bocas: E1 (25 en nortes y 19 en lluvias) y E7 (20 en nortes y 14 en lluvias) (Fig. 4 A). En la laguna El Carmen se identificaron un total de 61 especies (39 en nortes y 31 en lluvias), seguida por la laguna La Machona con 51 especies en total (34 en nortes y 24 en lluvias) y el canal Pajonal con sólo 25 (16 especies en nortes y 12 en lluvias).
El análisis BEST mostró que la temperatura, la salinidad y el pH fueron las variables que explicaron la mayoría de las variaciones en la comunidad fitoplanctónica al presentar una correlación de Spearman p = 0.621 (p˂0.01). El análisis dbRDA reveló que la composición del fitoplancton es diferente entre épocas climáticas al presentarse bien separadas en la ordenación (Figura 5 A)
El análisis dbRDA, explicó el 80% de la varianza total en los dos primeros ejes, la temperatura y salinidad se asociaron positivamente con el primer eje definiendo las condiciones ambientales durante la época de lluvias y en contraste, el oxígeno disuelto y el pH determinaron las condiciones de la época de nortes. Las Bacillariophyta y Cyanoprokaryota presentaron su mayor riqueza durante los nortes, mientras que los dinoflagelados se favorecieron de las condiciones desarrolladas en lluvias (Fig. 5 B-D).

Figura 6 Nuevos registros para Carmen Pajonal Machona, a) Plagiotropis arizonica, b) Rhizosolenia imbricata, c) Grammatophora marina, d) Alexandrium monilatum, e) Gonyaulax diegensis, f) G. turbynei, g) Planktothix rubescens, h) Prorocentrum scutellum, i) Dolichospermum smithii, j) Sphaerospermopsis aphanizomenoides. Las imágenes son de autoría propia.
DISCUSIÓN
Variables fisicoquímicas. En lagunas costeras como el complejo CPM, la variación de la temperatura está determinada por la variación de la temperatura ambiental según la época climática (Varona-Cordero et al., 2014) y se acentúa debido a su poca profundidad (Lloret et al., 2008). En general, en el Golfo de México (GM) la estacionalidad climática se describe en tres periodos definidos: secas, lluvias y nortes. En Tabasco, las épocas de secas y lluvias de 2016 presentaron una temperatura ambiental similar (26.21±1.39 y 26.87±1.52°C, CONAGUA, 2020) lo que explica que en lluvias se registraran las máximas temperaturas, debido a que fue el resultado del incremento en la radiación solar y al constante flujo de calor desde la atmosfera (Salas-Pérez & González-Gándara, 2016; Rosas-Valdez et al., 2019).
El incremento de la salinidad se relaciona con el incremento en la radiación solar y la evaporación (Mier-Reyes et al., 1997), dado a que octubre de 2016 la precipitación fue escasa y la radiación solar se mantuvo ante la escasez de nubes, es que las máximas salinidades fueron registradas en la temporada de lluvias. En adición, la comunicación permanente con el mar a través de las bocas de los sistemas Carmen y Machona contribuyó a mantener una salinidad alta (Pereira-Coutinho et al., 2012; García-Oliva et al., 2019).
En cuanto a la salinidad obtenida, se encontró que la temporalidad climatológica ejerció gran influencia al encontrar que ésta fluctuó menos (5) en nortes que en lluvias (11) (Tabla 1). Esta diferencia de salinidad entre temporadas pudo deberse a la intensidad de lluvias en cada año; ya que en la cuenca del río Grijalva durante 2015, los meses de octubre y noviembre se encontraron por arriba de la normal registrando valores de 135.80 y 174.50 mm, respectivamente, y un valor acumulado de 278.80 mm durante el mes de diciembre de 2015 (estación 27074-Cardenas ubicada a ≈12 km al sur del sistema CPM; CICESE, 2020) mientras que el año 2016 presentó una anomalía negativa en la precipitación, recibiendo durante el mes de octubre apenas 49.2 mm de precipitación (CONAGUA, 2020).
Este déficit en la precipitación durante octubre 2016 provocó que la salinidad en el sistema CPM se mantuviera alta (20.92), condición que ya había sido reportada con anterioridad por Reséndez-Medina (1979), pero que no impidió una distribución vertical de la salinidad en la columna de agua correspondiente a la de un estuario directo (Bridgewater, 2007; Cardoso-Mohedano et al., 2020). Sin embargo, sí influyó para que las especies de fitoplancton con mayor afinidad a bajas salinidades no estuvieran y en cambio dominaran dos especies de dinoflagelados (T. hircus y A. monilatum), tolerantes a condiciones polihalinas y euhalinas.
La salinidad durante la temporada de nortes presentó valores mínimos en E1, estación cercana a la boca del El Carmen y al arroyo Chicozapote (Fig. 1), mientras que los valores máximos de salinidad durante la temporada de lluvias fueron en dicha estación (E1) así como en la E7 ubicada en boca Panteones, siendo en la estación El Carmen ligeramente menor a la de Boca Panteones. Además, se presentó una ligera cuña salina en ambas bocas (Tabla 1). Los valores obtenidos reflejan condiciones mesohalinas y polihalinas, las cuales ya habían sido registradas en 2005 para el sistema (Cruz-Córdova, 2005), además en 2012 una condición mesohalina fue reportada para la laguna El Carmen y una condición euhalina para la laguna La Machona frente a la Boca Panteones (>30) (Carrillo-Alejandro et al., 2012). Por otro lado, en 1977 se registraron condiciones polihalinas (>18) con anomalía negativa en la precipitación (Reséndez-Medina, 1979; CONAGUA, 2016) similar a la presentada durante la temporada de lluvias de este estudio. Esta dilución de la salinidad por la precipitación y escorrentía de agua epicontinental en el sistema CPM no es un fenómeno recientemente descubierto y ha sido ampliamente observado en otros ambientes costeros del Golfo de México (López-Portillo et al., 2017; Morelos-Villegas et al., 2018; Torres et al., 2018).
Referente al pH y el OD, el primero presentó valores significativamente diferentes entre temporadas y dentro de lo reportado para el sistema (Cruz Córdova, 2005; Instituto Nacional de Pesca, 2018). Los intervalos del pH variaron desde 7.9 a 8.1 en nortes y 7.4 a 8 en lluvias, con valores máximos tanto de superficie como de fondo en Boca Panteones en temporada de lluvias reflejando la influencia del mar en la zona. El OD presentó valores de 6.9 mg L-1 a 7.8 mg L-1 en nortes y 2.8 mg L-1 a 9.7 mg L-1 en lluvias (Tabla 1), sin embargo, estas diferencias no fueron significativas para las diferentes temporadas estudiadas (Tabla 2, Fig. 2).
Fitoplancton. Los estudios referentes a la abundancia y diversidad de fitoplancton en las lagunas costeras del sureste mexicano comunicadas con del Golfo de México son escasos y en su mayoría desactualizados (Herrera-Silveira et al., 1998, 2019; Barreiro-Güemes & Aguirre-León, 1999; Barón-Campis et al., 2005; Campos-Campos et al., 2012, 2017; Poot-Delgado et al., 2015; Muciño-Márquez et al., 2014, 2017; Ulloa et al., 2017). La información limitada sobre las comunidades fitoplanctónicas de estos sistemas altamente productivos deja sin resolver el potencial daño que pueden llegar a generar éstas, sobre todo en las actividades pesqueras y ostricultura del área, ante la presencia de especies potencialmente tóxicas y nocivas, así como sus implicaciones en la salud pública por el consumo de producto pesquero contaminado, situación que podría presentarse en los demás ecosistemas de la región. Por lo que el presente estudio es una actualización de estudios sobre comunidades de fitoplancton para las lagunas costeras de la región y uno de los sistemas lagunares costeros más grandes del sureste mexicano con presión antropogénica por descargas residuales, actividad agrícola, petrolera y forestal que incrementan la vulnerabilidad del socioecosistema.
El fitoplancton del sistema lagunar de CPM estuvo dominado por especies de los grupos taxonómicos Bacillariophyta y Dinoflagellata, lo que resulta similar a lo reportado para otras lagunas costeras del sur del Golfo de México (De la Lanza & Gómez Aguirre, 1999; Campos-Campos, 2012; Poot-Delgado et al., 2015; Salcedo-Garduño et al., 2019) y en menor grado con las del norte del Golfo de México, según lo registrado por Quinlan & Phlips. (2007) y Badylak et al., (2007). Esta diferencia entre regiones está marcada especialmente por los florecimientos algales frecuentes de Karenia brevis (C. C. Davis) Gert Hansen & Moestrup (Dragovich & Kelly, 1964; Steidinger & Williams, 1970), Pyrodinium bahamense L. Plate, Karlodinium veneficum (D. Ballantine) J. Larsen y Pseudo-nitzschia pungens (Grunow ex Cleve) Hasle (Florida Fish and Wildlife Conservation Commission, 2020) que se presentan en dicha región disminuyendo la diversidad fitoplanctónica del área.
El sistema CPM presentó 47 especies exclusivas en temporada de nortes, de éstas 93% fueron diatomeas. Este elevado porcentaje coincide en que es el doble de las especies capturadas en lluvias, siendo 44 para nortes y 21 para lluvias. En contraste, los dinoflagelados fueron más representativos en lluvias (16) que en nortes (3) (Tabla 3), lo cual es entendible dado a que las especies registradas de este grupo son eurihalinas: Prorocentrum micans Ehrenberg (salinidades: 10-35) (Mahoney & McLaughlin, 1979), Tripos hircus (salinidades: 13-35) (Guerra-Martínez & Lara-Villa, 1996) y Protoperidinium crassipes (Kofoid) Balech (de 6-36) (Balech, 1988; Behera et al., 2012); sumado a que es un grupo con poca tolerancia a la turbulencia (Margalef, 1978; Margalef et al., 1979; Estrada & Berdalet, 1998) generada por los vientos de la temporada, aunque existen especies tolerantes a dicho factor (Smayda, 2002).
Por otro lado, las Cyanoprokaryota estuvieron mejor representadas en nortes con 10 especies, mientras que, en lluvias solo se capturaron tres especies de dicho grupo; y las Chlorophyta (3) solamente se presentaron en nortes (Tabla 3). Esto debido a la presencia de mezcla en la columna de agua, ya que de las 14 especies de ambos grupos (Cyanoprokaryota y Chlorophyta), ocho son de hábitos bentónicos y seis son planctónicos (Tabla 3).
La mayor riqueza específica se presentó en las dos bocas de cada laguna y por tanto con mayor influencia marina: Boca de Santa Ana o E1 y Boca Panteones o E7 (Fig. 3). La laguna con más especies fue la laguna el Carmen con 61 especies en total (10 tóxicas), mientras que La Machona presentó 51 especies en total (7 tóxicas). Del total de las especies reportadas para la laguna El Carmen, nueve especies potencialmente tóxicas no habían sido registradas, ya que sólo se había identificado a las especies de D. caudata, P. bahamense, y organismos de los géneros Alexandrium, Oscillatoria y Pseudo-nitzschia (Campos-Campos et al., 2017). Además, en el presente estudio se registró a la especie Tripos furca (Ehrenbeg) F. Gómez, reportada por Campos-Campos et al. (2017) como potencialmente nociva, aunque la fotografía publicada por estos autores en realidad corresponde a T. hircus.
Con relación a las abundancias relativas de las especies, ocho presentaron las abundancias relativas mayores; seis para la temporada de nortes y dos para la de lluvias. Para la temporada de nortes las dominantes fueron del grupo de las Cyanoprokaryota y Bacillaryophyta. Limnospira fusiformis (45.3%) y Dolichospermum smithii (40.6%) fueron las dominantes para E1, Gyrosigma balticum para E2 (40.3) y E5 (41%), y Coscinodiscus sp. para E3 (36.6%), Thalassiosira eccentrica para E4, y Phormidium sp. para E6 y E7; mientras que para la de lluvias lo fueron del grupo Dinoflagellata: T. hircus para E1 (31.6%), E2 (88.6%), E3 (79%) y E4 (80.6%) y Alexandrium monilatum para E5 (82.5%), E6 (87.6%) y E7 (81.3), lo que refuerza la hipótesis de que el comportamiento de los principales grupos taxonómicos fitoplanctónicos se corresponde con las variables ambientales.
Como es de esperarse, la dominancia presentada de las especies se vio reflejada en el índice de diversidad de Shannon calculada en cada temporada y en cada sitio, ya que los valores mayores se presentaron en su mayoría en la temporada de nortes (desde 1.69 bits/ind hasta 2.27 bits/inds) a pesar de que el valor máximo de dicho índice se presentó en lluvias (2.85 bits/ind) (Fig. 4). La baja diversidad calculada en lluvias y la abundancia elevada de T. hircus y A. monilatum consideradas potencialmente nocivas por su capacidad de producir FANs, hace pensar la posibilidad de haber existido Florecimientos en el momento de recolecta, uno de T. hircus cuya extensión incluyó tres estaciones (E2, E3 y E4) y otro de A. monilatum que también incluyó tres estaciones (E5, E6 y E7) donde dominaron con abundancias ≥ 79% (Tabla 4). Ambas especies reportadas en altas densidades para el sur del Golfo de México (Guerra-Martínez & Lara-Villa, 1996; Poot-Delgado et al., 2015). Sin embargo, las muestras de red no se encuentran consideradas dentro de los métodos para la detección de FAN (Intergovernmental Oceanographic Commission of UNESCO, 2010).
T. hicus es una especie que se ha encontrado en abundancias altas (14 640 Cél L-1) con abundancias relativas desde 6 hasta 97% en laguna Sontecomapan en el sur del Golfo de México (Guerra-Martínez & Lara-Villa, 1996). Debido a que en el pasado fue considerada una variedad de T. furca y a que en pocas ocasiones se reportaron las variedades es que pudiera ser que algunos florecimientos registrados de esta especie en la región se tratasen de T. hircus, incluido el florecimiento de T. furca para El Carmen mencionado por Mier-Terán et al., (2006). Por otro lado, A. monilatum es potencialmente tóxica y nociva por su capacidad de formar FANs y producir toxinas hemolisinas con propiedades neuroactivas (Landsberg, 2002; Juhl, 2005). La gonyautoxina, es producida por dicha especie y es muy dañina para peces (Anderson et al., 2012).
Las especies potencialmente tóxicas presentes en el sistema, en su conjunto, pueden producir las toxinas: hemolisina, ácido okadaico (D. caudata), anatoxina (D. smithii, L. fusiformis, P. rubescens), azaspirácidos (P. crassipes, hospedero), cilindrospermopsina, dinophysistoxina (D. caudata), microcystina (L. fusiformis, O. princeps, O. limosa, P. rubescens, S. aphanizomenoides y los géneros Dolichospermum y Phormidium,),pectenotixina (D. caudata), saxitoxina (P. bahamense, géneros Dolichospermum y Phormidium) y yesotoxina (G. spinifera) (Taylor et al., 1995; World Health Organization, 1999; Dortch, 2002; Landsberg, 2002; Rhodes et al., 2006; Moestrupet al., 2009; Reguera et al., 2014; Cirés & Ballot, 2016; Li et al., 2016). Hasta el momento solo se ha reportado la presencia de saxitoxina en tejido recolectado de bancos de ostión de El Carmen, aunque en cantidad inferior al límite máximo permisible en molusco (Mier-Terán et al., 2006). Por lo que se considera imprescindible que la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) continúe el monitoreo de las especies y sus toxinas para alertar a la población (conformada por 2380 habitantes, aproximadamente) de posibles daños a su salud o afectación a las actividades productivas y por tanto a su economía ante la posible generación de FANs.
Entre las diez especies reportadas por primera vez para el área (Fig. 6) se encuentra A. monilatum la cual no se descarta su presencia en CPM con anterioridad debido al reporte de Alexandrium sp. por Campos-Campos et al., (2017). Otro nuevo registro para el sistema lagunar es el dinoflagelado Prorocentrum scutellum B. Schröder. La morfología de esta especie presenta semejanza a la de Prorocentrum micans Ehrenberg. Lo que hace posible que se encontrara en el sistema lagunar desde tiempo atrás pero no había sido reportada, muy posiblemente, por confundirla con P. micans. P. scutellum es considerada una especie marina aunque en este estudio se presentó en condiciones mesohalinas (15.36-17 ups) y polihalinas (18-24.69), desde la laguna El Carmen hasta laguna La Machona. Otros autores ya la han reportado en condiciones de baja salinidad en lagunas costeras mediterráneas de España (Comín et al., 1991), Egipto (Touliabah et al., 2002), Turquía y Grecia (Roselli et al., 2013), considerándola una especie estuarina.
Las características ecológicas de estas especies son relativamente diferentes, mientras que T. hircus es una especie de amplio rango de tolerancia a la temperatura y salinidad, A. monilatum tiene, al parecer, un intervalo de tolerancia más estrecho pues se le ha registrado en temperaturas de 25 a 28°C y salinidades de 20 a 35 (Calvo et al., 2005; Juhl, 2005; Virginia Institute of Marine Science, 2020), con inhibición de crecimiento a partir de salinidades de 15 (Juhl, 2005). Por lo que las salinidades presentadas en Carmen Centro (E2) de 18 y Carmen Pajonal (E3) de 15.36 y 15.33 (Fig. 4) podrían ser el motivo de la ausencia de A. monilatum en dichas estaciones.
Dada la presencia de dos especies fitoplanctónicas dominantes por arriba del 80 % de abundancia relativa y la baja concentración de oxígeno disuelto en agua, se considera que ambas variables podrían tener relación. Lo que representa una alerta para el sistema y servicios ecosistémicos que el sistema ofrece a su población. Ésta podría significar pérdidas económicas importantes por la afectación a las actividades productivas (e.g. pesca, ostricultura y turismo) que ahí se desarrollan, así como afectaciones en su salud por la posible producción de toxinas por parte de las especies potencialmente tóxicas reportadas en la zona.
El análisis dbRDA reveló que en el sistema CPM la composición del fitoplancton estuvo mayormente influida por la temperatura del agua y la salinidad tanto en la temporada de nortes como en la temporada de lluvias (Fig. 5 A). Sin embargo, fue la salinidad la variable con mayor efecto sobre las células fitoplanctónicas pese a la dilución del agua como consecuencia de las escorrentías epicontinentales, ya que las especies dominantes fueron de hábitos marinos. Es posible que la turbulencia generada por las descargas de agua dulce y la entrada de agua marina al sistema estuarino hayan generado, en conjunto, las condiciones necesarias que favorecieron la diversidad y la abundancia de diatomeas (Fig. 5 B) sobre todo durante la temporada de nortes asociada a los vientos máximos (Jáuregui-Ostos, 1975).
De manera similar, los dinoflagelados también estuvieron influenciados por la fluctuación de la salinidad (Fig. 5 C) pero con mayor diversidad en la temporada de lluvias. Estos son organismos que suelen proliferar en aguas estratificadas debido a sus condiciones morfológicas (Wyatt, 2013) y es posible que el debilitamiento del viento durante esta temporada haya favorecido el crecimiento de éstos. Finalmente, las cianobacterias fueron un grupo poco diverso y con bajas abundancias en este estudio (Fig. 5 D), reveló que también fueron más representativas en la temporada de lluvias, evidenciando la presencia de agua de origen meramente continental en la zona. Es posible que la baja abundancia y diversidad de este grupo se haya visto afectada no sólo por el desplazamiento del agua por incremento del caudal y subsecuente transportación de los organismos, sino también, por la poca tolerancia de éstos frente a los cambios de la salinidad.
En resumen, la temperatura del agua y la variación de la salinidad definieron la composición del fitoplancton, mientras que, el pH no tuvo ningún efecto sobre los organismos. Con respecto a la variación en la concentración de oxígeno disuelto y su débil relación con los tres grupos de productores primarios, sugiere que ésta proviene del movimiento intrínseco del agua (turbulencia) y no exclusivamente del fitoplancton.











 nueva página del texto (beta)
nueva página del texto (beta)