INTRODUCCIÓN
Un fenómeno emergente y significativo es el florecimiento sin precedentes de algas pelágicas del género Sargassum en muchas regiones del Atlántico. Acontecimiento que hoy día afecta a África Occidental, donde desde 2009 comienzan a registrarse grandes acumulaciones de algas holopelágicas (Addico y de Graft-Johnson, 2016).
Comunmente, el patrón de distribución del sargazo pelágico es en pequeños grupos masivos, los que tienden a alinearse en filas en la dirección de los vientos. Durante los períodos de clima tranquilo, las algas a la deriva se agregan en parches más grandes (Butler et al., 1983), y una referencia de su abundancia es el Mar de los Sargazos que alberga alrededor de diez millones de toneladas de biomasa húmeda (Johnson et al., 2013). Este ecosistema flotante es capaz de fijar una gran cantidad de carbono y ha sido comparado con los manglares por su capacidad de fijación (Gouvêa et al., 2020). Registradas por Cristóbal Colón el 16 de septiembre de 1492 como “masas de algas flotantes”, según refiere Farlow (1914), constituye causa de preocupación en los últimos años, pues los niveles de existencia parecen incrementarse sin razón aparente en las áreas costeras del Atlántico, como por ejemplo el Golfo de México (Van-Tussenbroek et al., 2017; Wang et al., 2019); República Dominicana (Fernández et al., 2017); Cuba (Moreira y Alfonso, 2013), entre otros.
A pesar de ser informada su presencia en las costas del Golfo de México y el Mar Caribe (Taylor, 1960), es solo a partir de 2011 que la biomasa arrastrada alcanza niveles sin precedentes, y se observa en localidades donde fue poco común, o no se registraron presencias previas a esta fecha (Smetacek y Zingone, 2013; Gavio et al., 2015; Rodríguez-Martínez et al., 2016; Louime et al., 2017).
Varias hipótesis se han propuesto para explicar tales eventos, incluyendo un exceso de cargas de nutrientes, el cambio en las corrientes y temperaturas de la superficie del mar, inusualmente elevadas (Djakouré et al., 2017; Miron et al., 2020). Muchos de estos estudios sugieren que: 1)- Los florecimientos de Sargassum han sido producto de las descargas anómalas de nutrientes a través del río Amazonas y están relacionadas con la deforestación río arriba; 2)- Los cambios en los florecimientos del noroeste de África, causados por el aumento de la aridez en el continente y los vientos alisios más fuertes del NE indujeron un afloramiento o surgencia costera estacional intensiva; 3)- Los cambios en las surgencias, en mar abierto las que se relacionan con los cambios en las corrientes oceánicas anormales y los patrones de viento relacionados con el cambio climático; 4)- Cambios en la frecuencia o alteración de los patrones de deposición de polvo africano, son los responsables de este fenómeno o bien la combinación de los factores anteriormente mencionados (Sissini et al., 2017; Oviatt et al., 2019; Wang et al., 2019). Ninguno de estos estudios explicó la aparición repentina de Sargassum en los trópicos, o la recurrencia anual y continua de florecimientos masivos. Aunque Johns et al., (2020), al integrar toda la información disponible, lograron establecer modelos coherentes de pronósticos, y presentan una explicación basada en modelos de simulación.
Conocidas como “mareas doradas”, según Milledge y Harvey (2016), su llegada a las costas no deja de ser un acontecimiento inusual y perturbador, tanto para la pesca como para el turismo (Desrochers et al., 2020) y los daños a los ecosistemas cercanos a la costa y a los medios de vida costeros no se han hecho esperar; como tampoco lo han hecho los efectos que sobre la salud humana ha ocasionado la exposición al sargazo en descomposición (UNEP, 2018).
El aprovechamiento de los arribos de macroalgas marinas se remontan al siglo XIV, cuando ya en la antigua Bretaña y Normandía eran empleadas para enriquecer las tierras de cultivo (Bula-Meyer, 2004). Según resumen Desrochers et al., (2020), el sargazo pelágico es utilizado actualmente en sectores muy diversos como el sector agricola; así como en la obtención de biodiesel, bioplásticos, entre otras aplicaciones. No menos importante es su implementación como subproducto alimenticio en granjas avícolas y bovinas (Moreira y Alfonso, 2013), aunque es importante conocer previamente su composición química, ya que muchos elementos traza pueden afectar a los animales y se sugiere precaución en su implementación (Davis et al., 2021). A pesar de que se ha evaluado su potencial para el consumo humano (Rodríguez-Martínez et al., 2020), las altas concentraciones de arsénico han desestimado su implementación como recurso; de igual modo que los bajos rendimientos en la producción de alginatos han desalentado su explotación. Será necesario seguir trabajando para establecer rutas para la futura valorización de la biomasa pelágica de Sargassum que arriba a las costas.
La determinación de biomasa de Sargassum en la franja costera del Caribe Sur ha sido expuesta por Cabrera et al., (2021). En este estudio se presentan aspectos inéditos luego de un proceso de arribo masivo; así como el registro y cuantificación de morfotipos de Sargassum pelágicos.
MATERIALES Y MÉTODOS
Área de Estudio. Costa Rica se ubica en América Central, cuenta con costas en el Océano Pacífico y en el Mar Caribe (Fig. 1A). La costa caribeña tiene una extensión aproximada de 220 km, casi cinco veces menor que la costa Pacífica (Vargas, 2006). El clima en el Caribe se caracteriza por no presentar una estación seca definida, y muestra dos períodos en los que disminuyen las precipitaciones; el primero: febrero-marzo; y el segundo: septiembre-octubre (IMN, 2020). Por lo que el clima del Caribe Sur es húmedo, caliente, con una estación seca corta (Herrera, 1986). Las mareas tienen condición micro-mareal puesto que no superan los 30 cm de amplitud. El oleaje es marcadamente local, y su mayor intensidad es durante los últimos y los primeros meses del año. Lo que disminuye de septiembre a octubre cuando medran los vientos alisios (Murillo, 2001).
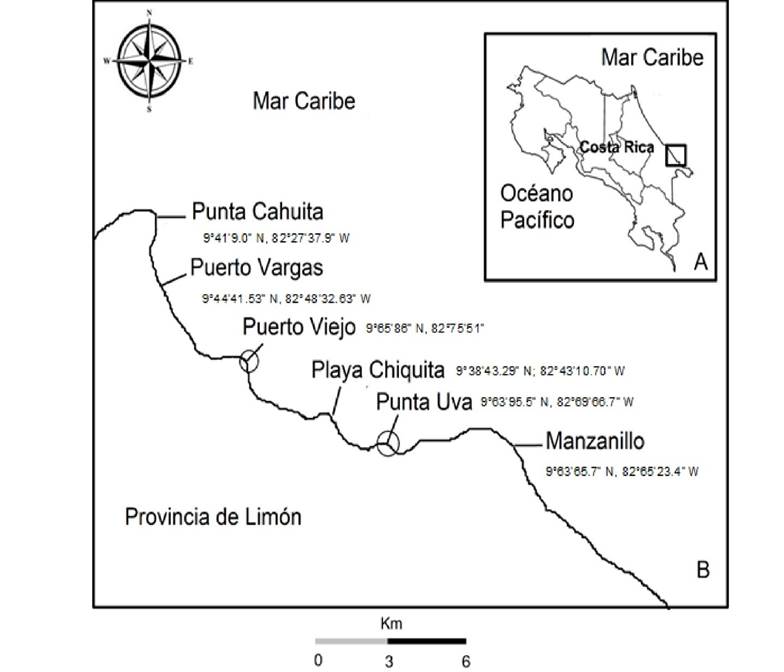
Figura 1 Zona de Estudio A, B. A, Límites geográficos de Costa Rica. B, Estaciones de muestreo. y#091;Punta Cahuita, Puerto Vargas, Puerto Viejo, Playa Chiquita, Punta Uva, Manzanillo. Se indican con círculos las estaciones donde se determina la biomasa de arribazón.
La costa está compuesta por promontorios rocosos que están asociados al complejo arrecifal, conocido como Formación Puerto Viejo. Posee afloramientos rocosos en Puerto Limón, Cahuita y Puerto Viejo, así como a lo largo de las costas rocosas que se presentan entre Puerto Viejo y Punta Mona. De acuerdo con Battistini y Bergoeing (1984), se trata de macizos de coral que alternan con brechas coralinas, así como con antiguos lechos de playa fosilizados (areniscas negras). Dicho complejo sobre yace en algunos sectores como Cahuita y Manzanillo, donde se hallan extensas plataformas arrecifales sumergidas.
Recolecta y procesamiento de muestras. El muestreo se realizó en seis localidades del Caribe Sur de Costa Rica (Fig. 1B), donde se registra el evento de arribo masivo de Sargassum pelágico, ocurrido entre los meses de marzo y abril de 2019.
Se recolectaron al azar treinta individuos de Sargassum en las seis localidades, desde Punta Cahuita hasta Manzanillo, en los meses de marzo y abril de 2019, para documentar el fenómeno. El material recolectado fue depositado y catalogado en el herbario de la Universidad Autónoma Metropolitana de México (UAMIZ) (Thiers, 2020), como evidencia del proceso de arribo en las costas del Caribe. Para cuantificar los morfotipos, se tomó el contenido de tres cuadrantes de 25 x 25 cm en cada uno de los sitios de los estudios, donde se separaron en tres categorías, de acuerdo a Parr (1939): Sargassum fluitans III (Sf III) Sargassum natans I (Sn I) y Sargassum natans VIII (Sn VIII).
Para la cuantificación de la biomasa de arribazón se recolectó material en dos localidades: Puerto Viejo y Punta Uva, las cuales fueron seleccionadas por facilidades logísticas, así como por las diferencias geomorfológicas de los sitios de recolecta. La ubicación de los transectos en el sector costero fue definida con el método sugerido por Areces et al. (1993), modificado de acuerdo con las características de las playas. Así, fueron ubicados cuatro transectos por sitio, con el empleo de una cuerda de 50 m de longitud, previamente anudada cada 5m, hasta cubrir la longitud de la cuerda. Se ubicaron los transectos paralelos a la línea de la costa en marea baja, de modo que permitiera abarcar aproximadamente el 75% de la longitud de las dos playas seleccionadas.
Para seleccionar los cinco puntos (de cada transecto) donde se realizaron los muestreos de biomasa, se utilizó el método de la tabla de números aleatorios. En cada punto, se ubicó un marco cuadrado de 25 x 25 cm en la zona más cercana al mar (límite de marea), donde comienza el arribazón. El cuadrante se trasladó perpendicularmente al transecto con la ayuda de una cuerda, para que abarcara el ancho de la franja de arribazón en el mesolitoral. El número de cuadrantes dependió del ancho del arribazón (Fig. 2). En cada punto se recolectó toda la biomasa dentro del marco cuadrado. Se pesó la biomasa húmeda in situ, con una balanza manual de resorte y, posteriormente, se almacenaron en bolsas de polietileno roturado para su traslado. Una vez en el laboratorio, el contenido de las bolsas fue clasificado. Se descartaron fanerógamas, así como los invertebrados incorporados al material vegetal recolectado. Solo se consideraron las macroalgas con más de 1 cm de longitud, para su identificación, debido a lo laborioso que resulta la identificación de organismos de menor porte; sobre todo si éstos no recubren significativamente el talo de las algas arribadas, hecho que sí puede tener un interés ecológico cuando está presente. El material seleccionado fue lavado con abundante agua corriente para eliminar exceso de arena e impurezas, y posteriormente escurrido para, finalmente, ser sometido a proceso de secado en una estufa a 60ºC, durante 12 horas. Ello permitió obtener el peso con el producto seco en una balanza técnica PCE-LS.
Análisis de datos. Los especímenes recolectados en las seis estaciones fueron identificados empleando claves y esquemas de literatura especializada (Parr, 1939; Taylor, 1960; Littler y Littler, 2000; Littler et al. 2008).
Para la clasificación de los especímenes recolectados, en sus respectivos grupos morfológicos, se siguieron los criterios de Parr (1939) y Winge (1923). El material para herbario recolectado se agrupó en tres morfotipos, sensuParr (1939): Sf III (n=6), Sn I (n=8) y Sn VIII (n=16). Los valores de n, se corresponden con el número de ejemplares depositados en el herbario UAMIZ.
En cuanto a los caracteres que los definen se puede decir que Sf III presenta espinas en el estipe y ausencia de éstas en las vesículas aéreas. Sn I, por su parte, es morfológicamente más coherente con la descripción de Sargassum natans (L.) Gaillon (Gaillon, 1828). Su forma es grácil y delgada, y posee un estipe liso y presenta espinas en las vesículas aéreas. El grupo más complejo basado en las variaciones morfológicas es S. natans VIII, que presentó características comunes a S. fluitans III y a S. natans I. Los miembros del grupo VIII presentaron filoides más largos y anchos que los otros dos morfotipos, no tiene espinas en el estipe como S. natans, y rara vez presenta espinas en las vesículas de aéreas. Cabe destacar que este morfotipo puede confundirse con la forma típica de Sargassum fluitans (Børgesen) Børgesen.
Con el objetivo de determinar el porcentaje por los grupos (I, III, VIII), se tomó el contenido del material vegetal de tres cuadrantes de 25 x 25 cm tomados al azar en cada uno de los sitios. Todo el material se separó convenientemente por clases (I, III, VIII). Estos grupos previamente catalogados se lavaron eliminando el exceso de arena y escurrieron para luego ser secados a 60° C, en estufa con aireación. Una vez seco el material, se pesó cada uno de los grupos, con la ayuda de una balanza técnica (precisión ± 0.01 g). Para determinar los porcentajes de contribución de cada grupo, se determinó el porcentaje por regla de tres directa:
Donde, X= porcentaje de contribución de un grupo. A= valor de una clase de datos. En este caso, peso seco de un grupo (I, III, VIII). B= sumatoria de todas las clases de datos, en este caso (Σ I, III, VIII).
Análisis de varianzas. Para la realización de estas pruebas paramétricas, se determinó si existía dependencia de la varianza con respecto a la media para los datos biomasa seca arribada. Los datos que presentaron correlación se transformaron tomando como criterio el valor de la pendiente (b), de la línea de regresión del logaritmo de la varianza sobre el logaritmo de la media, quedando como XT, donde T = 1 - b/2 y es el valor de la transformación, según la ley de potencia de Taylor (Elliot, 1971). El análisis de varianza se consideró un diseño bifactorial de efectos fijos, en el cual los factores son el mes (2 niveles) y el sitio (2 niveles). El procesamiento estadístico de los datos se realizó utilizando el paquete Statistica 10 (Statsoft Inc., 1984-2011). Se le aplicó una transformación de escala (X (0.43)) a los valores de biomasa seca. Para determinar si existían diferencias significativas en la biomasa seca que arribó a los dos sitios (Puerto Viejo y Punta Uva), y entre meses (Marzo y Abril) se usó la prueba de T de Student, con un 95% de confidencia.
RESULTADOS
Las dos especies del género Sargassum que arribaron a las costas del Caribe Sur fueron S. fluitans y S. natans, ambas están presentes en el Océano Atlántico Occidental (Wynne, 2017) y constituyen las principales especies que arriban de forma masiva a las costas del país desde el año 2011, según Cabrera et al. (2021). Sargassum natans, por su parte presenta, dos tipos morfológicos muy distintivos Sn I y Sn VIII (Fig. 3). No menos importante es la magnitud del proceso de arribo, sobre todo si lo comparamos con eventos anteriores a 2019 (Fig. 4).

Figura 3A-B. Sargassum natans. A. Sn I*. B. Sn VIII**. Diferencias morfológicas en la especie de acuerdo con Parr (1939). 701916 MICH*, s/n UAMIZ**. Escala = 2 cm. (los asteriscos se refieren al material de herbario al que corresponden).

Figura 4 A-D. Evidencias fotográficas que indican la magnitud del arribo de Sargassum pelágico en diferentes áreas y épocas en el Caribe Sur. A. Punta Uva, septiembre 2010. B. Puerto Vargas, julio de 2012. C. Playa Chiquita, abril de 2013. D. Puerto Viejo, abril de 2019. y#091;Fotografías (A, B, D, por: R. Cabrera y C, por R. Radulovich tomadas con una cámara Réflex Digital Nikon DXy#093;.
La totalidad de los individuos recolectados para herbario fueron separados convenientemente en grupos (Tabla 1) y se depositaron en el herbario UAMIZ (ver material examinado).
Tabla 1 Lista de especies de macroalgas más conspicuas asociadas al arribazón. (x= presencia, o= ausencia).
| ESPECIES | Punta Cahuita | Puerto Vargas | Puerto Viejo | Playa Chiquita | Punta Uva | Manzanillo | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| M | A | M | A | M | A | M | A | M | A | M | A | |||||||
| Chlorophyta | ||||||||||||||||||
| Anadyomene stellata (Wulfen) C. Agardh | x | x | x | x | x | x | x | o | o | o | x | x | ||||||
| Avrainvillea digitata D. S. Littler y Littler | o | o | o | o | x | x | o | o | o | o | x | x | ||||||
| Caulerpa prolifera (Forsskål) J. V. Lamouroux | o | o | o | o | o | o | x | x | o | o | o | o | ||||||
| Caulerpa sertularioides (S. G. Gmelin) M. Howe | x | x | o | o | x | o | o | o | x | x | o | o | ||||||
| Chaetomorpha aerea (Dillwyn) Kützing | o | o | x | x | x | x | o | o | o | o | o | o | ||||||
| Codium taylorii P.C. Silva | o | o | o | o | o | o | o | o | o | o | x | x | ||||||
| Dictyosphaeria cavernosa (Forsskål) Børgesen | x | x | o | o | o | o | o | o | o | o | x | x | ||||||
| Penicillus capitatus Lamarck | x | o | o | o | o | o | o | o | o | o | x | o | ||||||
| Ulva lactuca Linnaeus | o | o | o | o | o | o | o | o | o | o | x | x | ||||||
| Ochrophyta | ||||||||||||||||||
| Canistrocarpus cervicornis (Kützing) De | x | x | x | x | o | o | o | o | o | o | x | x | ||||||
| Paula y De Clerck | ||||||||||||||||||
| Dictyopteris delicatula J. V. Lamouroux | x | x | x | x | o | o | o | o | o | o | o | o | ||||||
| Dictyota caribaea Hörnig y Schnetter | x | x | x | x | x | x | o | o | o | o | x | x | ||||||
| Dictyota ciliolata Sonder ex Kützing | o | x | o | x | o | o | o | o | o | o | o | o | ||||||
| Sargassum cymosum C. Agardh | x | x | x | x | o | o | o | o | o | o | x | x | ||||||
| Sargassum filipendula C. Agardh | x | x | o | o | o | o | x | x | o | o | o | x | ||||||
| Sargassum filipendula var.montagnei | x | x | x | x | o | o | o | o | o | o | o | o | ||||||
| (Bailey) Grunow | ||||||||||||||||||
| Sargassum fluitans (Børgesen) Børgesen | x | x | x | x | x | x | x | x | x | x | x | x | ||||||
| Sargassum furcatumKützing | x | x | x | x | o | o | o | o | o | o | o | o | ||||||
| Sargassum hystrix J. Agardh | o | o | x | x | o | o | o | o | o | o | x | x | ||||||
| Sargassum hystrix var. spinulosum (Kützing) Grunow | x | x | x | x | o | o | o | o | o | o | o | o | ||||||
| Sargassum natans (Linnaeus) Gaillon | x | x | x | x | x | x | x | x | x | x | x | x | ||||||
| Sargassum polyceratium var.ovatum | x | x | o | o | o | o | o | o | o | o | x | x | ||||||
| (Collins) W. R. Taylor | ||||||||||||||||||
| Turbinaria tricostata E. S. Barton | o | o | o | o | o | o | x | x | o | o | o | o | ||||||
| Turbinaria turbinata (Linnaeus) Kuntze | x | o | o | o | o | o | o | o | o | o | x | o | ||||||
| Rhodophyta | ||||||||||||||||||
| Alsidium triquetrum (S. G. Gmelin) Trevisan | x | x | o | o | o | o | x | x | x | x | o | o | ||||||
| Chondrophycus perforatus(Bory) K. W. Nam | x | o | x | x | o | x | o | x | x | o | x | o | ||||||
| Gelidiella acerosa (Forsskål) Feldmann y Hamel | x | o | x | x | o | x | o | x | x | o | o | o | ||||||
| Laurencia spp. | o | o | o | x | o | x | x | x | x | o | x | x | ||||||
Material examinado:
Sargassum natans. Sn I. Caribe Sur de Costa Rica. Estación Punta Cahuita: 9˚41’9.0” N, 82˚27’37.9” W, profundidad: 0 m, sustrato: rocoso, 10/3/2019, 14/4/2019, leg R. Cabrera, s/n UAMIZ. Estación Puerto Vargas: 9°44’41.53” N, 82°48’32.63” W, profundidad: 0 m, sustrato: arenoso con rocas, 10/3/2019, leg. R. Cabrera, s/n UAMIZ. Estación Puerto Viejo, 9˚65’86”N, 82˚75’51”W, profundidad: 0 m, sustrato: arenoso-rocoso, 20/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Playa Chiquita, 9°38’43.29” N; 82°43’10.70” W, profundidad: 0 m, sustrato: arenoso con rocas aisladas, 17/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Punta Uva, 9˚63’95.5”N, 82˚69’66.7” W, profundidad: 0 m, sustrato: arenoso, -/4/2011, leg. R. Cabrera, 701916 MICH, 12/3/2019, 14/4/2019, leg. R. Cabrera. Estación Manzanillo, 9˚63’65.7”N, 82˚65’23.4”W, profundidad: 0 m, sustrato: rocoso, 18/4/2019, leg. R. Cabrera, s/n UAMIZ. Sn VIII. Caribe Sur de Costa Rica. Estación Punta Cahuita: 9˚41’9.0” N, 82˚27’37.9” W, profundidad: 0 m, sustrato: rocoso, 10/3/2019, 14/4/2019, 14/4/2019, 14/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Puerto Vargas: 9°44’41.53” N, 82°48’32.63” W, profundidad: 0 m, sustrato: arenoso con rocas, 10/3/2019, 14/4/2019, 14/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Puerto Viejo, 9˚65’86” N, 82˚75’51” W, profundidad: 0 m, sustrato: arenoso-rocoso, 14/3/2019, 14/3/2019, 14/3/2019, 20/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Playa Chiquita, 9°38’43.29” N; 82°43’10.70” W, profundidad: 0 m, sustrato: arenoso con rocas aisladas, 12/3/2019, 17/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Punta Uva, 9˚63’95.5”N, 82˚69’66.7” W, profundidad: 0 m, sustrato: arenoso, profundidad: 0 m, sustrato: arenoso, 12/3/2019, 14/4/2019, leg. R. Cabrera. Estación Manzanillo, 9˚63’65.7” N, 82˚65’23.4” W, profundidad: 0 m, sustrato: rocoso, 18/4/2019, leg. R. Cabrera, s/n UAMIZ.
Sargassum fluitans. Sf III. Caribe Sur de Costa Rica. Estación Punta Cahuita: 9˚41’9.0” N, 82˚27’37.9” W, profundidad: 0 m, sustrato: rocoso, 10/3/2019, 14/4/2019, leg. R. Cabrera, s/n UAMIZ. Playa Chiquita, 9°38’43.29” N; 82°43’10.70” W, profundidad: 0 m, sustrato: arenoso con rocas aisladas, 12/3/2019, 17/4/2019, leg. R. Cabrera, s/n UAMIZ. Estación Manzanillo, 9˚63’65.7” N, 82˚65’23.4” W, profundidad: 0 m, sustrato: rocoso, 15/3/2019; 18/4/2019, leg. R. Cabrera, s/n UAMIZ.
A los grupos de macroalgas que se cuantificaron en cada marco cuadrado (n=3), se identificaron utilizando caracteres morfológicos definidos por Parr (1939), que incluyeron características de la fronda (filoides), presencia o ausencia de espinas en los ejes, y presencia de apéndices (mucrón) en las vejigas de aire, así como por tamaño de los filoides que fue otra característica empleada. Según las definiciones de Parr,Sf. III, puede distinguirse de Sn. I ySn. VIII, basándose en la presencia de espinas en sus ejes del cauloides. Sargassum fluitanstampoco tiene apéndices (mucronados) en sus vesículas que, generalmente, están presentes en vesículas deSn. I y, ocasionalmente se encuentran en vesículas deSn. VIII. Las dos especies de S. natans también se pueden distinguir en función de lo ancho de sus filoides.Sn. I tiene los filoides mucho más estrechos queSn. VIII (Fig. 5).

Figura 5 A-C. Diferentes formas morfológicas de Sargassum pelágicos hallados en la zona de estudio. A, Sn. I. B. Sn. VIII. C. Sf. III. Según las descripciones de Parr (1939) y Schell et al. (2015) y#091;Iconografía R. Cabreray#093;.
En Costa Rica se presentaron para el Caribe Sur Sn. I y VIII, y entre éstos el más abundante, dado su porcentaje de aparición, fue Sn. VIII (65 vs 25 %). El Sf. III, por su parte, presentó niveles del 10% durante el periodo de estudio (Fig. 6). La composición por especies de macroalgas asociadas a los Sargassum holopelágicos fue baja (Tablas 2, 3), y los análisis estadísticos reflejaron que no se presentaron diferencias significativas al comparar la biomasa de arribazón, entre los meses o los sitios de interés. La biomasa arribada de algas presentó una interacción significativa para la combinación de los dos factores (Tabla 4). Los valores de biomasa de arribazón oscilaron entre 85.3 y 97.1 Kg/m2 para la mayoría de las combinaciones mes-sitio.
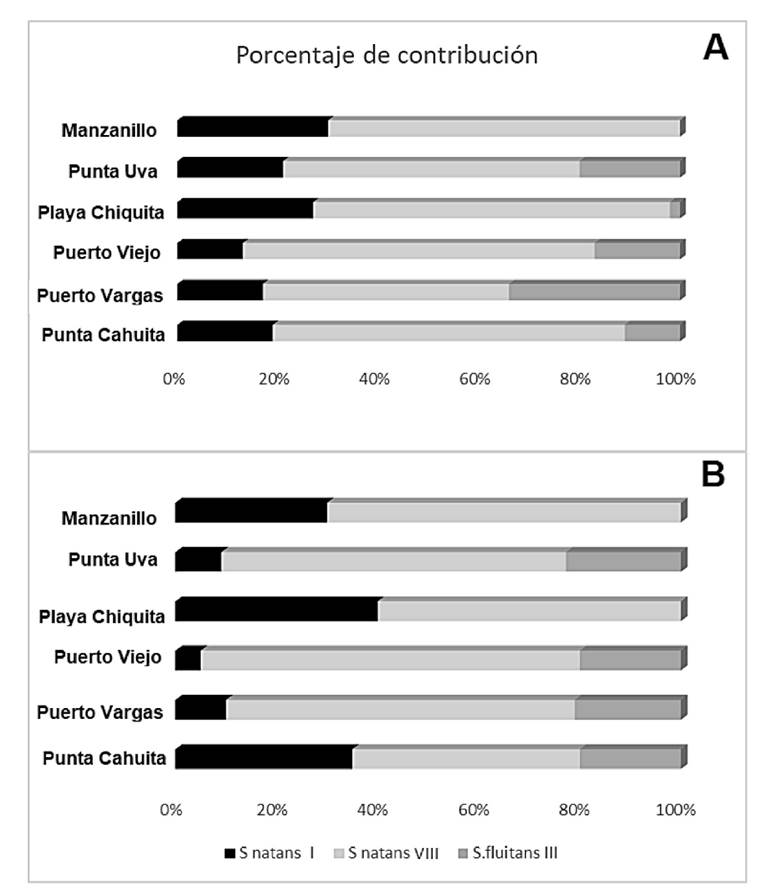
Figura 6 Porcentaje de distribución para S. natans I, S. natans VIII y S. fluitans III, en los diferentes sitios de estudios, en los meses de marzo (A) y abril (B) de 2019, cuando se describió un arribo masivo.
Tabla 2 Número de especies por zonas de recolecta en marzo (M) y abril (A) de 2019.
| Estaciones de recolecta | Chlorophyta | Ochrophyta | Rhodophyta | |||||
|---|---|---|---|---|---|---|---|---|
| M | A | M | A | M | A | |||
| Punta Cahuita | 4 | 3 | 12 | 12 | 3 | 1 | ||
| Puerto Vargas | 2 | 2 | 9 | 11 | 2 | 3 | ||
| Puerto Viejo | 4 | 3 | 3 | 3 | 0 | 3 | ||
| Playa Chiquita | 2 | 1 | 3 | 3 | 2 | 4 | ||
| Punta Uva | 1 | 1 | 2 | 2 | 4 | 1 | ||
| Manzanillo | 6 | 5 | 8 | 8 | 2 | 1 | ||
| Total | 17 | 16 | 36 | 39 | 13 | 13 | ||
Tabla 3 Distribución por grupos morfológicos Sn I, Sn VIII y Sf III para el material de herbario que corresponde al 2019.
| Estaciones de recolecta | Sargassum natans (I) | Sargassum natans (VIII) | Sargassum fluitans (III) |
|---|---|---|---|
| Punta Cahuita | 2 | 4 | 2 |
| Puerto Vargas | 1 | 3 | 0 |
| Puerto Viejo | 1 | 4 | 0 |
| Playa Chiquita | 1 | 2 | 2 |
| Punta Uva | 2 | 2 | 0 |
| Manzanillo | 1 | 1 | 2 |
| Total | 8 | 16 | 6 |
Tabla 4 Resultados del análisis de varianza bifactorial realizado a partir de la biomasa de algas arribadas. Los datos originales fueron transformados según X0.43. (ns= no significativo; *= significativo).
| Fuentes de Variación | Grados de libertad | Cuadrado Medio | F | P | |
|---|---|---|---|---|---|
| Mes (M) | 1 | 406,503 | 4,03 | 0,186 | ns |
| Sitio (S) | 1 | 520,248 | 5,16 | 0,002 | ns |
| M x S | 1 | 1353,586 | 13,43 | <0.001 | * |
| Error | 236 | 100,817 |
DISCUSIÓN
Los estudios de las arribazones pueden registrar otras especies de interés comercial (Núñez-Reséndiz et al., 2019), documentar, según interés, especies bentónicas y pelágicas de Sargassum (Moreira et al., 2006), o bien censar las algas acompañantes de las especies holopelágicas. Solo se reconocen 28 taxones infragenéricos conspicuos de macroalgas en el proceso de arribo que se describe para el Caribe Sur en 2019. Estos valores bajos, en cuanto al número de taxones, son contrarios a los expuestos por Torres-Conde y Martínez-Daranas (2019) para los arribos moderados al norte de Cuba, donde la diversidad de especies es significativa.
Recientemente, los procesos de arribazones se han enfocado no solo en su composición específica; como los realizados por Moreira y Alfonso (2013), quienes registran poblaciones monoespecíficas de Sargassum fluitans al Sur de Cuba, sino también en la presencia de grupos morfológicos dentro de las especies holopelágicas, donde cada forma descrita obedece a patrones ecológicos específicos con una fauna asociada característica (Schell et al., 2015). En nuestros resultados, solo observamos hidroides abundantes en los especímenes recolectados de los tipos Sn VIII y Sf III, esto es evidente en el material herborizado. Este resultado es similar al observado por Govindarajan et al. (2019) quienes no solo fueron capaces de registrar la abundancia sino la también la composición específica.
Sn I se registró en porcentajes muy bajos si se comparan con los resultados de Schell et al. (2015) para sus homólogos del Mar de los Sargazos, sitio donde el grupo I es dominante. El material que se analizó de Sn I se caracterizó por presentar una forma delgada y ligera, lo cual coincidió con su mayor acumulación en un mar típicamente oligotrófico (Morel et al., 2010), contrario a las observaciones de Torres-Conde y Martínez-Daranas (2020).
Las grandes porciones de Sn VIII, forma más robusta, están en correspondencia con Schell et al. (2015), quienes indican que el enriquecimiento acumulado por varios años, sumado a los cambios en los patrones de circulación, desencadenaron eventos masivos de colonización hacia el Caribe, Golfo de México y las Antillas, en el año 2011. Esta acumulación mayor e inesperada deSargassumse produjo cerca y a lo largo de las islas del Caribe oriental a partir de 2011 y continuó hasta diciembre de ese año (Gower et al., 2013,Hu et al., 2016). Un evento similar ocurrió en 2012 (Marechal et al., 2017), seguido de eventos de inundaciones de Sargassumaún mayores en todo el Caribe de 2014 a 2015 (Hu et al., 2016; Wang y Hu, 2016, 2017).
Sf III se distribuye de forma homogénea en el Atlántico. Este morfotipo muestra proporciones bajas (10%) con respecto a Sn I , y a los mostrados por Sn VIII en las regiones de las Antillas, el oriente del Caribe y el occidente del Atlántico Tropical, según Schell et al. (2015). Lo que también se cumple para la costa caribeña de Costa Rica.
Los niveles de biomasa seca total registrados fueron elevados, (± 95 Kg/m2) y comparables con los registrados para México, de aproximadamente 87 Kg/m2 (Rodríguez-Martínez et al., 2016). No se registraron diferencias significativas en la biomasa seca que arribó en los dos meses de estudio. Sin embargo, como resultado de las pruebas estadísticas, se registraron diferencias significativas en la biomasa seca en la interacción (Tabla 4). Esta interacción es de tipo sinérgica, donde se modifica la acción de un efecto por la acción de otro (Siegel, 1972). Esto puede estar asociado a las diferencias en la geomorfología del perfil costero, donde un arrecife más consolidado como el de Punta Uva pudo afectar, en algún sentido, el desplazamiento y arribo del material vegetal a la costa. A ello se une la existencia de patrones de corrientes muy dinámicos en la zona (Kinder, 1983), lo que puede contribuir a la presencia de los niveles de abundancia observados. Autores como Minor et al. (2020) consideran que la dinámica de las masas inertes de Sargassum y sus desplazamientos, obedecen a los efectos combinados. Ellos, a su vez, se basan en la teoría de Maxey-Riley (Beron-Vera et al., 2019), quienes consideran que el desplazamiento de la materia flotante dependerá de su naturaleza física, y toman en cuenta los efectos combinados de la corriente oceánica y el arrastre del viento sobre las partículas de tamaño finito (e. g Sargassum) que flotan en la superficie del océano.
Si bien los esfuerzos por cuantificar este fenómeno se van de la escala razonable, según muestran Moreira et al. (2006) y Torres-Conde y Martínez-Daranas (2020), en eventos regulares en la plataforma de Cuba, los niveles que se informan actualmente en la región del Caribe son preocupantes. Recientemente, la acumulación de biomasa en niveles como los que se registran para Costa Rica, se debe a una combinación de factores, y serán los estudios moleculares empleando microsatélites los que podrán esclarecer el origen de las arribazones en el Atlántico (Amaral-Zettler et al., 2017; Mansfield et al., 2017).
Hasta ahora es un hecho indiscutible, basados en nuestros resultados, que amplios registros pueden tener indicadores más confiables de cuantificación, como los aportados por estudios satelitales y no a una escala tan reducida que, por tanto, resulta preliminar a nivel regional.
Wang et al., (2019) registraron que para junio de 2018 la biomasa húmeda alcanzó más de 20 millones de toneladas en el Mar Caribe y Océano Atlántico Central, y en las costas del Caribe mexicano se enfrentaron esteras masivas atípicas de sargazo pelágico, en el verano de 2015 (Van-Tussenbroek et al., 2017). Posteriormente, hubo una disminución durante 2016 y 2017, pero durante la mayor parte de 2018 hasta la fecha la afluencia ha aumentado nuevamente (Langin, 2018; Putman et al., 2018).
Varios estudios revelaron que estas enormes esteras de Sargassum tienen una nueva fuente de distribución posible, diferente de la histórica Regional del Atlántico Norte conocida como “El mar de los Sargazos” (Schell et al., 2015). En cambio, el origen más probable de la afluencia masiva en las costas del Caribe es la Regional del Norte Ecuatorial (Johnson et al., 2013; Johns et al., 2020; Schell et al., 2015). Donde las altas temperaturas oceánicas e insumos de nutrientes, entre otros patrones oceanográficos acoplados, como los cambios de las corrientes superficiales, son las causas más probables de esta nueva región de florecimiento de Sargassum (Johnson et al., 2013; Gower et al., 2013; Sissini et al., 2017). Un estudio reciente de Wang et al. (2019) reveló que los aumentos de sargazo pelágico son impulsados por surgencias en África Occidental durante el invierno boreal y la descarga del río Amazonas durante la primavera y el verano. Los autores afirman que es probable que existan florecimientos recurrentes en el mar Caribe y el Atlántico tropical y destacan la importancia de comprender sus efectos en los ecosistemas existentes para una planificación futura. Uno de los principales desafios que enfrenta la humanidad, abocada al cambio climático inminente, es el uso de este exceso de biomasa con fines prácticos. Barbados, uno de los países más afectados por estos eventos, ha investigado la viabilidad de utilizar esta biomasa como materia prima para la producción de fertilizantes y electricidad. Sin embargo, considerando los resultados obtenidos por Milledge et al. (2020), la explotación de la biomasa de sargazo pelágico, por sí sola, para la producción de biogás, puede ser un desafío.











 nueva página del texto (beta)
nueva página del texto (beta)




