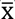INTRODUCCIÓN
Las lagunas costeras se caracterizan por su elevada productividad tanto primaria como secundaria (Day et al., 2013), además de constituir reservorios importantes de diversidad biológica de comunidades de vertebrados e invertebrados tales como el zooplancton (Souza et al., 2011). Las comunidades del zooplancton tienen una alta riqueza de especies, las cuales se clasifican en dos grupos de acuerdo con sus estrategias de vida. El holoplancton, cuyos organismos desarrollan todo su ciclo de vida como parte del plancton (entre los cuales destacan los copépodos), y el meroplancton, el cual, solo durante una fase de su ciclo de vida forman parte de la comunidad planctónica, ingresando usualmente como estadios larvarios a los sistemas estuarinos en busca de protección (Johnson & Allen, 2012), hasta alcanzar etapas más avanzadas de su desarrollo.
Aunque existen muchos estudios sobre la estructura de comunidades de zooplancton en sistemas costeros en el mar Caribe (Álvarez-Cadena & Segura-Puertas, 1997; Álvarez-Cadena et al., 2007; Castellanos & Suarez-Morales, 1997; Gasca & Castellanos, 1993; Gasca et al., 1994), así como sobre algunos grupos taxonómicos en particular, por ejemplo medusas (Mendoza-Becerril et al., 2009; Ocaña-Luna et al., 2015) e ictioplancton (Flores-Coto et al., 2009; Ocaña-Luna & Sánchez-Ramírez, 2016; Sánchez-Ramírez & Ocaña-Luna, 2015; Sanvicente-Añorve et al., 2000) en el Golfo de México, pocos estudios se han realizado en sistemas lagunares de Veracruz. Así, a pesar de que en el estado de Veracruz existen al menos 19 grandes sistemas estuarinos (Contreras, 2010), la estructura de toda la comunidad del zooplancton de estos sistemas permanece poco estudiada. Uno de los pocos trabajos es el reciente de Benítez-Díaz et al. (2014) para la laguna costera de Sontecomapan, Veracruz, en el cual se registran 54 taxa zooplanctónicos correspondientes a una amplia escala zoológica (de Rotifera hasta larvas de pez).
De manera particular, para la laguna La Mancha (sitio RAMSAR: humedal de importancia internacional), en sentido estricto del zooplancton, solo existe un trabajo sobre copépodos de las lagunas costeras de Veracruz (Álvarez-Silva & Gómez-Aguirre, 2000) donde queda incluida La Mancha. Con base en lo anterior, el objetivo del presente estudio es contribuir al conocimiento de riqueza de especies de la comunidad zooplanctónica de la laguna La Mancha, así como de algunos aspectos zoogeográficos, generando un inventario más amplio de las especies presentes en este sistema.
MATERIALES Y MÉTODOS
La laguna La Mancha es una laguna tropical localizada en la costa central del estado de Veracruz, en el Golfo de México (19°33’55’’ - 19°35’44’’ N y 96°22’45’’ - 96°23’39’’ O), la cual es un sistema somero que posee una extensión de 1.58 km2 y rodeada por bosque de manglar. Presenta conexión intermitente con el Golfo de México debido al patrón estacional de apertura/cierre de la barrera arenosa, la cual es regulada por las mareas, el viento y la descarga de agua dulce, teniendo influencia sobre los procesos hidrológicos, biológicos y ecológicos del sistema (Lara-Domínguez et al., 2006). El clima es cálido-subhúmedo (Aw2; García, 2004), definiéndose dos épocas climáticas: secas y lluvias. Durante la temporada de lluvias, la cual se extiende de junio a octubre con promedio de precipitación mensual mayor a 100 mm, la laguna recibe un aporte continuo de agua dulce a través del río Caño Grande, en contraste, durante la temporada seca, entre los meses de noviembre a mayo, registra un promedio de precipitación mensual menor a 60 mm, presentando condiciones marinas (Mecalco-Hernández et al., 2018). Durante el periodo de estudio, la boca de comunicación con el mar permaneció cerrada de mayo a junio 2012 y de enero a marzo 2013, con una amplitud media anual de marea de 26.11 cm.
Se realizaron muestreos diurnos (10:00 y 14:00 h), crepusculares (06:00 y 18:00) y nocturnos (22:00 y 02:00 h) cada mes, en un sitio cercano a la boca de la laguna (ca. 320 m), durante el periodo de mayo 2012 a abril 2013, con el fin de considerar ciclos de luz/oscuridad, para tener una mejor representación del componente nerítico del sistema. Las muestras se obtuvieron utilizando una red estándar de 30 cm de diámetro, 100 cm de largo y luz de malla de 150 µm, la cual fue arrastrada circularmente 160 metros durante 10 minutos a una velocidad aproximada de 0.5 nudos, a unos 15 cm de la superficie. Un total de 68 muestras fueron preservadas con formaldehído al 4% neutralizado con borato de sodio y posteriormente conservadas en etanol al 70%. En el laboratorio, la identificación de especies fue hecha hasta el nivel de especie cuando fue posible, utilizando claves especializadas para el zooplancton en general (Gosner, 1971; Johnson & Allen, 2012; Trégouboff & Rose, 1957), branquiuros (Suárez-Morales et al., 1998), copépodos (Campos & Suárez, 1994), peracáridos (Heard et al., 2004, 2007; Kensley & Schotte, 1989; Price, 1982), larvas y juveniles de peces (McEachran & Fechhelm, 2005; Richards, 2006). Para el análisis de aspectos zoogeográficos, también se consideraron dos trabajos que sobre invertebrados en general, se hacen para la laguna La Mancha (Ruiz & López-Portillo, 2006, 2014). La clasificación y nomenclatura de las especies de invertebrados se basó en el Registro Mundial de Especies Marinas (WoRMS, 2020), mientras que los nombres de las especies de peces se verificaron de acuerdo con Froese & Pauly (2020), tomado en cuenta el arreglo sistemático de Nelson et al. (2016).
Con el fin de evaluar si el esfuerzo de muestreo fue suficiente para representar la riqueza real de especies presente en el área de estudio, se realizó una curva de acumulación de especies, la cual fue optimizada aleatorizando el procedimiento a través de 100 permutaciones (Colwell, 2013; Magurran, 2004). Dado que el número de especies que se cuentan en un estudio de biodiversidad suele ser una subestimación parcial de la riqueza total de especies (debido a que muchas especies raras no se detectan), se calcularon estimadores no paramétricos de riqueza de especies como Chao 1, Chao 2, Jackknife 1, Jackknife 2 y Bootstrap (Magurran, 2004). La curva de acumulación de especies y los estimadores de riqueza total fueron determinados con el software EstimateS versión 9.1 (Colwell, 2013).
En relación con las variables ambientales, se registraron los intervalos de ocurrencia de cada uno de los taxa, bajo las diferentes condiciones de temperatura, salinidad y oxígeno en las que fueron capturados. Finalmente, para analizar cambios temporales de la riqueza de especies, se aplicó un análisis de varianza de dos vías (ANOVA), para evaluar el efecto de los meses y los períodos del día, así como la interacción entre estos factores (α < 0.05).
RESULTADOS
A partir de la revisión de todas las muestras, se identificaron 57 taxa o estadios ontogénicos, 49 de ellos se identificaron hasta especie, 6 hasta género y 2 como estadios ontogénicos (Tabla 1). Del total de éstos, 70% corresponde a grupos holoplanctónicos, mientras que el 30% restante corresponde a meroplancton.
Tabla 1 Clasificación taxonómica de las especies identificadas.
| Phylum/Clase | Subclase | Orden/Infraorden | Familia | Especie | Autor y año |
| Cnidaria Scyphozoa | Discomedusae | Semaeostomeae | Pelagiidae | Chrysaora quinquecirrha | (Desor, 1848) |
| Ulmaridae | Aurelia aurita | (Linnaeus, 1758) | |||
| Hydrozoa | Hydroidolina | Leptothecata | Campanulariidae | Obelia sp.* | |
| Ctenophora Tentaculata | Cydippida | Pleurobrachiidae | Pleurobrachia pileus | (O. F. Müller, 1776) | |
| Chaetognatha Sagittoidea | Aphragmophora | Sagittidae | Flaccisagitta enflata* | (Grassi, 1881) | |
| Annelida Polychaeta | Errantia | Phyllodocida | Nereididae | Laeonereis culveri | (Webster, 1879) |
| Nereis pelagica occidentalis | Hartman, 1945 | ||||
| Platynereis dumerilii | (Audouin & Milne-Edwards, 1833) | ||||
| Eunicida | Oenonidae | Arabella sp. | |||
| Arthropoda Crustacea | Branchiura | Arguloida | Argulidae | Argulus sp.* | |
| Copepoda | Calanoida | Acartiidae | Acartia (Odontacartia) lilljeborgii | Giesbrecht, 1889 | |
| Acartia (Acanthacartia) tonsa | Dana, 1849 | ||||
| Paracalanidae | Paracalanus aculeatus | Giesbrecht, 1888 | |||
| Pontellidae | Calanopia americana* | Dahl F., 1894 | |||
| Labidocera scotti | Giesbrecht, 1897 | ||||
| Pseudodiaptomidae | Pseudodiaptomus pelagicus | Herrick, 1884 | |||
| Temoridae | Temora stylifera* | (Dana, 1849) | |||
| Temora turbinata | (Dana, 1849) | ||||
| Tortanidae | Tortanus (Acutanus) setacaudatus | Williams, 1906 | |||
| Cyclopoida | |||||
| Oithonidae | Oithona nana | Giesbrecht, 1893 | |||
| Corycaeidae | Corycaeus (Urocorycaeus) lautus | (Dana, 1849) | |||
| Oncaeidae | Oncaea venusta* | Philippi, 1843 | |||
| Harpacticoida | Ectinosomatidae | Microsetella rosea* | (Dana, 1847) | ||
| Miraciidae | Macrosetella gracilis* | (Dana, 1846) | |||
| Tachidiidae | Euterpina acutifrons | (Dana, 1847) | |||
| Canuelloida | Longipediidae | Longipedia americana* | Wells, 1980 | ||
| Siphonostomatoida | Caligidae | Caligus rapax* | Milne-Edwards, 1840 | ||
| Malacostraca | Cumacea | Leuconidae | Leucon (Leucon) americanus* | Zimmer, 1943 | |
| Tanaidacea | Tanaididae | Tanais dulongii* | (Audouin,1826) | ||
| Isopoda | Cirolanidae | Eurydice piperata* | Menzies & Frankenberg, 1966 | ||
| Idoteidae | Edotia montosa* | (Stimpson, 1853) | |||
| Sphaeromatidae | Cassidinidea ovalis | (Say, 1818) | |||
| Amphipoda | Aoridae | Grandidierella bonnieroides | Stephensen, 1947 | ||
| Caprellidae | Caprella equilibra* | Say, 1818 | |||
| Gammaridae | Gammarus mucronatus | Say, 1818 | |||
| Gammarus sp. | |||||
| Melitidae | Melita nitida | S.I. Smith in Verrill, 1873 | |||
| Mysidacea | Mysidae | Americamysis almyra* | (Bowman, 1964) | ||
| Eucarida | Decapoda | Luciferidae | Belzebub faxoni* | (Borradaile, 1915) | |
| Penaeidae | Penaeus aztecus | Ives, 1891 | |||
| Penaeus setiferus | (Linnaeus, 1767) | ||||
| Portunidae | Callinectes sapidus | Rathbun, 1896 | |||
| Callinectes sp. | |||||
| Brachyura | Larva zoea | ||||
| Chordata Actinopterygii | Elopiformes | Megalopidae | Megalops atlanticus | Valenciennes, 1847 | |
| Clupeiformes | Engraulidae | Anchoa mitchilli | (Valenciennes, 1848) | ||
| Eleotridae | Dormitator maculatus | (Bloch, 1792) | |||
| Eleotris pisonis | (Gmelin, 1789) | ||||
| Gobiiformes | Oxudercidae | Ctenogobius boleosoma | (Jordan & Gilbert, 1882) | ||
| Gobionellus oceanicus | (Pallas, 1770) | ||||
| Gobiidae | Gobiosoma bosc | (Lacepède, 1800) | |||
| Microdesmus carri* | Gilbert, 1966 | ||||
| Pleuronectiformes | Paralichthyidae | Citharichthys spilopterus | Günther, 1862 | ||
| Syngnathiformes | Syngnathidae | Syngnathus louisianae | Günther, 1870 | ||
| Perciformes | Gerreidae | Eucinostomus melanopterus | (Bleeker, 1863) | ||
| Eucinostomus sp. | |||||
| Huevo de pez |
Los nuevos registros para el sistema son denotados con un “*”. Nombres científicos, autor y año, de acuerdo con WoRMS (2020) y Froese & Pauly (2020).
Los crustáceos fueron los mejor representados dentro del elenco sistemático, con 35 taxa y dentro de éstos, el grupo más diverso fue el de los copépodos con 17 taxa, sobresaliendo el orden Calanoida Sars, 1903. Del total de copépodos, 10 ya habían sido reportados para la laguna La Mancha, mientras que Calanopia americana, Temora stylifera, Macrosetella gracilis, Microsetella rosea, Longipedia americana, Oncaea venusta y Caligus rapax, así como el parásito branquiuro Argulus sp. representan nuevos registros para el sistema. Los peracáridos estuvieron representados por 11 taxa, de los cuales el cumáceo Leucon americanus, el tanaidáceo Tanais dulongii, los isópodos Edotia montosa y Eurydice piperata, el anfípodo Caprella equilibra y el misidáceo Americamysis almyra representan nuevos registros para la laguna La Mancha. Los decápodos estuvieron representados por seis grupos, constituidos principalmente por larvas zoea de braquiura, postlarvas de peneidos de Penaeus aztecus y P. setiferus, larvas megalopa de Callinectes sapidus y Callinectes spp., además del camarón fantasma Belzebub faxoni, el cual es nuevo registro para el sistema.
Nueve taxa correspondieron a otros invertebrados (cnidarios, ctenóforos, quetognatos y poliquetos) (Tabla 1), entre los cuales el cnidario hidromedusa Obelia sp. y el quetognato Flaccisagitta enflata, representan el primer registro para la laguna. Larvas y juveniles de peces fueron representados por 12 taxa, siendo la especie Microdesmus carri nuevo registro para el sistema.
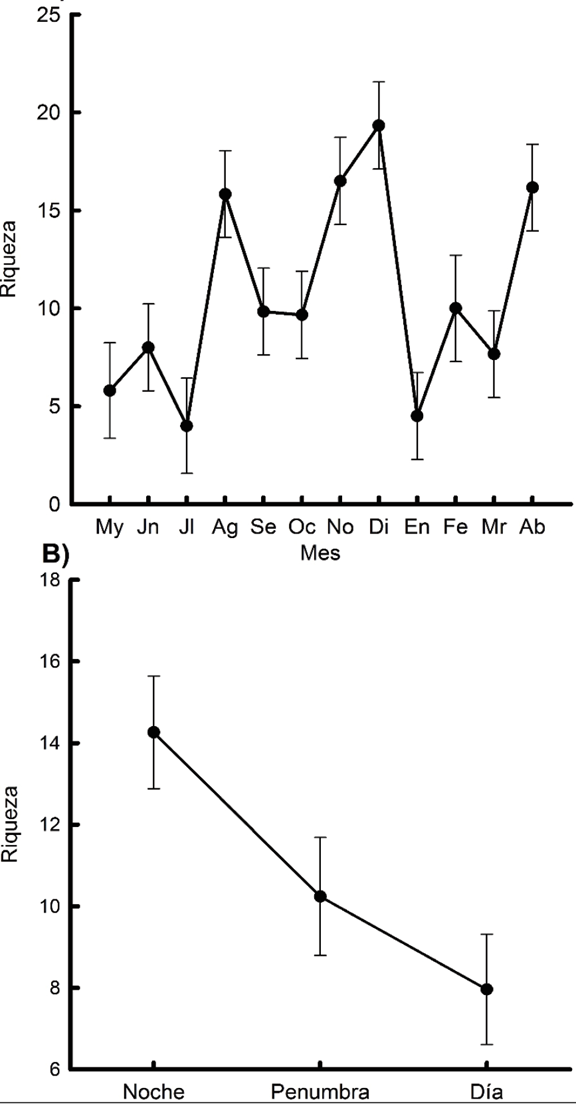
El número acumulado de especies colectadas con respecto a los muestreos ordenados cronológicamente (curvas especies-muestras) se muestra en la Figura 1. El número total de especies esperadas según cada uno de los estimadores no paramétricos utilizados para la estimación de la riqueza de especies fue: Chao 1: 59.67, Chao 2: 59.05, Jackknife 1: 61.92, Jackknife 2: 61.04 y Bootstrap: 59.86.
Figura 1 Curva de acumulación de especies para los ciclos de muestreos de zooplancton realizados en la laguna La Mancha, señalando promedios y error estándar.
El máximo, mínimo y promedio de la temperatura (°C), salinidad y oxígeno disuelto (mg L-1) registrados en la laguna durante el período de estudio se muestran en la Tabla 2. Asimismo, en esta tabla se presenta el intervalo de variación en el cual se registraron cada uno de los taxa identificados. Así, del total de registros, seis fueron consideradas estenohalinas (sus capturas fueron a intervalos de salinidad menor a seis unidades): Chrysaora quinquecirrha, Pleurobraquia pileus, Temora stylifera, Leucon americanus, Caprella equilibra y Citharichthys spilopterus. Pseudodiaptomus pelagicus, Tortanus (Acutanus) setacaudatus, Microsetella rosea, Gammarus sp., Melita nítida, larvas zoea y Penaeus setiferus presentaron un comportamiento eurihalino, registrándose en todo el intervalo de variación de la salinidad en la laguna (Tabla 2). Callinectes spp., Acartia (Odontacartia) lilljeborgii y Gobiosoma bosc fueron estenotermas, con capturas a intervalos de variación de temperatura menores a 2.5 °C, mientras que las larvas zoea y Penaeus setiferus, mostraron una condición euritérmica registrándose en todo el intervalo de variación de temperatura en la laguna (Tabla 2). Con respecto al oxígeno disuelto, todos los registros se presentaron en concentraciones mayores a 2.3 mg L-1.
Tabla 2 Máximo (Max), mínimo (Min) y promedio  de la temperatura,
salinidad y oxígeno registrada para la laguna La Mancha y para cada una
de las especies registradas, durante el periodo de estudio.
de la temperatura,
salinidad y oxígeno registrada para la laguna La Mancha y para cada una
de las especies registradas, durante el periodo de estudio.
Los nuevos registros para el sistema son denotados con un “*”.
En relación con la variación temporal de la riqueza, ésta mostró diferencias
significativas entre meses y entre períodos del día, con una interacción no
significativa entre estos factores (Tabla 3).
A lo largo del año, los promedios del número de especies tendieron a ser más altos
de agosto a diciembre y abril, mientras que los promedios más bajos tendieron a
presentarse de mayo a julio y de enero a marzo (Figura
2A). Así, el promedio del número de especies cuando la boca estuvo
abierta
Tabla 3 Resultadas del ANOVA de dos vías para evaluar el efecto de los meses y los períodos del día sobre la riqueza de especies.
| Origen de la variabilidad | Grados de libertad | Suma de cuadrados medios | F | P |
| Meses | 11 | 146.193 | 5.822 | < 0.0005 |
| Período del día | 2 | 232.957 | 9.278 | 0.001 |
| Interacción | 22 | 16.320 | 0.650 | 0.853 |
| Error | 32 | 25.109 |
DISCUSIÓN
Aunque el estudio formal del plancton en aguas mexicanas inició hace más de medio siglo, la mayoría de los estudios realizados corresponden principalmente a investigaciones en aguas epicontinentales y marinas, con referencia a la sistemática y distribución solo de algunos grupos del zooplancton (Suárez-Caabro & Gómez-Aguirre, 1965; Suárez-Morales, 2003), principalmente sobre cnidarios (Martell-Hernández et al., 2014; Mendoza-Becerril et al., 2009; Ocaña-Luna et al., 2015), copépodos (López-Salgado & Suarez-Morales, 1998; López-Salgado et al., 2000; Suárez-Morales & Gasca, 1998), e ictioplancton (Flores-Coto et al., 2009; Ocaña-Luna & Sánchez-Ramírez, 2016; Sánchez-Ramírez & Ocaña-Luna, 2015; Sanvicente-Añorve et al., 2000).
En este sentido, a pesar que la composición de especies de toda la comunidad zooplanctónica ha sido extensamente abordada en sistemas costeros del Caribe mexicano (Álvarez-Cadena & Segura-Puertas, 1997; Álvarez-Cadena et al., 2007; 2009; Castellanos & Suarez-Morales, 1997; Gasca & Castellanos, 1993; Gasca et al., 1994), relativamente pocos esfuerzos se han hecho en la zona costera del oeste central del Golfo de México (López-Salgado & Suarez-Morales, 1998) y menos aún en las lagunas costeras de la región suroccidental, salvo algunas excepciones, como son los casos de las lagunas de Sontecomapan (Benítez-Díaz et al., 2014) y Términos (Suárez-Caabro & Gómez-Aguirre, 1965).
Para la laguna La Mancha, a pesar de que se han realizado muchos estudios sobre fauna acuática, la gran mayoría de esta literatura ha permanecido en tesis o resúmenes de reuniones científicas (Contreras, 2010; Ruíz & López-Portillo, 2006). Así, en el estricto sentido de estudios zooplanctónicos, para este sistema sólo se han registrado 13 especies de copépodos (Álvarez-Silva & Gómez-Aguirre, 2000), de las cuales ocho fueron registradas en el presente estudio (A.lilljeborgii, A. tonsa, P. aculeatus, P. pelagicus, T. turbinata, T. setacaudatus, C. lautus y E. acutifrons), mientras que cinco no lo fueron (Centropages velificatus, Labidocera aestiva, Cymbasoma sp., Ergasilus versicolor y Diosaccus tenuicornis). Por lo que el presente estudio, a pesar de tener la limitación de haberse desarrollado en una sola localidad del sistema (boca), representa el primer reporte de la composición de especies del zooplancton para la laguna La Mancha y uno de los pocos reportes con estas características para lagunas costeras del suroccidente del Golfo de México.
En diferentes sistemas costeros del Golfo de México y Caribe mexicano se han reportado entre 30 y 80 grupos zooplanctónicos, de los cuales, entre 10 y 30 se han determinado hasta especie (Álvarez-Cadena et al., 2007; 2009; Benítez-Díaz et al., 2014; Castellanos & Suarez-Morales, 1997; Gasca et al., 1994), dependiendo estas cifras del nivel de determinación taxonómica hasta el que se reporten (Phylum, Orden, Familia, Género o Especie). Así, la composición del zooplancton reportada en el presente estudio, con 57 grupos, de los cuales 55 taxa fueron determinados hasta género o especie, muestra una riqueza relativamente alta para el sistema. Así, los 57 componentes zooplanctónicos registrados correspondieron a 43 familias, 25 órdenes y 6 phyla. La ocurrencia de una gran diversidad de invertebrados pertenecientes a una amplia escala zoológica acentúa la importancia de los estuarios como sitios de reproducción y crianza para muchas de estas especies (Day et al., 2013).
Los componentes zooplanctónicos mejor representados fueron los crustáceos, dentro de los cuales los copépodos fueron los más diversos con 17 especies, dominando los copépodos calanoideos de los géneros Acartia (principalmente A. tonsa), Calanopia, Pseudodiaptomus y Temora, como se ha registrado en otros sistemas costeros tanto del Golfo de México (Benítez-Díaz et al., 2014; Liu et al., 2017; Suárez-Caabro & Gómez-Aguirre, 1965), como del Caribe mexicano (Álvarez-Cadena et al., 2007; 2009; Castellanos & Suárez-Morales, 1997). Los peracáridos también estuvieron relativamente bien representados con 11 especies. Aunque los cumáceos, tanaidáceos, isópodos, anfípodos, así como la mayoría de los poliquetos, tienden a estar principalmente asociados al bentos, muchos pueden ascender por la columna de agua, por movimientos migratorios verticales (principalmente nocturnos) y por efecto de transporte de agua de fondo hacia la superficie (Gasca & Castellanos, 1993; Johnson & Allen, 2012). Los decápodos estuvieron constituidos solo por seis componentes, principalmente larvas zoea y megalopa, y su gran abundancia en sistemas costeros, se ha relacionado con los procesos reproductivos dentro del sistema (Gasca & Castellanos, 1993; Gasca et al., 1994).
En relación con el ictioplancton, aunque no se encontró una riqueza específica tan alta como la registrada en otras lagunas costeras del Golfo de México, donde el número de especies oscila entre 39 y 57 (Ocaña-Luna & Sánchez-Ramírez, 2016; Sánchez-Ramírez & Ocaña-Luna, 2015), se determinaron 12 especies, principalmente de los órdenes Gobiiformes y Clupeiformes. El zooplancton gelatinoso incluyó dos especies de medusas, una de ctenóforo y un género de hidromedusa (Obelia sp.), del cual no fue posible determinar taxonómicamente la especie, debido a que los caracteres de identificación a este nivel están basados en el pólipo y no en el estado de medusa (Martell-Hernández et al., 2014). Los poliquetos también incluyeron cuatro especies, mientras que un quetognato y un branquiuro completaron el elenco sistemático.
De todos los componentes registrados, 18 representaron nuevos registros para la laguna La Mancha, los cuales fueron 1 hidromedusa, 1 quetognato, 1 branquiuro, 7 copépodos, 6 peracáridos, 1 decápodo y 1 pez. Para comprender si estos nuevos registros implican además una ampliación en su distribución, se analizaron aspectos zoogeográficos de cada uno de ellos.
Así, para el Golfo de México han sido citadas al menos ocho especies de hidromedusas del género Obelia, tres de las cuales tienen una amplia distribución desde el noreste hasta el sureste (Calder & Cairns, 2009). La especie de quetognato Flaccisagitta enflata presenta una amplia distribución en el Golfo de México, con alta abundancia desde las costas de Tamaulipas, hasta el mar Caribe (Álvarez-Cadena et al., 2007; Mille-Pagaza & Carrillo-Laguna, 2003). Asimismo, para el Golfo de México han sido registradas al menos diez especies de branquiuros del género Argulus (Poly, 2009).
Cinco de los siete nuevos registros de copépodos, Calanopia americana, Temora stylifera, Macrosetella gracilis, Microsetella rosea y Oncaea venusta han sido registrados para sistemas tanto hacia el norte del sistema (López-Salgado & Suarez-Morales, 1998; López-Salgado et al., 2000), como en el Caribe mexicano (Álvarez-Cadena & Segura-Puertas, 1997; Álvarez-Cadena et al., 1998), todas ellas con una amplia distribución en todo el Golfo de México (Suárez-Morales et al., 2009). Similarmente, el copépodo Longipedia americana presenta registros tanto en el norte del golfo, como en el Caribe (Johnson & Allen 2012; Suárez-Morales et al., 2009), mientras que Caligus rapax ha sido reportada hacia el norte del sistema La Mancha, en laguna de Pueblo Viejo y para el sur, en la laguna de Alvarado (Álvarez-Silva & Gómez-Aguirre, 2000).
En relación con los nuevos registros de peracáridos, aunque el cumáceo Leucon americanus se ha reportado como restringido a la costa este de los Estados Unidos, estando en controversia su límite meridional en el norte del Golfo de México (Heard & Roccatagliata, 2009; Heard et al., 2007; Petrescu & Heard 2010; Roccatagliata, 2004), el presente reporte podría representar además una ampliación en su distribución meridional. El tanaidáceo Tanais dulongii (=T. cavolinii) ha sido registrado para la costa noreste de Estados Unidos (Gosner, 1971), con probable presencia en Florida (Heard et al., 2004) y hacia el sur en las lagunas de Alvarado y Términos, y mar Caribe (Escobar-Briones, 2004; García-Madrigal et al., 2002). Los isópodos Eurydice piperata y Edotea montosa presentan una distribución que incluye el noreste del Golfo de México y mar Caribe (Kensley & Shotte, 1989; Schotte et al., 2009). Similarmente, el anfípodo Caprella equilibra se encuentra ampliamente distribuida en todo el Golfo de México (LeCroy et al., 2009; Paz-Ríos et al., 2014), mientras que el misidáceo Americamysis almyra (= Mysis almyra) se presenta desde la costa norte de los Estados Unidos, hasta el sur del Golfo de México (Escobar-Briones & Soto, 1988; Johnson & Allen, 2012).
Con respecto a los decápodos, el camarón fantasma Belzebub faxoni presenta una amplia distribución en el océano Atlántico, desde Nueva Escocia, Canadá, hasta el Río Grande, Brasil (Cházaro-Olvera et al., 2017), y en relación con el ictioplancton, la distribución de Microdesmus carri se ha delimitado de manera general, del suroeste de México a Costa Rica (Froese & Pauly, 2020; Lara-Domínguez et al., 2011; McEachran & Fechhelm, 2005), por lo que este nuevo registro además puede representar el límite septentrional en su distribución. Así, de los 18 taxa reportados en el presente estudio como nuevos registros para la laguna La Mancha, solo dos casos representan una ampliación en su distribución geográfica (Leucon americanus y Microdesmus carri).
En cuanto a los intervalos de las variables ambientales, en los cuales se registraron para cada uno de los taxa encontrados, la información aportada permitirá determinar potenciales nuevos registros de tolerancias fisiológicas a la temperatura, salinidad y oxígeno disuelto, en las que pueden ocurrir las especies.
Las curvas de acumulación de especies permiten extrapolar el número de especies observado en un inventario y de esta manera poder estimar el total de especies que estarían presentes en la zona (Magurran, 2004). En este sentido, la curva de acumulación de especies realizada en el presente trabajo muestra un comportamiento asintótico, es decir, que un incremento en el esfuerzo de muestreo no causaría aumentos sustanciales en la riqueza de especies, resaltando así que la combinación del esfuerzo de muestreo realizado tanto a nivel mensual como por períodos del día permitió tener representada adecuadamente la riqueza de especies de la localidad estudiada. Asimismo, de acuerdo con los métodos no paramétricos para la estimación de la riqueza de especies, el número total de especies esperadas para la laguna podría variar entre 59 y 62, confirmando que el elenco sistemático reportado puede representar adecuadamente esta comunidad zooplanctónica.
En este contexto, en la determinación de riqueza de especies de un sistema, resalta la importancia de considerar muestreos nocturnos a lo largo de un ciclo anual de estudio, ya que esto permite aumentar la probabilidad de capturar especies con hábitos preferentemente nocturnos y por lo tanto obtener una representación más completa de la estructura de la comunidad (Castellanos & Suarez-Morales, 1997; Castillo-Rivera et al., 2005; Marques et al., 2009). De hecho, en el presente estudio se observó que la riqueza de especies fue significativamente mayor durante la noche que en los otros dos períodos del día.
Similarmente, a nivel estacional la riqueza también mostró diferencias significativas entre meses y aunque esto puede estar relacionado con los procesos de migración estacional inherentes a los ciclos de vida de las especies, en el presente estudio se observó que esta variación estuvo en lo general asociada con el estado de la boca del sistema, existiendo una mayor riqueza de especies cuando ésta permaneció abierta.











 nueva página del texto (beta)
nueva página del texto (beta)