INTRODUCCIÓN
El estudio de la diversidad parasitaria en vida silvestre ha sido abordado desde la distinción taxonómica de una comunidad de parásitos, la estimación de la biodiversidad relativa de parásitos, hasta la búsqueda de relaciones estrechas entre el parásito y su hospedero (Hechinger et al., 2007; Poulin, 2011). Esto ha generado un incremento en el reconocimiento e importancia que tienen los organismos parásitos en los estudios de la biodiversidad global, pues son relevantes en los ecosistemas en los cuales pueden regular la densidad y abundancia de sus hospederos, estabilizar cadenas tróficas, estructurar comunidades animales, por mencionar algunas (Luque & Poulin, 2007; Poulin et al., 2016). Por lo anterior, al estudiar la ocurrencia de los parásitos en una muestra o población de hospederos, que exhiben un complejo patrón, no puede ser adecuado usar una sola medición, se deben aplicar diferentes índices que capturen diferentes aspectos de la infección (Bego & Von-Zuben, 2010; Reiczigel et al., 2019).
En Perú los estudios parasitológicos en peces de la familia Serranidae han sido llevados a cabo a seis especies de las aproximadamente veintiocho especies registradas en el mar peruano (Froese & Pauly, 2018): Acanthistius pictus (Tschudi, 1846), Alphestes afer (Bloch, 1793), Hemanthias peruanus (Steindachner, 1875), Hemilutjanus macrophthalmos (Tschudi, 1846), Paralabrax humeralis (Valenciennes, 1828) y Paranthias colonus (Valenciennes, 1846) (Luque et al., 2016).De estas especies solo tres (A. pictus, H. peruanus y P. humeralis) han sido evaluadas a nivel de toda la comunidad de metazoos parásitos asociados a ellos (Iannacone & Alvariño, 2009; Luna et al., 2015; Gómez del Prado et al., 2017; Ferré-Alcántara et al., 2019).
Es conocido que los meros (Serranidae: Epinephelinae) albergan una amplia fauna parasitaria (Cribb et al., 2002;Justine et al., 2010), que incluye un número alto de especies monogénicas pertenecientes al género Pseudorhabdosynochus Yamaguti, 1958 (Kritsky et al., 2015) y a otros géneros de monogeneos (Justine, 2007; Justine & Henry, 2010; Justine et al., 2010).
El mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897), es una especie marina demersal, con un rango distribución geográfica que se extiende en el Pacífico oriental desde el Sur de California hasta Perú (Justine et al., 2010). Es una especie marina asociada a arrecifes rocosos y fondos blandos (Craig et al., 2011). A menudo se captura en redes de arrastre de camarón en la parte central del Golfo de California, aun así, no es considerada una especie de interés comercial (Froese & Pauly, 2018).
Probablemente por esto último, no existen estudios de aspecto ecológico parasitario, ni registros de especies de parásitos en el mero manchado, por lo que el objetivo de este trabajo fue evaluar la fauna de metazoarios parásitos acompañantes de H. niphobles, así como de su dinámica poblacional y grado de asociación entre los parámetros morfométricos del pez y sus parásitos.
MATERIALES Y MÉTODOS
Entre enero y febrero del 2018, fueron adquiridos 126 especímenes del mero manchado H.niphobles, distribuidos entre 83 machos y 43 hembras. Los especímenes fueron adquiridos en la terminal pesquera de Pucusana (12°28’47”S; 76°47’58”O), distrito de Pucusana, Lima, Perú. Para la identificación de los peces se usaron las claves taxonómicas de Chirichigno & Vélez (1998) y el catálogo de peces de Chirichigno & Cornejo (2001).
Antes de la necropsia de los peces se tomaron los datos de longitud total (LT), peso (W) y el sexo (S). Para la colecta de los parásitos fue revisada la cavidad bucal, branquias, cavidad celómica, estómago, intestino delgado, intestino grueso, ciegos pilóricos, gónadas, corazón, vejiga natatoria, riñones, hígado y bazo de los peces. Los parásitos fueron recolectados y conservados en alcohol etílico al 70% (Eiras et al., 2006).
Para el estudio taxonómico, los platelmintos fueron coloreados en ácido carmín acético y alternativamente en tricrómica de gomori, deshidratados en concentraciones de 50%, 70%, 90% y 100 % de alcohol etílico, diafanizados en eugenol y montados en bálsamo de Canadá (Eiras et al., 2006; Almeida & Almeida, 2014). Los crustáceos parásitos fueron macerados en ácido láctico o lactofenol por un tiempo de 24-48 h, colocados en láminas y observados directamente en microscopio (Boxshall et al., 2015).
La clasificación taxonómica de los monogeneos se realizó de acuerdo a Bychowsky (1957); Yamaguti (1963a); Cohen et al. (2013); para trematodos a Manter (1940), Kohn et al. (2007), Bray et al.(2008), para cestodos Khalil et al. (1994), para acantocéfalos Yamaguti (1963b) y finalmente para copépodos Yamaguti (1963c). La nomenclatura del hospedero y los parásitos fueron corroborados en World Register of Marine Species (WoRMS Editorial Board, 2019)
Para el análisis del componente de población parasitaria fueron calculados los índices ecológicos parasitológicos de prevalencia (P), abundancia media (AM) e intensidad media (IM) de infección siguiendo lo indicado por Bush et al. (1997) y Bautista-Hernández et al. (2015). El tipo de estrategia de cada especie parásita fue evaluada según el porcentaje de prevalencia, para lo cual las especies fueron catalogadas como especies “núcleo o central” para las especies con prevalencias mayores a 45%, especies “secundarias” para prevalencias entre 10% - 45% y especies “satélites” para prevalencias menores de 10% (Bush & Holmes, 1986).
Para el caso de las especies parásitas con prevalencias mayores al 10% (Esch et al., 1990), se emplearon los índices de dispersión (ID) para determinar el tipo de distribución espacial de las poblaciones parasitas, discrepancia de Poulin (DP) y K de la ecuación binomial negativa con su respectivo valor de Chi cuadrado (X2) para determinar el grado de agregación (Bego & Von-Zuben, 2010). Los cálculos fueron realizados usando el paquete estadístico Quantitative Parasitology 3,0 (Rózsa et al., 2000).
El componente de comunidad parasitaria fue el siguiente nivel evaluado, para lo cual se determinó la diversidad parasitaria mediante el índice de Shannon (H), la equitatividad fue determinada por el índice de uniformidad de Pielou (J) y se calculó la estimación del número especies esperadas con el índice de Chao-1 (Iannacone & Alvariño, 2013).
La LT y el peso de los hospederos fueron separados en rangos usando como criterio la regla de Sturges para determinar el número de intervalos, de los cuales se calcularon sus propios valores de P, AM e IM para evaluar la asociación entre estos parámetros y la LT y el peso. Para ellos fue empleado el coeficiente de correlación de Spearman, transformando previamente los valores de P% a raíz cuadrada de arcoseno. De manera similar, se utilizó el coeficiente de correlación de Pearson para determinar la relación de la LT y el peso del hospedero con la AM e IM de cada especie parásita. En todos los casos anteriores se verificaron la normalidad de los datos empleando la prueba de Kolmogorov-Smirnov con la modificación de Lillierfors y la homocesticidad de varianzas con base en la prueba de Levene (Zar, 2014).
Para calcular el grado de asociación entre el sexo del hospedero y P% de cada parásito se utilizaron tablas de contingencia 2x2, mediante X2 y la prueba de Razón de Verosimilitud. La prueba de t de Student fue utilizada para comparar la AM de cada parásito y el sexo del hospedero. El análisis de los parásitos en relación con la talla, peso y el sexo del hospedero se realizó únicamente para las especies con una prevalencia mayor al 10% (Esch et al., 1990). El nivel de significancia fue evaluado a un nivel de alfa = 0.05.
Se usó la técnica de escalamiento multi-dimensional no métrico (NMDS, por sus siglas en ingles) para evaluar el patrón en la estructura de la comunidad parásita en función de la abundancia de especies de parásitos. La matriz de similitud fue construida mediante el índice de Bray-Curtis. La abundancia de infección de cada especie de parásito en cada hospedero y su relación con el sexo del hospedero se analizaron mediante un análisis de varianza unidireccional con una prueba de ANOVA (PERMANOVA) permutacional no paramétrico, con diez mil permutaciones (Anderson, 2001; Míguez-Lozano et al., 2012; Minaya et al., 2018).
Se empleó el procedimiento de análisis de componentes principales (ACP) como una técnica para la reducción, ordenamiento y resumen de variables para determinar la asociación del patrón en la estructura de la comunidad parásita en función de la abundancia de especies de parásitos en cada hospedero y su relación con la longitud total y peso del hospedero (Yengle, 2012). Para la selección de los dos componentes más importantes se empleó el gráfico de sedimentación (screenplot), que se obtuvo al representar en las ordenadas las raíces características y en las abscisas el número de la componente en orden decreciente (Yengle, 2012). Se aplicó la rotación de factores Normalización VARIMAX con Kaiser-Meyer-Okin (KMO) con posterior prueba de Bartlett con base al X2 para lograr una mayor contribución de cada uno de los factores y para una mejor interpretación.
Para la determinación de los estadísticos descriptivos e inferenciales se empleó el paquete estadístico IBM SPSS Statistics 24.
Los especímenes de parásitos colectados en este estudio fueron depositados en la colección de Helmintos Parásitos e Invertebrados Afines - HPIA, de la colección zoológica del Museo de Historia Natural de la Universidad Nacional Federico Villarreal - MUFV, Lima, Perú; los códigos se muestran en la Tabla 1.
Tabla 1 Descriptores ecológicos de ocho metazoos parásitos evaluados en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú.
| Machos (n=83) | Hembras (n=43) | Total (n=126) | |||||||||||||
| Especies parasitas | HP | P% | AM | IM | HP | P% | AM | IM | HP | P% | AM | IM | SI | Tipo de estrategia | Código de deposito |
| MONOGENEA | |||||||||||||||
| Microcotyle sp. | 54 | 65.06 | 3.78 | 5.81 | 29 | 67.44 | 3.49 | 5.17 | 83 | 65.87 | 3.68 | 5.59 | B | núcleo | HPIA:143 |
| Benedenia sp. | 1 | 1.20 | 0.01 | 1 | - | - | - | - | 1 | 0.79 | 0.01 | 1 | B | satélite | HPIA:144 |
| TREMATODA | |||||||||||||||
| Helicometrina nimia Linton, 1910 | 17 | 20.48 | 0.51 | 2.47 | 13 | 30.23 | 0.53 | 1.77 | 30 | 23.81 | 0.52 | 2.17 | C | secundaria | HPIA:145 |
| Digeneo no id. | 1 | 1.20 | 0.01 | 1 | - | - | - | - | 1 | 0.79 | 0.01 | 1 | I | satélite | HPIA:146 |
| CESTODA | |||||||||||||||
| Neobothriocephalus aspinosus Mateo & Bullock, 1966 | 1 | 1.20 | 0.01 | 1 | 1 | 2.33 | 0.02 | 1.00 | 2 | 1.59 | 0.02 | 1 | I | satélite | HPIA:147 |
| ACANTOCEPHALA | |||||||||||||||
| Corynosoma australe Johnston, 1937 | 2 | 2.41 | 0.02 | 1 | 1 | 2.33 | 0.02 | 1.00 | 3 | 2.38 | 0.02 | 1 | M | satélite | HPIA:148 |
| CRUSTACEA | |||||||||||||||
| Lepeophtheirus ed wardsi Wilson C.B., 1905 | 3 | 3.61 | 0.04 | 1 | - | - | - | - | 3 | 2.38 | 0.02 | 1 | B | satélite | HPIA:149 |
| Caligus sp. | 4 | 4.82 | 0.23 | 4.75 | 6 | 13.95 | 0.28 | 2.00 | 10 | 7.94 | 0.25 | 3.10 | B | satélite | HPIA:150 |
AM= Abundancia media, HP= Hospederos parasitados, IM= Intensidad media, P%= Porcentaje de prevalencia de infección, SI= sitio de infección: B=branquias, C=ciego intestinal, I=intestino, M=mesenterio.
RESULTADOS
La población de H. niphobles recolectada para este estudio estuvo compuesta por 126 individuos, de los cuales el 66% fueron machos (n=83) y el 34% fueron hembras (n=43). La longitud total de los hospederos presentó rangos de 17.5 cm - 27.5 cm (22.69 ± 1.25 cm). Los machos estuvieron en el rango de 17.5 cm - 28.38 cm (22.63 ± 1.36 cm) y las hembras 18.4 cm - 26.4 cm (27.74 ± 1.39 cm). El peso de los peces osciló en el rango de 125 g - 318.2 g (200.62 ± 47.88 g). Los machos estuvieron en el rango de 125 g - 318.2 g (201.1 ± 48.29 g) y las hembras 125 g - 231.7 g (178.63 ± 48.13 g) (Fig. 1).
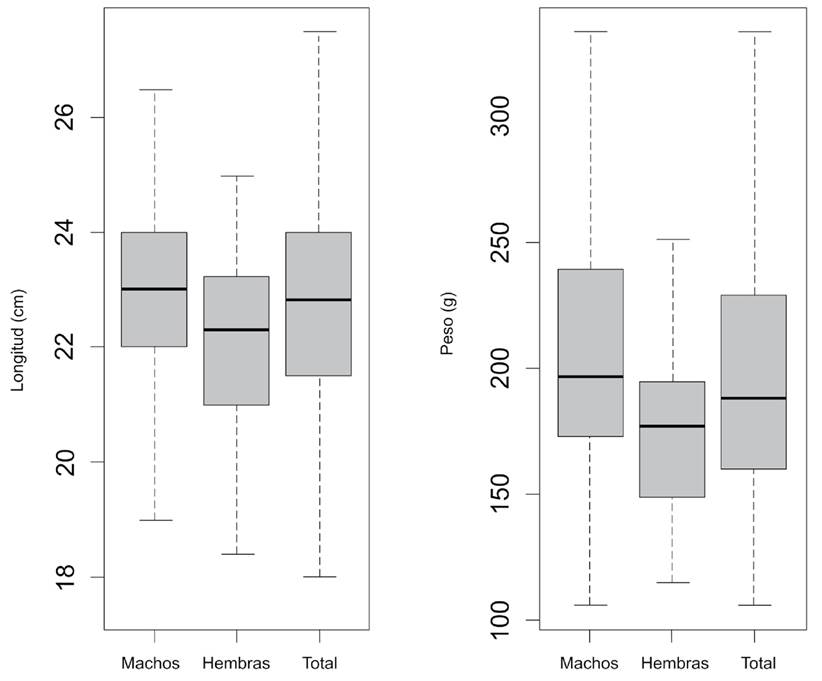
Figura 1 Diagrama de cajas para la longitud (cm) y el peso (g) de machos, hembras y total en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú.
La comunidad de parásitos en el mero manchado estuvo compuesta en su totalidad por monogeneos, trematodos, cestodos, acantocéfalos (Fig. 2) y crustáceos distribuidos en ocho especies entre endoparásitos y ectoparásitos. El monogeneo Microcotyle sp. fue el parásito con el mayor porcentaje de prevalencia (P=65.87%), la mayor abundancia media (AM=3.68) y la mayor intensidad media de infección (IM=5.59) en toda la comunidad parasitaria, seguido por el trematodo Helicometrina nimia Linton, 1910 (P=24%, n=30). Solo Microcotyle sp. fue la única especie considerada núcleo debido a la alta prevalencia, por encima del 45%. Las seis especies restantes presentaron prevalencias por debajo del 10% y se consideraron como especies raras o satélites (Tabla 1).

Figura 2 Especies representativas de helmintos parásitos en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú. A. Microcotyle sp., B. Benedenia sp., C. Helicometrina nimia Linton, 1910, D. Neobothriocephalus aspinosus Mateo & Bullock, 1966, E. Corynosoma australe Johnston, 1937.
La mayor P%, AM e IM de los parásitos estuvo presente en el grupo de los peces machos excepto para Caligus sp. que mostró mayores valores en el grupo de las hembras. La población de parásitos en los machos estuvo compuesta por ocho especies, mientras que en las hembras, solo cinco especies (Tabla 1).
El índice ID muestra que las especies Microcotyle sp. y H. nimia no se distribuyen homogéneamente en la población del mero, por el contrario, presentaron una distribución del tipo agregada o contagiosa (ID > 1), que es lo esperado en las especies parasitas en general, mientras que el índice DP señala que H. nimia presentó mayor grado de agregación (DP=0.85) que Microcotyle sp. (DP=0.72) lo indica que H. nimia tuvo mayor concentración en pocos hospederos y que la mayoría de los hospederos no estuvo infectada por esta especie (Tabla 2).
Tabla 2 Índices de agregación para evaluar la dispersión de los parásitos más prevalentes el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú.
| Índice | Microcotyle sp. | Helicometrina nimia |
| Índice de Dispersión (ID) | 15.14 | 3.34 |
| p/interpretación | Agregación | Agregación |
| Índice de discrepancia de Poulin (DP) | 0.72 | 0.85 |
| interpretación | Agregación | Agregación |
| Exponente K binomial negativo (K) | 0.44 | 0.23 |
| p/interpretación | 0.03/* | 0.97/agregación |
* Es difícil interpretar el K para estos datos, ya que la distribución K no se ajusta a ellos.
La diversidad, riqueza, abundancia, equidad y estimación de la riqueza muestran valores más bajos en la población de peces hembras que en los machos, mientras que en el componente comunitario total (machos y hembras) se observó una diversidad moderada según Shannon (H=0.66). El estimador Chao-1 muestra que el nivel de esfuerzo fue el esperado en la población de machos y en la población total, pero no en las hembras (Tabla 3).
Tabla 3 Índices de diversidad alfa para los parásitos según el sexo y la población en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú.
| Índices de Diversidad Alfa | Machos | Hembras | Total |
| (n=83) | (n=43) | (n=126) | |
| Riqueza | 8 | 5 | 8 |
| Abundancia | 382 | 187 | 569 |
| Shannon H | 0.65 | 0.67 | 0.66 |
| Equitabilidad J | 0.33 | 0.41 | 0.34 |
| Chao-1 | 8.5 | 6 | 8 |
La longitud total de H. niphobles examinados en este estudio no se evidenció relación con la P, AM e IM de Microcotyle sp. y H. nimia. Así mismo, no se observó algún grado de dependencia entre el sexo del hospedero y los parámetros parasitológicos. Solo la IM de Microcotyle sp. se encontró fuertemente relacionada de manera positiva (p = 0.01) con el peso de H. niphobles (Tabla 4).
Tabla 4 Correlación de la longitud total (LT), el peso (P) y el sexo en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) vs la prevalencia (P), Abundancia media (AM) e Intensidad media (IM) parasitaria adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú.
| Parámetros morfométricos vs parámetros parasitológicos | Microcotyle sp. | Helicometrina nimia Linton, 1910 | |
| LT vs. P | r (Spearman) | 0.13 | 0.49 |
| p | 0.76 | 0.22 | |
| LT vs AM | r (Pearson) | 0.13 | 0.49 |
| p | 0.75 | 0.22 | |
| LT vs IM | r (Pearson) | 0.22 | 0.63 |
| p | 0.60 | 0.09 | |
| Peso vs P | r (Spearman) | 0.27 | 0.22 |
| P | 0.52 | 0.61 | |
| Peso vs AM | r (Pearson) | 0.71 | 0.30 |
| P | 0.05 | 0.47 | |
| Peso vs IM | r (Pearson) | 0.85 | 0.24 |
| P | 0.01 | 0.56 | |
| Sexo vs P | X2 | 0.07 | 0.78 |
| p | 0.79 | 0.54 | |
| Sexo vs AM | t student | 0.22 | -0.12 |
| p | 0.84 | 0.90 | |
| F (Levene) | 0.15 | 0.08 | |
| p | 0.70 | 0.77 | |
| Sexo vs IM | t student | 0.32 | 0.99 |
| p | 0.75 | 0.33 | |
| F (Levene) | 0.13 | 3.66 | |
| p | 0.72 | 0.07 | |
F= Prueba de Levene, p= nivel de significancia, r=correlación, t= Prueba de t de Student, X2= Prueba de Chi cuadrado.
La ordenación NMDS, que evalúa el patrón en la estructura de la comunidad parásita en función de la abundancia de especies de parásitos con respecto al sexo, sugiere un alto grado de homogeneidad entre las comunidades (Fig. 3). El análisis de PERMANOVA confirma la baja heterogeneidad entre la comunidad de parásitos y el sexo del hospedero (Pseudo-F=0.5, p=0.73).
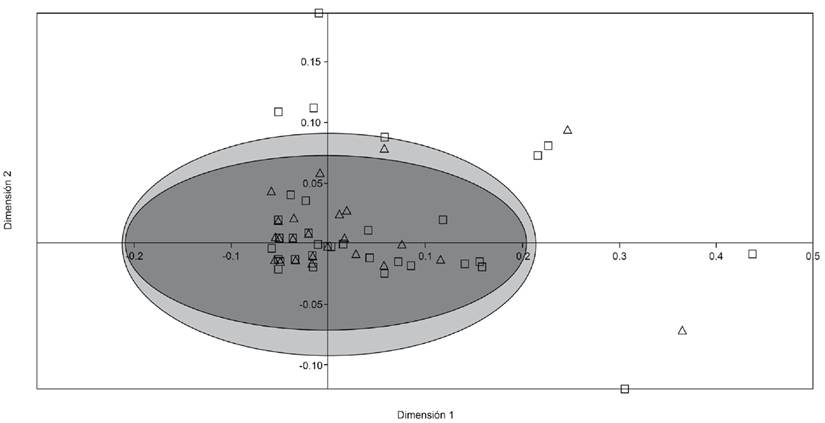
Figura 3 Escalamiento multidimensional no métrico (NMDS) trazando los resultados del sexo en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú.(∆ = hembras, □ = machos) en términos de su abundancia parasitaria. Similitud de Bray Curtis.
El ACP indica que en el componente 1 se encontró una mayor asociación principalmente entre la LT, P, H. nimia y C.australe, mientras que en el componente 2 ocurrió una mayor asociación principalmente entre N. aspinosus y Caligus sp. (Fig. 4). Los resultados del ACP evidencian una baja asociación entre la mayoría de las variables con cada uno de los dos componentes principales (KMO = 0.52; Prueba de Bartlett, X2 = 52.75, p=0.20).

Figura 4 Análisis de Componentes principales (ACP) que relaciona los resultados de la longitud total y el peso en el mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) adquiridos en la terminal pesquera de Pucusana, distrito de Pucusana, Lima, Perú con las abundancias de ocho metazoos evaluados. Lo = longitud total, P = peso. M = Microcotyle sp., B =Benedenia sp., H =Helicometrina nimia Linton, 1910, D = Digeneo no id., N =Neobothriocephalus aspinosus Mateo & Bullock, 1966, Co =Corynosoma australe Johnston, 1937, L = Lepeophtheirus edwarsi Wilson C.B., 1905, Ca = Caligus sp.
DISCUSIÓN
El mero manchado Hyporthodus niphobles (Gilbert & Starks, 1897) fue nombrada anteriormente como Epinephelus niphobles Gilbert & Starks, 1897 y Epinephelus peruanus Chirichigno, 1963 (Chirichigno, 1978; Thomson et al., 1979). En la actualidad estas tres especies fueron sinonimizadas a H. niphobles, la cual es la única especie aceptada (Froese & Pauly, 2018; WoRMS Editorial Board, 2019).
Actualmente existen 18 especies de peces del género Hyporthodus Gill, 1861 (Parenti & Randall, 2020), distribuidas entre el Océano Pacífico, Atlántico e Indico (Froese & Pauly, 2018; Parenti & Randall, 2020). De estas especies, solo tres: Hyporthodus nigritus (Holbrook, 1855), H. niveatus (Valenciennes, 1828) y H. flavolimbatus (Poey, 1865), tienen algún registro de parásitos, los cuales han sido enfocados al grupo taxonómico de los monogeneos, específicamente en los Diplectanidos del género Pseudorhabdosynochus Yamaguti, 1958 (Santos et al., 2000; Kritsky et al., 2015).
Todos los registros parasitarios en las tres especies de peces fueron realizados en el Golfo de México y las costas de Brasil, es decir, solo hay registros de parásitos en los peces del género Hyporthodus en el Océano Atlántico y no para el Pacífico, por lo que este sería el primer estudio en abordar la comunidad de parásitos en el género Hyporthodus para el Pacífico.
A pesar de que los monogeneos Dactylogyridea son frecuentes y específicos de peces de la familia Serranidae del Atlántico (Kritsky et al., 2015) y del Pacífico (Justine et al., 2010), en este estudio no se ha observado presencia de estos monogeneos, solo se encontraron miembros de las familias Microcotylidae Taschenberg, 1879 y Capsalidae Baird, 1853. En estudios similares a éste, dónde también fueron evaluados peces pertenecientes a la familia Serranidaeen Perú, e.g. Acanthistius pictus (Tschudi, 1846), Alphestes afer (Bloch, 1793), Hemilutjanus macrophthalmos (Tschudi, 1846), Paralabrax humeralis (Valenciennes, 1828) tampoco fueron encontrados monogeneos del grupo Dactylogyridea (Tantaleán & Lefevre, 2004; Iannacone & Alvariño, 2009; Luque et al., 2016; Ferré-Alcántara et al., 2019).
En relación a los índices parasitológicos en H. niphobles, la especie más importante fue Microcotyle sp. debido a los valores más altos de P, AM e IM de infección observados en este pez. En las costas del Pacífico Occidental han sido reportadas cuatro especies del género Microcotyle: M. nemadactylus Dillon & Hargis, 1965, M. neozealanica Dillon & Hargis, 1965, M. oceanica Caballero, Bravo & Grocott, 1953 y M. sebastis Goto, 1894, parasitando las branquias de peces perciformes, scorpaeniformes y beloniformes (Lamothe-Argumedo et al., 1997; Eiras et al., 2016). En Perú solo ha sido registrado M. nemadactylus en Cheilodactylus variegatus Valenciennes, 1833 en la localidad de Lima (Luque et al., 2016). Iannacone et al. (2003) evalúan la fauna parasitaria de C. variegatus en el cual también encuentran a una especie del género Microcotyle (M. nemadactylus) la cual, al igual que lo observado en este estudio, fue la especie núcleo o central en la comunidad parasitaria de C. variegatus.
Por otro lado, el tipo de distribución de Microcotyle sp. y H. nimia fue clasificada como agregada por los índices ID y DP, lo cual era lo esperado para estas especies con P mayor a 10% debido a que la agregación es el patrón predominante en todos los sistemas naturales de parásitos huésped (Anderson, 1982; Shaw & Dobson, 1995; Poulin, 2011; Bego & Von-Zuben, 2010).
También fue observada la falta de asociación entre la longitud de H. niphobles, y su carga parasitaria, la cual sugiere que otros factores ecológicos locales pueden ser más influyentes en la regulación de la comunidad de parásitos en este hospedero, lo cual fue confirmado mediante ACP. Este resultado es una excepción a lo mencionado por Poulin (2011), quien indica que los hospederos de mayor tamaño pueden proporcionar un mayor suministro de nutrientes a los parásitos y, por consecuencia, los más susceptibles a una mayor abundancia y diversidad parasitaria.
Asimismo, se observó una alta homogeneidad entre las comunidades de metazoos parásitos de H. niphobles. Las comunidades de parásitos generalmente no exhibieron diferencias claras en la abundancia con relación al sexo de H. niphobles, lo cual es corroborado con la ordenación NMDS y el PERMANOVA. Míguez-Lozano et al. (2012) sugiere que las diferencias en las características ambientales locales durante el período de evaluación, la dispersión espacial de sus huéspedes intermedios y las etapas de vida de los parásitos en el área son factores que podrían explicar la baja o alta heterogeneidad en las comunidades de parásitos de los huéspedes.
En esta evaluación hubo una mayor dominancia por parte del monogeneo Microcotyle sp., considerado como especie principal o nuclear. El mismo patrón de dominancia fue observado por Iannacone et al. (2003) en C. variegatus. El valor de Chao-1 señala que el componente comunitario total no requiere incrementar el tamaño de la muestra, debido a que se encontró el 100% de las especies esperadas. Este índice está influenciado y es sensible a las especies raras y posiblemente la presencia de seis especies raras encontradas en este estudio, expliquen que el tamaño de la muestra estudiada haya sido el óptimo (Escalante, 2003).
Otra especie con los mayores índices parasitológicos fue el trematodo H. nimia, el cual tiene una amplia distribución geográfica y de hospederos (Roumbedakis et al., 2014). Las familias de peces que usualmente usa como hospedero son las familias Serranidae, Pomodasydae, Scorpaenidae y Clinidae (Inzunza et al., 1989). A pesar de la amplia gama de hospederos, esta especie no ha sido reportada en este hospedero, haciendo que este sea el primer estudio en el que se reporta a la especie H. nimia parasitando al género Hyporthodus y por ende a la especie H. niphobles.
Por otro lado, la presencia de formas inmaduras del acantocéfalo Corynosoma australe Johnston, 1937 y las formas adultas del trematodo H. nimia y el cestodo Neobothriocephalus aspinosus Mateo & Bullock, 1966, puede considerarse como una marca de un nivel intermedio en la red alimenticia de H. niphobles, como lo mencionan Robertson y Allen (2015), quienes informan que la dieta de H. niphobles incluye peces óseos, crustáceos móviles bentónicos (camarones/cangrejos), pulpos, calamares, sepias.
En conclusión, la comunidad de parásitos en H. niphobles se diversificó entre especies raras, secundarias y centrales; de las cuales Microcotyle sp. y H. nimia fueron las más prevalentes y exhibiendo una distribución tipo agregada. No se ha encontrado asociación entre sus índices parasitológicos y los parámetros morfométricos de su hospedero, excepto entre la IM de Microcotyle sp. y el peso, probablemente debido a la influencia de otros actores no evaluados en este estudio. Por otra parte, al no encontrar en la literatura registro alguno de especies de parásitos en H. niphobles ni en sus sinónimos (Epinephelus niphobles, E. peruanus y E. niveatus), se le atribuye a este pez como nuevo hospedero para todas las especies de helmintos y crustáceos parásitos colectados y reportados en este estudio. Finalmente, los autores incentivan a continuar con este tipo de estudios, los cuales permitirán tener una mejor comprensión de la interacción de organismos parásitos y los meros.











 nueva página del texto (beta)
nueva página del texto (beta)



