INTRODUCCIÓN
En México, la pesca dirigida o incidental de tiburones y rayas constituye una actividad importante desde el punto de vista económico y social (Castillo-Geniz et al., 1998; Bizzarro et al., 2009a; Ramírez-Amaro et al., 2013), debido a la generación de empleos en las diferentes fases de la cadena productiva, iniciando con la captura hasta la comercialización de productos y subproductos pesqueros; así como a los efectos económicos indirectos en empleos por fabricación, reparación, venta y distribución de embarcaciones, motores, de materiales para la pesca y transformación, entre otros (DOF, 2007).
La pesquería comercial de batoideos en el Golfo de California es relativamente reciente, ya que fue hasta finales de los años 80’s cuando comenzó esta actividad (Márquez-Farías & Blanco-Parra, 2006; Ramírez-Amaro et al., 2013). A principio de los años 90’s, debido a una disminución en la captura del tiburón Rhizoprionodon longurio (Jordan & Gilbert, 1882) y el aumento en la demanda del recurso en el mercado, los pescadores artesanales iniciaron la captura de diferentes especies de batoideos como especies objetivos, para su posterior comercialización (Cudney-Bueno & Turk-Boyer, 1998; Márquez-Farías & Blanco-Parra, 2006; Ramírez-Amaro et al., 2013).
La pesquería artesanal de batoideos en el Golfo de California se encuentra en desarrollo desde hace varias décadas (Márquez-Farías & Blanco-Parra, 2006), y su captura sigue en incremento hasta la fecha (CONAPESCA, 2016). La pesquería ribereña artesanal de batoideos del estado de Baja California Sur (BCS), se ubica en el tercer lugar a nivel nacional con un 16.8% de las 9483 toneladas registradas para México (CONAPESCA, 2016).
El Golfo de California alberga una diversidad y abundancia relevante de fauna marina, gracias a sus particularidades hidrológicas, geológicas y biológicas, que lo convierten, además, en una de las principales áreas de pesca de México (Castro-Aguirre et al., 1995; Lluch-Cota et al., 2007). Las zonas de fondos rocosos a profundidades menores a los 50 m, ubicadas en la costa occidental del Golfo, incluyendo sus islas aledañas, han sido reseñadas con una alta diversidad íctica, en comparación con la zona oriental del mismo (Barjau et al., 2012; Del Moral-Flores et al., 2013).
La Isla Espíritu Santo (IES) se destaca por su elevada riqueza biológica dentro del conjunto de islas presentes en BCS, y alberga una de las mayores diversidades de peces reportadas para la región, explicada por diferentes factores, entre los que pueden resaltarse: la ubicación geográfica de la isla, alta heterogeneidad de hábitats, entre otros (Del Moral-Flores et al., 2013). En el presente trabajo se determina y actualiza la riqueza específica de batoideos en la zona de estudio. De igual manera, se estudia por primera vez la abundancia relativa de los batoideos capturados regularmente en la IES por la flota de pesca artesanal.
MATERIALES Y MÉTODOS
Área de estudio
El complejo Insular Espíritu Santo está ubicado en la porción suroccidental del Golfo de California, frente a las costas del Estado de Baja California Sur (CONANP, 2000). Este complejo, desde hace más de una década, ha sido declarado Área Federal Protegida con la modalidad de Parque Nacional Archipiélago Espíritu Santo (PNAES), incluyéndola dentro de las Áreas Naturales Protegidas del Golfo de California que forman parte del Patrimonio Natural Mundial de la Humanidad de la UNESCO, siendo el primer Parque Nacional Mexicano en obtener el Certificado Lista Verde de UICN (CONANP, 2000; Olmos-Martínez et al., 2015; Ortega-Rubio et al., 2019), restringiendo la práctica de la pesca artesanal principalmente a la zona sur del PNAES (Figura 1).
La IES es la de mayor extensión de las seis islas que conforman el complejo, y está separada de la península por el canal de San Lorenzo. El litoral oriental de la IES es de bordes escarpados y presenta una sola playa extensa en la zona sur llamada “La Bonanza”. En contraste, el litoral occidental del complejo insular está entrecortado por una docena de pequeñas bahías, ensenadas y caletas que presentan playas arenosas (Arizpe, 1997). El área de muestreo del presente estudio estuvo localizada hacia la zona sur y sureste de la IES, las cuales son áreas frecuentadas por pescadores ribereños para la pesca de tiburones y rayas (Figura 1).
Trabajo de campo
Se realizó un muestreo sistemático con base en campañas mensuales realizadas a bordo de una embarcación de la flota de pesca artesanal, entre octubre de 2013 y diciembre de 2015 (excepto septiembre y noviembre de 2014 y enero de 2015). Las faenas de pesca, con una duración promedio de tres días, fueron independientes de las jornadas de trabajo del pescador. Se utilizaron redes de enmalle de fondo (agalleras) con dos a cuatro lienzos, cada una de 100 m de longitud, 1.5 m de alto y con luz de malla de 25 cm (8"). Las redes fueron colocadas a profundidades entre los 5 y 65 m al atardecer y recuperadas a la mañana del siguiente día. Los ejemplares pertenecientes al género Mobula son especies protegidas por leyes nacionales e internacionales (DOF, 2007; IUCN, 2019), por lo tanto, fueron identificados, contados, y cuando fue posible medidos y pesados en la embarcación, para ser liberados vivos inmediatamente.
Los ejemplares del resto de las especies fueron llevados a la zona de desembarco conocida como campamento “El Morrito” para ser identificados empleando guías generales y específicas para este grupo de peces (Fischer et al., 1995; McEachran & Notarbartolo-di-Sciara, 1995; Castro-Aguirre & Espinosa-Pérez, 1996; Corro-Espinosa & Ramos-Carillo, 2004; Mejía-Falla et al., 2011). Los ejemplares fueron medidos con una cinta métrica (±0.1 cm de precisión) y pesados con una báscula digital marca Rapala modelo Mini Digital Fish Scale (50 libras) (±0.1 kg).
El arreglo sistemático de las especies identificadas y la validación de la nomenclatura científica se realizó de acuerdo con Last et al. (2016) y Fricke et al. (2020). Ejemplares de referencia fueron depositados en la Colección Ictiológica del Centro Interdisciplinario de Ciencias Marinas del Instituto Politécnico Nacional (CI-CICIMAR-IPN), para su respectivo proceso de preservación y asignación de código de registro (http://coleccion.cicimar.ipn.mx/).
Organización de los datos
El tratamiento de datos se realizó tomando en consideración la variación temporal del muestreo. Esto permitió realizar un análisis a diferentes resoluciones temporales mediante el agrupamiento de los datos, así: por mes, por año, por época climática, y por época climática por año.
Para el año 2013 se muestreó solamente en el periodo octubre-diciembre, para el 2014 fueron 10 meses de muestreo (con excepción de septiembre y noviembre) y para el 2015, fueron muestreados todos los meses del año, exceptuando enero. Con base en esto, los meses de muestreo fueron agrupados en épocas climáticas siguiendo el criterio de Guevara-Guillén et al. (2015): época fría 2013-2014 (diciembre 2013 a mayo 2014), época cálida 2014 (junio, julio, agosto y octubre), época fría 2014-2015 (desde diciembre de 2014 a mayo del 2015), época cálida 2015 (junio a noviembre), y para el arreglo mensual, los meses iguales correspondientes de cada año fueron considerados réplicas y agrupados como uno solo. Una vez agrupados los datos, acorde a las diferentes escalas temporales, se realizaron comparaciones entre ellas, promediando los valores de cada muestreo para cada especie capturada en cada una de las épocas o meses, ponderadas por el número total de observaciones correspondientes.
Descripción de la comunidad
La riqueza específica se calculó como el número total de especies capturadas en los muestreos y el peso total se tabuló en aquellas especies para las cuales fue posible realizar el registro completo de la información, con el peso mínimo y máximo por especie junto con su promedio y desviación estándar. De igual forma, se reportó el intervalo de tallas de los individuos por especie y el promedio de tallas capturadas con su desviación estándar. Para los ejemplares cuya única información registrada fue la talla, el peso fue estimado mediante la ecuación de la relación longitud-peso y las constantes a y b para cada especie de acuerdo con lo publicado por Blanco-Parra et al. (2009), Froese et al., (2014) y Ehemann et al. (2017a).
Estandarización del esfuerzo
Dado que el tamaño de la red y el tiempo efectivo de pesca fue relativamente heterogéneo entre los muestreos, la abundancia relativa de la CPUE fue estandarizada a una red de 100m de longitud por hora (x100 como factor de escalamiento) de la siguiente manera:
Donde:
CPUE: |
Captura por Unidad de Esfuerzo empleando la abundancia relativa de los individuos capturados en 100m de red por hora para especie, épocas, años, época por año y meses. |
Ci: |
número individuos capturados en la faena i. |
ti: |
número total de horas de la faena i (horas efectivas de pesca). |
ri: |
metros de la red de pesca en la faena i. |
tst: |
tiempo estándar (1 hora). |
n: |
número total de observaciones (lances) correspondiente a la variable calculada. |
Posteriormente se generó una matriz de abundancia relativa de las especies como captura por unidad de esfuerzo (CPUE), considerando el número ejemplares de cada especie capturados para 100 m de red por hora (CPUE= ind*h-1*100m red-1).
La normalidad de los datos fue verificada empleando la prueba de Shapiro-Wilk. De ser el caso, se realizaron pruebas no paramétricas de Kruskal-Wallis para evaluar diferencias en la CPUE entre las escalas temporales (años, meses, y épocas por años) y entre especies. En los casos en donde hubo diferencias significativas, se realizó una prueba de comparaciones múltiples no paramétrica. Para la escala temporal entre épocas (cálida y fría) se utilizó la prueba de Mann-Whitney.
RESULTADOS
Riqueza específica y peso: durante los 24 meses de estudio, se capturó un total de 2198 batoideos pertenecientes a cuatro órdenes, 10 familias, 10 géneros y 15 especies (Tabla 1). El esfuerzo total aplicado fue de 27560 metros de red y 1763 horas efectivas de pesca o remojo. La biomasa total registrada fue de 8283.8 kg, correspondiente a 1983 individuos capturados, medidos y pesados (Tabla 1). La diferencia del 9.7% en el número de ejemplares cuantificados y los empleados para la estimación del peso, se debe a que 190 ejemplares del género Mobula fueron devueltos al mar inmediatamente, sumado a 26 individuos de otras especies que se encontraron depredados por otros animales mientras permanecieron en la red.
Tabla 1 Número total de individuos de batoideos capturados y pesados por
especie (n). AD: ancho de disco; LT: longitud total;
Min: mínimo; Max: máximo;  : promedio y DE:
desviación estándar.
: promedio y DE:
desviación estándar.
El orden mejor representado fue Myliobatiformes (seis familias, seis géneros y 11 especies), cuya mayor riqueza específica (tres especies) fue registrada para el género Urobatis spp; mientras que Gymnura sp. y Rhinoptera sp. presentaron sólo una especie. El orden Rhinopristiformes estuvo representado por dos familias (Rhinobatidae y Trygonorrhinidae), dos géneros y dos especies. Los órdenes Torpediniformes y Rajifomes estuvieron representados por una sola especie (Tabla 1).
Las especies con mayor contribución en peso total fueron: H. dipterurus (3604.4 kg), M. munkiana (2264.8 kg), R. steindachneri (879.6 kg) y N. entemedor (748.4 kg); sin embargo, el peso promedio por individuo fue mayor en H. longus (8.7 kg ±3.5), seguida de H. dipterurus (5.7 kg ±4.1), R. steindachneri (5.2 kg ±3.2) y M. longirostris (5.1 kg ±3.0). Caso contrario fue el registrado para las especies U. concentricus (1.6 kg ±0.6), P. glaucostigma (1.2 kg ±0.6), U. halleri (0.9 kg ±3.2) y U. maculatus (0.5 kg ±0.2), las cuales contribuyeron con los menores valores de biomasa (Tabla 1).
Abundancia relativa (CPUE): La CPUE difirió significativamente en todas las escalas temporales excepto para meses, esto es: épocas (U(1, n= 112)= 1074; p= 0.007), años (H(2, n= 112)= 27.933; p= 0.0001), épocas por años (H (3, n= 99)= 30.755; p= 0.0001). La CPUE fue mayor durante la época cálida (Me= 54.4 ind*h-1*100m red-1) que durante la época fría (Me= 22.5 ind*h-1*100m red-1; Tabla 2; Figura 2a). El año 2015 registró la CPUE más alta (Me= 66.8 ind*h-1*100m red-1), estadísticamente diferente (p= 0.0001) de los otros dos años de estudio (Figura 2b).
Tabla 2 Valores del tamaño de muestra válido (n), mediana (Me), media, mínimos (Mín) y máximos (Máx) de la CPUE (# ind*h-1*100m red-1) para las distintas temporalidades calculadas.
| Temporalidad | n | Me | Media | Mín | Máx | |
|---|---|---|---|---|---|---|
| Épocas | Cálida | 48 | 54.4 | 74.5 | 5.9 | 309.2 |
| Fría | 64 | 22.5 | 40.6 | 2.2 | 240.0 | |
| Años | 2013 | 14 | 17.7 | 20.9 | 6.4 | 58.0 |
| 2014 | 48 | 20.3 | 41.6 | 2.2 | 309.2 | |
| 2015 | 50 | 66.8 | 77.7 | 5.8 | 281.3 | |
| Épocas por años | Fría (2013-2014) | 37 | 14.5 | 19.2 | 2.2 | 64.2 |
| Cálida (2014) | 15 | 41.4 | 77.8 | 5.9 | 309.2 | |
| Fría (2014-2015) | 21 | 46.1 | 67.8 | 5.8 | 240.0 | |
| Cálida (2015) | 26 | 69.4 | 84.8 | 8.6 | 281.3 | |
| Meses | Enero | 7 | 20.7 | 32.5 | 3.0 | 64.2 |
| Febrero | 10 | 33.5 | 49.8 | 11.1 | 107.4 | |
| Marzo | 14 | 13.7 | 26.0 | 2.3 | 151.1 | |
| Abril | 10 | 15.3 | 21.4 | 2.2 | 49.4 | |
| Mayo | 7 | 42.8 | 76.5 | 12.6 | 240.0 | |
| Junio | 7 | 41.4 | 76.2 | 9.3 | 278.8 | |
| Julio | 8 | 54.8 | 91.4 | 6.4 | 281.3 | |
| Agosto | 9 | 63.6 | 54.7 | 5.9 | 86.4 | |
| Septiembre | 3 | 67.0 | 76.9 | 62.5 | 101.3 | |
| Octubre | 11 | 58.0 | 111.4 | 8.9 | 309.2 | |
| Noviembre | 10 | 31.5 | 36.4 | 8.4 | 90.5 | |
| Diciembre | 16 | 40.6 | 47.4 | 6.4 | 125.5 |
La CPUE estimada para la temporada fría 2013-2014 registró las capturas más bajas (Me= 14.5 ind*h-1*100m red-1), difiriendo significativamente con la época fría 2014-2015 (Z= 3.921; p= 0.0001) y cálida 2015 (Z= 5.131; p= 0.0001); sin embargo, no presentó diferencia con respecto a la época cálida 2014 (Tabla 2; Figura 2c). La mayoría de los meses fríos (enero, marzo y abril) presentaron las CPUEs más bajas (Tabla 2; Figura 2d).
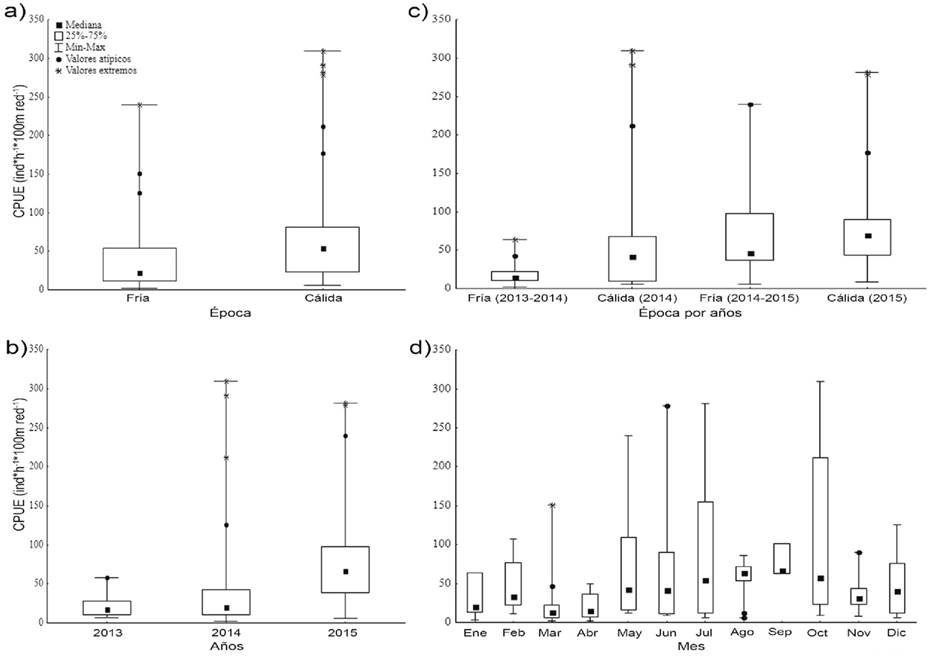
Figura 2 Variación de la CPUE de batoideos en la Isla Espíritu Santo: a) estacional-global, b) interanual, c) estacional-año, d) intermensual.
Mobula munkiana (Me= 10.9 ind*h-1*100m red-1) e H. dipterurus (Me= 8.8 ind*h-1*100m red-1) presentaron los mayores valores de CPUE, seguidas por N. entemedor (Me= 6.1 ind*h-1*100m red-1) y R. steindachneri (Me= 5.3 ind*h-1*100m red-1).
Únicamente la CPUE de M. munkiana y H. dipterurus presentaron diferencias significativas con respecto a las demás especies. Para M. munkiana con R. steindachneri (Z= 3.516; p<0.05), N. entemedor (Z= 3.8; p<0.05), Z. exasperata (Z=5.087; p<0.001), H. longus (Z= 6.119; p<0.001), Myliobatis longirostris (Z= 4.674; p<0.001), U. halleri (Z= 4.4; p<0.01), G. marmorata (Z= 3.577; p<0.05) y U. maculatus (Z= 3.823; p<0.05). Por otro lado, H. dipterurus con Z. exasperata (Z= 4.315; p<0.01), H. longus (Z= 5.370; p<0.001), M. longirostris (Z= 4.061; p<0.01) y U. halleri (Z= 3.820; p<0.05).
Los valores de la mediana de CPUE de cada especie para cada factor temporal estudiado se detallan en la Tabla 3.
Tabla 3 Valores de la mediana (Me) de la CPUE (ind*h-1*100m red-1) para las distintas temporalidades calculadas por especie. Los valores más altos están resaltados en negrita. Especie (Sp.); Cálida (C); Fría (F); 2013 (13); 2014 (14); 2015 (15); Enero (E); Febrero (F); Marzo (Mz) Abril (Ab); Mayo (My); Junio (Jn); Julio (Jl); Agosto (Ag); Septiembre (S); Octube (O); Noviembre (N); Diciembre (D); Pseudobatos glaucostigma (P.g); Zapteryx exasperata (Z.e); Narcine entemedor (N.e); Rostroraja velezi (R.v); Gymnura marmorata (G.m); Hypanus dipterurus (H.d); Hypanus longus (H.l); Urobatis concentricus (U.c); Urobatis halleri (U.h); Urobatis maculatus (U.m); Myliobatis californica (M.c) Myliobatis longirostris (M.l); Rhinoptera steindachneri (R.s); Mobula mobular (M.mo) y Mobula munkiana (M.mu).
| Época | Años | Época por año | Meses | ||||||||||||||||||
| Sp. | C | F | 13 | 14 | 15 | F 13-14 | C 14 | F 14-15 | C 15 | E | Fe | Mz | Ab | My | Jn | Jl | Ag | S | O | N | D |
| P.g | 5.1 | 6.5 | 0.0 | 0.0 | 5.4 | 0.0 | 0.0 | 5.2 | 5.1 | 0.0 | 0.0 | 0.0 | 3.9 | 2.6 | 7.7 | 4.0 | 5.4 | 4.8 | 0.0 | 0.0 | 13.8 |
| Z.e | 3.3 | 3.8 | 2.1 | 3.8 | 4.9 | 3.7 | 2.9 | 3.9 | 4.9 | 3.9 | 2.5 | 2.6 | 0.0 | 6.2 | 13.8 | 3.8 | 2.7 | 7.2 | 0.0 | 1.7 | 3.0 |
| N.e | 6.4 | 6.7 | 2.6 | 5.8 | 12.9 | 6.7 | 6.0 | 3.9 | 9.8 | 7.8 | 10.1 | 2.3 | 4.9 | 7.4 | 7.5 | 14.0 | 10.6 | 12.1 | 4.3 | 2.2 | 6.6 |
| R.v | 4.7 | 3.0 | 0.0 | 1.9 | 5.3 | 0.0 | 1.9 | 3.0 | 7.5 | 0.0 | 0.0 | 3.0 | 0.0 | 0.0 | 4.7 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| G.m | 2.4 | 3.6 | 0.0 | 11.8 | 3.5 | 0.0 | 0.0 | 7.7 | 2.4 | 0.0 | 3.6 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 3.9 | 2.4 | 0.0 | 2.4 | 3.5 |
| H.d | 15.7 | 18.0 | 8.6 | 9.2 | 20.6 | 6.3 | 5.8 | 34.4 | 18.1 | 4.7 | 21.4 | 4.5 | 11.2 | 15.1 | 15.0 | 3.8 | 27.6 | 4.8 | 13.6 | 21.6 | 10.5 |
| H.l | 4.4 | 3.1 | 3.1 | 3.1 | 4.8 | 3.1 | 4.9 | 3.0 | 6.1 | 1.5 | 2.4 | 2.2 | 3.1 | 3.6 | 4.1 | 8.0 | 4.1 | 4.8 | 6.4 | 2.8 | 4.1 |
| U.c | 4.0 | 1.7 | 0.0 | 1.8 | 5.4 | 1.7 | 1.9 | 0.0 | 5.4 | 0.0 | 0.0 | 1.7 | 0.0 | 0.0 | 2.6 | 1.9 | 5.4 | 9.6 | 0.0 | 0.0 | 0.0 |
| U.h | 3.0 | 2.8 | 2.1 | 0.0 | 3.4 | 2.1 | 0.0 | 0.0 | 3.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 2.5 | 3.5 | 0.0 | 2.4 | 4.3 | 0.0 | 2.1 |
| U.m | 2.2 | 3.3 | 0.0 | 0.0 | 2.4 | 0.0 | 0.0 | 3.3 | 2.2 | 0.0 | 0.0 | 0.0 | 0.0 | 2.6 | 0.0 | 2.0 | 0.0 | 2.4 | 0.0 | 0.0 | 0.0 |
| M.c | 2.4 | 0.0 | 0.0 | 0.0 | 2.4 | 0.0 | 0.0 | 0.0 | 2.4 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 5.6 | 2.0 | 0.0 | 0.0 | 0.0 | 2.4 | 0.0 |
| M.l | 2.6 | 3.7 | 1.6 | 4.3 | 2.6 | 3.7 | 5.0 | 2.8 | 2.6 | 0.0 | 3.7 | 2.9 | 2.8 | 3.7 | 2.6 | 0.0 | 0.0 | 0.0 | 0.0 | 1.6 | 0.0 |
| R.s | 6.0 | 5.0 | 0.0 | 5.0 | 11.7 | 3.7 | 7.2 | 38.1 | 4.8 | 20.0 | 8.5 | 2.9 | 2.5 | 7.3 | 2.9 | 21.2 | 3.3 | 0.0 | 7.4 | 2.9 | 0.0 |
| M.mo | 0.0 | 1.9 | 0.0 | 0.0 | 1.9 | 0.0 | 0.0 | 1.9 | 0.0 | 0.0 | 0.0 | 0.0 | 1.9 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| M.mu | 30.5 | 10.6 | 20.4 | 9.2 | 30.5 | 4.5 | 28.4 | 28.5 | 30.4 | 0.0 | 5.6 | 11.1 | 6.1 | 16.2 | 43.6 | 42.1 | 36.8 | 31.2 | 54.6 | 25.8 | 9.5 |
DISCUSIÓN
Riqueza específica
A la fecha se han descrito 646 especies de batoideos a nivel mundial (Last et al., 2016; Weigmann, 2017), con reportes actuales de 98 especies (15.2%) para la Zona Económica Exclusiva de México, de los cuales el 8.5% (55 especies) se distribuyen en el Pacífico mexicano y Golfo de California (Ehemann et al., 2018). Para el Golfo de California han sido reportadas 36 especies de batoideos, 31 de las cuales ocurren en la Bahía de La Paz (Abitia-Cárdenas et al., 1994; Balart et al., 1995; Castro-Aguirre & Balart, 1997; Del Moral-Flores et al., 2013; Lara-Mendoza et al., 2016; Last et al., 2016; González-Acosta et al., 2018; Burgos-Vázquez et al., 2019a).
Investigaciones relacionadas con batoideos en la IES han aumentado en años recientes (Burgos-Vázquez et al., 2017, 2018, 2019a; 2019b; Ehemann et al., 2017a; 2017b; 2019;). Del Moral-Flores et al. (2013) reportó ocho especies de batoideos para la IES [i.e. Diplobatis ommata (Jordan & Gilbert, 1890), Narcine entemedor, Z. exasperata, Urobatis concentricus, U. halleri, Dasyatis dipterura (Hypanus dipterurus), Aetobatus narinari (Euphrasen, 1790) actualmente Aetobatus laticeps (Gill 1865) y M. munkiana]. Recientemente, Ehemann et al. (2017a) incluyeron a las especies, Myliobatis longirostris Applegate & Fitch 1964, M. californica, Gymnura marmorata, H. longus y Rhinoptera steindachneri a la lista de batoideos para la IES. La presente investigación adiciona las especies M. mobular, P. glaucostigma, R. velezi y U. maculatus, incrementando la riqueza conocida de batoideos de la IES a 17 especies (47.2% de las reportadas para el Golfo de California). Esto la convierte en la isla de mayor riqueza específica de batoideos en todo el Golfo de California, seguida de la Isla Cerralvo con 13 especies (36.11%; Del Moral-Flores et al., 2013).
La riqueza específica de batoideos reportada para la IES así como para Isla Cerralvo, puede estar relacionada con la presencia de “bajos” o montañas submarinas y de arrecifes rocosos en las Islas. Esto se asocia con hábitats que favorecen una alta diversidad y abundancia de alimento, así como procesos de enriquecimiento, producto del corte y transporte vertical de las corrientes, remolinos del Golfo de California, entre otros, que incrementan los recursos tróficos potenciales para la comunidad de batoideos (Del Moral-Flores, 2010; Restrepo-Gómez, 2017; Cabrera-Meléndez, 2018; González-Rodríguez et al., 2018; Ehemann et al., 2019).
El orden Rajiformes contribuye con la mayor riqueza específica global entre los batoideos y los condrictios (Nelson et al., 2016; Weigmann, 2016; Weigmann, 2017); sin embargo, en el presente estudio este taxón estuvo representado únicamente por la especie R. velezi. Una posible explicación a dicho resultado es que los rájidos se distribuyen generalmente en profundidades promedio de 300m (Robertson & Allen, 2015), en comparación a la máxima profundidad (63 metros) a la que fueron caladas las redes de pesca en este estudio.
Peso y abundancia relativa (CPUE)
Los valores reseñados como atípicos y extremos por los estadísticos (Figura 2) pueden ser asociados a procesos etológicos y migratorios característicos de M. munkiana, como ha sido descrito para la IES y para diversas zonas del Pacífico Occidental (Notarbartolo-di-Sciara, 1988; Francis & Jones, 2016; Díaz-Palacios, 2018).
Las diferencias interespecíficas en peso son el resultado de la biomasa individual. Aunque H. dipterurus con un ancho de disco menor comparado con M. munkiana, su peso promedio fue mayor. Caso similar ocurrió con H. longus, cuyo peso promedio individual fue mayor que el de ejemplares de tallas más grandes de otras especies.
Valadez-González (2007) reportó para la costa de Jalisco siete especies de batoideos en común con esta investigación, pero con tallas y biomasas menores a este estudio. Estas diferencias posiblemente se deben a los diferentes artes de pesca empleados para la captura de los organismos en ambos estudios (redes de arrastre camaroneros vs. red de enmalle).
La mayor abundancia relativa de batoideos registrados en el presente estudio ocurrió durante la época cálida (Tabla 3), lo cual contrasta con lo previamente documentado para la costa oriental de BCS (Bizzarro et al., 2009a). Estos autores señalan las mayores capturas durante marzo-mayo (119 individuos) y enero-febrero (95 individuos), lo cual corresponde con nuestra época fría. Estas diferencias podrían ser atribuidas, al arte de pesca empleado y al diseño del muestreo utilizados en cada estudio. En el presente estudio el diseño de muestreo fue sistemático (tres años continuos de muestreo, dirigido exclusivamente a especies de batoideos), mientras en el estudio de Bizarro et al. (2007) los muestreos fueron de oportunidad, dado que el mayor esfuerzo de pesca estuvo dirigido a la captura de tiburones durante el verano y otoño, limitando la captura de batoideos.
Sin embargo, los resultados obtenidos en el presente estudio son congruentes con otras localidades del Golfo de California, específicamente para las costas de Sonora, donde la mayor captura de batoideos se presentó durante los meses de junio-agosto (60.7 individuos/barco/viaje), coincidiendo con la época cálida (Tabla 3; Bizarro et al., 2009b).
Los cambios en la temperatura superficial del mar del Golfo de California, la cual se expresa diferencialmente entre periodos (Bizzarro et al., 2009a; 2009b; Barjau et al., 2012) también constituyen una explicación fundamental en las diferencias o similitudes encontradas con la presente investigación. En la Bahía de La Paz, la variabilidad térmica puede presentar intervalos de hasta 10oC entre los meses de menor y mayor temperatura (Guevara-Guillén et al., 2015), siguiendo un patrón relacionado con el ciclo estacional de la radiación solar sobre la Bahía (Reyes-Salinas et al., 2003). Particularmente, en el año 2014, las condiciones oceanográficas en la Bahía de La Paz estuvieron afectadas por varios eventos naturales (e.g. año Niño, huracán Odile), fenómenos que pudieron tener un efecto reflejado en las bajas capturas obtenidas durante ese año, en comparación con el 2015 (Tabla 3).
Los resultados obtenidos referentes a las diferencias temporales en la CPUE permiten soportar la explicación originada por la dominancia de las principales especies capturadas en aguas locales (Tabla 3). Por ejemplo, M. munkiana está presente con mayor abundancia durante los meses cálidos (74.2%) aunque se presenta durante todo el año. Variaciones en la abundancia de esta especie han sido relacionadas con procesos migratorios, alimenticios o reproductivos (Serrano-López, 2009). Lo mismo se presenta para otras especies de batoideos en el Pacífico mexicano, entre ellas P. productus (Villavicencio-Garayzar, 1993a), N. entemedor (Villavicencio-Garayzar, 1993b) y R. steindachneri (Bizzarro et al., 2007).
Por otro lado, las mayores capturas de M. munkiana (24.7% del total) e H. dipterurus (20.3%), concuerdan con lo reportado por Bizzarro et al. (2009a) para otras zonas del Golfo de California (M. munkiana= 30.8% e H. dipterurus= 12.1%). Estos autores observaron que en varios campos pesqueros existía una pesca dirigida hacia algunas especies de mobúlidos (especialmente M. munkiana) en primavera e invierno. Por otra parte, en las costas de Sonora, las mayores CPUE correspondieron principalmente a P. productus (46.3%), seguido de H. dipterurus (15.7%), Gymnura spp. (12.9%) y R. steindachneri (11%) (Bizzarro et al., 2009b), lo cual difiere de lo encontrado en este estudio. Las diferencias entre las capturas de las costas de Sonora y BCS, podrían ser explicadas o influenciadas por las características del hábitat, artes de pesca empleados, tipo de muestreo, entre otras. Además, la plataforma continental del lado oriental del Golfo de California es de mayor amplitud con respecto a la que se encuentra en las costas occidentales del Golfo, lo cual podría favorecer una mayor concentración de batoideos de hábitos bentónicos y someros, como el caso de P. productus, en comparación con M. munkiana, especie de hábitos pelágicos.
Las especies dominantes con base en la abundancia relativa durante el periodo de estudio fueron M. munkiana e H. dipterurus. En el caso de M. munkiana, su alta abundancia puede ser explicada por su comportamiento gregario, el cual está ampliamente documentado en la literatura (Notarbartolo-di-Sciara, 1988; Díaz-Palacios, 2018), donde se han reportado agregaciones masivas en el sur del Golfo de California con fines reproductivos. Con respecto a H. dipterurus, su alta abundancia podría estar influenciada por el tipo de arte de pesca utilizado y la ubicación del mismo en la columna del agua. Es de resaltar que esta es una de las pocas especies de batoideos con captura dirigida en el área de estudio.
A pesar que no se encontraron diferencias estadísticas en la CPUE entre meses, las medianas fueron más altas en el trimestre agosto-octubre, periodo posterior a la veda de este recurso pesquero para la zona de estudio (mayo-julio). Por lo tanto, la implementación de la veda nacional podría tener una implicación favorable en la pesca sustentable de este recurso pesquero, otorgando un “descanso” al constante esfuerzo de captura que se mantiene sobre estas especies por parte de la pesca artesanal en la zona estudiada. Durante este tiempo de veda, el esfuerzo pesquero artesanal es canalizado y dirigido a otros recursos marinos locales, principalmente al conocido como pescado de escama (e.g. Lutjanus spp., Centropomus spp., Mugil spp., entre otros). Este tiempo también es aprovechado para la reparación/adquisición de aparejos de pesca (e.g. agalleros) o de sus embarcaciones. Este tipo de rotación de recursos marinos ha sido previamente documentado para otras pesquerías artesanales de batoideos costeros-demersales (Tagliafico et al., 2013; Tagliafico et al., 2016).
Finalmente, las mayores abundancias relativas de batoideos en los meses de verano (mayo a septiembre) se sobreponen parcialmente con la veda nacional (mayo a julio), sugiriendo un efecto de protección para estas especies al reducir la presión pesquera durante estos meses. A este efecto de menor presión se suma que algunas especies en la zona desarrollan parte de su ciclo reproductivo durante los meses de verano, otorgando esta veda tiempo para el desarrollo de procesos de apareamiento, ovulación y nacimiento de Rhinoptera steindachneri (Burgos-Vázquez et al., 2018) y de ovulación y crecimiento embrionario en Narcine entemedor (Burgos-Vázquez et al., 2017). Sin embargo, para evitar un efecto de rebote en la CPUE al finalizar la veda, y así permitir que el efecto positivo de ésta se refleje en el reclutamiento y el tamaño poblacional de las especies, es importante mantener un control o límite del esfuerzo pesquero que se ejerce en los meses posteriores a la veda.











 nueva página del texto (beta)
nueva página del texto (beta)