INTRODUCCIÓN
Algunas de las principales especies de moluscos bivalvos que se producen en México están representadas por los ostiones y las almejas (SAGARPA, 2016), las cuales, son destinadas al mercado local y en algunos casos, constituyen la única fuente de ingresos para muchas familias de los campos pesqueros ubicados en los márgenes de las bahías. De los bivalvos nativos explotados comercialmente destacan: Crassostrea corteziensis (Hertlein, 1951) (ostión de placer, Ostreidae) Anadara spp. (pata de mula, Arcidae), Atrina spp. (callo de hacha, Pinnidae), Chione spp. (almeja roñosa, Veneridae) y Megapitaria spp. (almeja chocolata, Veneridae) (SAGARPA, 2015). Las últimas estadísticas de producción de la almeja chocolata Megapitaria squalida (Sowerby, 1835) en Sinaloa, indican un volumen total de 5,083 toneladas (CONAPESCA, 2018). Específicamente en Bahía Altata, Sinaloa, la captura promedio anual de M. squalida en 2009 fue de 41.22 toneladas, sin embargo, se presentó un colapso en el volumen de extracción en 2014 y 2017, años en los que se registraron solo 1.18 y 2.82 toneladas, respectivamente (CONAPESCA, 2018), lo que sugiere la acción de factores como la sobreexplotación, que han afectado su población; aunque la contaminación de su hábitat (Muñoz-Sevilla et al., 2017) y las enfermedades provocadas por parásitos (Góngora-Gómez et al., 2016) también deben ser considerados en la reducción de su población.
La afección de patógenos en moluscos es descrita con diversos signos que van desde el simple desarrollo de la enfermedad (Navarro-Barrera, 2011), daño en tejidos (Aguirre-Macedo et al., 2007) y perforaciones de la concha (Gallo-García et al., 2004), hasta mortalidades masivas (Enríquez-Espinoza et al., 2010). Cáceres-Martínez et al. (2010) concluyeron que el protozoario Perkinsus marinus (Levine, 1978) representa uno de los mayores riesgos en la industria ostrícola. De hecho, Enríquez-Espinoza et al. (2010) reportaron que la mortalidad masiva registrada en más de 30 granjas de ostión de la costa de Sonora durante 2006, estuvo asociada con la presencia de este parásito. Los bivalvos que han sido infectados en el Golfo de California por diversas especies de Perkinsus incluyen poblaciones silvestres de ostiones (Cáceres-Martínez et al., 2008; 2012), almejas (Enríquez-Espinoza et al., 2015) y callos de hacha (Góngora-Gómez et al., 2016); además de ostiones cultivados (Enríquez-Espinoza et al., 2010; Villanueva-Fonseca & Escobedo-Bonilla, 2013).
A pesar de los reportes acerca de la presencia de este protozoario en moluscos de la costa sureste del Golfo de California (Villanueva-Fonseca & Escobedo-Bonilla, 2013; Góngora-Gómez et al., 2016), de la facilidad con que se transmite horizontalmente entre huéspedes de diferentes especies (Villalba et al., 2004; OIE, 2012) y de ser la presunta causa de mortalidades en moluscos comerciales del noroeste de México (Enríquez-Espinoza et al., 2010; Cáceres-Martínez & Vázquez-Yoemans, 2012), no existe información disponible del estado sanitario de M. squalida en Sinaloa con relación a la presencia de Perkinsus sp., por lo que es prioritario registrar su posible aparición y grado de infección en la población silvestre de esta almeja mantenida en el refugio pesquero de bahía de Altata, Municipio de Navolato, Sinaloa, donde regularmente se siembran semillas producidas en laboratorio con fines de repoblación. Por lo tanto, la determinación de la prevalencia y grado de infección de Perkinsus sp. con relación a la talla de la almeja M. squalida del refugio pesquero de bahía de Altata, Sinaloa, representa el objetivo de la presente investigación.
MATERIALES Y MÉTODOS
La bahía de Altata se encuentra dentro del sistema lagunar Altata-Pabellones, Navolato, Sinaloa (Fig. 1), entre las coordenadas 24º 20´ y 24º 40´ de latitud norte y los 107º 30´ y 108º 00´ longitud oeste (CAADES, 1996). La siembra se realizó introduciendo 5,000 semillas de almeja chocolata (5.73 mm altura de la concha y 0.03 g de peso inicial) donadas por el Instituto Sinaloense de Acuacultura y Pesca (ISAPESCA), en el corral acuícola (10 X 5 metros) ubicado dentro del refugio pesquero en la bahía de Altata (Fig.1).
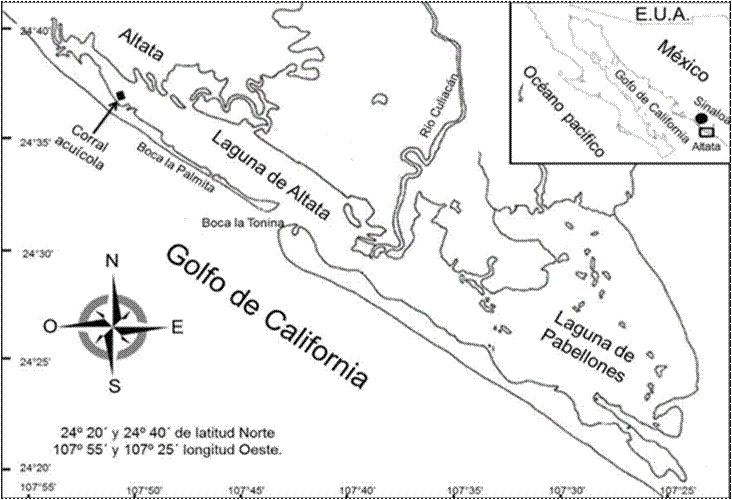
Figura 1 Localización geográfica del corral acuícola frente a la bahía de Altata-Ensenada del Pabellón, Navolato, Sinaloa.
Las semillas fueron aclimatadas y sembradas siguiendo el método descrito por Góngora-Gómez et al. (2012) para especies bentónicas. Después de los primeros cuatro meses de mantenimiento en bolsas mosquiteras contenidas en canastas ostrícolas, las almejas fueron esparcidas dentro del corral. Cada mes durante 18 meses (junio 2015 a noviembre 2016), se recolectaron al azar 60 almejas del refugio pesquero mediante buceo libre (semiautónomo).
De las conchas, se obtuvieron la longitud (distancia desde la zona anterior hasta la zona posterior de la concha), altura (distancia desde el umbo hasta la parte más distal de la concha) y ancho (la parte más amplia de la concha por el lado dorsal) utilizando una regla vernier de precisión digital (0.01 mm, Mitutoyo, CD-8” CS) (Figura 2). El peso total individual se registró con una balanza granataria (0.01 g, OHAUS, Scout Pro SP 2001).
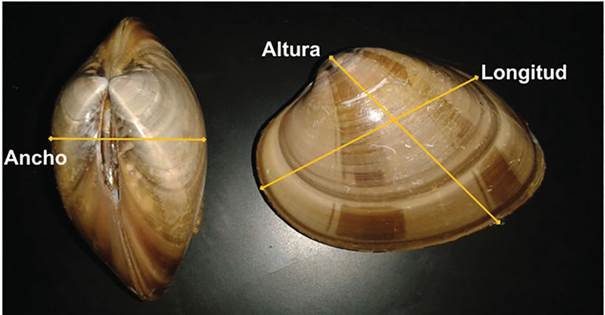
Figura 2 Medidas biométricas (longitud, altura y ancho de la concha) de Megapitaria squalida (Sowerby, 1835).
Mensualmente, se obtuvieron los parámetros fisicoquímicos in situ: la salinidad se registró con un refractómetro de precisión (Atago, S/ Mill, Japón); el pH se obtuvo con un potenciómetro (HANNA, HI 8314, USA); el oxígeno disuelto y la temperatura del agua se midieron con un oxímetro (YIS, 55/12 FT, Ohio 45387); la profundidad y transparencia con un disco Secchi; y para la temperatura ambiente, se utilizó un termómetro de mercurio. Para la clorofila a (Cla), las muestras de agua se analizaron de acuerdo al protocolo descrito por Strickland & Parsons (1972) y los cálculos usando la ecuación de Jeffrey & Humphrey (1975).
Para determinar la presencia de posibles hipnosporas de Perkinsus sp. en M. squalida, se preparó medio fluido de tioglicolato de Ray (MFTR), el cual, es considerado la mejor técnica para la detección de este protozoario (OIE, 2009) por su alta sensibilidad y bajo costo. El MFTR se enriqueció con dextrosa y cloruro de sodio siguiendo las concentraciones recomendadas por la OIE (2016): Para 610 ml de H2O destilada, se agregaron 18.17 g de MFTR, 17.81 g de dextrosa y 12.2 g de NaCl. Posteriormente, se disolvieron los compuestos aplicando calor y agitación en un termo-agitador y el medio se esterilizó usando una autoclave (120 °C) por 15 minutos a una atmósfera de presión. Después, se adicionaron antibióticos (pemprocilina a 500 U ml-1 y estreptomicina a 500 U ml-1), se vertieron 25 ml de medio preparado en tubos de 50 ml y como antifúngico, se aplicó Nistatina a 400 U ml-1 directamente en el tubo (OIE, 2016).
Las muestras de tejido (glándula digestiva, branquias y manto) recolectadas mensualmente, fueron colocadas en tubos de 50 ml conteniendo MFTR y antibióticos. Los tubos se incubaron en oscuridad a temperatura ambiente durante 4-7 días. Después, los fragmentos de tejido se maceraron con una hoja de bisturí estéril sobre un portaobjetos de vidrio, se añadió solución yodada de Lugol, para finalmente, contar el número de presuntas hipnosporas mediante observación al microscopio (10X). La intensidad de infección por Perkinsus sp. se calculó con el uso de la escala de Mackin (1962) (Tabla 1).
Tabla 1 Escala de Mackin para calcular la intensidad de infección (Ray, 1954).
| Nivel | No. de células de Perkinsus marinus (Levine, 1978) |
| 1 | 0 (no infectada) |
| 2 | 1 a 10 células (leve) |
| 3 | 11 a 30 células (moderada) |
| 4 | 31 a 100 células (alta) |
| 5 | Más de 101 células (muy alta) |
La prevalencia de la infección (P, %) por Perkinsus sp. se obtuvo aplicando la fórmula de Thrusfield (1995): P = (Número de organismos infectados/No. total de organismos analizados) X 100. Para confirmar la identidad del parásito se realizó un análisis de ADN con la técnica de PCR. Para eso, se extrajo ADN del tejido de branquia (50-100 mg) utilizando el método de DNAzol® siguiendo las indicaciones del fabricante (Molecular Research Center, Inc. Cincinnati OH, USA). Se aplicó la técnica de la reacción en cadena de la polimerasa (PCR; OIE, 2009), utilizando los oligonucleótidos PerkITS85 (5’-CCG CTT TGT TTG GAT CCC-3’) y PerkITS750 (5’-ACA TCA GGC CTT CTA ATG ATG-3’) (SIGMA-ALDRICH) que amplifican la región espaciadora transcrita interna (internal transcribed spacer, ITS) del rARN ribosomal de Perkinsus sp., obteniendo un producto de 703 pares de bases (pb) (OIE, 2009). Los componentes de la reacción fueron los siguientes: My Taq Reaction Buffer 5X (BIOLINE), My Taq DNA Polymerasa 1 U (Bioline Cat. B10 21105 y 1 μM de cada oligonucleótido. Para la reacción, se usaron 100 ng de ADN molde. Estos iniciadores detectan cualquier especie del género Perkinsus sp. excepto P. qugwadi sp. nov. (incertae sedis) (OIE, 2009). El volumen de cada reacción fue de 25 µL.
El ADN extraído del ostión Crassostrea viginica (Gmelin, 1791) infectado por P. marinus fue utilizado como control positivo; mientras que el control negativo consistió en la mezcla de reacción de la PCR sustituyendo el ADN por agua estéril. Las condiciones de amplificación fueron las siguientes: desnaturalización inicial a 95 ºC por 5 min; 35 ciclos de 94 ºC por 1 min, 60 ºC por 1 min y 72 ºC por 1 min; y extensión final de 72 ºC por 5 min. Los productos de PCR fueron separados por electroforesis en gel de agarosa al 1 % y visualizados con bromuro de etidio (1 μg ml-1) bajo luz UV.
Se realizaron pruebas de normalidad (Kolmogorov-Smirnov) y homoscedasticidad (Bartlett) para analizar los datos obtenidos. Las diferencias entre los promedios de cada indicador biométrico de M. squalida (n = 60 almejas cada mes durante 18 meses), se obtuvieron con las pruebas de ANOVA y de Tukey. La relación entre las variables fisicoquímicas, prevalencia e intensidad de la infección fueron obtenidas usando la correlación de Pearson. Para analizar los datos se utilizó el programa STATISTICA 8, a un nivel de confianza de 95%.
RESULTADOS
Los intervalos de las variables ambientales fueron: temperatura 20-32.5 °C, salinidad 29.8-35‰, pH 5.15-7.84, oxígeno disuelto 3.07-9.56 mg l-1, profundidad y transparencia 0.7-1.8 m y clorofila a 0.6-11.7 mg m-3. Ninguno de los parámetros mostró correlación con la prevalencia de Perkinsus sp. (r = -0.15, r = 0.22, r = 0.37, r = -0.10, r = 0.11 y r = 0.04, respectivamente). Después de 18 meses, las almejas alcanzaron las siguientes medidas: largo de la concha = 59.6 mm, altura de la concha = 46.2 mm, ancho de la concha = 27.5 mm y peso total = 52.6 g. Al igual que los parámetros ambientales, las variables biométricas de M. squalida no mostraron correlación con la prevalencia mensual del parásito (r = -0.37, r = -0.24, r = 0.40 y r =-0.34, respectivamente). La detección de Perkinsus sp. por medio de la técnica MFTR mostro células esféricas en el microscopio (10X) de color oscuro indicando la presencia de presuntas hipnosporas del patógeno en los primeros 17 meses (Figuras 3 y 4). La intensidad de la infección fluctuó desde 0 células (junio 2015) hasta 2.2 células (octubre 2016). En promedio, la intensidad total fue de 2 (1-10 esporas, Mackin, 1962), considerándose leve.

Figura 3 Presuntas hipnosporas de Perkinsus sp. (10X) en tejido de Megapitaria squalida (Sowerby, 1835) mostrando un grado de infección 2 en la escala de Mackin (Ray 1954).
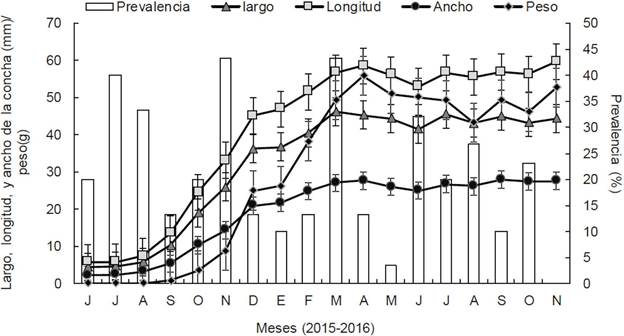
Figura 4 Prevalencia (%) de Perkinsus sp. y parámetros biométricos [largo, longitud y ancho de la concha (mm) y peso (g)] de la almeja chocolata Megapitaria squalida (Sowerby, 1835) registrada durante los 18 meses de cultivo en el corral acuícola de bahía de Altata, Navolato, Sinaloa.
La prevalencia no mostró tendencia o relación con la talla de la almeja (Fig. 4).
Para la confirmación de Perkinsus sp. mediante la técnica de PCR, se analizaron 112 muestras (positivas con MFTR) de M. squalida presuntamente infectadas por el protozoario, pero ninguna resultó positiva (Figura 5).
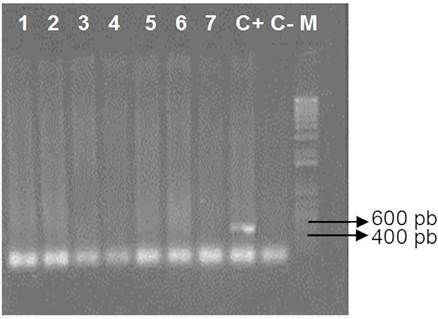
Figura 5 Diagnóstico molecular de Perkinsus sp. en gel de agarosa (1%). Detección de la región ITS del rRNA de Perkinsus sp. por PCR en Megapitaria squalida (Sowerby, 1835) de la bahía de Altata, Navolato, Sinaloa. Carriles 1-7) muestras negativas de Perkinsus sp.; C+ Control positivo de Perkinsus sp.; C- Control negativo y M) Marcador de peso molecular.
DISCUSIÓN
La prevalencia e intensidad de infección de Perkinsus sp. fue determinada en M. squalida desde juveniles recién producidos en laboratorio, hasta almejas que, por la talla alcanzada después de 18 meses en el refugio pesquero, pueden considerarse como adultas (Álvarez-Dagnino et al., 2017). La presencia del parásito en el primer mes (20% de prevalencia) y su ausencia en el último muestreo, sugieren que la almeja chocolata pudiera ser infectada con diferentes grados de intensidad, independientemente de su talla, lo cual, es contradictorio a lo encontrado por Taskinen & Valtonen (1995) y Yee-Duarte et al. (2017) quienes reportaron que la intensidad infecciosa de diversos parásitos aumenta con la talla y edad de las almejas Anodonta piscinalis (Nilsson, 1823) y M. squalida, respectivamente. La prevalencia e intensidad de infección encontradas para la almeja chocolata en este trabajo sugieren que en comparación con otros moluscos bivalvos (Aguirre-Macedo et al., 2007; Gullian-Klanian et al., 2008; Enríquez-Espinoza et al., 2010; Pineda-García, 2011; Luz et al., 2018), pudiera ser poco susceptible a Perkinsus spp., lo cual, coincide con las conclusiones reportadas por Sotelo-López (2014) y Sandoval-Rivera (2016) en M. squalida colectada cerca de la zona de este estudio. La prevalencia de la infección mostró tres picos (julio y noviembre 2015 y mayo 2016) durante el estudio sin presentar tendencia estacional, coincidiendo con Brandao et al. (2013) para Crassostrea rhizophorae (Guilding, 1828). Burreson & Ragone-Calvo (1996) y Villalba et al. (2005) mencionan que la dinámica de infección del parásito está fuertemente asociada a la aparición de amplios intervalos en la temperatura (<20 y >30 ºC) y la salinidad del agua (<15 y >35‰), lo cual, es común en el Golfo de México donde se cultiva el ostión americano C. virginica. En nuestro trabajo, los intervalos fluctuaron de 20 a 32.5°C para la temperatura y de 29.8 a 35‰ para la salinidad sin presentar correlación con los indicadores de infección, lo que sugiere que dichos parámetros no alteraron la relación huésped-parásito más allá de los valores de prevalencia e intensidad infecciosa obtenidos.
La detección de esferas redondas y oscuras en M. squalida, características de presuntas hipnosporas de Perkinsus sp. mediante MFTR, indicaron la presencia en lugar de infección del parásito, sin embargo, no se confirmó al probar las muestras positivas con PCR. Algunos autores mencionan que esto puede deberse a una baja intensidad infecciosa del parásito y/o a la poca cantidad de ADN del patógeno usada en la prueba (Burreson, 2008; Sanil et al., 2012; Villanueva-Fonseca & Escobedo-Bonilla, 2013; Enríquez-Espinoza et al., 2015). Dantas-Neto et al. (2015) reportó mayores prevalencias de infección de Perkinsus sp. en C. rhizophorae (Guilding, 1828) utilizando MFTR comparado con PCR, en dos esteros de Brasil. Por lo anterior, se considera que el método de MFTR es más sensible que el PCR (OIE, 2009) en la detección de presuntas hipnosporas de Perkinsus sp. Enríquez-Espinoza et al. (2015) mencionan que para tener resultados positivos con la prueba de PCR, es necesario que la infección sea moderada o mayor según la escala de Mackin (Ray, 1954), lo cual, no sucedió en este estudio.
Los resultados obtenidos pueden ser discutidos analizando algunos factores externos e inherentes a la almeja. Por ejemplo, Villalba et al. (2004) mencionan que la fase de vida libre del parásito se caracteriza por células biflageladas que forman parte del plancton, es decir, se encuentran suspendidas en la columna de agua. Por otro lado, el hábitat bentónico de la almeja implica que una vez asentada en el fondo arenoso, donde permanece enterrada gran parte de su vida, reduciría la posibilidad de contacto entre el bivalvo con Perkinsus sp. Por otro lado, la mayor parte de las mortalidades reportadas para moluscos comerciales por este protozoario, se refieren a ostiones (Villalba et al., 2011; Da Silva et al., 2014; Scardua et al., 2017), moluscos cuyos tejidos corporales son más blandos que los que presenta M. squalida. Lo anterior sugiere una mayor dificultad de Perkinsus sp. para penetrar los tejidos de la almeja, sin embargo, es necesaria la realización de estudios al respecto para confirmarlo.
Aunque la prevalencia e intensidad de infección fueron bajas, la detección de Perkinsus sp en M. squalida de la Bahía de Altata, Sinaloa, plantea la necesidad de establecer un programa de monitoreo para conocer el estado sanitario de esa población de almejas en dicho lugar, ya que cambios ambientales y/o efectos antropogénicos conjuntamente con cambios en la dinámica de infección de este patógeno u otros, pudieran poner en riesgo su condición fisiológica y tolerancia a ser infectado. De hecho, es recomendable monitorear sanitariamente otras especies de moluscos en la zona para prevenir y/o evitar una posible transmisión debido a la fácil dispersión del patógeno entre diferentes especies de moluscos (Villalba et al., 2004; OIE, 2012).
El presente trabajo representa el primer informe de la presencia de Perkinsus sp. en M. squalida en la costa central de Sinaloa, considerando, además, la dinámica de la infección con relación a la talla de la almeja. Sin embargo, es importante realizar otros estudios aplicando diversas técnicas como histología, hibridización in vitro u otras herramientas moleculares ( Shridhar et al., 2013; Aranguren & Figueras, 2016; Guo & Ford, 2016) para conocer el papel como huésped de la almeja en la posible dispersión del protozoario en el refugio pesquero de bahía Altata, Sinaloa y en la entidad en general. En conclusión, la prevalencia de Perkinsus sp. no mostró relación con el desarrollo de M. squalida y la intensidad de la infección fue leve (grado 2). Se infiere que la almeja chocolata presentó baja susceptibilidad al protozoario.











 nueva página del texto (beta)
nueva página del texto (beta)


