Introducción
En los últimos años, la pesca de Haliotis spp. ha declinado en todo el mundo, mientras que el cultivo de estos gastrópodos ha aumentado de manera significativa (Gordon & Cook, 2013). Actualmente, se han implementado programas de cultivo de varias especies, para lo cual es esencial el control efectivo de la reproducción (Morse, 1984), que incluye, entre otras cosas, el mejoramiento en la calidad de los gametos y la estimación de la fecundidad. En Haliotis spp. esta estimación ha sido definida como fecundidad absoluta, equivalente al número total de ovocitos maduros presentes en la gónada (Litaay & De Silva, 2003; Bilbao et al., 2010), y como fecundidad potencial, equivalente al número total de ovocitos presentes en la gónada (Guzmán del Próo et al., 2001). Ambos son parámetros necesarios para evaluar la tasa de fertilización, la proporción óptima de ovocitos y espermatozoides, la tasa de reclutamiento y la tasa de eclosión, así como el efecto de la dieta y de las variables ambientales en la calidad de los desoves y en la capacidad reproductiva de los organismos (Witthames et al., 2009).
En México, el abulón azul, Haliotis fulgens Philippi, 1845, y el abulón amarillo, Haliotis corrugata W. Wood, 1828, son las especies más importantes para la pesquería (Guzmán-del Próo, 1992; Arreguín-Sánchez et al., 2006). Como en todo el mundo, su pesca ha colapsado sustancialmente a partir del siglo pasado (Guzmán-del Próo, 1992). La información relacionada con su fecundidad es importante debido a que su conocimiento puede contribuir al mejor desarrollo del cultivo de estas especies; sin embargo, sólo se ha realizado un estudio en el abulón amarillo, H. corrugata (Ortiz-Quintanilla et al., 1987), en el cual se encontraron diferencias en la fecundidad, correlacionadas a la diferencia de años, atribuida por los autores al grado de madurez de los organismos. En cuanto a H. fulgens, Guzmán del Próo et al. (2001) reportaron la fecundidad en Bahía Tortugas y Ortiz-Quintanilla et al. (1987) en isla Cedros. Cabe señalar que en estos trabajos se utilizaron organismos en todas las fases de madurez gonádica, las cuales se determinaron mediante un estudio del índice gonádico, lo cual indica que sus resultados únicamente estiman la fecundidad potencial.
Los métodos convencionales para estimar la fecundidad de especies marinas incluyen análisis histológicos, gravimétricos y volumétricos con una gran variabilidad de resultados para la misma especie, que además de subestimar o sobrestimar los resultados, no permiten comparar entre autores. Los contadores de partículas y células en dilución son equipos semiautomáticos que permiten estimar el número y el tamaño de partículas y células en suspensión de manera confiable y rápida, por lo que en las últimas décadas han sido ampliamente utilizados para el monitoreo del crecimiento de cultivos celulares (bacterias, microalgas, etc.), así como para el conteo de células sanguíneas. Estos equipos ya se ha utilizado en el conteo de huevos expulsados en condiciones de laboratorio para estudios de fecundidad, especialmente en una especie de bivalvo (Dreissena polymorpha Pallas, 1771), lo cual comprueba que la fecundidad estimada por ese método está en el rango de la fecundidad estimada por otros (Sprung, 1991).
Este trabajo es el primero que utiliza un contador de células y partículas para determinar el número y el tamaño de ovocitos en Haliotis, lo cual elimina los errores causados por un observador. Además, en el caso de especies que presentan desarrollo gonádico continuo y desoves parciales, permite contar y medir las células, y así estimar tanto la fecundidad absoluta, como la fecundidad potencial. Por consiguiente, el objetivo del presente estudio fue conocer la fecundidad absoluta y potencial de H. fulgens y H. corrugata en hembras con gónadas en fase de madurez identificadas mediante un análisis histológico.
Materiales y métodos
Se realizaron muestreos mensuales, de octubre de 2011 a febrero de 2013, en dos localidades de la costa noroeste del Pacífico mexicano, La Bocana, Baja California Sur (BCS) (26. 8° N, 113.73° O) y Bahía Tortugas BCS (27.67° N, 114.95° O). En cada sitio de muestreo se recolectaron 30 organismos adultos de cada especie, de los que se registró la longitud, la masa total y se extrajo el complejo hepatogonadal, el cual se fijó durante 48 h en formol al 10 % preparado con agua de mar. Posteriormente, se disectó el complejo gónada-hepatopáncreas y se obtuvo el peso húmedo de la gónada con una balanza analítica. Se tomó una muestra de 1 cm de grosor de la porción central de la gónada y fue procesada con técnicas histológicas convencionales, que incluyen la deshidrataron con etanol, la aclaración del tejido con CitriSolv y la inclusión en parafina. Los cortes histológicos, de 5 μm de grosor, se tiñeron con hematoxilina-eosina (Humason, 1979) y se montaron con resina sintética para su observación en el microscopio. Se utilizó el criterio de Vélez-Arellano et al. (2015) para determinar las fases de desarrollo gonádico de ambas especies, el cual describe sus características histológicas. El tejido gonádico de las hembras maduras se lavó en agua marina filtrada (1µm), y con pipetas de vidrio se recolectaron muestras de los ovocitos desprendidos de las trabéculas para colocarlos en tubos eppendorf de 1.5 mL por triplicado. El exceso de agua de las muestras de ovocitos se eliminó por decantación y por absorción con papel absorbente. El peso húmedo de las muestras (0.08 g) se determinó en una balanza analítica. La tasa de dilución óptima de las muestras se estableció con un modelo de regresión lineal (R2 = 0.9376), a partir de diluciones seriales (por triplicado) preparadas con base en una solución de ovocitos de concentración conocida (0.08 g/mL), utilizando como diluyente agua marina filtrada (1µm).
Para cada organismo se prepararon (por triplicado) muestras de ovocitos (200 ml) a una tasa de dilución óptima (0.005 g/mL) con la finalidad de realizar el conteo de ovocitos en el contador de partículas (Multisizer 3) con apertura de 560 µm. El conteo de los ovocitos se realizó en agitación constante para evitar su sedimentación, tal como en la preparación de las muestras en agua marina filtrada.
El flujo de la muestra en el contador de partículas se estableció midiendo el volumen de diluyente desplazado a través de la apertura (560 µm) por unidad de tiempo (min). El flujo resultante fue considerado para estimar la fecundidad absoluta (concentración de ovocitos, σT), de acuerdo con las instrucciones del fabricante del equipo, mediante la siguiente fórmula:
En donde σ representa el número de ovocitos en la muestra, VT es igual al volumen total de la muestra (mL) y f, el flujo (mL/min). El número de ovocitos por unidad de peso húmedo (N) se calculó con base en la concentración de ovocitos calculada (σT) y el peso húmedo de la submuestra de ovocitos (0.005 g).
En donde g representa el peso húmedo de ovocitos de la muestra (en gramos).
La fecundidad (F) se definió como el número total de ovocitos de cada organismo y se estimó con base en el peso húmedo total de la gónada (G) y en el número de ovocitos por unidad de peso (N), como se muestra en la siguiente fórmula:
F = (N) G
Para estimar la fecundidad absoluta se consideró el número total de ovocitos maduros de cada muestra (diámetro entre 150 y 250 µm: Belmar-Pérez y Guzmán del Proó, 1991), y para estimar la fecundidad potencial se consideró el número total de ovocitos de cada muestra (diámetro entre 60 y 250 µm).
Análisis estadístico. El tratamiento de los datos se realizó entre especies, zonas y meses, y sus diferencias se evaluaron con un análisis de comparación de Kolmogorov-Smirnov (p <0.05) (Zar, 2010), por medio del programa Statistica 8.0 (StatSoft Inc., Estados Unidos). Para analizar la posible relación entre la fecundidad absoluta y la fecundidad potencial con el peso del organismo y la longitud, se buscó la curva de mejor ajuste con el paquete estadístico Curve expert versión 1.3 (2008).
Resultados
Del total de la muestra de La Bocana, sólo se encontraron cuatro hembras maduras de abulón azul y dos de abulón amarillo en agosto de 2012 y dos hembras maduras de abulón azul en enero de 2013. En Bahía Tortugas se identificaron cuatro hembras maduras de abulón azul en enero de 2013.
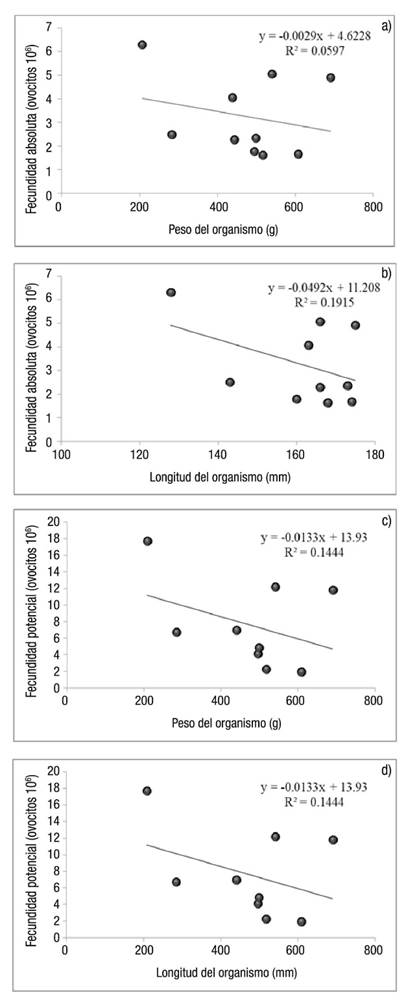
La fecundidad absoluta y potencial de H. fulgens y H. corrugata en La Bocana en agosto de 2012 se muestra en la Tabla 1, en la que destaca una diferencia significativa (p <0.05) entre la fecundidad potencial y la fecundidad absoluta, y donde también se observa que en promedio la fecundidad no varía entre especies; en H. fulgens fue de 5.02 x 106 huevos en la gónada, mientras que en H. corrugata fue de 4.87 x 106 huevos en la gónada. La fecundidad absoluta y potencial de H. fulgens en Bahía Tortugas y La Bocana en enero de 2013 se muestra en la Tabla 1, donde se observa una diferencia de la fecundidad absoluta entre zonas de estudio; en Bahía Tortugas fue de 10.86 x 106, mientras que en La Bocana fue de 4.82 x 106. En el presente trabajo no se encontró una relación estadísticamente significativa entre la fecundidad (absoluta y potencial), y la longitud o el peso del organismo. Sin embargo, se observa una tendencia negativa entre el peso, la talla de los organismos y la fecundidad (Figs. 1a-d).
Tabla 1 Fecundidad potencial y fecundidad absoluta (106) por organismo de Haliotis fulgens Philippi, 1845, en Bahía Tortugas y La Bocana. BCS, México, entre agosto de 2012 y enero de 2013, y fecundidad potencial absoluta de Haliotis corrugata W. Wood, 1828, en La Bocana, BCS, México, en agosto de 2012.
| Localidad | Fecha | FP ±Des | FA ±Des | PG (g) | Long (mm) | PO (g) |
|---|---|---|---|---|---|---|
| La Bocana | 08/2012 | 11.81 ± 1.33 | 4.90 ± 0.12 | 37.8 | 175 | 690.5 |
| H. fulgens | ||||||
| H. fulgens | 08/2012 | 4.11 ± 0.27 | 1.78 ± 0.17 | 14.2 | 160 | 495.0 |
| H. fulgens | 08/2012 | 2.24 ± 0.22 | 1.63 ± 0.04 | 11.9 | 168 | 516.9 |
| H. fulgens | 08/2012 | 1.95 ± 0.99 | 1.67 ± 0.13 | 11.9 | 174 | 608.0 |
| H. fulgens | 01/2013 | 2.28 ± 0.22 | 16.9 | 166 | 443.7 | |
| H. fulgens | 01/2013 | 4.82 ± 2.03 | 2.34 ± 0.62 | 12.7 | 173 | 498.4 |
| Bahía Tortugas | ||||||
| H. fulgens | 01/2013 | 17.68 ± 0.56 | 6.30 ± 0.47 | 37.1 | 128 | 207.2 |
| H. fulgens | 01/2013 | 12.14 ± 1.2 | 5.06 ± 0.33 | 38.4 | 166 | 540.4 |
| H. fulgens | 01/2013 | 6.67 ± 1.31 | 2.5 ± 0.11 | 14.7 | 143 | 283.7 |
| H. fulgens | 01/2013 | 6.96 ± 1.72 | 4.07 ± 0.27 | 25.5 | 163 | 439.7 |
| La Bocana | ||||||
| H. corrugata | 08/2012 | 4.93 ± 1.2 | 1.99 ± 0.3 | 18.5 | 106 | 140.8 |
| H. corrugata | 08/2012 | 4.82 ± 0.32 | 2.19 ± 0.1 | 16.3 | 99 | 94 |
Fecundidad potencial (FP), fecundidad absoluta (FA), Desviación estándar (±Desv), masa de la gónada (PG), longitud total del organismo (Long), masa del tejido húmedo de cada organismo (PO).
Discusión
Durante los meses de muestreo no fue posible capturar un número mayor de hembras en estado de madurez, debido a que estas especies presentan desoves parciales continuos y pocos organismos alcanzan el estadio de madurez, tal como lo informaron Vélez-Arellano et al. (2016), quienes además encontraron que H. fulgens presenta los estadios de desarrollo y desove durante todo el año. Esto se presenta en otras especies como Haliotis tuberculata coccinea Reeve, 1846, en la que la gónada presenta distintos grados de madurez de los ovocitos (Bilbao et al., 2010). El cálculo de fecundidad absoluta se ha realizado en otros trabajos, como el de Bilbao et al. (2010), quienes contaron únicamente ovocitos maduros para estimarla. En el presente trabajo, la fecundidad absoluta en H. fulgens varió entre las zonas de estudio: en Bahía Tortugas fue de 2.49 x 106 ovocitos y en La Bocana, de 2.31 x 106 ovocitos, posiblemente debido a las diferencias en las condiciones ambientales y a la presión pesquera, pues se sabe que la gran variabilidad en la frecuencia de los desoves entre poblaciones de la misma especie, o la de un mismo organismo a lo largo de uno o varios ciclos anuales, puede atribuirse a factores biológicos, ambientales y antropogénicos (Ault, 1985; Giorgi & De Martini, 1977; Molina, 1983; Ortiz-Quintanilla et al., 1987). En este sentido, se ha reportado que la fecundidad para esta misma especie en isla Cedros, durante distintos meses y años, varió de 5.16 x 106 ovocitos, en junio de 1982, a 7.24 x 106 ovocitos, en septiembre de 1984, y a 3.34 x 106 ovocitos, en junio de 1985 (Ortiz-Quintanilla et al., 1987). No obstante, en el presente trabajo la fecundidad absoluta permaneció invariable entre meses, pues tanto en agosto como en enero la fecundidad absoluta fue de 2 x 106 ovocitos. Para H. corrugata, Ortiz-Quintanilla et al. (1987) reportaron variaciones en la fecundidad, de 10.4 x 106 en junio de 1982 a 1.34 X 106 en junio de 1985, diferencia que atribuyen al grado de madurez de los organismos, y que también difieren de los valores de la fecundidad reportada en el presente trabajo, puesto que sólo se consideraron hembras maduras para las dos zonas de pesca estudiadas. Una explicación verosímil para entender estas variaciones en la fecundidad podría ser el cambio ambiental, como el causado por El Niño en 1997 en Bahía Tortugas, en donde, tras realizarse un estudio en H. fulgens, se reportó una fecundidad de 0.99 x 106 a 22.34 x 106 ovocitos (Guzmán del Próo et al., 2001). Al respecto, Kasyanov (2001) menciona que el nivel de máxima fecundidad de una especie se presenta en las condiciones de hábitat más favorables, es decir, cuando los organismos gastan la energía máxima disponible para la reproducción, mientras que Ault (1985) demostró que la fecundidad de organismos silvestres recién capturados de Haliotis rufescens Swainson, 1822, fue tres veces menor que en organismos de talla similar mantenidos en el laboratorio en condiciones óptimas entre 70 y 90 días. Asimismo, en enero de 1973 Poore (1973) reportó que Haliotis australis Gmelin, 1791, presentó una fecundidad entre 0.046 x 106 y 2.91 x 106 ovocitos, en ejemplares cuya longitud varió de 62 a 91 mm; menor a la observada en julio de 1968, cuando fue de 0.19 a 1.38 x106 ovocitos, a longitudes de 67 a 87 mm. El autor lo atribuye a la etapa del ciclo reproductivo en la que se encontraban los organismos. Cabe señalar que para estimar la fecundidad, tanto Poore (1973), como Ortiz-Quintanilla (1987) contaron todos los ovocitos presentes en la muestra, es decir, desde ovocitos previtelogénicos hasta ovocitos maduros, donde los organismos utilizados se hallaban en diferentes grados de madurez gonádica. En el presente trabajo no se observaron diferencias en la fecundidad absoluta de H. fulgens de la misma zona, en distintas temporadas de muestreo, debido a que los organismos analizados se encontraban en la misma etapa reproductiva (madurez) y únicamente se contaron los ovocitos maduros. Sin embargo, sí se observó una diferencia en la fecundidad potencial de H. fulgens entre zonas y en la misma zona, que varió de 17 a 6 millones en Bahía Tortugas y de 11 a 1.9 millones en La Bocana, posiblemente porque se contaron todos los ovocitos presentes en la gónada.
De acuerdo con un análisis de isótopos estables de carbono y nitrógeno, se determinó que los abulones de Bahía Tortugas y de La Bocana presentan diferentes dietas (Vega-García et al., 2016), además existe una clara diferenciación entre la especie de macroalga dominante en cada zona, cuya preponderancia en Bahía Tortugas era de Macrocystis pyrifera (Linnaeus) C. Agardh y de Eisenia arborea J. E. Areschoug, en La Bocana (Vega-García, 2016), por lo que la diferencia en la fecundidad absoluta entre zonas de estudio puede deberse a las condiciones de hábitat y alimentación; sin embargo, la carencia de estudios ecológicos en estas zonas no permite saber cuál de ellas tiene las mejores condiciones para la reproducción.
Estudios previos han encontrado una relación significativa entre la fecundidad y el peso o tamaño del organismo (Poore, 1973; Molina, 1983; Guzmán-del Próo, 2001; Bilbao et al., 2010). En cambio, en el presente trabajo no se encontró relación significativa entre la fecundidad absoluta o potencial y el peso o tamaño del organismo, pero sí se observa una tendencia que demuestra que a menor peso y talla, mayor número de huevos en la gónada, donde, posiblemente, la significancia estadística se deba al tamaño de muestra y a la dispersión de los datos.
Los resultados obtenidos indican que para conocer la fecundidad absoluta de H. fulgens y de H. corrugata se deben analizar las gónadas de todas las hembras sin importar el grado de desarrollo gonádico, pero únicamente se deben considerar los ovocitos maduros, para así tener un tamaño de muestra que permita obtener una relación con el tamaño o masa del organismo.











 nueva página del texto (beta)
nueva página del texto (beta)