Introducción
Los camarones carecen de una respuesta inmune específica o adaptativa, por lo que dependen de su sistema innato para combatir a los patógenos que los afectan. Este sistema incluye la protección por barreras físicas y la defensa interna mediada por efectores celulares (hemocitos) y humorales (plasma) (Tassanakajon et al., 2013). Dentro del sistema humoral se encuentran las lectinas, que actúan como unidades de reconocimiento para facilitar la eliminación de patógenos invasivos y desencadenar diferentes mecanismos de defensa (Wang & Wang, 2013; Lu et al., 2017); entre ellos, aglutinación, fagocitosis mediada por opsonización y encapsulación de virus, bacterias y hongos y activación del estallido respiratorio. Además, las lectinas participan en la activación del sistema profenoloxidasa y algunas pueden presentar actividad antimicrobiana (Wei et al., 2012; Li et al., 2014; Xu et al., 2014a b; Wang et al., 2014).
Los inmunoestimulantes se encuentran disponibles como tratamientos alternativos, que actúan como moléculas de alarma para activar el sistema inmune del camarón (Pais et al., 2008). La mayoría son compuestos químicos que se encuentran como elementos estructurales de bacterias, micelios de hongos y levadura (Alpuche et al., 2005). Los inmunoestimulantes más utilizados para evaluar los efectos que provocan sobre el sistema inmune de camarones forman parte del grupo de los lipopolisacárido (LPS), β-1,3/1,6 glucanos y peptidoglucanos (Amparyup et al., 2016; Chen et al., 2016).
Los glucanos han sido ampliamente utilizados como inmunoestimulantes para aumentar la resistencia de los crustáceos contra las enfermedades virales (Wilson et al., 2015). Se han realizado varios estudios sobre el efecto de los β-1,3 glucanos en algunos factores de la respuesta inmune innata de los camarones (Campa-Córdova et al., 2005; Sukumaran et al., 2010; Sarlin & Philip, 2011; Zhao et al., 2012). De forma similar, los peptidoglucanos han tenido éxito al ser utilizados como imunoestimulantes en los camarones (Itami et al., 2002; Purivirojkul et al., 2006; Pan et al., 2015). Además, en varias investigaciones se ha demostrado que las bacterias del género Bacillus pueden estimular la respuesta del sistema inmune o la resistencia al virus de la mancha blanca (Li et al., 2009; Zhang et al., 2011; Chai et al., 2016). Sin embargo, son pocos los estudios enfocados en evaluar el efecto de los glucanos y de los peptidoglucanos de bacterias y levaduras en la inmunoestimulación de lectinas en camarones (Sritunyalucksana et al., 1999; Pais et al., 2008; Bae et al., 2012). Considerando que los anticuerpos monoclonales antilectina de Macrobrachium rosenbergii (MrL) (De Man, 1879) presentaron reacción cruzada con lectinas de diferentes crustáceos (Pereyra et al., 2009), en este estudio se utilizaron anticuerpos monoclonales contra la lectina de MrL para evaluar el efecto de diferentes inmunoestimulantes sobre la concentración de lectina en la hemolinfa de L. vannamei (Boone, 1931).
Materiales y métodos
Animales. Se utilizaron juveniles de camarón blanco, Litopenaeus vannamei, obtenidos de los estanques de cultivo del Centro de Investigaciones Biológicas del Noroeste (Cibnor, La Paz, Baja California Sur, México). Los camarones fueron aclimatados durante 15 días (antes de iniciar los experimentos) en tanques de fibra de vidrio de 1,500 l con agua de mar filtrada (5 μm) a una temperatura de 28 °C y aireación constante. Los camarones fueron alimentados diariamente ad libitum en la mañana y en la tarde (8:00 am y 5:00 pm) por medio del alimento comercial marca Piasa (La Paz, B.C.S., México) con 35 % de proteína.
Obtención de hemolinfa de camarón para la purificación de lectinas. Previo al bioensayo con inmunoestimulantes, se extrajo hemolinfa a un lote de 30 camarones juveniles de 8.0 ± 0.5 g de peso promedio. A cada camarón se le extrajo un aproximado de 1 ml de hemolinfa sin anticoagulante en la base del pleópodo del primer segmento abdominal, cerca del poro genital. La hemolinfa fue centrifugada a 16,000 g por 30 min para obtener el plasma, el cual se mantuvo en congelación a -4 °C hasta su utilización (Alpuche et al., 2005).
Aislamiento y purificación de lectinas. Las lectinas de L. vannamei se purificaron por cromatografía de afinidad con una matriz de eritrocitos de rata lisados y contenidos en una columna de Sephadex G-25 (15 x 2 cm) mediante el método de Alpuche et al. (2005) modificado. La columna fue equilibrada con solución salina al 0.9%, a la cual se le aplicaron 300 μl de plasma de L. vannamei (previamente incubados 20 min a 37 °C con 300 μl de CaCl2 40 mM) a un flujo de 2 ml min-1. Mientras que el material no retenido fue eluído con solución salina al 0.9% hasta que la densidad óptica a 280 nm de las fracciones colectadas (2 ml) fue menor a 0.001. La lectina fue eluída posteriormente de la columna por medio de ácido acético al 3%.
Caracterización de lectina de L. vannamei . La determinación de proteínas se realizó por el método de Bradford (1976). Las muestras se leyeron a una absorbancia de 570 nm y se calculó la concentración de proteínas en mg ml-1 de suero de camarón.
Determinación del peso molecular de la lectina. Para identificar el grado de homogeneidad y determinar el peso molecular de la lectina, se realizó una electroforesis en gel de poliacrilamida con urea de acuerdo al método descrito por Bollag et al. (1996). La lectina purificada (100 µL o 25 µL, según la turbidez de la muestra) fue precipitada con acetona y ácido tricloroacético (TCA) al 20% y fue suspendida en 20 µL de amortiguador de muestra (Tris-HCl 125 mM, urea 6 M, SDS 4%, glicerol 20%, azul de bromofenol 0.02%, DTT 0.2 M). También se realizó una electroforesis del suero (fracción no retenida y fracción retenida) de acuerdo con el método descrito por Laemmli (1970), en el cual se utilizan geles de poliacrilamida al 10% y dodecil sulfato de sodio (SDS-PAGE). Se usaron 2 µl de agregado de lectina (fracción retenida), 20 µg de suero y 20 µg de la fracción no retenida, los cuales fueron precipitados con TCA al 20 % y acetona, y suspendidos en 15 µL de amortiguador (Sigma). Posteriormente, fueron sometidos a ebullición por 10 minutos. Se utilizaron estándares de peso molecular conocido con un rango de 6.5 a 205 kDa (Amersham Biosciences, Reino Unido). La migración electroforética se realizó aplicando un voltaje constante de 80 V en amortiguador de corrida (TRIS 0.025 M, glicina 0.190 M, SDS 0.2%). El gel se tiñó con plata mediante el kit Bio-Rad Silver Stain (http://www.bio-rad.com/es-mx/product/silver-stains-kits). La migración relativa (Rf) de los estándares y la muestra se calcularon con la fórmula: Rf = distancia de migración de la proteína/distancia de migración del colorante, y para calcular el peso molecular de la lectina purificada se construyó una curva estándar.
Actividad hemaglutinante de la lectina. Se obtuvieron eritrocitos de ratón, rata, conejo, hámster y cuyo del bioterio de la Facultad de Medicina de la UNAM, así como eritrocitos humanos tipo A, B y O del banco de sangre del Instituto Mexicano del Seguro Social (México). Se evaluó la actividad hemaglutinante de lectinas de camarón con base en el método descrito por Alpuche et al. (2005) para Litopenaeus setiferus (Linnaeus, 1767). La actividad hemaglutinante se reportó como el inverso de la última dilución que mostró actividad aglutinante visible. Los ensayos de hemaglutinación también se realizaron en presencia de eritrocitos tratados previamente con sialidasa [0.1 U de sialidasa tipo V de Clostridium perfringens (Sigma Chem. Co., St. Louis, Estados Unidos)] por 0.5 ml de paquete de eritrocitos incubados a 37 °C por 30 min, usando como control positivo lectina Arachis hypogaea (Linnaeus, 1753) (Sigma), y con tripsina (0.5 mg de tripsina Sigma por 0.5 ml de paquete de eritrocitos incubados 1 h a temperatura ambiente, usando como control positivo lectina de amaranto).
Especificidad. La especificidad de la lectina por los azúcares se determinó comparando la actividad inhibitoria de varios carbohidratos (D-Galactosa, D-Galactosamina, N-Acetil-D-Galactosamina, D-Glucosa, D-Glucosamina, N-Acetil-D-glucosamina, D-Manosa, D-manosamina, L-fucosa). Se realizaron diluciones dobles seriadas en solución salina-Calcio del suero de camarón en platos U de microtitulación y se incubaron 30 min a 37 °C con 25 μL de azúcares a 400 mM. Inmediatamente después, se añadieron 25 μL de eritrocitos de conejo al 2% en PBS. La capacidad inhibitoria se expresó en porcentaje de inhibición, que corresponde al porcentaje que disminuyó la actividad hemaglutinante inicial de 512 UHA.
Preparación de inmunoestimulantes. La cepa probiótica de levadura Debaryomyces hansenii [(Zopf) Lodder and Kreger-van Rij, cepa DHHBCS005], que se obtuvo de la Colección de Levaduras Marinas del Cibnor, fue cultivada en 500 ml del medio YPD-caldo (Difco), a 30 °C durante 48 h. La levadura fue suspendida en agua de mar estéril con 0.9 % de NaCl y se determinó la concentración utilizando una densidad óptica de 540 nm en colorímetro (Linson 3) hasta llegar a una absorbancia de 1 para obtener una concentración de 1 x 109 UFC ml-1. A partir de la concentración que se obtuvo, se realizaron las diluciones requeridas en los bioensayos para utilizar una concentración final de 1 x 106 UFC ml-1.
Bacterias del género Bacillus (B. tequilensis Gatson et al., 2006; B. licheniformis Weigmann, 1898; B. endophyticus Reva et al., 2002), que fueron aisladas del intestino de L. vannamei (Luis-Villaseñor et al., 2011) y donadas por el Laboratorio de Patología del Centro de Investigaciones Biológicas del Noroeste, fueron cultivadas en 500 ml de caldo marino, a 30 °C durante 24 h. Las bacterias fueron suspendidas en agua de mar estéril con 0.9 % de NaCl y se determinó la concentración por medio del colorímetro Linson 3, a una longitud de onda de 540 nm hasta llegar a una absorbancia de 0.7 para obtener una concentración de 1 × 109 UFC ml-1. A partir de la concentración obtenida, se realizaron las diluciones requeridas en los bioensayos para utilizar una concen tración final de 1 x 106 UFC ml-1 de cada una de las cepas bacterias. Se hicieron dos mezclas de bacterias: mezcla 1, YC5-2: Bacillus tequilensis (1 x 106 UFC ml-1) y YC3-C Bacillus licheniformis (1 x 106 UFC ml-1); mez cla 2, YC3-B: Bacillus endophyticus (1 x 106 UFC ml-1) y C2-2: Bacillus endophyticus (1 x 106 UFC ml-1).
Se utilizó la laminarina (β-1,3 glucano), que se extrajo de la macroalga Laminaria digitata (Hudson) J.V.Lamouroux, como inmunoestimulante comercial (Sigma # Cat. L-9634). Las suspensiones de β-1,3 glucano se mezclaron en 10 L de agua de mar para obtener una concentración final de 0.5 mg ml-1.
Cultivo de juveniles de L. vannamei tratados con inmunoestimulantes comerciales y Debaryomyces hansenii . Se colocaron 5 grupos con 15 camarones cada uno, con peso promedio de 5 ± 0.1 g en tanques de fibra de vidrio con capacidad de 30 L con agua de mar filtrada a 1 μm con aireación constante y una temperatura de 28 °C ± 0.5. Los 5 tratamientos se agregaron directamente al agua de cultivo cada 48 h durante 12 días de cultivo: 1) Control, sin tratamientos; 2) Laminarina (β-1,3 glucano, 0.5 mg ml-1); 3) mezcla 1 (B. tequilensis, 1 x 106 UFC ml-1; B. licheniformis, 1 x 106 UFC ml-1); 4) mezcla 2 (B. endophyticus, 1 x 106 UFC ml-1; B. endophyticus, 1 x 106 UFC ml-1); 5) levadura (D. hansenii, 1 x 106 UFC ml-1). Los camarones fueron alimentados ad libitum con una dieta comercial (Piasa, 35 % de proteína) dos veces con recambio de agua diario del 60%. Los tratamientos se realizaron por triplicado y se tomaron al azar 3 camarones de cada grupo, a las 24, 48 y 72 h después de la última aplicación de los tratamientos (día 12), para la cuantificación de lectinas.
Obtención de hemolinfa de camarones tratados. A cada camarón se le extrajo una muestra de aproximadamente 0.2 ml de hemolinfa de la base del pleópodo del primer segmento abdominal, cerca del poro genital. Para evitar la coagulación de la muestra se utilizó una solución anticoagulante (SIC-EDTA). El anticoagulante fue diseñado con base en los valores iónicos y osmóticos de la hemolinfa del camarón (450 mM NaCl, 10 mM KCl, 10 mM EDTA-Na2, 10 mM HEPES, pH 7.3, 850 mOsm kg-1) de acuerdo con la técnica descrita por Vargas-Albores et al. (1993). Las muestras se centrifugaron a 800 g-rfc por 10 min a 4 °C para obtener el plasma, el cual se mantuvo en congelación a -20 °C hasta su posterior utilización.
Determinación de la concentración de lectina. La concentración de lectina en la hemolinfa del camarón blanco se determinó por ELISA en placas de poliestireno, al utilizar anticuerpos monoclonales contra la lectina de Macrobrachium rosenbergii (MrL) de acuerdo al método descrito por Agundis et al. (2000), con algunas modificaciones. En breve, el plasma de L. vannamei fue diluido 1/10 en 0.1 M de amortiguador de carbonato (pH 9.5) y se fijó al fondo de los pozos con una incubación de 100 μl de amortiguador de carbonato (pH 9.5) a 37 °C durante una hora y posteriormente a 4 °C toda la noche; después, las placas se lavaron cuatro veces con PBS adicionado de 0.01% Tween 20 (PBS-T). Los sitios de unión inespecíficos fueron bloqueados con 300 μl de PBS con 5% de leche descremada e incubados 60 min a 37 °C, para luego ser lavados 4 veces con PBS-T. Después se agregaron 100 μl de anticuerpos marcados con peroxidasa en una dilución de 1:100 y se incubaron por 90 min a 37 °C. Las placas se lavaron exhaustivamente con PBS-T y la reacción fue revelada al añadir 100 μl de O-fenilendiamina y H2O2 en 100 mM de amortiguador de citratos (pH 5.6). La reacción se detuvo al agregar 100 μl de 3N HCl y las muestras se leyeron a 492 nm en un lector de ELISA. La estandarización de la curva se realizó mediante lectina MrL y anticuerpos contra la lectina MrL de acuerdo con el método descrito por Agundis et al. (2000).
Para confirmar que los anticuerpos monoclonales de MrL reconocen a la lectina de L. vannamei se realizó un Western blot. La lectina de L. vannamei fue separada electroforéticamente en un gel de poliacrilamida con urea al 10%, de acuerdo con el método descrito por Bollag et al. (1996); después fue transferida a una membrana de nitrocelulosa, como indica el método descrito por Towbin et al. (1979), por medio de un aparato de transferencia semi-seca (Bio-Rad) a 25 mV por 1.5 h. Los sitios de unión inespecíficos fueron bloqueados con PBS-leche toda la noche a 4 °C y posteriormente se lavaron con PBS-T varias veces. La membrana se incubó con anticuerpos contra la lectina de MrL en una dilución de 1:100 por 2 h y se lavó con PBS-T. La reacción fue revelada al agregar una solución de 3-3 diaminobenzidina y H2O2 en PBS.
Análisis estadísticos. Se realizó la prueba de Kolmogórov-Smirnov para verificar la normalidad de la distribución de los datos, y la prueba de homoscedasticidad de Bartlett para corroborar la homogenidad de distribución de varianzas. Se efectúo la prueba de análisis de varianza (ANOVA) de una vía para determinar si hubo diferencias significativas en la concentración de lectinas en el plasma entre los camarones expuestos a diferentes inmunoestimulantes y el control. Cuando se encontraron diferencias, se realizó un análisis posterior de Tukey. Los cálculos estadísticos se realizaron con el programa Statistics v9.
Resultados
Purificación de lectina. A partir de hemolinfa de L. vannamei se purificó una lectina mediante cromatografía de afinidad en una columna de estroma de eritrocitos de rata. La fracción no retenida no mostró aglutinación de eritrocitos de conejo ni de rata en solución salina-calcio al 2 %. En contraparte, la fracción retenida presentó actividad hemaglutinante en eritrocitos de conejo y rata, 640 y 320 UHA (unidades hemaglutinantes por ml de muestra), respectivamente.
Se determinó el peso molecular de la lectina por electroforesis en gel de poliacrilamida con urea y teñido con plata, y se obtuvieron 4 fracciones proteicas de 80 kDa, 61 kDa, 48 kDa, y 33 kDa (Fig. 1). El suero de camarón aglutinó eritrocitos de diferentes especies, en especial eritrocitos de ratón, que fueron 8 veces más que los eritrocitos de las otras especies probadas (conejo, rata, cuyo, hámster y humano). La actividad aglutinante aumentó en presencia de CaCl2, de eritrocitos tratados con tripisina y algunos tratados con sialidasa (conejo, hámster y humano).
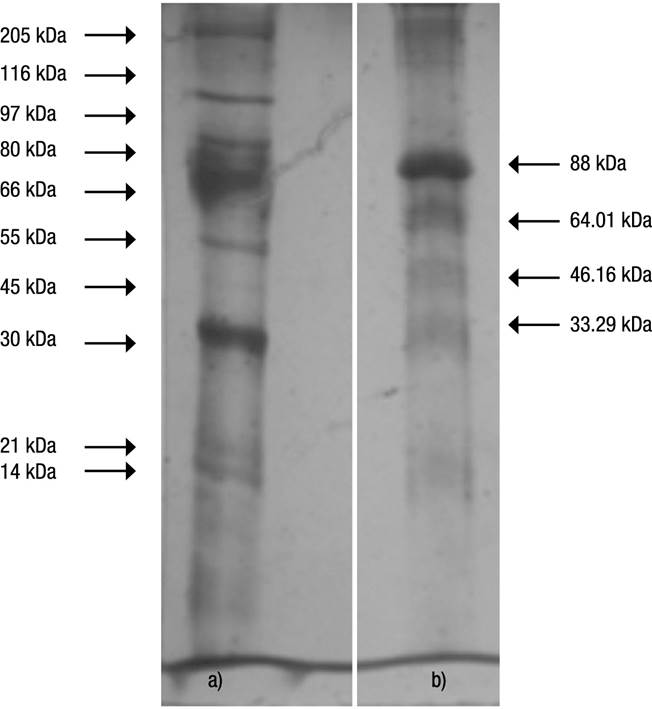
Figuras 1a-b Electroforesis en gel de poliacrilamida con urea de lectina purificada en la columna de estroma de rata. Carril (a): marcadores moleculares. Carril (b): lectina purificada de camarón Litopenaeus vannamei (Boone, 1931).
La especificidad se determinó al comparar la actividad inhibitoria de 9 carbohidratos (200 mM) en la hemaglutinación de eritrocitos de conejo al 2 %. La D-glucosamina fue el mayor inhibidor de aglutinación con un 96.8%, seguido de fucosa con 87.5%, galactosa y glucosa con 75%. Los 5 monosacáridos restantes, N-acetil-glucosamina, galactosamina, N-acetil-galactosamina, manosa y manosamina, no inhibieron la aglutinación.
Se realizó un Western blot utilizando agregados de la lectina purificada de camarón blanco y anticuerpos monoclonales contra la lectina de M. rosenbergii a una dilución de 1:40, lo cual reveló que los anticuerpos monoclonales contra la lectina de MrL reconocen 3 (80, 61 y 48 kDa) de las 4 fracciones purificadas de la lectina de L. vannamei (Fig. 2).
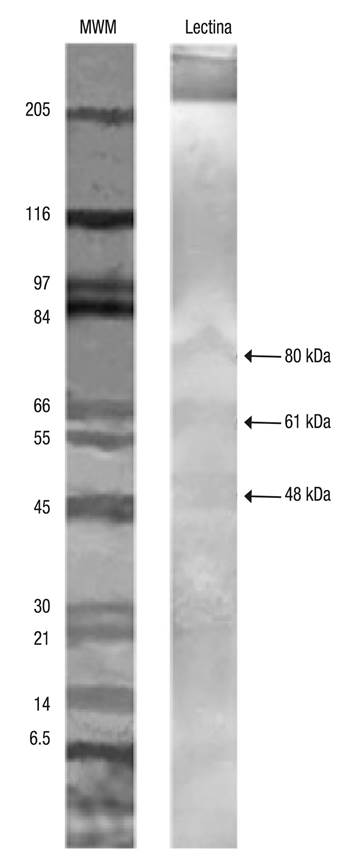
Figura 2 Western blot de lectina de camarón Litopenaeus vannamei (Boone, 1931) y anticuerpos monoclonales contra MrL.
Concentración de la lectina en plasma de camarón expuesto a inmunoestimulantes. En la Figura 3 se observan diferencias significativas (p <0.05) en los camarones tratados con laminarina respecto al grupo control, a las 24 h posteriores a la última administración de los tratamientos. A las 48 h posteriores a la exposición de los inmunoestimulantes no se observaron diferencias significativas (p > 0.05) respecto al control. Los juveniles expuestos a la mezcla 1 (B. tequilensis + B. licheniformis) y mezcla 2 (B. endophyticus + B. endophyticus) registraron un aumento significativo en la concentración de lectina a las 72 h respecto al grupo control. La concentración de lectina no se modificó significativamente en los juveniles tratados con la levadura D. hansenii respecto al grupo control (Fig. 3).
Discusión
Los invertebrados poseen lectinas que son proteínas ampliamente distribuidas en la naturaleza y tienen la capacidad de reconocer de manera específica carbohidratos en la superficie celular, desencadenando diferentes mecanismos de defensa (Wang & Wang, 2013; Li & Xiang, 2013). Asimismo, se ha sugerido que las lectinas podrían ser los precursores funcionales de los anticuerpos en vertebrados, ya que muestran una gran especificidad por ciertos carbohidratos y porque están involucradas en el reconocimiento y eliminación de patógenos (Wei et al., 2012; Li et al., 2014; Xu et al., 2014a b; Wang et al., 2014; Li et al., 2015).
En este trabajo se utilizaron anticuerpos monoclonales contra la lectina de M. rosenbergii (MrL) para determinar la concentración de lectina en plasma de L. vannamei. Los anticuerpos monoclonales tienen una alta especificidad; sin embargo, algunos anticuerpos monoclonales de gran afinidad presentan reactividad cruzada. En una investigación realizada por Pereyra et al. (2009), se demostró que los anticuerpos monoclonales anti MrL presentan reactividad cruzada con proteínas presentes en la hemolinfa de Procambarus clarkii (Girard, 1852); Procambarus americanus (H. Milne-Edwards, 1837); Litopenaeus setiferus (Linnaeus, 1767) y Pseudothelphusa americana (Saussure, 1857). Sus resultados sugieren que los anticuerpos reconocen regiones conservadas en las moléculas de lectina de estas especies. En la inmunoelectrotransferencia se identificó que los anticuerpos pueden reconocer 3 (80, 61, 48 kDa) de las 4 fracciones de lectina purificada de L. vannamei, lo cual implica un reconocimiento del 75% de lectina presente en la hemolinfa. Es probable que la lectina de M. rosenbergii y L. vannamei compartan epítopes comunes, debido a que las lectinas de estos crustáceos se consideran evolutivamente bien conservadas (Pereyra et al., 2009; Luo et al., 2011; Denis et al., 2016). Adicionalmente, en un estudio realizado por Pereyra et al. (2012), anticuerpos monoclonales anti MrL de M. rosenbergii detectaron dos subunidades de lectina (42.7 y 66.2 kDa) de Macrobrachium americanum (Bate, 1868), de las 3 subunidades previamente purificadas (86.6, 42.7 y 66.2 kDa), lo cual demuestra que el anticuerpo reconoce epítopes conservados en lectinas de ambas especies.
La administración de glucanos en la dieta pueden estimular el sistema profenoloxidasa y la aglutinación de patógenos mediada por lectinas (Sivakamavalli & Vaseeharan, 2014; Sivakamavalli et al., 2015), las cuales se incrementan después de un reto infeccioso en el camarón (Bae et al., 2012). Pais et al. (2008) trataron durante 1 h vía inmersión a juveniles de Penaeus monodon (Fabricius, 1798) con β-glucanos extraídos de la levadura Saccharomyces cerevisiae (Meyen Ex E.C. Hansen) a una concentración de 0.15 mg ml-1, y observaron un aumento a las 24 h de postinmersión en los niveles de hemaglutinación de eritrocitos de ratón al ser expuestos al suero del camarón. De forma similar, en este estudio los camarones expuestos vía inmersión al β-glucano del inmunoestimulante comercial (laminarina, 0.5 mg ml-1) incrementaron la concentración de lectina en hemolinfa a las 24 h posteriores al tratamiento.
En estudios previos se ha reportado la importancia en la frecuencia de administración de los inmunoestimulantes, ya sea vía inmersión o incluidos en el alimento, para que el camarón mantenga un mejor estado inmunológico durante su cultivo (Pacheco-Marges et al., 2012; Chen et al., 2016). En este estudio, la frecuencia de administración de los inmunoestimulantes se realizó cada tercer día, y se encontró que en los camarones tratados vía inmersión con laminarina se indujo un incremento en la concentración de lectinas a las 24 h posteriores a la última aplicación de los tratamientos, seguida a las 72 h por las mezclas 1 (B. tequilensis y B. licheniformis) y 2 (cepas YC3-B y C2-2 de B. endophyticus). Sung et al. (1994) demostraron que la supervivencia de Penaeus monodon puede incrementarse si los camarones se inmunoestimulan hasta 18 días antes de un reto con Vibrio vulnificus. Campa-Córdova et al. (2002) reportaron que no es necesario aplicar inmunoestimulantes diariamente a juveniles de L. vannamei, ya que una sola aplicación incrementa la respuesta inmune de los camarones durante 7 días. Campa-Córdova et al. (2005) utilizaron concentraciones subletales de Vibrio penaeicida para activar la respuesta inmune en juveniles de L. vannamei, y encontraron que los camarones previamente expuestos a β-glucano, lipopolisacárido y fucoidán mantuvieron una respuesta inmune superior al control hasta 10 días posteriores a la aplicación de los inmunoestimulantes.
Al tratar a los camarones con D. hansenii (1 x 106 UFC ml-1) no se detectó un incremento en la concentración de lectina respecto al grupo control, lo que sugiere como posible causa una dosis insuficiente de levadura. En este sentido, Chai et al. (2016) observaron que la suplementación de Bacillus sp. a concentraciones más altas de 1 x 107 y 1 x 109 UFC ml-1 aumentó la expresión del gen de la lectina tipo C en hemocitos de camarón blanco L. vannamei.
En este estudio se encontró que la concentración de lectina en plasma de L. vannamei se incrementa al exponer a los camarones a inmunoestimulantes de origen microbiano o comercial, por lo que podría ser utilizada como herramienta bioindicadora de inmunoestimulación en camarón. Se recomienda realizar más estudios con patógenos de camarón para determinar si el incremento de lectinas activado por exposición a inmunoestimulantes es suficiente para inducir resistencia a enfermedades de origen bacteriano o viral en los cultivos.











 nueva página del texto (beta)
nueva página del texto (beta)




