Introducción
Los tiburones son un grupo de depredadores tope, importantes dentro del ecosistema marino y vulnerables a la sobreexplotación pesquera, debido entre otras cosas, a las características particulares de su historia de vida (Watson et al., 2009). El tiburón martillo Sphyrna lewini (Griffith & Smith, 1834) se caracteriza por ser una especie migratoria, de hábitos pelágicos y costeros, de aguas cálidas (Compagno, 1984), cuyos individuos se agregan en grandes cardúmenes (Simpfendorfer & Heupel, 2004), lo cual hace a sus poblaciones vulnerables a la pesca industrial en aguas oceánicas, a la pesca camaronera semiindustrial y a la pesca artesanal en zonas costeras (López-Martínez et al., 2010).
Hace algunas décadas, S. lewini era considerada una especie con potencial de explotación por su abundancia (FAO, 1999); sin embargo, dada la sobrexplotación de sus poblaciones, actualmente se encuentra incluida, desde 2006, como especie amenazada en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN, por sus siglas en inglés) (Chapman et al., 2009) y en el Apéndice II de la Convención sobre el Comercio Internacional de Flora y Fauna (CITES, por sus siglas en inglés).
Sphyrna lewini es una especie semioceánica con distribución global en aguas tropicales y templadas cálidas (Compagno, 1984). Presenta segregación espacial entre adultos y juveniles (Klimley, 1987). Las hembras paren a sus crías en sitios protegidos, ricos en alimento, cercanos a la costa y de aguas someras, denominados “áreas de crianza” (Clarke, 1971; Castro, 1993; Merson & Pratt, 2001; Heupel et al., 2007). Una vez alcanzada la madurez sexual, inician sus migraciones cambiando los hábitats costeros por zonas de aguas oceánicas y pelágicas donde se reduce la competencia intraespecífica (Simpfendorfer & Milward, 1993; Duncan & Holland, 2006).
Debido a su amplia distribución e importancia pesquera, se han llevado a cabo estudios sobre sus aspectos reproductivos en diferentes partes del mundo (Clarke, 1971; Bass et al., 1975; Branstetter, 1987; Stevens & Lyle, 1989; Cappe et al., 1998; Lessa et al., 1999; Chen et al., 1998; Hazin, 2001; White et al., 2008, Zanella & López-Garro, 2015). En México se cuenta con los estudios de Torres-Huerta et al. (2009) para el golfo de California, Anislado-Tolentino & Robinson-Mendoza (2001) para el Pacífico central, y Soriano et al. (2006) y Bejarano et al. (2011) para el Pacífico sur.
Sphyrna lewini es una de las especies objetivo más importantes en el Pacífico mexicano, tanto en las pesquerías artesanales como en las de mediana altura, lo cual representa el 37% de las capturas (DOF, 2004). El golfo de California y el golfo de Tehuantepec (litoral de los estados de Oaxaca y Chiapas) han sido considerados como reservorios de diversidad genética de la especie (Castillo-Olguín et al., 2011). Sin embargo, en el caso del golfo de Tehuantepec, los estudios son escasos, a pesar de que Puerto Chiapas es el punto de mayor descarga de tiburón en el país, donde Carcharhinus falciformis y Sphyrna lewini representan el 89% de las capturas (Soriano et al., 2006), y de que en Oaxaca ambas especies conforman el 37% de las capturas por la pesca artesanal (Alejo-Plata et al., 2006a; Alejo-Plata et al., 2009).
El presente estudio analiza la estructura y dinámica poblacional de Sphyrna lewini, a partir de las tallas, proporción de sexos, fecundidad, época y talla de nacimiento en las capturas de la pesca artesanal de la costa de Oaxaca, México.
Materiales y métodos
La zona de estudio corresponde a la parte centro-oeste del golfo de Tehuantepec en la costa de Oaxaca (Fig. 1). De acuerdo con la batimetría extraída de la base de datos ETOPO2 (http://www.ngdc.noaa.gov/mgg/global/etopo2.html), considerando la isobata de los 200 m como el límite de la plataforma continental, ésta se ensancha hacia el este, alcanza una amplitud máxima de ~106.8 km a los 93-94°O y se reduce hacia el oeste, con una amplitud mínima de ~17.8 km a los 95.5°O (Fig. 1).
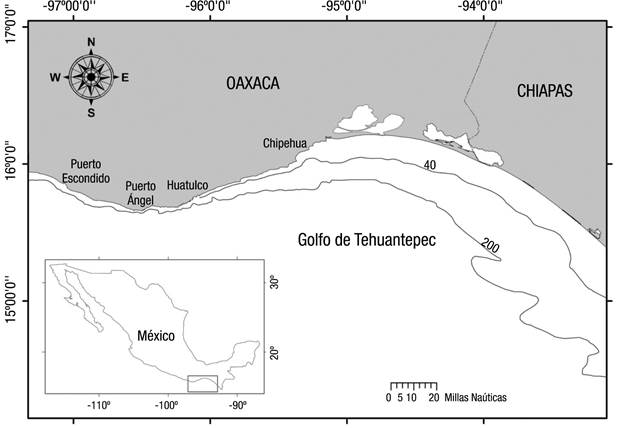
Figura 1 Área de estudio en la costa de Oaxaca. El límite de la plataforma continental está representado por la isóbata de 200 m. La batimetría fue obtenida de la base de datos ETOPO2. (http://www.ngdc.noaa.gov/mgg/global/etopo2.html).
La región se caracteriza por la presencia de lluvias de mayo a octubre y por secas de noviembre a abril, como se muestra en la Fig. 2, la cual fue construida con registros de la base de datos histórica de la estación meteorológica automática (EMA) del Servicio Meteorológico Nacional (SMN), localizada en Puerto Ángel, Oaxaca (15°40’16” N, 96°29’50” O) a una altitud de 91 m sobre el nivel medio del mar (http://smn.cna.gob.mx/emas), y con datos de imágenes nivel 3 con resolución de 4km del MODIS-Aqua (http://oceancolor.gsfc.nasa.gov/).
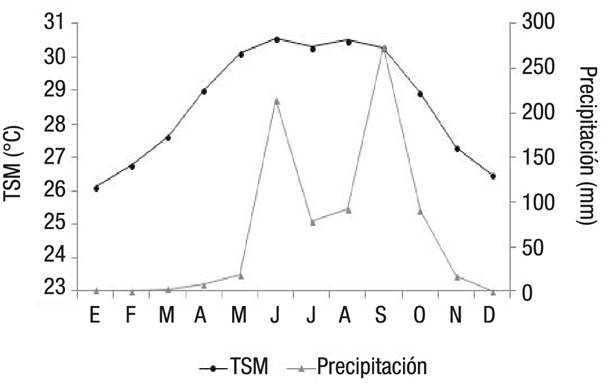
Figura 2 Promedios mensuales de precipitación (P) (15°40’16” N, 96°29’50” O) y de temperatura superficial del mar (TSM) en la costa de Oaxaca durante el período de 2001 a 2007.
Por otro lado, de acuerdo con Reyes y Mejía-Trejo (1991), durante los meses de mayo y junio se activa la formación de tormentas tropicales y huracanes en el Pacífico noreste, la cual se extiende hasta los meses de octubre y noviembre. Otra característica atmosférica de gran importancia en el golfo de Tehuantepec es el arribo (principalmente entre noviembre y abril) de vientos del norte, o “Tehuanos”, con intensidades mayores que 10 m/s y duración típica de 2 a 6 días (Lavín et al., 1992; Romero-Centeno et al., 2003). Estos episodios de viento contribuyen a que las aguas del golfo sean relativamente productivas y frías comparadas con sus alrededores (Trasviña et al., 1995), rasgos claramente visibles en imágenes de satélite (https://oceancolor.gsfc.nasa.gov) como una lengua de concentraciones comparativamente altas de Clorofila-a (>1.0 mg/m3) y temperatura superficial del mar relativamente baja (~17 °C). La formación de esta lengua de agua fría, en esta época del año, fragmenta la alberca de agua cálida del Pacífico este (temperatura superficial del mar por arriba de 28.5 °C; Wang & Enfield, 2001).
De agosto de 2001 a diciembre de 2007 se efectuaron muestreos en las capturas de la flota artesanal de Oaxaca. El trabajo de campo se realizó durante dos días a la semana en Puerto Escondido, Puerto Ángel-San Agustinillo, Huatulco, y quincenalmente en la ensenada Chipehua (Fig. 1). Alejo-Palta et al. (2016) mencionan que en la región se encuentran tres unidades pesqueras artesanales que capturan tiburón: la unidad tiburonera (pesca dirigida), la unidad pelágica y la unidad demersal (ambas con captura incidental de tiburones).
Los ejemplares fueron identificados con las claves taxonómicas de Compagno (1984) y se clasificaron de acuerdo con los criterios de Clark & von Schmidt (1965), Pratt (1979) y Castro (1993) como neonatos (organismos con cicatriz umbilical abierta), juveniles del año (JUA, organismos de nado libre y con cicatriz umbilical parcialmente cerrada), juveniles y adultos. Debido a las características de desembarque y manejo del tiburón en playa, donde estos fueron descargados sin eviscerar, fue posible determinar los estados de madurez y fecundidad, así como el número, sexo y talla de los embriones.
El sexo se registró a partir de la presencia o ausencia de mixopterigios (órgano copulador), se midió su longitud (mm) y observó el grado de calcificación. Con base en los criterios de Clark & Von Schmidt (1965) y Castro (1993), los machos que presentaron mixopterigios cortos y suaves se consideraron como inmaduros o juveniles; los machos fueron catalogados como maduros cuando los mixopterigios sobrepasaban el extremo posterior de las aletas pélvicas, se encontraban calcificados y rotaban fácilmente.
Las hembras se consideraron maduras cuando se observaron ovocitos vitelogénicos y vascularizados (cuando fue posible se midieron los ovocitos de mayor diámetro), glándulas oviductuales grandes y úteros desarrollados o, bien, si contenían huevos o embriones (Liu et al., 1999). En el caso de hembras preñadas, los embriones fueron contados, y se revisó su sexo y longitud total (LT, al 0.5 cm inferior); cuando las actividades de pesca lo permitieron, se registró el diámetro del ovocito de mayor tamaño y más cercano al oviducto.
Con el fin de obtener los datos biométricos utilizados para recobrar información de organismos eviscerados, sin aletas y sin cabeza (en esta región y en otras de México, se denominan “troncho”), se registró (al 0.5 cm inferior) la longitud total (LT), longitud furcal (Lf) y longitud del troncho (Ltr, medida entre la última abertura branquial y la muesca precaudal). Para obtener la LT de los organismos sin cabeza se utilizó la relación lineal por medio del método de mínimos cuadrados entre LT y Ltr.
Los datos de las tallas por sexo se agruparon trimestralmente (enero-marzo, abril-junio, julio-septiembre, octubre-diciembre) y se analizaron por temporadas, de lluvias (mayo-octubre) y secas (noviembre-abril); para comparar las tallas entre ambas temporadas se aplicó el método no paramétrico Kruskal-Wallis, debido a que los datos no presentan homocedasticidad (Zar, 1999).
Las longitudes se representaron en histogramas de frecuencia, y para determinar las modas observadas se realizó un análisis multimodal de las frecuencias de tallas (LT) que se ajustó con la función de máxima verosimilitud propuesta por Haddon (1991).
Se determinó la proporción de sexos a partir de la relación entre el número de hembras y machos (H:M) registrados en las capturas; se utilizó la prueba estadística Chi cuadrada (x2) aplicando la corrección de Yates para determinar si la proporción de sexos por estado ontogénico y por mes se desviaba de la relación 1:1 (Zar, 1999). En el caso de los embriones, se calculó la proporción media de las hembras por camada y se comparó con el valor teórico de 0.5; se consideró como unidad muestral a la madre de la camada (Walker, 2005).
La longitud en la que el 50% de los tiburones están maduros (L50) se determinó para hembras y machos, y también se estimó la talla de maternidad (L50 de maternidad) (Mollet et al., 2000; Corro-Espinosa et al., 2011; Soto-López et al., 2018) para hembras por medio de la función logística:
Donde, Fm es la fracción de tiburones maduros (o fracción de hembras preñadas), Li la longitud total, los parámetros a y L50 fueron estimados ajustando la función mediante el criterio de máxima verosimilitud (Haddon, 2001); el valor de a representa la pendiente de la curva que describe la tasa de cambio de hembras inmaduras a hembras maduras y L50 la talla a la cual el 50% de la población se encuentra madura.
La fecundidad se estimó en cada hembra preñada contando los embriones presentes en cada útero. La fecundidad (F) para S. lewini fue correlacionada con la LT. Para analizar el patrón estacional en el crecimiento de los embriones, se agruparon las muestras de 2001 a 2007 a fin de construir un “año tipo”. Para establecer el período de gestación se consideró el crecimiento promedio mensual en longitud total de los embriones; la talla de nacimiento se estimó como el promedio entre la talla máxima del embrión observada y la talla mínima del individuo de nado libre capturado en el mismo tiempo y lugar (Pratt & Casey, 1990).
Resultados
Tallas y proporción de sexos. La distribución de frecuencias de tallas de S. lewini fue estimada en un total de 822 individuos. Se registraron 388 hembras con intervalo de tallas de 44 a 332 cm LT (Media = 104.5, DE = 56.1) y 434 machos con intervalo de tallas de 44 a 308 cm LT (Media = 131.2, DE = 75.9).
Las capturas estuvieron conformadas por neonatos (24.3%, 44-74 cm LT), juveniles del año y juveniles (42.2%, 75-170 cm LT), y adultos (33.5% > 170 cm LT).
Para poder realizar la comparación de la talla con trabajos previos, los resultados se reportaron en LT. Las relaciones biométricas mostraron un alto nivel de asociación entre las variables, el cual está representado por los valores de R2 en las siguientes expresiones:
Machos LT = 1.86Ltr + 13.78 (R2 =0.95, n = 200, p < 0.05)
Hembras LT = 1.92Ltr + 11.87 (R2=0.91, n = 156, p < 0.05)
El análisis multinomial mostró para las hembras tres modas, las cuales corresponden a neonatos (media = 63.5 cm LT, DE = 7.4), juveniles (media = 134.2 cm LT, DE = 9.7) y adultos (media = 209.0 cm LT, DE = 7.4) (Fig. 3a). Los machos presentaron cuatro modas, neonatos (media = 62.0 cm LT, DE = 5.8), juveniles con dos modas (media = 102.5 cm LT, DE = 20.9; media = 142.6 cm LT, DE = 7.6) y adultos (media = 235.9 cm LT, DE = 25.5) (Fig. 3b).
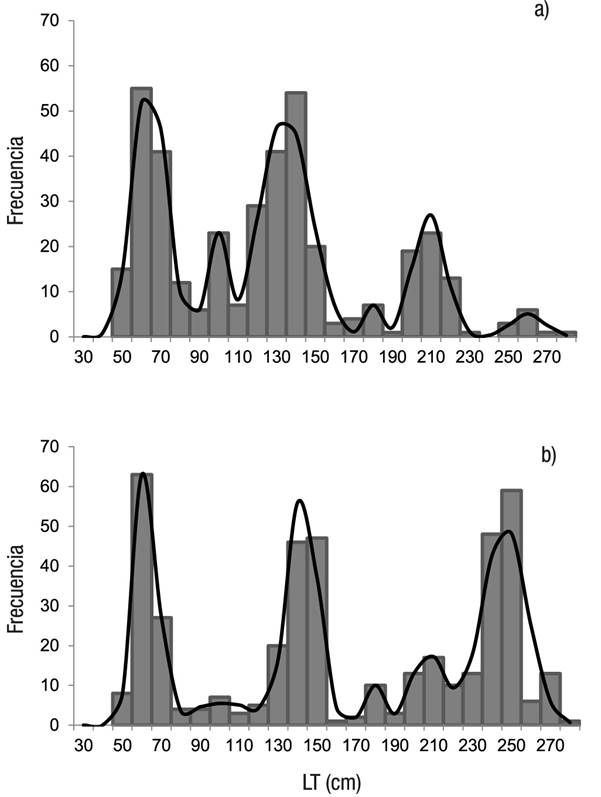
Figuras 3a-b Estructura de tallas por sexo de Sphyrna lewini (Griffith & Smith,1834), capturados por la pesca artesanal en la costa de Oaxaca durante el periodo de 2001 a 2007. La línea continua indica las modas obtenidas a partir del análisis multinomial. a) Hembras; b) Machos.
La proporción de sexos en los neonatos y juveniles del año (JUA) fue 1:1 (χ20.05,1 =0.087, p >0.05), para juveniles se observó predominio de las hembras (1H:0.6M; χ20.05,1 =15.78, p <0.05), a diferencia de los adultos, donde se obtuvo una proporción de sexos de 1H:2.6M (χ20.05,1 =54.12, p <0.05).
En la temporada de secas (noviembre-abril) se registraron bajas capturas de S. lewini (15.5%) con un predominio de tallas mayores a 100 cm LT en ambos sexos; las mayores capturas (85.5%) se observaron en la temporada de lluvias (mayo-octubre). Los neonatos fueron observados en cada uno de los trimestres del año, pero con una mayor frecuencia de julio a septiembre, donde se produce una clase modal de 50 a 60 cm LT. La clase modal de esta cohorte se incrementa de 70 a 80 cm LT de octubre a diciembre y de 120 a 140 cm LT en el trimestre enero-marzo; de abril a junio se observaron nuevamente neonatos (Fig. 4).
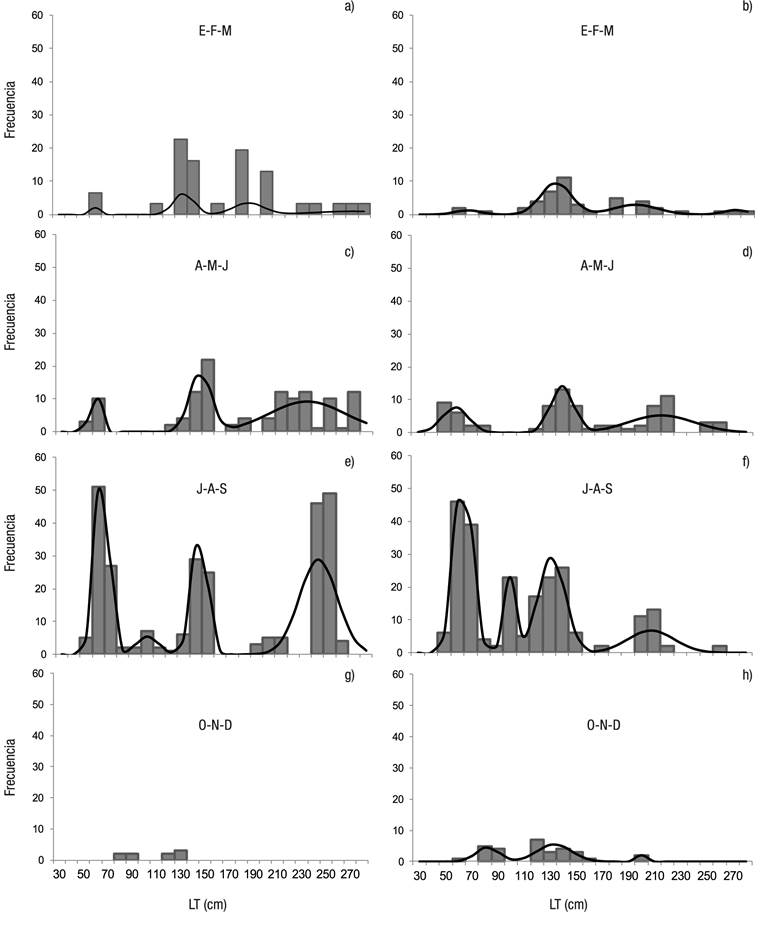
Figuras 4a-h Estructura de tallas por trimestre de Sphyrna lewini (Griffith & Smith, 1834), capturado por la pesca artesanal en la costa de Oaxaca durante el período de 2001 a 2007. La línea continua indica las modas obtenidas a partir del análisis multinomial. a-b) Trimestre enero a marzo; c-d) Trimestre abril a junio; e-f) Trimestre julio a septiembre; g-h) Trimestre octubre a diciembre. a, c, e, g) Hembras; b, d, f, h) Machos.
De octubre a diciembre y de enero a marzo se observó una predominancia de hembras (3H:1M, χ20.05,1 = 9, p <0.05; 1.5H:1M, χ20.05,1 = 1.49, p <0.05 respectivamente) y se registraron las menores tallas, así como tamaños de muestra relativamente bajos (Fig. 3). Las mayores capturas se registraron de abril a junio (24.9%) y de julio a septiembre (60.8%); en ambos trimestres se observaron los intervalos de talla más amplios, con predominancia de juveniles y adultos y una mayor proporción de machos (1M:0.7H, χ20.05,1 = 6.32, p <0.05 y 1M:0.8H, χ20.05,1 = 5.2, p <0.05, respectivamente) (Fig. 4).
Aspectos reproductivos. La relación entre la longitud del mixopterigio (Lm) y la LT se describe con la ecuación Lm = 0.1112LT - 4.4417 (R2= 0.86, p <0.001). Los machos con una LT < 140 cm que tenían el mixopterigio sin calcificar se clasificaron como inmaduros. El comienzo de la madurez sexual se presentó alrededor de 120 cm LT, cuando la longitud del mixopterigio se incrementó abruptamente y con una estructura semirígida. Los machos maduros con mixopterigio totalmente calcificado se observaron a los 155 cm LT y todos los machos mayores a 190 cm LT estaban maduros. Organismos con mixopterigio mayor de 200 mm tenían fluido seminal y algunos presentaron hematomas; este órgano experimenta un lento crecimiento durante el periodo en que no hay calcificación; por lo tanto, aumenta su longitud notablemente al inicio de su calcificación, y por ende, su maduración (Fig. 5).
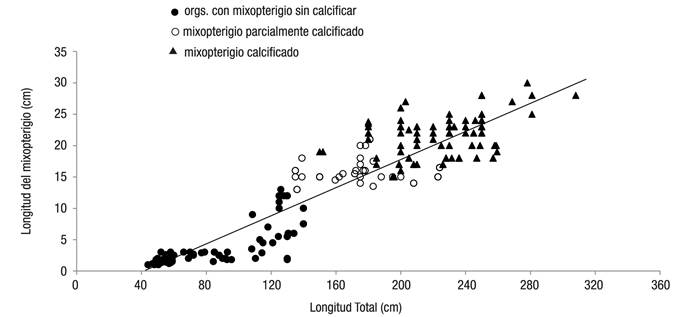
Figura 5 Relación entre la longitud del mixopterigio y la longitud total en machos de Sphyrna lewini (Griffith & Smith, 1834) capturados por la pesca artesanal en la costa de Oaxaca (México) durante el periodo de 2001 a 2007. n = 284.
Las hembras maduras se registraron a partir del intervalo de clase de 160-170 cm LT. La LT50 estimada fue de 198.8 ±1.7 cm (intervalo de confianza 95%; Fig. 6a). La madurez sexual en machos se presentó a partir del intervalo de 120-125 cm LT, la LT50 estimada fue de 181 ± 4.14 cm (intervalo de confianza 95%; Fig. 6b).
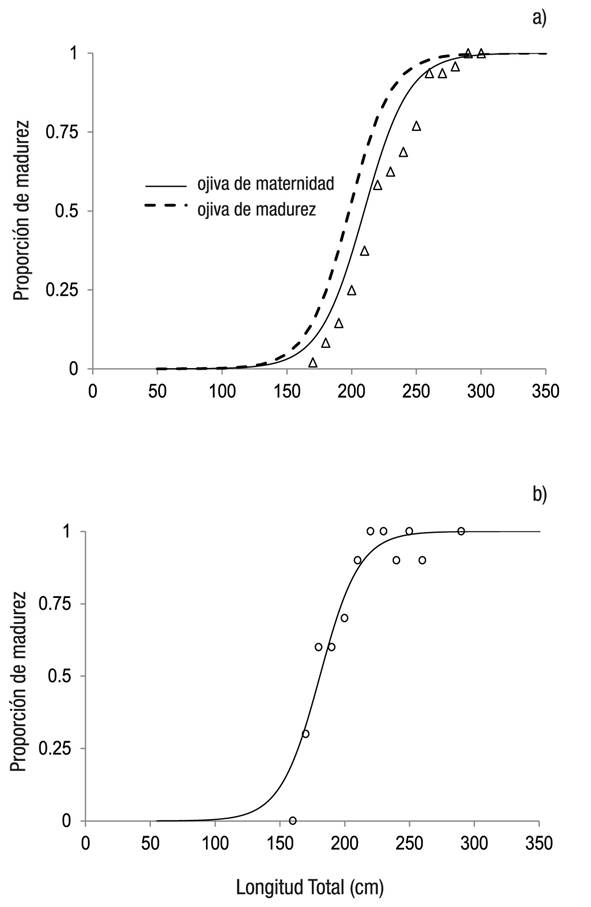
Figuras 6a-b Proporción de individuos maduros de Sphyrna lewini (Griffith &Smith, 1834) capturados por la pesca artesanal en la costa de Oaxaca (México) durante el periodo de 2001 a 2007. a) Hembras; b) Machos.
Se registraron 37 hembras grávidas con tallas de 175 a 281 cm LT (media = 221.96, DE = 31.48) entre los meses de abril a agosto; la LT50 de maternidad estimada fue de 205 cm LT (Fig. 6a).
De 985 embriones pertenecientes a 37 hembras, se midieron y sexaron 519 organismos, con lo cual se determinó que no existieron diferencias significativas en la proporción de sexos (χ20.05,1 = 2.51, p >0.05) o camadas individuales (χ20.05,1 = 0.028-0.64, p >0.05). Las camadas estuvieron conformadas de 15 a 42 embriones con un promedio de 26 crías (DE = 9). La fecundidad en número de crías se describió con la ecuación F = 0.2094LT - 19.433 (R2= 0.53, p <0.001).
Además, se observaron ovocitos con un diámetro de 1-5 cm, cuya muestra correspondió únicamente a 5 hembras, debido a la dificultad para obtener la medida de éstos cuando se están procesando los tiburones en playa.
En agosto se registraron embriones grandes con talla de 54 cm de LT; el neonato más pequeño, que se capturó en julio, tenía una talla de 44 cm de LT. Los neonatos oscilaron en talla desde 44 hasta 64 cm de LT (media = 62.5; DE = 6.6), por lo tanto, se podría esperar que el nacimiento de estos embriones se produjera con tallas entre 44 y 54 cm LT. Los recién nacidos se observaron en cada trimestre del año, pero fueron más frecuentes entre julio y septiembre, durante la temporada de lluvias, cuando la temperatura superficial del mar es la más elevada del año (29 a 31 ºC; Fig. 2). El periodo de gestación de S. lewini para la costa de Oaxaca se consideró de 10 a 11 meses.
Discusión
La costa de Oaxaca se caracteriza por tener importantes sistemas lagunares y bahías, lo que conforma un ambiente propicio para una especie tropical de hábitos gregarios y costeros como S. lewini (Last & Stevens, 1994). En la zona de estudio, los resultados muestran que el tiburón martillo se acerca a la costa dependiendo de la alternancia del régimen lluvias y secas característico de la región. Las mayores capturas (85.5%) se presentaron en la temporada de lluvias, cuando la presencia de S. Lewini en la zona de estudio en conjunto con el limitado radio de operación de las embarcaciones de pesca artesanal (Alejo-Plata et al., 2006; 2006a) favorecieron su pesca.
En Oaxaca las capturas de S. lewini registraron diferencias de acuerdo con la talla, sexo, temporada del año y arte de pesca. Los neonatos, JUA y juveniles pequeños se presentaron a lo largo del año, con un pico de abundancia de julio a septiembre; su captura se realizó por la unidad de pesca demersal, la cual utiliza redes de enmalle y opera en los “bajos” (aguas poco profundas y protegidas) próximos a la costa, en las bahías y cerca de las bocabarras de los ríos Copalita, Tonameca, Río Grande y los Perros (Alejo-Plata et al., 2006; 2006a). Las tallas de los neonatos y JUA capturados por la pesca artesanal sugiere que permanecen por varios meses en estas áreas; de acuerdo con Castro (1993) las aguas someras incrementan su probabilidad de sobrevivencia al brindarles mayor protección de sus depredadores. En otras localidades del Pacífico mexicano también se han reportado capturas de neonatos de S. lewini en aguas poco profundas. Así lo asentaron Torres-Huerta et al. (2009) en la costa este del golfo de California durante julio, Anislado-Tolentino (2000) en la costa de Michoacán entre julio y agosto, en aguas que no sobrepasan los 50 m, y Campuzano-Caballero (2002) en la costa de Chiapas de mayo a agosto.
Los juveniles grandes permanecen todo el año en la zona de estudio; su mayor abundancia se presentó a finales de la temporada de lluvia. Fueron capturados con palangres de superficie por la unidad de pesca pelágica que opera entre 5 y 20 millas de la costa (Alejo-Plata et al., 2006; 2006a), lo que indica que se desplazan a aguas más alejadas de la costa. Saucedo-Barrón et al. (1982), en un estudio en la costa de Sinaloa, atribuye este desplazamiento a dos posibles causas: a la necesidad de condiciones diferentes para alimentarse y alcanzar la madurez sexual y a su distribución en la columna de agua, las cuales los hace poco vulnerables a las artes de pesca.
Los adultos fueron capturados por la unidad de pesca tiburonera de palangre, que opera alejada de la costa en un radio de 30 a 50 millas (Alejo-Plata et al., 2006; 2006a), esto indica que los adultos migran a aguas oceánicas. En estas capturas los machos adultos fueron más numerosos que las hembras, con un pulso de abundancia de abril a junio.
Como en otras especies de tiburón distribuidas en la zona de estudio (Soriano et al., 2006; Alejo-Plata et al., 2016), los machos maduran a una LT menor que las hembras (181 cm frente a 198.5 cm), estos valores se encuentran dentro de los intervalos reportados para esta especie en otros estudios (machos: 140-198 cm LT; hembras: 169-250 cm LT, Tabla 1). Al respecto, White et al. (2008) remarcan que las diferencias en la LT50 de S. lewini sugieren la necesidad de obtener datos regionales que permitan caracterizar los patrones reproductivos a lo largo de su amplia distribución.
Tabla 1 Resumen de los estudios que describen algunos aspectos de la biología reproductiva de Sphyrna lewini (Griffith & Smith, 1834).
| Región | Talla de madurez (cm) | Periodo de gestación (meses) | Parto | Tamaño camada | Talla nacimiento (LT, cm) | Referencia | |
|---|---|---|---|---|---|---|---|
| Machos | Hembras | ||||||
| Hawái | verano | 15-31 | 40-50 | Clarke (1971) | |||
| Sur de Mozambique | 140-165 | 212 | verano | 30 | 50 | Bass et al. (1975) | |
| Noreste del golfo de México | 180 | 250 | 12 | >30 | 49 | Branstetter (1987) | |
| Noroeste de Taiwan | 198 | 210 | 10 | verano | 12-38 | >47 | Chen et al. (1988) |
| Norte de Australia | 140-160 | 200 | 9-10 | verano | 13-23 | 45-50 | Stevens & Lyle (1989) |
| Senegal | verano | 18-22 | 37-52 | Capapé et al. (1998) | |||
| Norte de Brasil | 150 | 40-50 | Lessa et al. (1999) | ||||
| Noroeste de Brasil | 180-200 | 240 | 10 | verano | 2-21 | >38 | Hazin et al. (2001) |
| Golfo Dulce, Costa Rica | junio-agosto | Zanella & López-Garro (2015) | |||||
| Indonesia | 175.5 | 228.5 | octubre-noviembre | 14-41 | 40 | White et al. (2008) | |
| Golfo de California | 170 | 207 | 11 | junio | 32 | 41-53 | Torres et al. 2009 |
| Pacífico central de México | 10 | mayo-julio | 44.7(M) 47.8(H) | Anislado-Tolentino y Robinson-Mendoza (2001) | |||
| Golfo de Tehuantepec | 154 | 169 | 12 | lluvias | 3-48 | 24-59 | Soriano et al. (2006) |
| Golfo de Tehuantepec | 178 | 220 | julio-agosto | 6-40 | 41-51 | Bejarano et al. (2011) | |
| Costa de Oaxaca, México | 181 | 198.5 | 10-11 | julio-septiembre | 15-42 | 44-54 | Presente estudio |
Para diferentes zonas geográficas se ha documentado la preferencia de las hembras grandes de S. lewini por aguas oceánicas y pelágicas (Branstetter, 1987; Stevens & Lyle, 1989; Duncan & Holland, 2006). En la parte sur del golfo de Tehuantepec, donde la pesca se efectúa en aguas lejanas de la costa, Soriano et al. (2006) registraron, en las capturas de la pesca artesanal, la agregación de hembras grandes y en estados iniciales de preñez en los meses de mayo a julio. En contraste, en la costa de Oaxaca (región centro-oeste del golfo de Tehuantepec), se registraron hembras en avanzado estado de preñez durante la temporada de lluvias y fueron capturadas con redes de enmalle de la pesca demersal. Esto sugiere que migran a la costa para dar a luz, como se ha reportado en otros trabajos (Clarke, 1971; Duncan & Holland, 2006).
Con respecto al periodo de gestación de S. lewini, la temporalidad de 10 a 11 meses coincide con otros registros hechos en el Pacífico mexicano, excepto con aquél reportado por Soriano et al. (2006) para el sur del golfo de Tehuantepec, el cual sugiere un periodo de gestación de 12 meses. Las especies de tiburón que se reproducen en aguas tropicales y subtropicales presentan un ciclo reproductivo estacional (Stevens & Lyle, 1989), lo cual se demuestra con nacimientos de S. lewini durante el verano en la costa de Oaxaca y en diferentes áreas de su distribución (Tabla 1).
La talla de nacimiento de S. lewini estimada en el presente estudio (44-54 cm LT) se encuentra en el intervalo reportado por otros autores (24-59 cm LT; Tabla 1), lo que sugiere que la talla de nacimiento de esta especie podría ser similar en toda el área de distribución. En Oaxaca, S. lewini nace durante la temporada de lluvias, cuando la temperatura superficial del mar es la más elevada del año y se encuentra una alta disponibilidad de alimento en el litoral oaxaqueño (Pennington et al., 2006). Se conoce que los neonatos de tiburón tienen altas tasas de crecimiento (Corro-Espinosa et al., 2011) debido al consumo elevado de alimento, lo cual indica que tienden a permanecer en áreas donde el alimento es abundante (Branstetter, 1990; Castro, 1993; Simpfendorfer & Milward, 1993). Además, de acuerdo con Yates et al. (2015), el nacimiento de tiburones en los meses más cálidos puede influir en la supervivencia y eficacia biológica; por ejemplo, se pueden beneficiar de una mayor asimilación de energía debido a su capacidad de retener el calor metabólico generado por la actividad continua de los músculos aerobios durante el nado, así como por el generado durante el proceso de la digestión y la asimilación (Bernal et al., 2012).
En Oaxaca observamos que nacen igual número de hembras y machos, y que la proporción se mantiene en los JUA. Esto concuerda con lo reportado por Torres-Huerta et al. (2009) para la costa de Baja California, Anislado-Tolentino (2000) para la costa de Michoacán y Campuzano-Caballero (2002) en la Costa de Chiapas.
Con respecto al tamaño de la camada, observamos una correlación positiva entre el tamaño de ésta y la longitud de la madre; esto ha sido reportado en Taiwan (Chen et al., 1998) e Indonesia (White et al., 2008). La camada más numerosa registrada en este trabajo fue de 42 embriones; en la región sur del golfo de Tehuantepec, Soriano et al. (2006) reportan camadas de hasta 48 embriones. El tamaño de camadas pequeñas registradas en otras regiones (Tabla 1) sugiere que algunos embriones han sido abortados, esto por efecto de parto inducido por la captura y por los métodos de captura utilizados (Adams et al., 2018).
Las observaciones en la costa de Oaxaca indican una menor captura de pesca sobre los adultos, de tal modo que las hembras con tallas menores a su LT50 representaron el 83.5% de todas las hembras capturadas, y los machos con tallas menores a LT50 alcanzaron el 56% del total de machos capturados. Las bajas capturas sobre los adultos de S. lewini en comparación con los juveniles se puede deber a que la pesca de tiburón se realiza en aguas cercanas a la costa, debido, entre otras causas, a los costos elevados de los viajes de pesca y a las condiciones oceanográficas durante la temporada de pesca de tiburón. Lo anterior ha sido observado en el golfo de California por Furlong-Estrada et al. (2015), quienes sugieren que la baja presión pesquera sobre los adultos de S. lewini ha actuado probablemente de manera inadvertida en favor de la estabilidad poblacional.
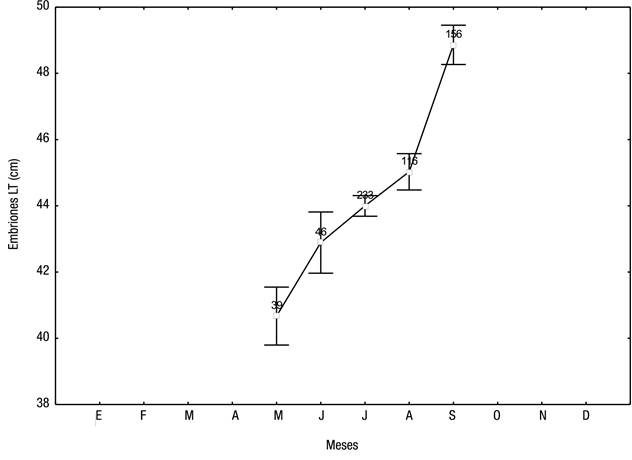
Figura 7 Longitud media total de embriones en el útero de cada hembra preñada de Sphyrna lewini (Griffith & Smith, 1834) capturadas por la pesca artesanal en la costa de Oaxaca (México) entre 2001 y 2007. Sobre la barra se indica el número total de embriones.
En las capturas de la zona de estudio se presentaron de manera simultánea hembras grávidas con embriones terminales, neonatos y JUA, además de una importante abundancia de juveniles durante todo el año, lo cual indica que las capturas se realizan en la zona de reproducción. Esta información, junto con los patrones de la presencia de S. Lewini, sugieren que es probable que en la costa de Oaxaca se encuentre un área de nacimiento y crianza, debido a que se cumplen parcialmente los criterios propuestos por Heupel et al. (2007): a) los tiburones se encuentran con más frecuencia en esta área que en otras: la zona de estudio no cumple este criterio, pues en la parte sur del golfo de Tehuantepec Soriano et al. (2006) han reportado neonatos y juveniles de S. lewini, por lo cual su presencia no es exclusiva de la costa de Oaxaca; b) los tiburones tienen la tendencia de permanecer o regresar por extensos periodos al área de crianza: la zona de estudio lo cumple parcialmente, en las capturas se registraron neonatos y juveniles cercanos a la madurez, lo que indica que permanecen por varios años en la costa de Oaxaca, y c) el área es utilizada repetidamente a través de los años: sehan registrado neonatos y juveniles del año en muestreos de por lo menos seis años, lo que sugiere que la costa de Oaxaca es usada por neonatos y juveniles del año repetidamente a través de los años. Asimismo, se ha reportado la presencia de neonatos, juveniles del año y juveniles de Carcharhinus falciformis en la costa de Oaxaca (Alejo-Plata et al., 2007; Alejo-Plata et al., 2016).
Para confirmar o no a la costa de Oaxaca como un área de crianza de S. lewini, es necesario realizar un estudio regional que incluya un programa de marcado y recaptura de neonatos y juveniles del año. Los resultados de este trabajo contribuyen al conocimiento del ciclo reproductivo de S. lewini e identifican a la costa de Oaxaca como un área importante para su reproducción en la costa sur del Pacífico mexicano, por lo tanto, aportan información para el manejo y conservación de esta especie.











 nova página do texto(beta)
nova página do texto(beta)



