Introducción
La langosta espinosa del Caribe Panulirus argus (Latreille, 1804) constituye uno de los recursos de mayor importancia económica para las pesquerías de la región del Gran Caribe (Ehrhardt et al., 2010). Su comercialización sitúa a México en el séptimo lugar a nivel mundial (Puga, 2002), donde los estados de Yucatán y Quintana Roo son los que participan con el 35% de su captura nacional (Salas et al., 2005).
En 1994 se descubrió en los Cayos de la Florida, EUA, el primer virus que infecta a la langosta espinosa P. argus, denominado Panulirus argus virus 1 (PaV1, por sus siglas) (Shields & Behringer, 2004). Este es un virus de doble cadena de ADN que se encuentra aún sin clasificación, pero comparte características de las familias Herpesviridae e Iridoviridae. PaV1 es altamente patogénico y mortal; infecta principalmente a juveniles bentónicos [20-55 mm de longitud de la cola (LC)], en los cuales se observa prevalencia de hasta 60%, la cual decrece hasta 11 % en langostas adultas (Shields & Behringer, 2004). En México, el virus PaV1 se reportó por primera vez en langostas juveniles de Puerto Morelos, Quintana Roo (Huchín-Mian et al., 2008). Este virus produce una infección crónico-degenerativa que se caracteriza por la destrucción masiva de los hemocitos hialinocitos y semigranulocitos, la falta de coagulación en la hemolinfa, el daño estructural irreversible en el tejido hepatopancreático y una marcada coloración lechosa de la hemolinfa (Shields & Behringer, 2004; Li et al., 2008; Huchin-Mian et al., 2013). En el hepatopáncreas se observan nucleocapsides icosaédricas (~182 ± 9 nm) distribuidas en el citoplasma y la periferia nuclear de las células. Asimismo, en las células epiteliales se detectan inclusiones virales eosinofílicas (Cowdry tipo A), caracterizadas con cromatina y proteínas condensadas en el citoplasma, además de hipertrofia nuclear observada por microscopía electrónica de transmisión (TEM) (Shields & Behringer, 2004). Las langostas con infecciones severas presentan una notable falta de reservas de glucógeno, letargia e isquemia tisular del hepatopáncreas, que conlleva a su muerte por agotamiento metabólico (Li et al., 2008).
Una de las características de la infección viral (PaV1) es que su prevalencia es mayor en tallas pequeñas de langostas y va disminuyendo en tallas más grandes (subadultas y adultas) (Lozano-Álvarez et al., 2008; Behringer et al., 2011; Cruz-Quintana et al., 2011; Moss et al., 2013). De igual forma, disminuyen también los signos clínicos; por lo que, si se utilizan solamente los signos clínicos para identificar la prevalencia del virus en adultas y subadultas, este valor estaría subestimado.
La presencia de PaV1 se ha reportado en México (Huchin-Mian et al., 2008; Lozano-Álvarez et al., 2008), en las Islas Vírgenes, Estados Unidos (Butler et al., 2008), en Belice (Huchin-Mian et al., 2009) y en Cuba (Cruz Quintana et al., 2011), a través de análisis histológicos del hepatopáncreas y por la técnica de reacción en cadena de la polimerasa o PCR (por sus siglas en inglés, polymerase chain reaction) en organismos juveniles con prevalencias del 5 al 60% (Behringer et al., 2011). Mientras que en langostas adultas se ha reportado hasta 11% de prevalencia (Behringer et al., 2012), 9.2% en Belice (Huchin-Mian et al., 2013) y 0.95 % en Cuba (Cruz-Quintana et al., 2011). El virus PaV1 está muy extendido en las langostas adultas en la parte central y norte del mar Caribe; en cambio, tiene una baja prevalencia en el Caribe suroccidental y está ausente en la parte sureste del Caribe (Moss et al., 2013).
México y otros países del Gran Caribe exportan colas de langosta congelada a distintas regiones del mundo, por lo que conocer la prevalencia de PaV1 en organismos frescos o congelados destinados a la venta comercial es muy importante para determinar el riesgo potencial que implica su posible distribución local e internacional y evitar posibles epizootias, como ha ocurrido con el virus de la mancha blanca en camarones peneidos (Hasson et al., 1999).
Aunque el estado de Yucatán no forma parte de la región del Caribe, la captura de langosta representa también una importante pesquería. Actualmente, la legislación emitida para el manejo de esta actividad es la siguiente: una talla mínima de captura (135 mm de longitud abdominal), la prohibición de captura de hembras ovígeras o “parchadas” y el establecimiento de una veda que incluye los meses de mayor actividad reproductiva en la población (marzo-junio) (Ríos-Lara et al., 2013).
Aunado a esto, el esfuerzo de pesca es regulado a través de la combinación de áreas concesionadas o permisos de pesca y número de permisos de embarcaciones que otorgan a las organizaciones sociales. Las embarcaciones menores están distribuidas en cuatro zonas: 1) poniente: Celestún y Sisal; 2) centro-Progreso: arrecife Alacranes; 3) centro: Dzilam de Bravo, y 4) oriente: río Lagartos, San Felipe y el Cuyo; cada una de estas pequeñas embarcaciones están equipadas con un compresor para el buceo, su jornada es de un día y capturan organismos subadultos y adultos. Las embarcaciones mayores (60 a 80 pies de eslora) pescan en las cercanías del arrecife Alacranes a profundidades que oscilan entre los 5 y 30 m, y realizan viajes de hasta 15 días, en los que capturan organismos adultos principalmente (Salas et al., 2005).
El objetivo de este trabajo fue conocer la prevalencia del virus PaV1 en langostas P. argus capturadas en dos localidades del estado de Yucatán (en el arrecife Alacranes-Progreso y en el río Lagartos), al comprobar la relación entre la prevalencia de infección de PaV1 (variable dependiente) y otros factores tales como talla, estado de la muda, sexo y zona de colecta de las langostas (variables regresoras).
Materiales y Métodos
Área de estudio. Se seleccionaron dos áreas de pesca de langosta: 1) zona norte (Progreso): que comprende el Parque Nacional de Arrecife Alacranes y zonas arrecifales rocosas profundas aledañas, 2) río Lagartos, que es un área caracterizada por praderas de Thalasia testudinum (Banks, 1805) y formaciones rocosas naturales (Fig. 1). El arrecife Alacranes es el complejo coralino más importante del golfo de México y se encuentra a 132 km al norte del puerto de Progreso, Yucatán, entre los 22° 21′ 45″ - 22° 34′ 55″ N y 89° 36′ 47″ - 89° 47′ 53″ O. Es un complejo arrecifal emergente de forma oval que cubre un área total de 293 km2, con una longitud y una anchura máximas de 26.5 km y 14.8 km (Bello-Pineda, 1998). Está constituido por una plataforma que se eleva desde los 50 m de profundidad, y sus características morfológicas más sobresalientes las constituyen el cantil y la barrera de barlovento, el cantil norte, el cantil de sotavento, la meseta o zócalo arrecifal y las islas de pequeñas dimensiones conocidas como Pérez, Pájaros, Chica, Muertos, Desterrada y Desaparecida (De la Cruz et al., 1993; Ardisson et al., 1996). El clima es de tipo seco-cálido, con lluvias escasas y temperatura anual media de 26.7 °C (rango entre 10 y 40 °C). Las corrientes marinas se dirigen al oeste y los vientos dominantes más intensos se presentan entre octubre y marzo, provenientes del oeste y noreste. Además, a estas corrientes se suman también los efectos de tormentas tropicales, huracanes y nortes (Logan, 1969).
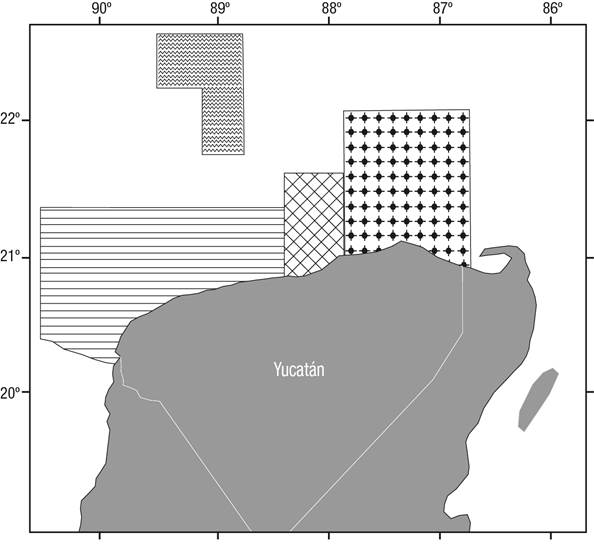
Figura 1 Áreas de pesca de langosta Panulirus argus
(Latreille, 1804) en el litoral del estado de Yucatán, México. =
 Alacranes-Progreso,
Alacranes-Progreso,  4= Poniente,
4= Poniente,
 =
Centro,
=
Centro,  = Oriente (tomado de Salas et
al., 2005 y modificado por Bello et
al., 2000).
= Oriente (tomado de Salas et
al., 2005 y modificado por Bello et
al., 2000).
El puerto de río Lagartos se localiza en la región litoral norte del estado, entre los 21° 37’ 35.55” N y 88° 10’ 56.96” O; ocupa una superficie de 249.09 km2 y está limitado al norte con el golfo de México, al sur con el municipio de Panabá, al este con el municipio de Tizimín y al oeste con el puerto de San Felipe. Su clima es cálido semi-seco y templado con lluvias escasas, su temperatura anual media es de 25.4 °C (con rangos entre 10 y 41 °C) y la precipitación pluvial media es de 41.3 mm, con predominio de vientos procedentes del noroeste (INEGI, 2010) y de vegetación de duna costera.
Colecta de muestras: Se realizó un muestreo dirigido de 30 salidas quincenales durante la temporada de pesca, del 1 de julio de 2013 al 30 de enero de 2014 y del 1 al 30 de julio de 2014 (nunca se quebrantó la temporada de veda). Durante ese periodo se visitaron dos cooperativas: en Progreso, la Sociedad Cooperativa de Producción Pesquera Pescadores de Sisal S. C. de R. L., donde se almacenan langostas capturadas por la flota mayor, provenientes de la zona de arrecife Alacranes, y en río Lagartos, la Sociedad Cooperativa de Producción Pesquera Pescadores de río Lagartos S. C. de R. L., donde se acopian organismos que provienen de la pesca artesanal, caracterizados por embarcaciones pequeñas (flota menor). En ambas cooperativas se midió cada cola de langosta con un vernier (± 0.1 mm) y se determinó el sexo con base en caracteres dimórficos externos (Briones-Fourzán et al., 2007).
Las tallas (fases ontogénicas) de las langostas se calcularon por medio de la longitud de la cola y a través de la aplicación de las fórmulas del modelo de regresión propuesto por Briones-Fourzán et al. (2007): macho TL = 1.79 LC + 37.31 R2 = 0.82; hembra TL = 1.47 LC + 10.58 R2 = 0.61. Dónde: TL = longitud total (mm); LC = longitud de la cola. Este modelo de regresión utiliza el método bootstrap o remuestreo, ya que a partir de la medición de las colas se estiman los tamaños totales de los organismos. Este modelo se basa en un muestreo probabilístico que permite establecer el grado de significancia (usualmente el 5%) como la máxima cantidad de error, al hacer estimaciones alternativas de los parámetros de la regresión (Briones-Fourzán et al., 2007).
Debido a que las colas de langosta estaban destinadas a exportación, se colectó de cada una de ellas aproximadamente 50 mg de tejido de intestino cercano a la región anal, de acuerdo con lo descrito por Huchín-Mian et al. (2009). Cada porción de tejido colectado se guardó en un vial de plástico (Eppendorf, EUA) de 1.5 ml, con alcohol etílico al 96% para su conservación. Cada vial se etiquetó con el número de langosta y la zona de captura. Durante la colecta de tejido se utilizaron tijeras y pinzas estériles, cuyo cuidado consistió en su lavado y esterilización con alcohol etílico al 70% y su posterior flameo en un mechero de alcohol para evitar contaminación cruzada con ADN.
A las 496 colas (327 colas de langosta se colectaron en la primera cooperativa y 169 en la segunda) también se les cortó el extremo distal de uno de sus pleópodos para determinar el estado de muda, de acuerdo con las características descritas por Lyle y McDonald (1983). Los pleópodos se colocaron en viales de plástico con agua de mar y después se observaron en fresco en un microscopio compuesto (100x). Este análisis consiste en observar las características generales de la morfología externa y describir alguna de las cinco fases de desarrollo de la seta, epidermis y cutícula. En la fase temprana de la postmuda (A) la epidermis está presente en la seta y se retrae en la postmuda (B). En la fase de intermuda (C) la epidermis se retrae bajo la seta para formar una línea recta en el fondo. En la fase temprana de la premuda (D1) la epidermis se retrae de la cutícula vieja para formar una nueva cutícula. Y en la fase final (antes de la muda, D2) se forma una nueva seta debajo de la cutícula vieja. Los estados del ciclo de muda en los crustáceos están caracterizados por una serie de cambios morfológicos, fisiológicos y bioquímicos, por lo que es importante diferenciar si estos cambios son debido al estado de muda o son signos clínicos asociados a la infección por PaV1 (Huchín-Mian et al., 2013).
Extracción de ADN. El ADN genómico se extrajo individualmente de cada muestra de tejido intestinal mediante el estuche comercial Wizard® SV Genomic DNA Purification System (Promega, EUA) (Huchin-Mian et al., 2009). La concentración de ADN de cada muestra se cuantificó en un espectrofotómetro NanoDrop 2000 (Thermo Scientific™, Thermo Fisher Scientific, EUA), al medir los valores de absorbancia del ADN a 260 nm y 280 nm, respectivamente para cada muestra. El criterio para su utilización en la prueba de PCR fue la obtención de una relación de ≥1.8 del promedio de los valores a 260/280 nm.
Reacción en cadena de la polimerasa. El PCR simple se realizó en un volumen de 25 µl, el cual consistió en: 1 µl de plantillas de ADN, 0.33 µM de iniciadores específicos (45aF TTCCAGCCCAGGTACGTATC y 543aR AACAGATTTTCCAGCAGCGT) que amplifican un fragmento de 499 pb (Montgomery-Fullerton et al. 2007), 2.5 mM de MgCl2, 1.2x de búfer de reacción, 0.2 mM de la mezcla de DNTP y 2.5 U de Taq polimerasa (Thermo Fisher Scientific, EUA). Las condiciones de amplificación fueron de 94 °C durante 10 min, seguido por 30 ciclos de 94 °C por 30 s, 63 °C por 30 s, y 72 °C por 1 min, con una extensión final de 72 °C por 10 min en un termociclador T100 (Bio-Rad, EUA). Los productos de PCR se analizaron en geles de agarosa al 2%, teñidos con 0.001 mg de bromuro de etidio y visualizados en un transiluminador de luz ultravioleta (MiniBis Pro®). En todos los casos se utilizó agua ultrapura y tejido de langostas no infectadas como controles negativos, y ADN de langostas infectada con PaV1 como control positivo (Montgomery-Fullerton et al., 2007; Huchin-Mian et al., 2008). Como control interno se utilizó actina (AF399872.1 H. americanus alpha actin mRNA); 3ActF (TCATGAGGTGCGACATTGAT) y 3ActR (GAGCCAGAGCAGTGATTTCC), los cuales amplificaron una región de 120 pares de bases. Las reacciones se realizaron en un volumen de 25 μl de volumen total con contenido: 2 µl de ADN, 0.33 μM de cada iniciador específico (F y R), 2.5 mM de MgCl2, 1.2x buffer de reacción, 0.4 mM de la mezcla de dNTPs (Promega) y 1 U de Taq DNA polymerase (Thermo Fisher Scientific, EUA), y se llevaron a cabo en un termociclador T100 (Bio-Rad, EUA) a 95 °C por 10 min, seguido de 30 ciclos de 95 °C / 30 s, 60°C / 30 s y 72 °C / 1 min, con una extensión final de 72 °C / 10 min. Se utilizó una escalera de 100 pb -3 kb como referencia (Promega, EUA)
Los productos de PCR se secuenciaron por el método de la cadena terminal de Sanger utilizando el secuenciador automático Abi 310 (Abi Prism® 310, Thermo Fisher Scientific, EUA) (Sanger et al., 1977). Las secuencias se compararon con las depositadas en el banco de genes (GenBank; https://www.ncbi.nlm.nih.gov/genbank/)para buscar homologías con las depositadas en las bases de datos de PaV1 a través del sistema BLAST (Basic Local Alignment Research Tool) (http://www.ncbi.nlm.nih.gov/blast/Blast). En este portal se evaluaron los porcentajes de similitud, de cobertura y significancia (E) (Análisis ClustalW) de las secuencias de ADN del virus PaV1 de este estudio con las secuencias de PAV1 depositadas en el GenBank.
Análisis de datos. Los análisis estadísticos se realizaron con el programa InfoStat (DiRienzo et al., 2010). La prevalencia de la infección de determinó a través de la fórmula descrita por Bush y colaboradores (1997): prevalencia es igual al número de organismos infectados entre el número total de organismos, expresado en porcentaje (%).
Para la comparación de la prevalencia del virus PaV1 en las langostas P. argus entre las tallas (juveniles, adultos y subadultos), el sexo (machos y hembras) y los sitios de pesca, se utilizó la prueba X2 de Wald (con sus grados de libertad [gl]) con el fin de determinar las diferencias entre estas variables a través de la prueba de mínimos cuadrados. Asimismo, se realizó un análisis de regresión logística para comprobar la relación entre la prevalencia de infección de PaV1 (variable dependiente) y factores tales como talla, estado de la muda, sexo y zona (río Lagartos y arrecife Alacranes-Progreso, variables regresoras). Este análisis calcula, para cada una de las variables del modelo, el coeficiente de regresión (y su error estándar), el cual permite estimar la razón de productos cruzados o razón de momios [odds ratio (OR)] para cada variable regresora. El modelo de regresión logística puede ser usado para predecir la probabilidad (p) de que la variable respuesta asuma un valor determinado. Los resultados fueron interpretados por medio de la OR, la cual es un parámetro de cuantificación que indica la probabilidad de riesgo de que una langosta sea infectada por el virus PaV1. El modelo de regresión logística utiliza la prueba X2 de Wald para la validación de los valores de los coeficientes de regresión y los OR. Para el análisis de datos se utilizó el programa Infostat (DiRienzo et al., 2010).
Resultados
Ninguna de las 496 colas de langosta analizadas tenía signos clínicos de la enfermedad causada por PaV1, como son: coloración rojiza de cefalotórax ni vestigios de hemolinfa lechosa. Todos los organismos estuvieron en intermuda.
Se detectó DNA de PaV1 en 13 colas de langosta P. argus por la prueba de PCR. En la Figura 2 se muestra un ejemplo de la amplificación de un amplicón de 499 pb correspondiente al PaV1. Asimismo, en la Figura 3 se muestra la amplificación de un producto de 120 pb, correspondientes a la región control de Actina. En total se obtuvo una prevalencia de 2.62% (Tabla 1).
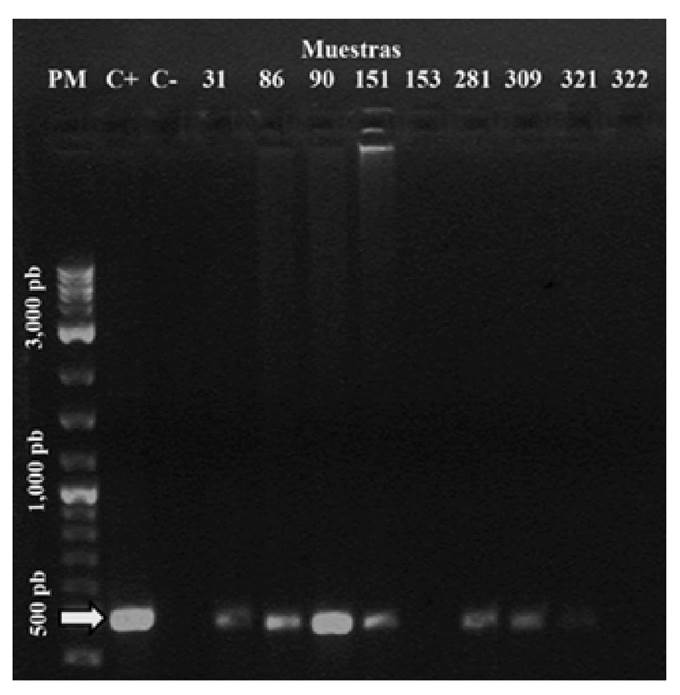
Figura 2 Prueba de PCR-simple para detectar al virus PaV1 (499 pb) en las colas de langostas Panulirus argus (Latreille, 1804). PM = escalera de peso molecular de 100 pb plus, C+ = control positivo, C- = control negativo). Los números denotan el número asignado a cada muestra de langosta.
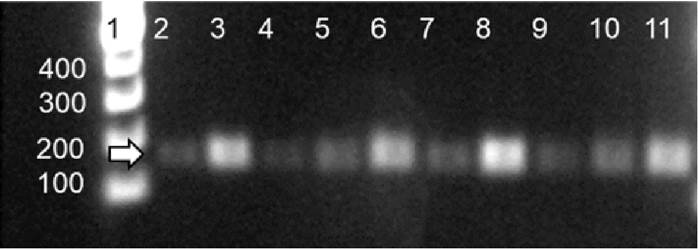
Figura 3 Prueba de PCR de la región control de actina. Línea 1: marcador molecular de 100 pb. Líneas 2-11: DNA de Panulirus argus (Latreille, 1804).
Tabla 1 Prevalencia del Panulirus argus virus 1 (PaV1) en las colas congeladas de langosta espinosa Panulirus argus (Latreille, 1804)
| Variable | N* | Número de langostas positivas a PCR | Prevalencia (%) de PaV1 |
|---|---|---|---|
| Sitio | |||
| Progreso | 327 | 5 | 1.53 |
| Río Lagartos | 169 | 8 | 4.73 |
| Fase | |||
| Subadultas | 202 | 8 | 3.96 |
| Adultas | 294 | 5 | 1.7 |
| Sexo | |||
| Hembra | 208 | 5 | 2.4 |
| Macho | 288 | 8 | 2.77 |
*número de organismos
Los resultados BLAST obtenidos de la comparación de las secuencias de ADN de PaV1 de este estudio (número de acceso en el GenBank: KR362559), mostraron 100% de homología y de cobertura con las secuencias de PaV1 reportadas en juveniles P. argus de la Florida, EUA (número de acceso: EF206313) (E = 0.0) y 99% de homología y 100 % de cobertura con la secuencia de DNA de puerulos de P. argus colectados en Puerto Morelos, Quintana Roo (E = 0.0) (número de acceso: KR362560) (Lozano-Álvarez et al., 2015).
La proporción de tallas de las langostas varió entre las zonas de captura: 202 subadultas (79 de arrecife Alacranes, Progreso y 123 de río Lagartos) y 294 adultos (248 de arrecife Alacranes, Progreso y 46 de río Lagartos), donde una mayor proporción de estos últimos se encontró en arrecife Alacranes, Progreso (Fig. 3). La distribución de organismos machos y hembras fue similar entre los dos sitios de muestreo, pero para la talla adulta se observó una mayor proporción de organismos machos (Fig. 4a).
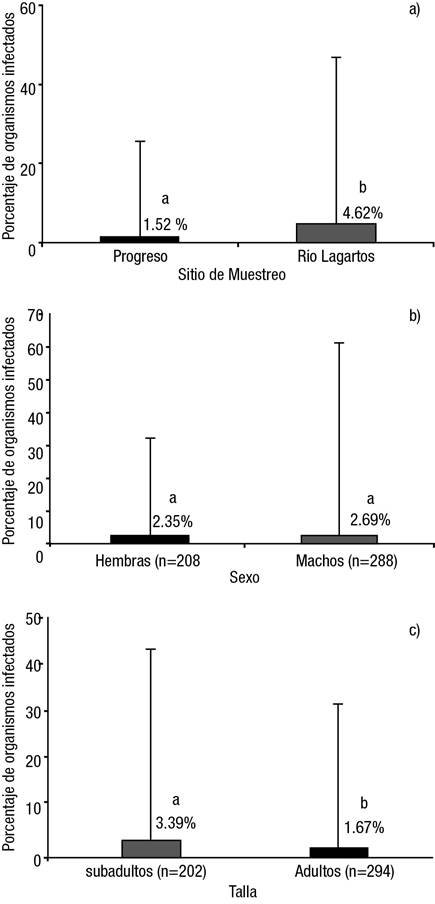
Figuras 4a-c Prevalencia (± intervalos de confianza al 95 %) del virus PaV1 en langostas Panulirus argus (Latreille, 1804). a) Por sitio de muestreo; b) Por sexo (machos y hembras); c) Por etapa ontogénica (talla). Letras diferentes en la barras indican diferencias estadísticas significativas.
Determinación de los factores de riesgo asociados a la prevalencia del virus PaV1. Se observó una mayor prevalencia de PaV1 en el río Lagartos (4.62%) en comparación con arrecife Alacranes, Progreso (1.52%) (X2 = 4.28, p =0.0038) (Fig. 4). No se encontraron diferencias significativas en la prevalencia del PaV1 entre machos (2.35%) y hembras (2.69%) (X2 = 0.06, p =0.8132) (Tabla 1, Fig. 4b).
En cambio, sí se registraron diferencias significativas entre las tallas de langosta, donde la talla subadulta presentó una mayor prevalencia de PaV1 (3.39%) en contraste con la talla adulta (1.67%) (X2 = 9.62, p =0.0081) (Tabla 1, Fig. 4c).
Los estimados del análisis de regresión logística de las variables regresoras (talla, zona de pesca, estado de la muda y sexo) sobre la probabilidad de encontrar langostas con el virus PaV1 mostraron que solamente dos variables presentaban una relación significativa: la talla de las langostas y la zona de muestreo. Con este análisis se observó que la probabilidad de encontrar DNA de PaV1 en las langostas disminuyó significativamente conforme aumentó la talla de langosta, situación que fue significativamente mayor en río Lagartos en contraste con arrecife Alacranes, Progreso (Tabla 2).
Tabla 2 Estimaciones de regresión logística y la probabilidad de infección (odds ratio ± intervalos de confianza al 95%) con el virus PaV1 en colas de langostas Panulirus argus (Latreille, 1804) entre tallas, sitios de muestreo, estado de la muda y sexos (variables explicatorias).
| Variable | Coeficiente de regresión | Error estándar | Odds ratio [OR] (intervalos de confianza de 95%) | Wald-X2 | gl | p* |
|---|---|---|---|---|---|---|
| Talla | ||||||
| Subadulta | -3.49 | 1.41 | 0.03 (0.001-0.49) | 6.1 | 2 | 0.0135** |
| Sitio | ||||||
| Río Lagartos | 6.44 | 1.77 | 626.6 (19.3-20314.4) | 13.17 | 1 | 0.0003** |
| Muda | -0.06 | 0.36 | 0.94 (0.47-1.9) | 0.03 | 3 | 0.8703 |
| Sexo | ||||||
| Macho | -1.01 | 0.61 | 0.36 (0.11-1.21) | 2.71 | 1 | 0.0995 |
* Estimación de la significancia. **Se observaron diferencias significativas con p ≤0.05.
Discusión
La exportación de colas de langosta P. argus genera una valiosa fuente de ingresos económicos para la península de Yucatán. En este recurso se ha detectado al virus PaV1. Aún no se sabe si éste tiene algún efecto sobre su pesquería, dado que en juveniles causa una enfermedad sistémica y crónico-degenerativa que provoca su muerte (Huchin-Mian et al., 2009; 2013; Cruz-Quintana et al., 2011; Behringer et al., 2012). Este virus se encuentra en organismos de vida libre y su erradicación es imposible hasta ahora (Behringer et al., 2012). Aunque PaV1 es el único agente viral reportado en P. argus, a la fecha no existe alguna normatividad referente a los requerimientos o las regulaciones sanitarias oficiales para detectar su presencia antes de ser distribuidos al mercado internacional. Se ha reportado que el transporte de organismos enfermos es un riesgo potencial para la propagación del virus de un área geográfica a otra, como ha ocurrido con otros patógenos en crustáceos (Hasson et al., 1999; Huchin-Mian et al., 2009). En ese sentido, este trabajo se propuso evaluar la prevalencia de PaV1 en dos de las principales zonas de pesca de langostas P. argus de la plataforma de la península de Yucatán destinadas a la exportación, con el fin de establecer algún factor de riesgo asociado a la presencia de PaV1.
Debido a que este estudio se basó en un muestreo dirigido, no se estimó el número de muestra en la colecta de organismos, no obstante, sí se siguieron las indicaciones de la Organización Internacional de Epizootias (OIE), que sugiere colectar al menos 30 organismos para la vigilancia de patógenos exóticos (OIE, 2010).
Las secuencias de ADN de PaV1 (KR362559) obtenidas en este estudio tuvieron 100% de homología con secuencias de PaV1 reportadas en langostas juveniles P. argus de Florida (E = 0.0) (Montgomery-Fullerton et al., 2007) y 99% de homología con secuencias de puerulos reportados en Puerto Morelos, Quintana Roo (E = 0.0) (Lozano-Álvarez et al., 2015). No se analizaron juveniles ni puerulos debido a que el objetivo de este trabajo fue la detección de PaV1 en langostas P. argus subadultas y adultas destinadas a la comercialización. En este sentido, es importante recalcar que ninguna de las colas de langostas analizadas mostró algún signo clínico característico de PaV1 (coloración rojiza del cefalotórax y hemolinfa lechosa). Considerando ese criterio, se puede asumir que los organismos analizados no se encontraban infectados. Ya que esto es más evidente en las langostas juveniles (Shields & Behringer, 2004); sin embargo, estos signos también pasan desapercibidos inadvertidos en juveniles durante las fases tempranas de la infección (Li et al., 2008). En infecciones experimentales con langostas juveniles, los signos clínicos se empezaron a observar 80 días después de la inyección del virus (Li et al., 2008). En el medio natural esta gran ventana de tiempo en la fase subclínica o asintomática puede favorecer la propagación del virus (Behringer et al., 2006; Shields, 2011).
La prevalencia de 2.55% determinada por PCR indica la presencia del ADN viral en las colas de langostas destinadas a la exportación. Al evaluar los factores de riesgo, no se observaron diferencias significativas entre machos y hembras, ni con el estado de muda, pero sí se observaron diferencias significativas entre zonas de pesca: la prevalencia de PaV1 fue significativamente mayor en las langostas de río Lagartos (4.62%) respecto a las de Progreso (1.52%) (Tablas 1 y 2). En río Lagartos se practica la pesca artesanal en un área de captura de 10 a 20 m que está caracterizada por zonas de pastos marinos y vegetación sumergida, éstas brindan protección principalmente a las langostas juveniles y subadultas, las cuales son más susceptibles a la infección por PaV1. Sin embargo, esta vegetación también promueve el gregarismo, el cual incrementa el contacto entre las langostas y aumenta el riesgo de transmisión de PaV1 al compartir refugios (Beringher et al., 2012; Briones-Fourzán et al., 2012; Shields, 2012). Por otro lado, la presencia de pastos marinos y vegetación costera provee condiciones propicias para zonas de crianza de las poblaciones de langosta P. argus del estado de Yucatán (Salas et al., 2015). Además, se trata de un área protegida en donde se regula la pesca a través de vedas, por lo que tiene periodos de pesca bien definidos que van del 1 de julio al 30 de enero (Salas et al., 2015). Por otro lado, en el Arrecife Alacranes la pesca comercial de langostas se realiza por medio de trampas, donde se capturan principalmente organismos subadultos y adultos a profundidades mayores de 30 m. Esta área, cuyo desembarque se realiza en el puerto de Progreso, tiene igualmente una arquitectura de fondo compleja y con gran diversidad de refugios (Ríos-Lara et al., 2013).
La variación espacial de la prevalencia entre poblaciones de P. argus en zonas cercanas está relacionada con factores abióticos, como la profundidad y las características del tipo de fondo (Briones-Fourzán et al., 2012; Stentiford & Feist, 2005; Shields, 2011). En Quintana Roo se han observado diferencias en la prevalencia de PaV1 en las poblaciones naturales de P. argus entre hábitats cercanos (menos de 15 km). Por ejemplo, en Bahía de la Ascensión no se reportaron langostas infectadas, mientras que en Vigía Chico la prevalencia fue por arriba del 8% por PCR y de 1.8% por signos clínicos (Candia-Zulbarán et al., 2012; Huchín-Mian et al., 2013).
En este estudio la prevalencia de PaV1 fue mayor en langostas subadultas (3.39%) que en langostas adultas (1.67%) (Tabla 2). La razón de que las adultas sean más resistentes a la infección por PaV1 aún se desconoce, por lo tanto, es motivo de estudio. No obstante, los resultados de esta investigación coinciden con otros realizados en diferentes áreas geográficas del Caribe, en donde la prevalencia de PaV1 aumenta al disminuir la talla de P. argus (Shields & Behringer, 2004; Behringer et al., 2006; Butler et al., 2008; Lozano-Álvarez et al., 2008; Cruz-Quintana et al., 2011; Huchin-Mian et al., 2013).
Debido a que los signos clínicos son menos evidentes en langostas subadultas y adultas, las pruebas de PCR sirven de apoyo para la identificación de ADN de PaV1 (Moss et al., 2013). Aunque la identificación del DNA viral no puede discernir entre una infección pasada o presente, su utilidad en la determinación de áreas geográficas libres de PaV1 es relevante (Huchin-Mian et al., 2013).
El conocimiento del estado de salud de P. argus en estas dos principales zonas de pesca proporciona información de línea base a los organismos encargados de establecer normativas sobre su regulación sanitaria.
En conclusión, los resultados de este trabajo muestran que el DNA del virus PaV1 está presente en colas de langostas congeladas, almacenadas y destinadas a la exportación. El riesgo de transmisión de PaV1 estuvo asociado a las variables: zona de pesca y fase ontogénica. Las langostas provenientes de río Lagartos (zona 4) tuvieron una prevalencia mayor que las langostas provenientes del arrecife Alacranes (zona 2). De igual forma, la prevalencia de PaV1 en langostas subadultas fue mayor que en las langostas adultas.











 nueva página del texto (beta)
nueva página del texto (beta)



