Introducción
La acuacultura busca optimizar el rendimiento productivo, por lo cual es de gran relevancia la alimentación en las distintas etapas del cultivo de las diversas especies. La alimentación tiene un papel importante en la capacidad de asimilación de nutrientes en los organismos, lo que determina el estado de salud de los peces y, con ello, la capacidad de respuesta ante posibles enfermedades. Es así que la búsqueda de alternativas nutricionales que produzcan efectos favorables en el rendimiento productivo se torna necesaria, ya que de los costos totales, el 40-60% corresponden al costo de alimentación y el 10% al control y prevención de enfermedades (Uribe et al., 2011).
Debido a esto, el uso de alimentos con inclusión de ingredientes funcionales es relevante para el aumento productivo y para el reforzamiento del sistema inmune (Carbone & Faggio, 2016; Gültepe et al., 2011). Dentro de estos alimentos se encuentran los probióticos, prebióticos y simbióticos (Akhter et al., 2015). Los oligosacáridos de manano (MOS) son derivados de las paredes celulares de la levadura (Saccharomyces cerevisiae Meyen ex E.C. Hansen, 1883), y son de los prebióticos más evaluados en peces (Hoseinifar et al., 2015); sin embargo, los resultados reportados han sido diversos, ya que en algunas especies la inclusión de MOS promueve el crecimiento, los parámetros digestivos y el sistema inmune (Gültepe et al., 2011), mientras que en otras especies no genera efectos en crecimiento pero sí en la mejora del sistema inmune (Genc et al., 2007; Talpur et al., 2014). Debido a lo anterior, el objetivo del presente estudio es determinar si la inclusión de MOS en dietas para juveniles de pejelagarto (Atractosteus tropicus Gill, 1863) genera un efecto en el crecimiento, la supervivencia, los índices somáticos y la actividad de enzimas digestivas.
Materiales y métodos
Obtención de los juveniles. El presente estudio se realizó en las instalaciones del Laboratorio de Acuicultura Tropical de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco (Dacbiol-UJAT). Un total de 180 juveniles de A. tropicus (4.64 ± 0.07 g) se obtuvieron del desove inducido de una hembra (3.5 kg) y tres machos (1.5 kg) por medio de una inyección intramuscular de hormona liberadora de hormona luteinizante (LHRHa 35 μg kg de pez-1) en la aleta pélvica. Después de la eclosión de los huevos (día 3 después de la fertilización), los eleuteroembriones se colocaron en tanques circulares de plástico de 70 L y se siguió un esquema de alimentación de acuerdo con informes anteriores (Frías-Quintana et al., 2010). Se realizó el cuidado de los organismos hasta llegar a la talla necesaria para ser utilizados en el bioensayo.
Diseño experimental. Se diseñó un experimento de una vía simple completamente aleatorizado con seis tratamientos experimentales, empleando diferentes niveles de inclusión de MOS (0.0, 0.2, 0.4, 0.6 y 0.8 %) y un alimento balanceado para trucha (Silver Cup™) como dieta control (DC), los cuales fueron evaluados por triplicado.
Al iniciar el experimento se registró el peso (g) con una balanza digital portátil (Ohaus HH120, precisión 120 ± 0.01 g, Shenzhen, China) y su longitud (cm) con una regla con precisión de 0.1 cm. Posteriormente, la biometría total de los organismos en experimentación se realizó cada 15 días. Para este experimento se ocuparon 180 juveniles (5.11 ± 0.08 g), los cuales se distribuyeron en 18 tanques circulares con 70 L de agua, conectados a un sistema de recirculación con un reservorio de 1,500 L que funciona como sedimentador de sólidos y filtro biológico, además de una bomba de agua 1 HP (Jacuzzi, JWPA5D-230A, Delavan WI, USA) y un termostato de titanio (PSA, R9CE371, Delavan WI, USA). La calidad del agua del sistema fue monitoreada diariamente durante los 62 días registrando la temperatura (27.1 ± 0.8 °C) y el oxígeno disuelto (5.7 ± 0.2 mg L-1) mediante un oxímetro (YSI 85, Ohio, USA), y el pH (7.3 ± 0.2) con un potenciómetro (HANNA HI 991001, Rumania). Se realizaron recambios de agua parciales de 50% cada dos días y recambios totales cada 5 días. Las dietas fueron proporcionadas 4 veces al día (8:00, 11:00, 14:00 y 17:00 horas) y se determinó el consumo de alimento por diferencia entre la cantidad de dieta suministrada de peso seco y la obtenida al secar de nuevo el alimento sobrante (que consistió en recolectar por sifoneo el sobrante de alimento). El alimento sobrante fue secado a la temperatura en que se elaboraron de dietas (pellets) en una estufa marca Fisher ScientificMR con temperatura controlada de 60 a 70°C.
Formulación y elaboración de dietas experimentales. La formulación de las dietas experimentales se realizó por medio del programa Mixit Win V. 5.0, donde la dieta 0 % MOS se utilizó con base en la propuesta por Frías-Quintana et al. (2010), a la cual se le adicionó 0.2, 0.4, 0.6 y 0.8% de MOS para la fabricación de las otras dietas experimentales (Tabla 1), y se utilizó el alimento comercial (Silver Cup™), con 45% de proteína y 16% de lípidos como dieta control (DC).
Tabla 1 Formulación de dietas experimentales para juveniles de pejelagarto (Atractosteus tropicus Gill, 1863) con diferentes niveles de oligosacáridos de manano (MOS) (0, 0.2, 0.4, 0.6 y 0.8%) y composición proximal.
| Ingredientes g/100g (%) | MOS | ||||
|---|---|---|---|---|---|
| 0.0 | 0.2 | 0.4 | 0.6 | 0.8 | |
| Harina de sardina a | 54.61 | 54.61 | 54.61 | 54.61 | 54.61 |
| Aceite de sardina b | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| Hidrolizado de pescado c | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 |
| Lecitina de soya d | 2.7 | 2.7 | 2.7 | 2.7 | 2.7 |
| Almidón de maíz e | 6.25 | 6.25 | 6.25 | 6.25 | 6.25 |
| Grenetina f | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
| Premezcla de vitaminas g | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| Premezcla de minerales g | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| Vitamina C h | 0.08 | 0.08 | 0.08 | 0.08 | 0.08 |
| Mos (Alltech) i | 0 | 0.2 | 0.4 | 0.6 | 0.8 |
| Harina de sorgo 8-10% j | 26.01 | 25.90 | 25.70 | 25.50 | 25.30 |
| Composición proximal (%) | |||||
| Energía (Kcal/g) | 4.09 ± 0.01 | 4.16 ± 0.01 | 4.20 ± 0.02 | 4.18 ± 0.20 | 4.14 ± 0.17 |
| Proteína | 51.8 ± 0.3 | 51.6 ± 0.3 | 52.6 ± 0.3 | 52.4 ± 0.3 | 52.6 ± 0.3 |
| Lípidos | 12.9 ± 0.1 | 13.4 ± 0.1 | 14.1 ± 0.1 | 13.2 ± 0.1 | 13.7 ± 0.1 |
| Fibra | 16.1 ± 0.2 | 15.6 ± 0.3 | 14.9 ± 0.2 | 15.1 ± 0.1 | 16.3 ± 0.2 |
| Ceniza | 14.8 ± 0.1 | 13.9 ± 0.1 | 14.1 ± 0.1 | 14.6 ± 0.1 | 13.6 ± 0.1 |
a Proteínas Marinas y Agropecuarias S. A. de C. V., Guadalajara, Jalisco; b GALMEX Comercializadora de Insumos Agrícolas S. A. de C. V., Villahermosa, Tabasco, México; c FERPAC; d Sigma-Aldrich núm. de catálogo F-8020; e Pronat Ultra, Mérida, Yucatán, México; f D´gari, Productos Alimenticios y Dietéticos Relámpago, S. A. de C. V., Tlalpan, Cd. de México; g Jalmek núm. de catálogo C5260-05; h Pedregal (para trucha Silver Cup), Toluca, Edo. de Mex. México; i Alltech Inc., Nicholasville, KY, USA; j GALMEX Comercializadora de Insumos Agrícolas S. A. de C. V., Villahermosa, Tabasco.
Para la elaboración de las dietas experimentales se siguió el protocolo propuesto por Álvarez-González et al. (2001). Los ingredientes se pesaron con ayuda de una balanza analítica con capacidad de 2,000 g (Ohaus, mod. CS2000, Greifensee, Suiza), a continuación, se mezclaron los macronutrientes en seco (harinas proteicas, almidón de maíz y harina de trigo) durante 15 minutos mediante una batidora industrial (Bathamex, 178716, México). Asimismo, se pesaron los micronutrientes (MOS, premezclas de vitaminas, minerales y vitamina C) y fueron agregados a la mezcla de los macronutrientes para revolverse por otros 15 minutos. Posteriormente, se pesaron los ingredientes líquidos (aceite de pescado y lecitina de soya), los cuales se añadieron a la mezcla anterior y se mezclaron por otros 15 minutos. Por último, se agregó el agua (aproximadamente 400 ml por K de dieta) y se mezcló durante otros 15 minutos. La mezcla final obtenida se colocó en un molino para carne 1 HP (Torrey, M-22RI, Monterrey, México) para obtener pellets con una criba de 5 mm, los cuales fueron secados en un horno (Coriat, HC- 35-D, Cd. México, México) durante 12 horas a 60 °C. Las dietas fueron colocadas en bolsas de plástico selladas herméticamente y almacenadas a una temperatura de -20 °C, hasta su uso.
Sacrificio y toma de muestras de especímenes. Al término del experimento se realizó la última biometría para posteriormente sacrificar tres organismos por réplica, lo cual se realizó con un corte en la médula espinal en la parte posterior de la cabeza, enseguida se realizó un corte en la zona ventral para llevar a cabo la extracción de vísceras y registrar el peso de órganos, así como la extracción de órganos del tracto digestivo (estómago, ciegos pilóricos e intestino), para análisis de enzimas digestivas. Las muestras del tracto digestivo fueron congeladas a una temperatura de -80 °C hasta su tratamiento.
Índices de calidad del alimento y supervivencia. La supervivencia se determinó por medio del conteo del total de peces por réplica. Con base en los datos obtenidos de consumo y crecimiento de los juveniles de A. tropicus, se calcularon los siguientes índices: ganancia en peso (WG) = [(peso final - peso inicial)/ peso inicial] x 100; tasa de crecimiento específica (SGR) = [(Ln peso final - Ln peso inicial) / números de días] x 100; tasa de conversión alimenticia (FCR) = alimento consumido (g) / peso ganado (g); tasa de conversión proteica (PER) = peso ganado / proteína ingerida; supervivencia (SUR) = (núm. final de organismos / núm. inicial de organismos) x 100; factor de condición (CF)= [PC (g)/ LC3 (cm)] x 100; índice hepatosomático (HSI)= (peso de hígado (g) x 100)/ PC (g); índice viscerosomático (VSI) = (peso de víscera (g) x 100)/ PC (g); índice somático intestinal (ISI)= (peso de intestino (cm) x 100)/ PC (g). Donde, PC indica el peso corporal (g) y LC indica longitud total corporal (cm) del pez (Tabla 2).
Tabla 2 Índices de rendimiento productivo e índices somáticos en juveniles de pejelagarto (Atractosteus tropicus Gill, 1863) alimentados con dietas experimentales con diferentes niveles de oligosacáridos de manano (MOS) (0, 0.2, 0.4, 0.6 y 0.8 %).
| Índices | MOS | DC | ||||
|---|---|---|---|---|---|---|
| 0% | 0.2% | 0.4% | 0.6% | 0.8% | ||
| WG (%) | 307.4 ±10.4b | 374.0 ± 3.6a | 261.8 ± 0.5b | 254.5 ± 1.6b | 291.9 ± 8.1b | 143.3 ± 7.0c |
| SGR (%/día-1) | 2.34 ± 0.04b | 2.59 ± 0.01a | 2.18 ± 0.00b | 2.18 ± 0.01b | 2.28 ± 0.03b | 1.48 ± 0.05c |
| FCR | 1.57 ± 0.06c | 1.48 ± 0.05d | 1.62 ± 0.34b | 1.59 ± 0.17c | 1.57 ± 0.17c | 2.67 ± 0.06a |
| PER | 1.19 ± 0.04b | 1.26 ± 0.04a | 1.14 ± 0.34d | 1.17 ± 0.17b | 1.18 ± 0.17c | 0.7 ± 0.06e |
| SUR (%) | 100 ± 0.0 | 96.6 ± 5.7 | 96.6 ± 5.7 | 100 ± 0.0 | 100 ± 0.0 | 100 ± 0.0 |
| CF | 0.35 ± 0.02 | 0.36 ± 0.02 | 0.36 ± 0.03 | 0.35 ± 0.03 | 0.34 ± 0.05 | 0.32 ± 0.05 |
| HSI | 2.76 ± 0.32ab | 3.06 ± 0.35ab | 3.64 ± 0.70a | 3.19 ± 0.44ab | 2.66 ± 0.43b | 2.94 ± 0.41ab |
| VSI | 5.93 ± 0.62b | 6.28 ± 0.62ab | 7.12 ± 0.95a | 7.08 ± 0.81a | 6.39 ± 0.82ab | 7.31 ± 0.69a |
| ISI | 1.11 ± 0.36 | 1.18 ± 0.30 | 1.23 ± 0.25 | 1.21 ± 0.27 | 1.14 ± 0.26 | 1.16 ± 0.32 |
Letras diferentes significan diferencias significativas (p <0.05).
Ganancia en peso (WG) = [(peso final - peso inicial)/ peso inicial] x 100
Tasa de crecimiento especifica (SGR) = [(Ln peso final - Ln peso inicial) / números de días] x 100
Tasa de conversión alimenticia (FCR) = alimento consumido (g) / peso ganado (g)
Tasa de conversión proteica (PER) = peso ganado / proteína ingerida
Supervivencia (SUR) = núm. final de organismos / núm. inicial de organismos) x 100
Factor de condición (CF) = [PC (g)/LC3 (cm)] x 100
Índice hepatosomático (HSI) = peso de hígado (g) x 100/ PC (g)
Índice Viscerosomático (VSI) = peso de víscera (g) x 100/ PC (g)
Índice somático intestinal (ISI) = Peso de intestino (cm) x 100/ PC (cm)
Donde, PC indica el peso corporal (g) y LC indica longitud total corporal (cm) del pez.
Actividad enzimática digestiva. La obtención del extracto multienzimático se realizó a partir del estómago (fase ácida digestiva), el intestino y los ciegos pilóricos (fase alcalina digestiva) por medio del macerado de 30 mg de tejido húmedo por ml-1 en cada réplica. Los intestinos y ciegos pilóricos fueron homogenados bajo condiciones frías (4 °C) con un Ultra-Turrax en solución Tris-HCl 50 mmol L-1 a pH 9, y los estómagos fueron homogenados en solución glicina-HCl 50 mmol L-1 a pH 2. Las muestras homogenadas fueron centrifugadas (12,000 RPM por 15 min a 4 °C) y el sobrenadante fue separado en alícuotas de 500 μL en tubos eppendorf que fueron congelados a -80 °C. La concentración de proteína soluble se evaluó con la técnica de Bradford (1976) al usar una curva estándar de albúmina bovina sérica (BSA). Para determinar la actividad de proteasas ácidas (pepsina) se utilizó el método de Anson (1938) con un sustrato de hemoglobina (0.5%) en buffer, Glicina-HCl 100 mmol L-1 a pH 2 y 37 °C. La proteasa alcalina fue medida con la técnica de Walter (1984) en sustrato de caseína al 0.5% en buffer Tris- HCl 50 mmol L-1, CaCl2 10 mmol L-1 a pH 9 y 37 °C. El producto de la reacción para proteasas ácidas y alcalinas se medió a 280 nm. La unidad de actividad enzimática fue definida como 1 μg de tirosina liberada por minuto y se utilizó un coeficiente de extinción molar (CEM) de 0.005 ml μg-1 cm-1. La actividad de tripsina fue determinada por el método de Erlanger et al. (1961) con BAPNA (Nα-Benzoil-DL-Arginina- ƿ -nitroanilida) 1mmol L-1 como sustrato, disuelta en buffer Tris-HCl 50 mmol L-1, CaCl2 10 mmol L-1 a pH 8.2 y 37 °C. El producto de reacción fue medido a 410 nm. La unidad de actividad enzimática se definió como 1μmol de ƿ-nitroanilide liberada por minuto y se utilizó un CEM de 8,800 cm-1 M-1. La actividad quimotripsina se determinó con el método de Del Mar et al. (1961) con BTEE (N-benzoil-L-tirosina etil ester) 0.56 mmol L-1 en buffer Tris-HCl 44.4 mmol L-1, CaCl2 55.5 mmol L-1 a pH 7.8 y 37 °C. El producto de reacción fue medido a 256 nm y la unidad de actividad enzimática se definió como un 1 mol de BTEE hidrolizado por minuto, con un CEM de 964 cm-1 M-1. La actividad leucina aminopeptidasa se determinó por el método de Maraux et al. (1973) con L-leucina-p-nitroanilida 1.2 mmol L-1 como sustrato en buffer fosfato sódico 50 mmol L-1 a pH 7.2 y 37 °C. El producto de reacción fue medido a 410 nm y la unidad de actividad enzimática se definió como 1 μmol de ƿ-nitroanilide liberada por minuto, con un CEM de 8,800 cm-1 M-1. La actividad Carboxipeptidasa A se determinó por el método de Folk & Schirmer (1963), con Hyppuryl-L-phenyl-alanine 25 mmol L-1 como sustrato en buffer de Tris-HCl 50 mmol L-1, NaCl 25 mmol L-1, a pH 7.5 y 25 °C. El producto de reacción fue medido a 254 nm y la unidad de actividad enzimática fue definida como 1μmol de ácido hipúrico liberado por minuto, con un CEM de 0.36 cm-1 M-1. La actividad α-amilasa se determinó por el método de Robyt & Whelan (1968) con almidón al 2% como sustrato en buffer citrato-fosfato 100 mmol L-1, NaCl 50 mmol L-1, pH 7.5 y 37°C.
El producto de reacción fue medido a 600 nm y la unidad de actividad enzimática fue definida como 1 μg de maltosa por minuto, donde se utilizó un CEM de 3,400 cm-1 M-1.La actividad lipasa se determinó por el método de Versaw et al. (1989), con β-naftil caprilato 200 mmol L-1 como sustrato en buffer Tris-HCl 50 mmol L-1 con tauracolato de sodio 100 mmol L-1 a pH 7.5 y 25 °C. El producto de reacción fue medido a 540 nm y la unidad de actividad enzimática fue definida como 1 μg de naftol liberado por minuto, con un CEM de 0.02 cm-1M-1.
Las actividades de fosfatasa ácida y alcalina se determinaron por el método de Bergmeyer (1974), con 4-nitrofenilfosfato al 2.04% para fosfatasas ácidas en buffer de ácido cítrico y citrato de sodio (1:1 p/p) 0.1 mmol L-1 a pH 5.5, y buffer de glicina NaOH 0.1 mmol L-1 a pH 10.1 para fosfatasas alcalinas. El producto de reacción fue medido a 405 nm y la unidad de actividad enzimática fue definida como 1 mg de nitrofenol liberado por minuto, donde se utilizó un CEM de 18.5 cm-1 M-1.
La actividad enzimática de los extractos se determinaron usando las siguientes ecuaciones: 1) Unidades por ml (U ml-1) = [Δabs x volumen final de reacción (ml)] [CEM x tiempo (min) x volumen del extracto (ml)]-1; 2) Unidades por mg de proteína-1 (U mg proteína-1)= U ml-1/mg de proteína soluble; El Δabs representa el incremento de absorbancia a la longitud de onda de cada técnica.
Análisis estadístico. Los datos de peso, longitud, parámetros productivos, índices somáticos y actividad enzimática fueron evaluados para los supuestos de normalidad y homocedasticidad. En caso de cumplir los supuestos, se realizó un ANOVA de una vía y una prueba a posteriori de Tukey. En caso de no cumplir con los supuestos, se realizó un análisis de Kruskal-Wallis y la prueba a posteriori de Nemenyi. Todas las pruebas se realizaron con un nivel de significancia de α =0.05 en el programa estadístico Sigma Plot 11.0.
Resultados
Evaluación de crecimiento. Los organismos alimentados con la dieta de 0.2% MOS presentaron el mayor crecimiento de todas las dietas (p ≤0.05), con un peso total de 27.04 ± 0.33 g y una talla de 19.11 ± 0.19 cm, mientras que los organismos alimentados con la dieta control obtuvieron el menor crecimiento (p ≤0.05), con 13.07 ± 0.51 g y una talla de 15.58 ± 0.18 cm (Figs. 1a-b).
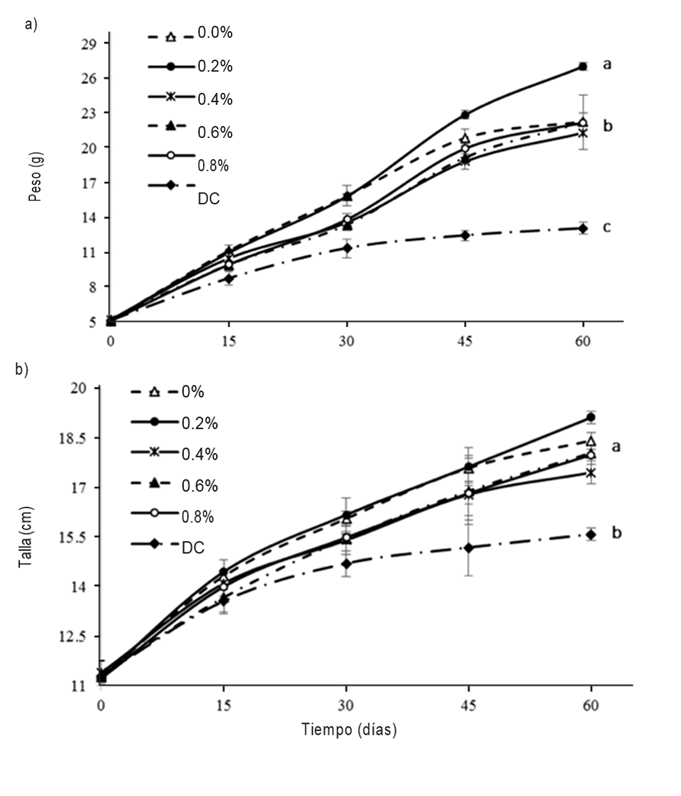
Figuras 1a-b Crecimiento en peso y longitud de juveniles de pejelagarto (Atractosteus tropicus Gill, 1863) alimentados con dietas experimentales con diferentes niveles de oligosacáridos de manano (0, 0.2, 0.4, 0.6 y 0.8 %); a) Curva de crecimiento en peso (g ± DE); b) Curva de crecimiento en longitud (cm ± DE). Las letras minúsculas significan diferencias significativas entre tratamientos (p <0.05).
Índices de calidad del alimento y supervivencia. Los índices de rendimiento productivo e índices somáticos se muestran en la Tabla 2. Los peces alimentados con la dieta de 0.2% MOS presentaron los valores más altos en WG, SGR, PER (374.0 ± 3.6, 2.59 ± 0.01 y 1.26 ± 0.04, respectivamente) y el valor más bajo en FCR (1.48 ± 0.05) (p ≤0.05). Los resultados del índice hepatosomático mostraron el mayor valor para peces alimentados con dieta de 0.2% MOS, mientras que los valores más altos de índice viscerosomático se presentaron en peces alimentados con dietas de 0.2% y 0.4% MOS con 7.12 ± 0.95 y 7.08 ± 0.81, respectivamente (p ≤0.05). Los resultados de supervivencia, factor de condición, e índice somático intestinal no mostraron diferencias entre los tratamientos (p >0.05).
Actividad de enzimas digestivas. Los resultados en la actividad de enzimas digestivas (Tabla 3) muestran diferencias en la actividad específica de todas las enzimas medidas (p ≤0.05). Los resultados de la actividad de proteasas ácidas presentaron un mayor valor en peces alimentados con dietas de 0.4%, 0.6% y 0.8% MOS con 28.13 ± 0.73, 25.75 ± 0.68 y 25.95 ± 1.55 U/mg proteína-1, respectivamente (p ≤0.05). La actividad de proteasas alcalinas mostró un mayor valor en peces alimentados con dietas de 0.2%, 0.4% y 0.6% % MOS con 81.27 ± 0.48, 81.36 ± 1.80 y 77.26 ± 1.69 U/mg proteína-1, respectivamente (p ≤0.05). Por otro lado, la mayor actividad de tripsina, lipasa y α-amilasa fue mayor en los peces alimentados con dieta de 0.4% MOS con 0.614 ± 0.02, 55.24 ± 0.28 y 8.75 ± 0.14 U/mg proteína-1, respectivamente (p ≤0.05). La actividad de quimotripsina registró un mayor valor en peces alimentados con la dieta de 0% MOS con 86.55 ± 0.73 U/mg proteína-1 (p ≤0.05). En cambio, la actividad de leucina aminopeptidasa mostró un mayor valor en peces alimentados con la dieta de 0.6 % MOS con 0.645 ± 0.05 U/mg proteína-1 (p ≤0.05). La actividad de carboxipeptidasas presentó un mayor valor en peces alimentados con dietas 0.6% MOS y DC con 0.471 ± 0.01 y 0.450 ± 0.02 U/mg proteína-1, respectivamente (p ≤0.05). Por último, los mayores valores de actividad de fosfatasas ácidas y fosfatasas alcalinas se encontraron en peces alimentados con dieta DC, con 0.357 ± 0.01 y 0.636 ± 0.12 U/mg proteína-1, respectivamente (p ≤0.05).
Tabla 3 Actividad de enzimas digestivas en juveniles de pejelagarto (Atractosteus tropicus Gill, 1863) alimentados con diferentes niveles de oligosacáridos de manano (MOS) (0, 0.2, 0.4, 0.6 y 0.8 %).
| Actividad (U mg proteína-1 ; mU mg proteína-1 *) | MOS | DC | ||||
|---|---|---|---|---|---|---|
| 0% | 0.2% | 0.4% | 0.6% | 0.8% | ||
| Proteasa ácida | 23.87 ± 1.02b | 21.09 ± 1.01c | 28.13 ± 0.73a | 25.75 ± 0.68a | 25.95 ± 1.55a | 17.32 ± 0.99d |
| Proteasa alcalina | 67.16 ± 1.23b | 81.27 ± 0.48a | 81.36 ± 1.80a | 77.26 ± 1.69a | 69.67 ± 0.67b | 27.63 ± 2.39c |
| Tripsina | 0.52 ± 0.004b | 0.46 ± 0.04b | 0.614 ± 0.02a | 0.37 ± 0.03b | 0.354 ± 0.01b | 0.27 ± 0.03c |
| Quimotripsina | 86.55 ± 0.73a | 51.24 ± 0.4b | 22.06 ± 0.68c | 10.13 ± 0.50d | 8.86 ± 0.21de | 7.96 ± 0.11e |
| LAP | 0.122 ± 0.01c | 0.422 ± 0.02b | 0.389 ± 0.01b | 0.645 ± 0.05a | 0.465 ± 0.01b | 0.373 ± 0.06b |
| Carboxipeptidasa | 0.223 ± 0.01d | 0.191 ± 0.01e | 0.269 ± 0.01c | 0.471 ± 0.01a | 0.371 ± 0.01b | 0.450 ± 0.02a |
| Lipasa | 44.96 ± 1.16b | 44.33 ± 0.45b | 55.24 ± 0.28a | 22.62 ± 0.43c | 25.57 ± 1.15c | 19.50 ± 3.33c |
| α-amilasa | 7.93 ± 0.20b | 6.34 ± 0.09c | 8.75 ± 0.14a | 6.08 ± 0.22c | 5.45 ± 0.48c | 3.08 ± 0.02d |
| Fosfatasa ácida* | 0.198 ± 0.01b | 0.145 ± 0.01c | 0.197 ± 0.02b | 0.226 ± 0.01b | 0.153 ± 0.01c | 0.357 ± 0.01a |
| Fosfatasa alcalina* | 0.306 ± 0.02b | 0.248 ± 0.01c | 0.403 ± 0.03b | 0.244 ± 0.01c | 0.313 ± 0.04b | 0.636 ± 0.12a |
Letras diferentes significan diferencias significativas (p <0.05).
Ganancia en peso (WG) = [(peso final - peso inicial)/ peso inicial] x 100
Tasa de crecimiento especifica (SGR) = [(Ln peso final - Ln peso inicial) / números de días] x 100
Tasa de conversión alimenticia (FCR) = alimento consumido (g) / peso ganado (g)
Tasa de conversión proteica (PER) = peso ganado / proteína ingerida
Supervivencia (SUR) = núm. final de organismos / núm. inicial de organismos) x 100
Factor de condición (CF) = [PC (g)/LC3 (cm)] x 100
Índice hepatosomático (HSI) = peso de hígado (g) x 100/ PC (g)
Índice Viscerosomático (VSI) = peso de víscera (g) x 100/ PC (g)
Índice somático intestinal (ISI) = Peso de intestino (cm) x 100/ PC (cm)
Donde, PC indica el peso corporal (g) y LC indica longitud total corporal (cm) del pez.
Discusión
Los efectos de la suplementación dietaria de oligosacáridos de manano en peces han sido ampliamente estudiados, con varios parámetros de respuesta medidos, como crecimiento, supervivencia, índices productivos (SGR, FCR, PER), índices somáticos (CF, HSI, VSI, ISI), digestibilidad de nutrientes, actividad de enzimas digestivas, histopatología de hígado e intestino, respuesta inmune y hematología, entre otros. Lo anterior, con el fin de demostrar respuestas específicas según la especie y la etapa de vida.
En el presente trabajo, los juveniles de A. tropicus alimentados con dieta de 0.2 % MOS presentaron mayor crecimiento en peso y longitud, así como un mayor aprovechamiento de alimento y proteína (FCR y PER). Se han reportado resultados similares para la dorada (Sparus aurata Linnaeus, 1758) (Gültepe et al., 2011); sin embargo, otros resultados indican que la adición de MOS en el rango de 0.05% a 0.4% no promueve efectos significativos en el crecimiento de peces como tilapia híbrida (Oreochromis niloticus Linnaeus, 1758; x O. aureus Steindachner, 1864) (Genc et al., 2007), bagre de canal (Ictalurus punctatus Rafinesque, 1818) (Peterson et al., 2010), pez beta (Betta splendens Regan, 1910) (Vieira de Azevedo et al., 2016), carpa común (Cyprinus carpio Linnaeus, 1758) (Momeni-Moghaddam et al., 2015), esturión gigante (Huso huso Linnaeus, 1758) (Mansour et al., 2012) y cabeza de serpiente (Channa striata Bloch, 1793) (Talpur et al., 2014). No obstante, en algunas de las especies antes mencionadas, se observa un efecto positivo en parámetros de resistencia del sistema inmune, lo que resalta principalmente el beneficio de MOS como inmunoestimulantes y, a su vez, genera la necesidad de realizar estudios sobre sus efectos inmunoestimulantes en juveniles de A. tropicus.
Los resultados del presente estudio muestran diferencias entre tratamientos para el índice hepatosomático y el índice viscerosomático; dado que fueron mayores en los peces alimentados con la dieta de 0.2% MOS. En contraste con estos resultados, estudios en la dorada (Sparus aurata) muestran una disminución del HSI en organismos alimentados con 0.2% y 0.4% MOS (Dimitroglou et al., 2010), mientras que estudios en tilapia híbrida (Oreochromis niloticus x O. aureus) muestran que la inclusión de 0.15, 0.3 y 0.45 % MOS no causa un efecto en el HSI y el VSI (Genc et al., 2007). La relación del peso del hígado con respecto al peso corporal depende del estado metabólico del organismo, donde los hígados de mayor tamaño representan la presencia de reservas energéticas de glicógeno y lípidos (Polakof et al., 2012). Lo cual quiere decir que los juveniles de A. tropicus alimentados con la dieta de 0.2% MOS generan un aumento en las reservas energéticas hepáticas como posible reflejo del cambio del metabolismo de glucosa y lípidos. Sin embargo, es necesario realizar más estudios sobre composición hepática, así como cortes histológicos para poder aseverar la acumulación de reservas energéticas, así como caracterizar posibles modificaciones morfológicas de dicho tejido.
La importancia biológica de las enzimas digestivas reside en que son las encargadas de convertir los macronutrientes (proteínas, carbohidratos y lípidos) en micronutrientes (aminoácidos, azúcares y ácidos grasos), para que los últimos puedan ser absorbidos con mayor facilidad por los enterecitos intestinales y así ser utilizados para los diferentes procesos bioquímicos y metabólicos de los organismos (Guillaume et al., 2004). Aunque los prebióticos son alimentos indigestibles para el hospedero, también son aditivos que funcionan como sustrato selectivo para algunos microorganismos, lo cual puede resultar benéfico para el hospedero, ya que limita la colonización de otro tipo de bacterias con potencial patógeno en el tracto digestivo (lo que altera significativamente la microbiota) y genera un aumento en la digestibilidad de nutrientes y cambios histológicos en los tejidos involucrados (Gibson and Roberfroid, 1995). En el presente trabajo se determinó la actividad de enzimas digestivas de origen pancreático e intestinal, y los resultados indican que la inclusión de MOS en dietas para juveniles de A. tropicus modifica la actividad específica de casi todas las enzimas digestivas medidas, sin mostrar relación directa con el tratamiento que mostró mejor crecimiento. Reportes en corvina roja (Sciaenops ocellatus Linnaeus, 1766), lobina rayada (Morone chrysops Rafinesque, 1820 x M. saxatilis Walbaum, 1792) y dorada (S. aurata), muestran que no necesariamente la asimilación de los nutrientes es generada por un aumento en la actividad de enzimas digestivas, ya que los cambios estructurales en el tracto gastrointestinal (acrecencia de área de microvellosidades) se encuentran relacionados con el incremento de la capacidad de absorción, debido al aumento en el área superficie de la membrana borde cepillo (Dimitroglou et al., 2010; Anguiano et al., 2012). Dicho lo anterior, es necesario reunir esfuerzos para evaluar los posibles cambios morfológicos en la membrana borde cepillo en juveniles de A. tropicus alimentados con dietas suplementadas con MOS, no solo en la dieta de 0.2% MOS, sino también en los demás tratamientos, esto con el fin de entender por qué se generó una disminución de crecimiento en los tratamientos con mayor inclusión de MOS.
En conclusión, los resultados indican que la suplementación de un 0.2% de oligosacáridos de manano en la dieta para juveniles de A. tropicus genera mejoras de crecimiento en peso y talla, en la tasa de crecimiento específica, en la tasa de conversión alimenticia y en la tasa de eficiencia proteica. La inclusión de MOS en diferentes niveles sí generó efectos sobre índice hepatosomático, índice viscerosomático y actividad de enzimas digestivas. Por consiguiente, es necesario generar estudios sobre los efectos de la inclusión de MOS en el sistema inmune, así como en los efectos histológicos en hígado e intestino, con el objetivo de entender los mecanismos de tales efectos sobre juveniles de A. tropicus.











 nova página do texto(beta)
nova página do texto(beta)



