La variación morfológica del aparato bucal se refleja principalmente en el tipo de dentición, así como en la fuerza y abertura de la mandíbula, los cuales a su vez definen el tipo y tamaño de las presas consumidas; además, algunos estudios reportan diferencias entre sexos en la forma y tamaño de los dientes de varias especies de elasmobranquios (Feduccia & Slaughter, 1974; Wootton, 1990; Winemiller, 1991; Gerking, 1994; Sáez & Laminilla, 2004).
Adicionalmente, las características dentales son en muchos casos, el único rasgo disponible para la discriminación entre elasmobranquios, de tal manera que la observación y descripción de los patrones en los dientes contribuye al conocimiento del grupo en estudio (Mendoza-Vargas & Espinosa-Arrubarrena, 2016). Sin embargo, debido al reemplazo continuo de los dientes (polifiodontos; Moss, 1972), en ocasiones se presenta una descripción incompleta de la morfología dentaria en varias especies de batoideos, lo que dificulta una evaluación de las diferencias intraespecíficas e interespecíficas. Sumado a ello, los dientes pueden cambiar significativamente de forma y tamaño en función de su posición en la mandíbula, la edad y el sexo del organismo.
El presente estudio describe las diferencias intra e interespecíficas en la morfología y disposición de los dientes en dos especies de batoideos: Urotrygon rogersi (Jordan & Starks, 1985) y Urotrygon nana Miyake & McEachran, 1988, con el fin de aportar información morfo-funcional para futuros estudios comparativos.
Con este fin, se recolectaron las mandíbulas de diez individuos adultos (cinco de cada sexo) de U. nana (20.6 cm a 22.9 cm LT) y de U. rogersi (30.9 cm a 41.2 cm LT). Los organismos fueron capturados en la pesquería de arrastre comercial de camarón en la plataforma continental frente a Nayarit y Sinaloa, México, entre septiembre de 2007 y marzo de 2008. Las mandíbulas fueron limpiadas manualmente y se fotografiaron con una cámara digital de 12 megapíxeles (Canon Powershot Sx510).
Con la ayuda de un microscopio se contó el número de series o hileras (alineación mesiodistal de los dientes a lo largo del borde de la mandíbula) y filas (secuencia labiolingual del diente) de la primera hilera funcional, desde la sínfisis hasta los extremos de ambos cartílagos; para ello, las placas dentarias fueron divididas en dos secciones: comisurales y sinfisiales (Fig.1a). Se describió la forma de los cartílagos y la posición y estructura de cada diente (corona y raíz; Fig.1b). Se identificó el tipo de heterodoncia y la morfología de la dentición: cúspide redonda (R), cúspide aguzada (A), y cúspide redonda en comisura y aguzada en sínfisis (R+A) (McEachran & Stehmann, 1984; Braccini & Chiaramonte, 2002).
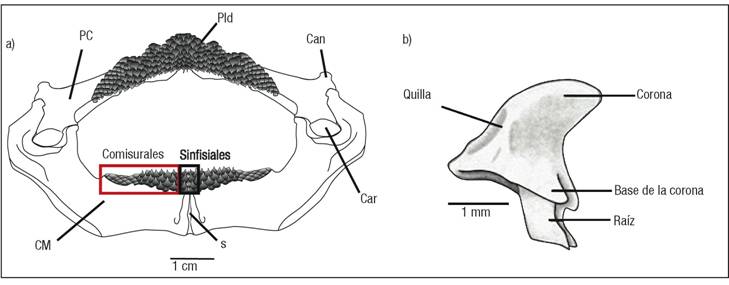
Figuras 1a-b a) Mandíbula típica de un batoideo, que indica las estructuras consideradas para la descripción morfológica y las secciones de la placa dentaria. PC: Palatocuadrado; Pld: Placa dentaria; Can: Cóndilo anterior; Car: Cóndilo articular; CM: Cartílago de Meckel; S: Sínfisis). b) Caracteres morfológicos utilizados para la descripción de los dientes.
Se observaron similitudes entre los cartílagos y los dientes de ambas especies, como la presencia de una sínfisis mandibular en ambos cartílagos, el Palatocuadrado más delgado que el cartílago de Meckel y cóndilos anteriores y articulares completamente desarrollados. Los dientes de ambas especies se encuentran unidos a la mandíbula mediante la superficie adherente (sección de la raíz que se asienta en la membrana dental, tejido conectivo fibroso), así mismo, en la parte media de la raíz se observa un surco transversal que, en vista labial, presenta dos pequeños lóbulos. Por otro lado, la corona muestra una cúspide primaria bien desarrollada en ambas especies.
Mandíbulas de Urotrygon nana. En el Palatocuadrado (Pc), U. nana presentó de 32 a 37 filas y de 6 a 9 series, con 192 y 333 dientes. En el cartílago de Meckel (CM) el número de filas varió entre 33 y 37, y entre 6 a 11 series, con 198 a 407 dientes. Las hembras presentaron una fila de dientes más en las comisuras del cartílago de Meckel (Tabla 1).
Tabla 1 Número de filas y series de dientes en Palatocuadrado y cartílago de Meckel de Urotrygon nana Miyake & McEachran, 1988 y Urotrygon rogersi (Jordan & Starks, 1985). Cder: Comisura derecha; S: Sínfisis; Cizq: Comisura izquierda.
| Palatocuadrado | Cartílago de Meckel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Especie | Sexo | Cder | S | Cizq | Filas | Series | Cder | S | Cizq | Filas | Series |
| U. nana | ♂ | 17 - 18 | 1 | 17 - 18 | 35 - 37 | 7 - 9 | 16 - 17 | 1 | 16 - 17 | 33 - 35 | 6 - 11 |
| ♀ | 16 - 18 | 1 | 15 - 18 | 32 - 37 | 6 - 9 | 16 - 18 | 1 | 16 - 18 | 33 - 37 | 7 -11 | |
| U. rogersi | ♂ | 18 - 19 | 1 | 19 | 38 - 39 | 7 - 11 | 16 - 20 | 1 | 15 - 20 | 32 - 40 | 9 - 14 |
| ♀ | 23 | 1 | 22 | 46 | 8 - 10 | 21 | 1 | 18 | 40 | 8 - 10 | |
Dentición de Urotrygon nana. En ambos sexos se presentó heterodoncia monognática, la cual se caracteriza por mostrar tres morfotipos dentarios en el Palatocuadrado (Fig. 2a). El morfotipo I se localiza en las comisuras y se caracteriza por ser más ancho que alto, con cúspides R. El morfotipo II se localiza en la parte media, entre la comisura y la sínfisis, y se caracteriza por presentar una forma intermedia entre romboide y ovalada con cúspides redondeadas. El morfotipo III se encuentra en las diez hileras intermedias y la fila sinfisial del Palatocuadrado, y presenta una forma triangular con una pequeña cúspide que apunta al interior de la boca, rasgo más conspicuo en hembras que en machos (Fig. 2b). En el cartílago de Meckel únicamente se observaron los morfotipos I y II, que muestran las cúspides más desgastadas que en el Palatocuadrado.
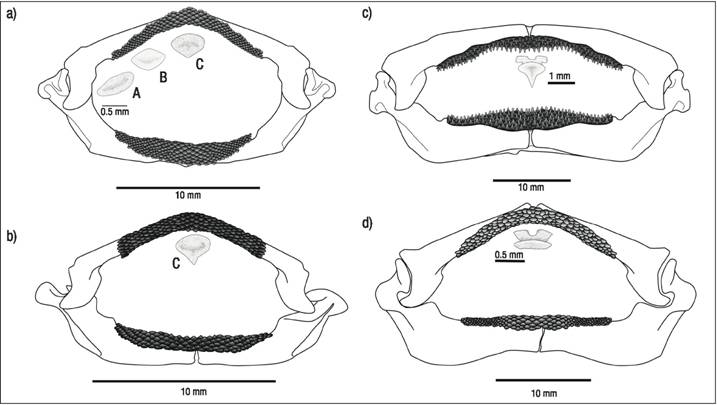
Figuras 2a-d a-b) Mandíbula y dientes del Palatocuadrado de Urotrygon nana Miyake & McEachran, 1988. a) macho; b) hembra; c-d) Mandíbula y dientes del Palatocuadrado de macho (c) y hembra (d) de Urotrygon rogersi (Jordan & Starks,1895). A: Comisural; B: Medio; C: Sinfisial.
Mandíbulas de Urotrygon rogersi. El Palatocuadrado presentó de 38 a 46 filas y de 7 a 11 series, con 266 y 506 dientes. En el cartílago de Meckel el número de filas varió entre 32 y 40, y de 8 a 14 series, con 256 a 560 dientes. Se observaron diferencias en las fórmulas dentarias entre machos y hembras; éstas últimas presentaron un mayor número de filas dentales tanto en el Palatocuadrado (23/22) como en la comisura derecha del cartílago de Meckel (21). En el caso de los machos, se presentó mayor cantidad de filas en la comisura izquierda del cartílago de Meckel (20) (Tabla 1).
Dentición de Urotrygon rogersi. La revisión de las placas dentarias reveló una heterodoncia sexual o dimorfismo sexual con un solo morfotipo. Todos los dientes de los machos presentaron cúspides A (Fig. 2c) orientadas hacia el interior de la boca, mientras que para las hembras, las cúspides son R con la presencia de una cresta transversal (surco en la parte media; Fig. 2d). En ambos sexos el tamaño del diente y del ápice se reduce gradualmente conforme se aproximan a las comisuras bucales.
Los resultados del análisis de las placas dentarias revelaron una heterodoncia sexual en organismos adultos de U. rogersi. Este patrón de dimorfismo sexual en la dentición es común en otras especies de batoideos, donde se han observado cambios en los machos durante la temporada reproductiva principalmente (Kajimura & Tricas, 1996; Sáez & Laminilla, 2004; Braccini & Chiaramonte, 2002; Rangel et al., 2014).
Se ha descrito que la presencia de dientes relativamente largos con cúspides aguzadas es característica de organismos que atrapan o sujetan sus presas antes de tragarlas; sin embargo, la heterodoncia sexual de U. rogersi no parece ajustarse a este patrón, pues a pesar de la marcada diferencia morfológica en los elementos dentales, ambos sexos consumen prácticamente el mismo tipo de presas, difiriendo únicamente en las proporciones en las que son consumidas (Navarro-González et al., 2012).
En el caso de U. nana, el arreglo dentario de hembras y machos se caracterizó por la presencia de una heterodoncia monognática, lo cual ha sido observado en otras especies de batoideos como Discopyge tschudii Heckel, 1846 (Spath et al., 2017). Este tipo de arreglo dista mucho de la configuración dentaria de U. rogersi, por lo que se considera necesario ampliar el número de muestra, considerando los diferentes estadios de vida, y desarrollar estudios etológicos de las especies, que permitan evaluar las relaciones entre los patrones dentarios y el comportamiento reproductivo de las especies.











 nueva página del texto (beta)
nueva página del texto (beta)


