Introducción
Los humedales son ecosistemas que abarcan diversos tipos de vegetación con una gran biodiversidad; sus características hidrobiológicas dan lugar a lagunas someras, humedales herbáceos de agua dulce, marismas, manglares, pantanos y selvas inundables, entre otros (Moreno-Casasola et al., 2010). Todos estos tipos de humedales han sido alterados drásticamente alrededor del mundo, lo cual ha causado pérdidas de biodiversidad y de servicios ecosistémicos (Constanza et al., 1997; MEA, 2005; Korsgaard & Schou, 2010). Landgrave y Moreno-Casasola (2012) reportan en México una pérdida o degradación de humedales del 62.1.
Las comunidades vegetales con una fisonomía particular que conforman estos ecosistemas, además de ser el componente biótico distintivo de los humedales, hacen posible el funcionamiento ecosistémico que los distingue de los ecosistemas terrestres (Mitsch & Gosselink, 2000; Moreno-Casasola et al., 2010), ya que participan como base de la cadena alimentaria y proporcionan el hábitat para una variedad de organismos acuáticos, anfibios y terrestres, que incluye macroinvertebrados, bacterias epífitas, perifiton, aves, peces, reptiles, anfibios y aves (Zedler & Kercher, 2005; Mitsch & Gosselink, 2000). La vegetación influye en el régimen hidrológico, los procesos de sedimentación y la dinámica de los nutrientes (Zedler & Kercher, 2005; Korsgaard & Schou, 2010).
Entre los diferentes disturbios naturales que los impactan, el fuego se considera generalmente infrecuente, debido a los altos niveles de humedad y a las diferencias en los potenciales combustibles respecto a los ecosistemas terrestres (Miller et al., 1998; Bisson et al., 2003; Pettit & Naiman, 2007). Sin embargo, los rayos (Bisson et al., 2003), la combustión espontánea (Miller et al., 1998; Bisson et al., 2003) y los incendios naturales en las partes altas de los ecosistemas pueden propagarse hacia los humedales y hacer posible la presencia del fuego en algunos de ellos, o bien aumentar su extensión e intensidad en aquéllos con un régimen natural de incendios (Pettit & Naiman, 2007; Norton & De Lange, 2002; Miller et al., 1998). Asimismo, diversos humedales son sometidos a regímenes de disturbio por fuego provocados por el ser humano (Bixby et al., 2015).
Un disturbio como el fuego modifica la composición y estructura de las comunidades vegetales a través de las respuestas y características funcionales de las especies presentes en el sitio. Además, el fuego interacciona con otros tipos de disturbio, como cambios en el hidroperiodo o la introducción de especies exóticas (Zedler & Kercher, 2004; López Rosas & Moreno-Casasola, 2012).
En las comunidades vegetales se ha documentado la modificación de las interrelaciones entre las especies como uno de los efectos del disturbio por fuego. Por ejemplo, en los Everglades, en los Estados Unidos, donde coinciden Typha domingensis Pers. y Phragmites australis (Cav.) Trin ex Stuedel, la primera puede llegar a desplazar a la segunda -al menos temporalmente- en zonas con un régimen de fuegos que presentan alteraciones en su hidrología (Newman et al., 1996; David, 1996; Miller et al., 1998; Rice et al., 2000; Pettit & Naiman, 2007). En otros casos, la combinación de inundación y aumento en la salinidad tras un incendio puede disminuir significativamente la cobertura de P. australis (Rice et al., 2000; Bart & Hartam, 2003). Diversos estudios en humedales riparios han demostrado que P. australis y Tamarix ramossisima Ledeb crean una sinergia con el fuego debido a que acumulan una gran cantidad de materia orgánica en pie que favorece incendios de alta intensidad con un mayor tiempo de residencia, lo cual deposita mayor cantidad de fósforo en el agua y, por lo tanto, elimina a otras especies vegetales más sensibles al fuego (Mitsch & Gosselink, 2000; Zedler & Kercher, 2005; Pettit & Naiman, 2007). Lo anterior indica que la respuesta de la vegetación y de las especies de los humedales al fuego es idiosincrática, lo que obliga a estudiar la relación de este con cada tipo de humedal.
En un estudio anterior realizado por Escutia-Lara et al. (2012) fue posible determinar que la cosecha de Phragmites australis puede ser una medida efectiva de control, particularmente útil en sitios en donde el uso de herbicidas no es recomendable. Sin embargo, la cosecha produce múltiples fragmentos de longitudes pequeñas que no es posible retirar del sitio y que pueden dar origen a nuevos individuos y propagar la especie a zonas no invadidas dentro del humedal manejado. Debido a esto, se llevó a cabo un experimento en mesocosmos, con el objetivo de cuantificar el éxito en el establecimiento de fragmentos de P. australis bajo doseles de Schoenoplectus americanus (Pers.) Volkart ex Schinz & R. Keller (una especie dominante de humedales del occidente de México) sometidos al efecto del fuego. En él se buscó comprobar si el fuego es un factor que favorece el establecimiento de P. australis, al reducir la competencia con Schoenoplectus americanus.
Materiales y métodos
Descripción del sistema de referencia y las especies utilizadas. Los propágulos de Phragmites australis fueron colectados en el manantial de la Mintzita, sitio RAMSAR (101º 172´ 47´´ O 19º 38´ 43´´ N), ubicado al sur de la ciudad de Morelia, Michoacán, México, cuyo ecosistema está dominado por Typha domingensis y Schoenoplectus americanus (Hall et al., 2008; Escutia et al., 2009; del Val et al., 2012). Este humedal se ve afectado por fuertes presiones de actividad humana: provee alrededor del 35% de la totalidad de agua de la ciudad, presenta procesos de eutrofización, ramoneo de la vegetación por ganado y disturbio por fuegos que escapan de campos de cultivo aledaños (Escutia et al., 2009; Escutia et al., 2012). Asimismo, las especies nativas sufren la presión de plantas invasoras como Phragmites australis, pues éstas han empezado a formar manchones que dominan algunas partes del humedal.
Las especies dominantes en este sistema son comunes para la mayoría de los humedales templados de México. En las partes menos profundas se encuentra Schoenoplectus americanus (de la familia Cyperaceae), que es una planta perenne rizomatosa con un tallo erecto triangular que mide hasta 1.5 m de altura. Esta especie se distribuye en las regiones templadas desde Estados Unidos hasta Venezuela y Chile (Moreno-Casasola et al., 2010; Zedler & Kercher, 2005). En el sitio de colecta de plántulas -que hemos estudiado por más de diez años- se encuentra regularmente más cerca a la orilla del humedal, en donde el agua se encuentra por debajo de la superficie del suelo (Escutia et al., 2009; Escutia et al., 2012).
Por otro lado, Phragmites australis es una planta de la familia Poaceae con una amplia distribución geográfica, desde zonas templadas a tropicales. Crece de dos a cuatro metros de altura y presenta hojas lisas y planas de 1 a 5 cm de ancho. Además, se propaga fácilmente por medio de estolones, rizomas y fragmentos de tallos (Escutia-Lara et al., 2012; Bart & Hartman, 2003) y forma conjuntos densos que excluyen a otras especies vegetales (Swearinger & Saltonstall, 2010).
Diseño experimental. Construcción de los mesocosmos. Se construyeron 36 mesocosmos con tinas de plástico de 210 L de capacidad (100 x 68 x 40 cm) con un área superficial de 0.58 m2. Cada mesocosmo fue llenado con una mezcla de turba comercial y suelo de la localidad (tipo arcilloso) con una proporción de 1:1 (0.1 m3 por material) (Fig. 1). El sistema de riego mantenía un nivel constante de agua, 5 cm por debajo de la superficie del sustrato. Los mesocosmos se encontraban al aire libre, sometidos a las variaciones naturales del clima.
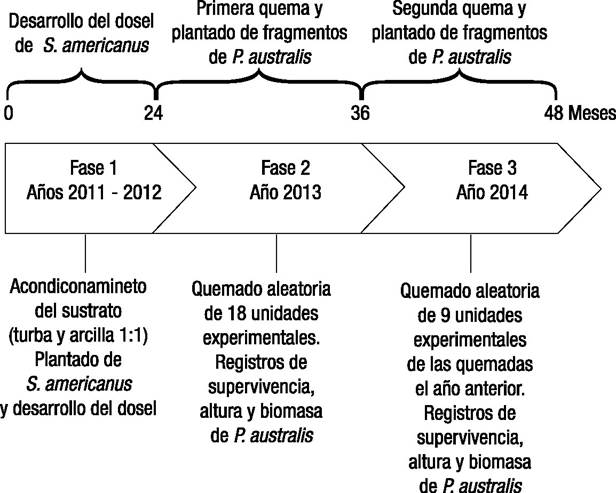
Figura 1. Línea del tiempo con descripción de las fases del experimento del establecimiento de fragmentos de Phragmites australis (Cav.) Trin ex Stuedel en un dosel de Schoenoplectus americanus (Pers.) Volkart ex Schinz & R. Keller a lo largo de 4 años.
Fase 1. Plantado y desarrollo del dosel. Se efectuó el plantado de fragmentos de rizoma de Schoenoplectus americanus en los mesocosmos (16 por mesocosmo), y se dejó desarrollar un dosel de esta especie durante dos años, de 2011 a 2012 (Fig. 1). Este periodo de acondicionamiento permitió validar que no hubo diferencias entre los 36 mesocosmos en la densidad de tallos de Schoenoplectus americanus al final del periodo de acondicionamiento (p >0.05).
Fase 2. Primera aplicación de fuego en el bioensayo. El primer tratamiento de quemado se aplicó durante la primera semana del mes de abril del 2013 a 18 unidades experimentales (la mitad) seleccionadas al azar. Cada mesocosmo fue asignado a un tratamiento por medio de una tabla de números aleatorios (Fig. 2). Una vez quemados los doseles de los mesocosmos asignados a este tratamiento, se trasplantaron dos segmentos vegetativos de Phragmites australis en cada uno de los 36 mesocosmos, con un total de 72 fragmentos. Los fragmentos, que eran de 30 cm de longitud y 8 ± 2 mm de diámetro cada uno, fueron enraizados previamente en agua corriente en las instalaciones del Instituto de Investigaciones en Ecosistemas y Sustentabilidad durante 30 días (Fig. 1). Se plantaron en la parte central de cada mesocosmo a una distancia de 36 cm uno del otro por medio de una varilla de metal, a fin de causar el menor daño posible al sistema radicular de las plantas circunstantes.
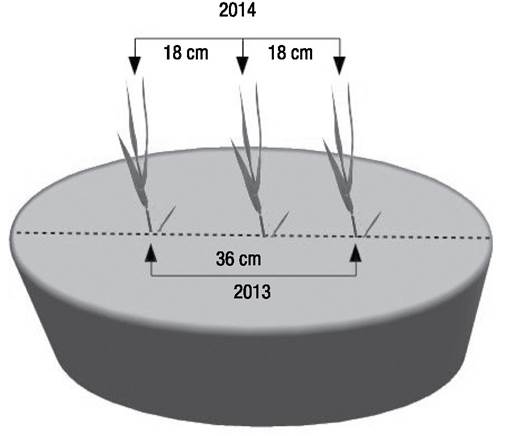
Figura 2. Esquema del plantado de los fragmentos de Phragmites australis (Cav.) Trin ex Stuedel los mesocosmos. Para el primer año se plantaron dos individuos por unidad y, al no haber evidencia de interferencia entre las plantas, para el segundo año se plantaron tres.
Fase 3. Segunda aplicación de fuego en el bioensayo. En el año 2014, durante la primera semana del mes de abril, se quemaron al azar 9 de los 18 mesocosmos que fueron quemados el año anterior (Figs. 1-2). Debido a que se pudo determinar que no había riesgo de competencia entre los segmentos de Phragmites durante una sola temporada de crecimiento, para esta aplicación se incluyó un mayor número de segmentos, ya que se pudieron plantar con menor distancia, de tal forma que se pudo incrementar el tamaño de muestra.
Respuesta de Phragmites australis: supervivencia, crecimiento y acumulación de biomasa. En ambas temporadas de crecimiento (de abril a octubre de 2013 y 2014) se registró la supervivencia y la altura máxima de los 36 mesocosmos (se utilizó una regla graduada cada 0.5 cm). Para obtener los datos de biomasa aérea se colectaron los individuos de Phragmites australis en la última semana del mes de octubre; se colocaron en un horno de secado (Lumistel HEC-41) a 60 °C, hasta peso constante (lo que para la mayoría de las muestras ocurrió a las 48 horas), y se pesaron en una balanza semianalítica (Ohaus AV53). El dosel de Schoenoplectus americanus no se evaluó a lo largo del experimento debido a su rápida recuperación.
Análisis estadístico. Los datos fueron analizados por medio de modelos lineales generalizados para supervivencia usando la distribución binomial. Para las variables continuas (altura y biomasa) se utilizó la distribución Poisson (Crawley, 2007), debido a que no cumplían con los supuestos asociados a la distribución normal. Todos los análisis estadísticos se llevaron a cabo con el paquete R (R Core Team, 2017).

Figura 3. Esquema del experimento completo y la asignación de los mesocosmos a los diferentes tratamientos de fuego en el dosel de Schoenoplectus americanus (Pers.) Volkart ex Schinz & R. Keller. Después del segundo año de quema, 18 mesocosmos fueron quemados una sola vez, 9 fueron quemados dos veces y 9 no fueron quemados.
Resultados
Al inicio del experimento los mesocosmos mantuvieron una densidad de 11.0 ± 0.6 tallos/dm2 de Schoenoplectus americanus, antes de efectuar la primera quema (p = 0.55), lo que garantizó condiciones ambientales similares en los 36 mesocosmos. Cabe destacar que antes de las quema todos los mesocosmos presentaron rebrotes de Schoenoplectus americanus; el registro de su aparición inicio del mes de febrero de cada año y alcanzó la máxima cobertura del dosel en la segunda semana de agosto de 2013, aproximadamente cuatro meses después de aplicar el fuego durante la primera semana del mes de abril.
Posterior a la primera quema, en 2013, la supervivencia de las plantas de P. autralis fue de 27.8%, mayor a lo detectado en los mesocosmos control, de 8.6%. Después de la segunda quema, en 2014, en los mesocosmos quemados sólo en ese año la supervivencia fue de 7.4%, de 9.4% para los mesocosmos quemados por dos años consecutivos y nula para los mesocosmos control.
En términos del incremento de altura de P. australis, al final de la temporada de crecimiento posterior a la primera quema, en 2013, el crecimiento en los mesocosmos sometidos al fuego fue de 55.9 ± 36.7 cm, valor promedio mayor a lo detectado en los mesocosmos control, que fue de 35.3 ± 6.2 cm. Estas diferencias fueron validadas mediante un modelo lineal generalizado para los mesocosmos en donde había plantas vivas (Z = 3.12; p = 0.002; n = 13). Para el segundo año de quemas, 2014, el crecimiento de los mesocosmos sometidos al fuego por un solo año dio como resultado alturas promedio de 86.76 cm, valor promedio mayor al de los mesocosmos quemados en dos años consecutivos, que fue de 60.6 ± 10.7 cm en promedio, y no hubo registros de altura para los mesocosmos control debido a que todos los individuos murieron. La diferencia en altura para las plantas de mesocosmos quemados un año y dos años no fue estadísticamente significativa (Z = -1.726; p = 0.085; n = 9) (Fig. 4). Al final de la primera temporada de crecimiento después de la primera quema en 2013, el peso seco presentó el mayor incremento en los mesocosmos sometidos a tratamiento por fuego (1.48 ± 2.03 g), seguido de los mesocosmos control (0.537 ± 0.11 g). Al final de la temporada de crecimiento, después del segundo año de quema, el promedio de la producción de biomasa para todos los tratamientos fue superior a la obtenida en la temporada de crecimiento anterior (1.79 ±.85 g); sin embargo, no se presentaron diferencias significativas entre los tratamientos de quema por una ocasión, dos ocasiones y el control sin quema (Z = 1.52; p = 0.128; n = 13).
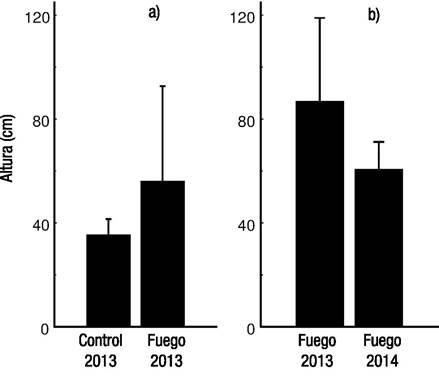
Figura 4a-b. Longitud máxima de la ramificación de Phragmites australis (Cav.) Trin ex Stuedel en un experimento de mesocosmos realizado en las instalaciones del Instituto de Investigaciones en Ecosistemas y Sustentabilidad (Morelia, Michoacán, México) en el que los tratamientos fueron: quema por un año en 2013 (a), o por dos años en 2013 y 2014 (b) durante dos estaciones de crecimiento. Las barras representan la desviación estándar.
Discusión
Phragmites australis es considerada como una especie con gran capacidad de invasión de hábitat, pues responde positivamente a incrementos en las concentraciones de nutrientes y de salinidad. Por lo anterior, Price et al. (2014) indican que el monitoreo de esta especie es fundamental para el buen manejo de humedales, ya que su capacidad de invasión depende sobre todo de la dispersión de fragmentos (Kettenring et al., 2016). A pesar de lo citado, los resultados de esta investigación indican que incluso después de incendios que eliminan el dosel de especies nativas, la supervivencia y crecimiento de los fragmentos de P. australis fue muy baja. Resultados similares fueron reportados por Montejo-Mayo et al. (2015).
Cabe mencionar que la mayor parte del crecimiento de S. americanus se presentó de mayo a julio, pues en este último mes alcanzó la máxima densidad de toda la temporada al cerrar el dosel y cubrir a P. australis. Este proceso de crecimiento de S. americanus fue aún más rápido durante el segundo año en que se aplicó el tratamiento de fuego a algunas de las unidades experimentales, lo cual ocasionó que los individuos de P. australis presentaran alturas menores que durante el primer año. Respecto a la biomasa, ésta fue similar para los individuos de Phragmites australis independientemente de si crecieron en mesocosmos quemados o no quemados, lo que sugiere que las diferencias de altura responden a que las plantas en los mesocosmos control se encontraban etioladas como respuesta al ambiente lumínico (Monsi & Saeki, 2005). En este experimento, las condiciones más estresantes para la especie invasora, P. australis, se dieron en los mesocosmos control, dado que nunca perdieron el dosel. En cambio, en los mesocosmos sometidos a fuego se generó un periodo en el que el dosel estuvo ausente, lo que permitió que al menos unos pocos individuos de Phragmites australis se establecieran y lograran desarrollar un tamaño considerable para crecer en mejores condiciones, antes de que se volviera a cerrar el dosel de S. americanus.
El presente estudio sugiere que se necesita de más de un evento de disturbio por fuego o una acción combinada con otros tipos de disturbios para alterar la dinámica entre Schoenoplectus americanus y Phragmites australis y permitir que la segunda se establezca y alcance un tamaño que le permita convertirse en dominante. Al parecer, las altas tasas de crecimiento de S. americanus y el dosel denso que desarrolla limitan la disponibilidad de luz para el establecimiento de fragmentos vegetativos de P. australis. Reducir la disponibilidad de luz mediada por las características del dosel de las especies nativas también reduce el establecimiento de otra especie invasora de humedales como Phalaris arundinacea L. (Lindig-Cisneros & Zedler, 2002a; Lindig-Cisneros & Zedler, 2002b).
Cuando se transporta suelo de humedales en donde crece P. australis, se puede favorecer la invasión, debido a que los fragmentos se establecen exitosamente en ausencia de competencia con otras especies (Juneau & Tarasoff, 2013). De hecho, aunque en algunos lugares las semillas producen un gran número de plántulas, su supervivencia es muy baja y la mayoría de las plantas que sobreviven después de dos años se generan a través de fragmentos (Albert et al., 2015), lo que indica la importancia de controlar su dispersión por este medio.
Phragmites australis, conocida como carrizo común, se considera una especie invasora traslocada y de extensa distribución en el país (Bonilla-Barbosa & Santa María, 2014). Lowe et al. (2004) la catalogan entre las 100 especies invasoras más dañinas del mundo. Es una fuerte competidora que elimina a otras especies del humedal, provee poco alimento o refugio para especies silvestres y es capaz de eliminar diversos hábitats en canales y charcas relevantes para invertebrados, peces y aves silvestres. Al descomponerse puede elevar rápidamente el nivel del suelo y reducir la inundación y los nutrientes disponibles, lo cual le da aun mayor superioridad competitiva (U.S. Fish & Wildlife Service, 2016). Por lo anterior, es de gran importancia para la conservación de los humedales del Altiplano mexicano conocer su capacidad de invasión, a partir de fragmentos, y su interacción con las especies nativas hidrófitas.
En términos de manejo, en humedales en donde Phragmites australis ya está presente pero que cuentan con una cobertura dominada por especies nativas, la cosecha de esta especie invasora es una estrategia efectiva (Escutia-Lara et al., 2012). De acuerdo con lo anterior y con los resultados obtenidos en este estudio, la cosecha de P. australis en sitios que no han sufrido efectos del fuego puede generar fragmentos que prácticamente no tienen posibilidades de establecerse, incluso si la cosecha se lleva a cabo después de eventos aislados o poco recurrentes de fuego, la posibilidad es muy baja.











 nueva página del texto (beta)
nueva página del texto (beta)


