Introducción
La acuicultura es parte esencial del quehacer económico y social, ya que ha favorecido la sobreexplotación de pesquerías y el aumento en el consumo de productos acuícolas, los cuales han permitido que está actividad se convierta en una alternativa para ampliar y contribuir a la oferta alimentaria, además de crear fuentes permanentes de empleo que estimulan el desarrollo regional y generación de divisas (FAO, 2012).
Entre las especies acuícolas de mayor consumo en México, de acuerdo con el Anuario Estadístico de Acuacultura y Pesca (SAGARPA, 2014), destaca la trucha arcoíris Oncorhynchus mykiss (Walbaum, 1792), que se ubica en el sexto lugar de la producción nacional, con 15 695 toneladas, y a nivel mundial en el treintavo lugar.
En los centros de cultivo de peces el alimento representa el mayor costo en la producción; puede llegar a ser de hasta un 30%, mientras que su calidad y cantidad afectan directamente la fisiología, que de manera sustancial se ve reflejada en la reproducción (Bobe & Labbé, 2010; Hajirezaee et al., 2010).
Para la mayoría de los peces el ciclo reproductivo es estacional y su duración es variable; ésta determina la calidad y cantidad de los gametos (Büyükhatipoglu & Holtz, 1984; Munkittrick & Moccia, 1987; Aral et al., 2005; Sahin et al., 2014; Bustamante-González et al., 2016a).
En la reproducción de peces uno de los factores que afecta el potencial de fertilidad es la calidad espermática (Bobe & Labbé, 2010; Hajirezaee et al., 2010), la cual se define como la habilidad del espermatozoide para fertilizar un óvulo. De acuerdo con Alavi & Cosson (2005), Aral et al. (2007), Cosson (2008), Alavi et al. (2008a, b) y Bustamante-González et al. (2016b), su evaluación se realiza a partir de parámetros cualitativos, como color y consistencia, y cuantitativos, como volumen, pH, concentración espermática y movilidad. Sin embargo, al igual que en otras especies, hay factores que contribuyen a las variaciones reproductivas entre los individuos: edad, tipo de alimentación, origen genético, fotoperiodo, temperatura, temporada reproductiva y estrés generado durante la manipulación, pues influyen directamente sobre la calidad del semen (Billard et al., 1995; Rurangwa et al., 2004; Bobe & Labbé, 2010; Hajirezaee et al., 2010).
Por lo anterior, el objetivo de la presente investigación fue evaluar el crecimiento de la trucha arcoíris y su calidad espermática durante la temporada reproductiva, información que permitirá establecer estrategias para optimizar su reproducción.
Materiales y métodos
La presente investigación se realizó en el centro acuícola El Zarco, en el municipio de Ocoyoacac, Estado de México, con una muestra de 32 machos sexualmente maduros de tres años de edad, monitoreados de julio a febrero (Bustamante-González et al., 2016a).
Los organismos se mantuvieron en estanque rústico de 13.5 m de largo y 6 m de ancho, con una profundidad de 75 cm, un flujo promedio de 121.27 L min-1, una temperatura promedio del agua de 11.31 ± 1.25 C y con un fotoperiodo natural. Fueron alimentados una vez al día con Winfish-Zeigler® para trucha, equivalente al 1.3% de la biomasa, ajustada mensualmente. Previo a la obtención de muestras, se mantuvieron en ayuno durante 24 horas, con el fin de prevenir la contaminación del semen con materia fecal. Para minimizar el estrés fueron sedados con esencia de clavo a una concentración de 0.05 mL L-1 de agua (Rodríguez-Gutiérrez et al., 2007).
Biometría. La longitud total, altura y grosor (cm) se determinaron mediante un ictiómetro de 90 cm ± 0.01 de precisión y escuadra de 90º; el peso (g), con una balanza Adam CBK 70a Max 32 kg d = 1.0 g, una vez al mes.
Crecimiento. La ganancia de peso (GP) se calculó de acuerdo con la fórmula propuesta por Moreno et al. (2000):
GP = W2− W1
Donde:
GP |
= ganancia de peso en gramos |
W2 |
= peso en gramos al finalizar el periodo |
W1 |
= peso en gramos al iniciar el periodo |
La tasa de crecimiento absoluto (TCA) se determinó de acuerdo con la fórmula propuesta por Wootton (1999):
TCA = VBF−VBI
Donde:
TCA |
= tasa de crecimiento absoluto |
VBF |
= variable biométrica final (longitud, altura, grosor, peso) |
VBI |
= variable biométrica inicial (longitud, altura, grosor, peso) |
La tasa instantánea de crecimiento (TIC) se estableció conforme a lo propuesto en Soriano y Hernández (2002):
TIC= Ln VBF −Ln VBIT (100)
Donde:
Ln |
= logaritmo natural |
VBF |
= variable biométrica final (longitud, altura, grosor, peso) |
VBI |
= variable biométrica inicial (longitud, altura, grosor, peso) |
T |
= tiempo (días) |
Recolecta y evaluación del semen. Las muestras se obtuvieron durante el periodo reproductivo, de agosto a febrero (Bustamante-González et al., 2016a). La extracción se obtuvo mediante ligera presión abdominal en dirección opérculo-caudal y se recolectó en tubos graduados con capacidad de 50 mL, para evitar la contaminación con orina, heces, sangre o agua (Rodríguez-Gutiérrez et al., 2007).
Se evaluó color, consistencia y concentración espermática del semen a partir de una solución madre compuesta de formol al 4% y NaCl al 0.9%, con el semen previamente homogeneizado, y el volumen se expresó en mL. El conteo se realizó en cámara de Neubauer con el programa Image-Pro 5.1®, bajo un microscopio Olimpus Optical BX41TF®, y se expresó como número de células mL-1 (Rodríguez-Gutiérrez et al., 2007; Bustamante-González et al., 2016b).
El pH del semen se determinó con potenciómetro Hanna HI 9125® y electrodo HI 1330®. La movilidad (n ≥ 5) se activó con agua y se registró con cronómetro la duración total, en segundos, bajo el microscopio óptico Olimpus Optical BX41TF® 40x (Bustamante-González et al., 2016b).
Análisis estadístico. Las variables de estudio fueron procesadas con análisis descriptivos, expresados con media ± desviación estándar (DE), y por medio del análisis de varianza de una vía (ANOVA). Al determinar diferencias se aplicó la prueba de Tukey, con un nivel de significancia de p <0.05 (Daniel, 2017).
Asimismo, por mes de muestreo se realizó un análisis de correlación múltiple entre las variables independientes: longitud (cm), peso (kg), altura (cm) y grosor (cm), con respecto a las variables dependientes: volumen de semen (mL) y concentración espermática, con un nivel de significancia de p <0.05.
Resultados
Crecimiento. En cuanto a longitud y peso, los mayores valores de TCA, GP y TIC se obtuvieron de julio a agosto, mes previo al periodo reproductivo. De agosto a febrero la TCA fue de 1.13 cm; GP de 0.01 g y TIC de 0.0321 ± 0.0522 cm y 0.0932 ± 0.2223 g, en promedio (Tabla 1). Al respecto, se establecieron diferencias en longitud y peso (p <0.05) entre julio y los meses que comprenden el periodo reproductivo. Las curvas del crecimiento se ajustaron al modelo logarítmico (longitud y altura), polinómico (peso) y potencial (grosor) (Fig. 1).
Tabla 1 Indicadores del crecimiento de Oncorhynchus mykiss (Walbaum, 1792), valores promedio ± DE, desde julio hasta febrero.
| Mes | Días | Variable | Valor inicial | Valor final | TCA | TIC |
|---|---|---|---|---|---|---|
| Jul. - Agosto | 31 | Longitud total (cm) | 54.68 ± 2.34 | 57.44 ± 2.56 | 2.76 | 0.1586 |
| Altura (cm) | 13.26 ± 0.55 | 14.17± 0.73 | 0.91 | 0.2143 | ||
| Grosor (cm) | 7.52 ± 0.36 | 08.22 ± 0.61 | 0.7 | 0.2862 | ||
| Peso (kg) | 2.37 ± 0.30 | 02.87 ± 0.38 | 0.5 | 0.625 | ||
| Agosto - Sept. | 38 | Longitud total (cm) | 57.44 ± 2.56 | 57.79 ± 2.81 | 0.35 | 0.016 |
| Altura (cm) | 14.17 ± 0.73 | 14.61 ± 0.92 | 0.44 | 0.08 | ||
| Grosor (cm) | 8.22 ± 0.61 | 07.77 ± 0.34 | -0.42 | -0.1376 | ||
| Peso (kg) | 2.87 ± 0.38 | 02.84 ± 0.39 | -0.04 | -0.0335 | ||
| Longitud total (cm) | 57.79 ± 2.81 | 57.87 ± 2.78 | 0.08 | 0.0037 | ||
| Altura (cm) | 14.61 ± 0.92 | 14.71 ± 1.09 | 0.1 | 0.019 | ||
| Grosor (cm) | 7.77 ± 0.34 | 08.16 ± 0.60 | 0.36 | 0.1258 | ||
| Peso (kg) | 2.84 ± 0.39 | 2.89 ± 0.47 | 0.05 | 0.0503 | ||
| Oct.- Nov | 30 | Longitud total (cm) | 57.87 ± 2.78 | 58.09 ± 2.71 | 0.22 | 0.0127 |
| Altura (cm) | 14.71 ± 1.09 | 15.03 ± 1.22 | 0.32 | 0.0719 | ||
| Grosor (cm) | 8.16 ± 0.60 | 08.48 ± 0.69 | 0.32 | 0.128 | ||
| Peso (kg) | 2.89 ± 0.47 | 02.95 ± 0.46 | 0.06 | 0.0718 | ||
| Nov. - Dic. | 35 | Longitud total (cm) | 58.09 ± 2.71 | 58.20 ± 2.96 | 0.11 | 0.0053 |
| Altura (cm) | 15.03 ± 1.22 | 15.09 ± 1.15 | 0.06 | 0.0116 | ||
| Grosor (cm) | 8.48 ± 0.69 | 08.34 ± 0.65 | -0.14 | -0.0492 | ||
| Peso (kg) | 2.95 ± 0.46 | 02.90 ± 0.47 | -0.05 | -0.0537 | ||
| Dic. - Enero | 28 | Longitud total (cm) | 58.20 ± 2.96 | 58.24 ± 2.86 | 0.04 | 0.0024 |
| Altura (cm) | 15.09 ± 1.15 | 15.19 ± 1.29 | 0.1 | 0.0241 | ||
| Grosor (cm) | 8.34 ± 0.65 | 08.17 ± 0.52 | -0.17 | -0.0718 | ||
| Peso (kg) | 2.90 ± 0.47 | 02.86 ± 0.45 | -0.04 | -0.05 | ||
| Enero - Feb. | 22 | Longitud total (cm) | 58.24 ± 2.86 | 58.57 ± 2.90 | 0.33 | 0.026 |
| Altura (cm) | 15.07 ± 1.23 | 15.35 ± 1.19 | 0.19 | 0.0554 | ||
| Grosor (cm) | 8.17 ± 0.52 | 08.85 ± 0.84 | 0.68 | 0.362 | ||
| Peso (kg) | 2.86 ± 0.45 | 02.88 ± 0.47 | 0.03 | 0.0424 |
TCA = Tasa de crecimiento absoluto. TIC = Tasa instantánea de crecimiento.
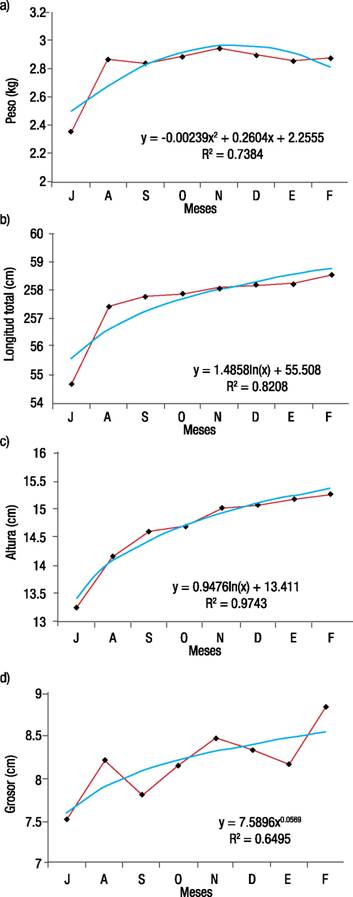
Figuras 1a-d Curvas de tendencia de crecimiento de julio a febrero de Oncorhynchus mykiss (Walbaum, 1792). a) peso (kg); b) longitud total (cm); c) altura (cm); d) grosor (cm).
Producción de semen. El patrón de producción de semen incrementó de agosto a octubre, y tras este periodo la producción decreció hasta febrero. Las diferencias establecidas entre septiembre, octubre y noviembre fueron de (p <0.05), lapso donde se presentó la mayor producción y porcentaje de madurez, que determina el pico reproductivo de la especie (Tabla 2).
Tabla 2 Valores promedio ± DE, porcentaje de madurez, volumen de semen, concentración, pH y movilidad espermática en Oncorhynchus mykiss (Walbaum, 1792), durante la temporada reproductiva.
| n | Temporada reproductiva | % madurez | Volumen de semen (mL) | Concentración espermática (x109 mL-1 ) | pH | Movilidad | |
|---|---|---|---|---|---|---|---|
| n | Duración (s) | ||||||
| 32 | Agosto | 66 | 11.58 ± 9.97SON | 6.02 ± 4.87SDEF | 8.11 ± 0.15 | 8 | 41.31 ± 2.80NDE |
| 31 | Septiembre | 100 | 22.38 ± 14.51ADEF | 8.17 ± 2.06AODEF | 8.19 ± 0.20 | 17 | 32.71 ± 8.45NDE |
| 31 | Octubre | 94 | 24.62 ± 11.04ADEF | 5.99 ± 1.75 SF | 8.00 ± 0.20 | 9 | 42.61 ± 6.02NDE |
| 26 | Noviembre | 96 | 19.86 ± 16.01AEF | 6.90 ± 2.34DEF | 8.58 ± 1.89 | 6 | 61.06 ± 12.27SODF |
| 25 | Diciembre | 88 | 12.25 ± 8.34SO | 4.10 ± 1.82ASNF | 7.87 ± 0.36 | 7 | 88.79 ± 10.64ASONEF |
| 20 | Enero | 85 | 9.21 ± 7.88SO | 3.77 ± 1.64ASNF | 8.01 ± 0.26 | 5 | 65.50 ± 3.83ASODF |
| 19 | Febrero | 32 | 4.88 ± 2.35SON | 2.25 ± 1.51ASONDE | 7.94 ± 0.48 | 5 | 38.67 ± 2.99NDE |
| Promedio | 17.26 ± 13.15 | 5.89 ± 3.19 | 8.07 ± 0.31 | 48.75 ± 21.39 | |||
Los superíndices indican la inicial de los meses durante los que se presentaron diferencias significativas (p <0.05).
Color y consistencia del semen. De acuerdo con el análisis de frecuencias, es más común encontrar semen de color blanco y consistencia lechosa (Tabla 3).
Tabla 3 Análisis de frecuencias de acuerdo al color y consistencia del semen en Oncorhynchus mykiss (Walbaum, 1792), durante la temporada reproductiva.
| Color | Consistencia | Frecuencia relativa (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| Agosto | Sept. | Oct. | Nov. | Dic. | Enero | Feb. | ||
| Transparente | Acuosa | 0.17 | ||||||
| Grisáceo | Acuosa | 0.12 | ||||||
| Grisáceo | Lechosa | 0.10 | ||||||
| Blanco | Acuosa | 0.10 | 0.28 | 0.24 | 0.68 | 0.41 | 0.33 | |
| Blanco | Lechosa | 0.82 | 0.70 | 0.72 | 0.68 | 0.32 | 0.41 | 0.50 |
| Blanco | Cremosa | 0.13 | 0.10 | 0.08 | 0.06 | |||
| Amarillento | Lechosa | 0.05 | ||||||
Concentración espermática. La mayor concentración se presentó en septiembre, con 8.17 ± 2.06 x 109 mL-1 y disminuyó durante la temporada reproductiva (Tabla 2) con diferencias significativas (p <0.05).
pH. Se estableció un rango de alcalinidad a partir del valor máximo de 8.58 ± 1.89 registrado en noviembre y un valor mínimo de 7.87 ± 0.36, registrado en diciembre. El valor promedio fue de 8.07 ± 0.31 (Tabla 2). No se detectaron diferencias significativas entre los meses (p >0.05).
Movilidad espermática. Se detectó un incremento de agosto a diciembre y un decremento de enero a febrero. En diciembre se obtuvo la mayor duración con 88.79 ± 10.64 s. Se registraron diferencias significativas (p <0.05) entre los meses (Tabla 2).
Asociación de variables. El análisis de correlación múltiple determinó que no hay asociación entre peso (kg), longitud total (cm), longitud patrón (cm), altura (cm) y grosor (cm) con respecto al volumen de semen (mL) y la concentración espermática entre los meses que comprenden el periodo reproductivo (Tabla 4).
Tabla 4 Análisis de correlación múltiple entre las variables peso, longitud total, longitud patrón, altura y grosor, con las variables volumen de semen y concentración espermática (mL-1) en Oncorhynchus mykiss (Walbaum, 1792), durante la temporada reproductiva.
| Variables | Agosto | Sept. | Oct. | Nov. | Dic. | Enero | Feb. |
|---|---|---|---|---|---|---|---|
| r | r | r | r | r | r | r | |
| Peso (kg)-Volumen de semen (mL) | 0.1079 | -0.0165 | -0.1345 | 0.1697 | 0.3184 | 0.3471 | 0.1441 |
| Peso (kg)-Concentración espermática (mL-1) | -0.0003 | -0.239 | -0.201 | -0.1958 | 0.1373 | 0.153 | 0.2948 |
| Longitud total (cm)-Volumen de semen (mL) | 0.1134 | 0.0897 | 0.0749 | 0.301 | 0.2088 | 0.3339 | 0.3444 |
| Longitud total (cm)-Concentración espermática (mL-1) | 0.1549 | -0.3003 | -0.2887 | -0.3181 | -0.1237 | -0.0706 | 0.0981 |
| Longitud patrón (cm)-Volumen de semen (mL) | 0.0371 | 0.0396 | 0.115 | 0.3009 | 0.2761 | 0.3318 | 0.3381 |
| Longitud patrón (cm)-Concentración espermática (mL-1) | 0.0846 | -0.2979 | -0.2757 | -0.3538 | -0.0854 | 0.0471 | 0.138 |
| Altura (cm)-Volumen de semen (mL) | 0.1883 | 0.1052 | -0.1435 | 0.1929 | 0.2947 | 0.5004* | -0.0043 |
| Altura (cm)-Concentración espermática (mL-1) | 0.0035 | -0.2049 | -0.1452 | -0.1399 | 0.0975 | 0.1038 | 0.4425 |
| Grosor (cm)-Volumen de semen (mL) | -0.1084 | 0.0092 | -0.1836 | 0.3136 | 0.1541 | 0.2407 | -0.0097 |
| Grosor (cm)-Concentración espermática (mL-1) | -0.1533 | -0.2033 | -0.1792 | -0.1343 | 0.0094 | 0.0022 | 0.2538 |
| Volumen de semen (mL)- Concentración espermática (mL-1) | 0.4535* | -0.2783 | 0.3035 | 0.041 | 0.5158* | 0.4186 | 0.5837* |
*Indica diferencias significativas (p <0.05).
Discusión
El crecimiento en los peces es continuo hasta alcanzar el peso o longitud final, pero su tasa varía durante el ciclo de vida, que se ve afectado por la cantidad y tipo de alimento, condiciones físico-químicas del agua, densidad y el estado fisiológico de los organismos (Von Bertalanffy, 1938; Royce 1972).
Los resultados con respecto al crecimiento, previos a la temporada reproductiva, demostraron un incremento significativo (p <0.05) y mayor TIC entre julio y agosto; sin embargo, durante el periodo reproductivo (de agosto a febrero) el crecimiento fue mínimo y no se detectaron diferencias (p >0.05), probablemente a que el suministro de alimento fue menor a la tasa recomendada por el proveedor, lo cual está sustentado en estudios previos como los de Hunter y Leong (1981) y Camacho et al. (2000).
No obstante lo anterior, la producción de semen no se vio afectada, ya que la energía proporcionada por el alimento fue destinada para asegurar la reproducción, tal como se reporta en Wootton (1999) y Hao y Chen (2009), quienes mencionan que la energía adquirida del alimento se reparte entre el crecimiento y supervivencia, y al entrar en etapa reproductiva gran parte de ésta energía se destina a los diversos procesos de maduración sexual.
Evaluar la calidad y cantidad del semen en los centros de cultivo a lo largo de la temporada reproductiva permite estimar el potencial reproductivo de la población y el número de machos necesarios para la reproducción (Sahin et al., 2014; Bustamante-González et al., 2016a). Se ha reportado que la madurez sexual en machos de trucha arcoíris inicia al año y medio de edad, de agosto a febrero, y que está directamente relacionada con los factores bióticos y abióticos (Sosa et al., 2000; Bustamante-González et al., 2016a). Los resultados de esta investigación, que corresponden a machos sexualmente maduros de tres años, determinaron que el volumen de semen, concentración espermática y movilidad varían significativamente durante la temporada reproductiva (p <0.05), comportamiento similar al reportado en salmónidos (Büyükhatipoglu & Holtz, 1984; Munkittrick & Moccia, 1987; Hajirezaee et al., 2010; Johnson et al., 2013).
En cuanto al volumen de semen, se alcanzó un comportamiento análogo al obtenido para esta especie por Büyükhatipoglu y Holtz (1984) en Alemania, en Canadá por Munkittrick y Moccica (1987) y en Turquía por Aral et al. (2005) y Sahin et al. (2014), quienes refieren que la producción de semen va en aumento en los primeros meses y alcanza su máximo entre el tercer y cuarto mes, comportamiento contrario al reportado en otros teleósteos de la familia Ciprinidae, como Barbus barbus (Linnaeus, 1758) (Alavi et al., 2008b) y como Pseudoplatystoma metaense (Bleeker, 1862) de la familia Pimelodidae (Ramírez-Merlano et al., 2011), especies cuya madurez inicia con el volumen máximo, a partir del cual comienza el decremento, que se extiende hasta el final de la temporada reproductiva.
El color y consistencia del semen se atribuyen a la concentración espermática y del líquido seminal, que sirve como medio de suspensión. Valdebenito et al. (1995), Cruz-Casallas (2001) y Torres et al. (2014) reportan que el semen en salmónidos es de color blanco, consistencia lechosa y, en algunos casos, viscoso, características que concuerdan con las obtenidas en la presente investigación, donde el color blanco de consistencia lechosa fue el más frecuente durante el periodo reproductivo, lo cual está relacionado también con el hecho de que los espermatozoides de los peces obtienen la capacitación y maduración durante la migración a lo largo del conducto eferente con la producción del fluido que determina su hidratación (Schulz & Miura, 2002).
La concentración espermática incrementó progresivamente y el máximo registro se presentó en septiembre. Varios estudios en salmónidos concuerdan con este resultado en Oncorhynchus mykiss (Walbaum, 1792) (Aral et al., 2005; Sahin et al., 2014; Bustamante-González et al., 2016a), Salmo trutta caspius (Kessler, 1877) (Hajirezaee et al., 2010) y Salvelinus namaycush (Walbaum, 1792) (Johnson et al., 2013), pero es contrario en ciprínidos como Schizothorax richardsonii (Gray, 1832) (Agarwal & Raghuvanshi, 2009), Barbus barbus (Linnaeus, 1758) (Alavi et al., 2008b) y Tinca tinca (Linnaeus, 1758) (Zuromska, 1981), así como espáridos: Sparus aurata (Linnaeus, 1758) y morónidos como: Dicentrarchus labrax (Linnaeus, 1758) (Kara & Labed, 1994), lo cual demuestra que la concentración espermática y el volumen de semen tienen una relación específica.
De acuerdo con Rurangwa et al. (2004), Bradshaw y Holpsafel (2007), Bobe y Labbé (2010), Hajirezaee et al. (2010), Aragón-Flores et al. (2014) y Bustamante-González et al. (2016a) las diferencias en el volumen de semen y concentración espermática pueden atribuirse a la especie, temporada reproductiva, alimentación, edad, origen genético, métodos de recolecta y estímulos ambientales como temperatura y fotoperiodo, donde estos últimos, que dependen de la latitud, altitud y estación del año, resultan relevantes para la reproducción. Lo anterior, explica las diferencias entre los resultados de la presente investigación y los reportes previos de Büyükhatipoglu y Holtz (1984), Munkittrick y Moccia (1987), Aral et al. (2005), Sahin et al. (2014) y Bustamante-González et al. (2016a).
La movilidad de los espermatozoides en peces de fertilización externa se adquiere al iniciar el contacto con un medio acuoso, en donde responden a condiciones fisicoquímicas, como cambios en la presión osmótica, temperatura y pH, las cuales se pierden pocos segundos después (Alavi & Cosson, 2005, 2006; Bustamante-González et al., 2016b).
El pH cumple un papel relevante en la activación de la movilidad espermática, Alavi y Cosson (2005) mencionan que el pH del plasma seminal se encuentra usualmente entre 7.5 y 8.5; de la misma forma, Billard (1986) y Gatti et al. (1990) reportan que el pH interno de los espermatozoides es de aproximadamente una unidad por debajo del externo. El pH externo influye en la concentración de protones intracelulares, los cuales afectan el potencial de membrana y la movilidad (Boitano & Omoto, 1992). Lahnsteiner et al. (1998) señalan que el pH para la movilidad óptima de los espermatozoides en trucha arcoíris es de 8.0 a 8.2; sin embargo, se ha reportado que la frecuencia del batido flagelar de los espermatozoides de trucha depende del pH de la solución activadora (Billard & Cosson, 1989).
Al respecto, hay registros de movilidad superior al minuto con un pH ≤ 8.0. En el presente estudio el pH promedio fue de 8.07 ± 0.31, con movilidad entre 24.22 y 127 s, similar a lo obtenido con trucha arcoíris por Secer et al. (2004), Rurangwa et al. (2004), Dietrich et al. (2005), Bozkurt (2006), Aral et al. (2007), Cosson (2008) y Nynca et al. (2012) al utilizar agua como solución activadora. Lo anterior demuestra que el volumen, concentración espermática, pH y movilidad son parámetros que definen la calidad de semen y pueden ser utilizados como indicadores de la capacidad fecundante (Rurangwa et al., 2004; Cosson, 2008; Bobe & Labbé, 2010; Hajirezaee et al., 2010), la cual varía de acuerdo con la especie, organismos y temporada reproductiva (Büyükhatipoglu & Holtz, 1984; Munkittrick & Moccica, 1987; Aral et al., 2005; Sahin et al., 2014; Alavi et al., 2008b; Agarwal & Raghuvanshi, 2009; Ramírez-Merlano et al., 2011; Johnson et al., 2013; Bustamante-González et al., 2016a).
El estudio demostró que al entrar en el periodo reproductivo la energía procedente del alimento se destina a asegurar la reproducción, por lo que el crecimiento se ralentiza; sin embargo, la calidad del semen no se ve afectada y varía durante la temporada reproductiva.











 nueva página del texto (beta)
nueva página del texto (beta)


