Introducción
En animales ovíparos el tamaño de la nidada es considerado una característica importante para el éxito reproductivo (Greer, 1975; Skutch, 1985). Por ejemplo, el proceso de la eclosión, momento crucial en la transición de la etapa de embrión a neonato, se ve favorecido cuando se realiza de manera grupal por los miembros de la nidada (Patiño-Martínez et al., 2010). Adicionalmente, la temperatura de incubación es una condición importante para el desarrollo embrionario y la eclosión (Lang, 1987; Webb & Cooper-Preston, 1989), ya que puede ocasionar variación en la duración del periodo de incubación (López-Luna et al., 2015) o en la del proceso de eclosión, tal como se ha observado principalmente en reptiles (Burger, 1991; Van Dame et al., 1992).
En el medio silvestre las hembras de cocodrilo cuidan el nido mientras la nidada se incuba, y en el momento de la eclosión auxilian a salir a las crías (Álvarez, 1974). La asistencia materna ocurre cuando los embriones emiten llamados preeclosionales desde el interior del huevo (Álvarez, 1974; Pooley, 1977; Vergne & Mathevon, 2008; Mazzotti, 1989). Las crías también realizan llamados en condiciones de incubación artificial, pero es factible que eclosionen sin asistencia al no encontrarse dentro de un sustrato compactado que les impida el abandono del nido, como ocurre en su hábitat natural (Mandujano et al., 2015).
Los sonidos emitidos por los cocodrilos en el interior del nido anuncian el comienzo del proceso de eclosión de la nidada (Britton, 2000; Garrick & Lang, 1977; Lang, 1992). Dado que la formación somática del embrión se completa a los setenta días de incubación, es posible que los llamados preeclosionales inicien a partir de estos días, pero la eclosión ocurre en los días subsiguientes (Ferguson, 1985). El proceso de la eclosión se divide en dos fases: preeclosional, con emisión de llamados desde el interior del huevo, y poseclosional o neonatal, cuando la cría emerge del huevo (Ardila-Robayo et al., 1999).
La duración del proceso de eclosión corresponde al tiempo transcurrido desde la emisión del primer llamado preeclosional hasta que emerge el último miembro de la nidada (Magnusson, 1980). Algunos autores han comentado que los embriones de cocodrilo del medio silvestre raramente emiten llamados preeclosionales de forma espontánea; por el contario, requieren de estímulos mecánicos, como el movimiento de la superficie del nido o cerca de éste, para comenzar con el proceso de eclosión (Allsteadt, 1994; Álvarez, 1974; Kushlan & Kushlan, 1980; Magnusson, 1980). Por su parte, en condiciones de incubación artificial se ha observado que el inicio de los llamados preeclosionales es espontáneo (Mandujano & Hénaut, 2014).
La eclosión en grupo de los cocodrilos es la primera interacción gregaria en su historia de vida; además, el tamaño de los grupos es variable e influye en la supervivencia (Lang, 1987; Maier, 2001). Sin embargo, la duración de las interacciones, así como su éxito o fracaso, dependen del comportamiento óptimo que desarrollen para lograr el mayor beneficio con el menor esfuerzo o riesgo (Alcock, 1993; Johnstone, 1997).
La estrategia conductual de los llamados preeclosionales en los cocodrilos parece sustentarse en la capacidad de los integrantes de la nidada para ponerse de acuerdo y lograr abandonar el nido en grupo a fin de reducir el riesgo de la depredación; además, atraen la atención de la madre para que ella abra el nido y así recibir su protección (Britton, 2000; Garrick & Lang, 1977; Herzog, 1975; Hunt, 1975; Johnstone, 1997; Lang, 1992; Vergne & Mathevon, 2008). Por lo anterior, es posible que el tamaño de la nidada sea un factor importante en la duración del proceso de eclosión.
En este trabajo se documenta por primera vez, en condiciones de laboratorio, el efecto del tamaño de la nidada sobre la duración y el éxito de eclosión en el cocodrilo de pantano, Crocodylus moreletii (Duméril & Bibron, 1851), una especie nativa de ambientes acuáticos de Belice, Guatemala y México (Álvarez, 1974; Cedeño-Vázquez et al., 2006). Lo anterior aporta información para comprender el papel que cumplen las estrategias de comunicación dentro del desarrollo del cuidado parental y de la organización social del proceso de eclosión como parte de la realización del comportamiento de los llamados preeclosionales.
Materiales y métodos
El trabajo se desarrolló en la Unidad de Manejo para la Conservación de la Vida Silvestre (UMA) Granja de Lagartos, en la ranchería de Buena Vista, Tabasco, México (18° 08´ 28.7” N y 92°44´59.54” O). Dentro de la granja, con una superficie de 7000 m², se cuenta con recintos para la conservación y manejo intensivo de C. moreletii. El periodo de experimentación abarcó de mayo a septiembre de 2010.
Se seleccionaron cuatro nidadas almacenadas en la incubadora artificial de la granja. El criterio único de selección fue que cada una contara con al menos 25 huevos fértiles de los 30 huevos que típicamente integran las nidadas de la granja (Casas et al., 2011; Greer, 1975; Mandujano et al., 2015). La fertilidad de los huevos fue confirmada por la observación del desarrollo y presencia de una banda opaca en el cascarón (Bolton, 1989; Ferguson, 1985). Los 25 huevos fértiles seleccionados por cada nidada se asignaron aleatoriamente a tres cajas de incubación (de 113 cm3 de material plástico) con diferentes cantidades de huevos o tamaño de nidada, definidos como: grande (15 huevos; 50% de una nidada típica de la granja), mediana (9 huevos; 30% de una nidada típica de la granja) y nidada pequeña (un huevo; representa la unidad funcional de la nidada), con base en los registros previos de éxito de eclosión para la especie in situ (López-Luna et al., 2011) y ex situ (Casas et al., 2011). De esta forma, cada nidada fue distribuida en tres cajas de incubación y se realizó una repetición del experimento, el cual también se clasificó en nidada grande, mediana y pequeña.
Los huevos se depositaron en tapetes individuales de hule espuma húmedos, pero no saturados, previamente lavados con agua corriente. La distancia entre cada huevo fue ≥ 2.5 cm. El registro de temperatura, humedad relativa y eclosiones dentro del laboratorio se realizó en dos horarios: de 5:00 a 12:00 h y de 17:00 a 24:00 h, recopilando datos cada hora. En las cajas de incubación se colocó un termómetro-higrómetro marca Steren, modelo Ter-150, con precisión de ± 1.5 °C para la temperatura y de ± 10% para la humedad relativa. Se registró la temperatura y humedad relativa en el momento en que se detectó un llamado preeclosional, así como al final de la última eclosión. Estos valores de temperatura y humedad relativa de las eclosiones fueron comparados en los diferentes tamaños de nidada a través de pruebas H de Kruskal-Wallis. Las actividades se realizaron en completo silencio para evitar estímulos mecánicos o auditivos hacia las nidadas.
Las cajas de incubación se colocaron en una sala acondicionada como laboratorio, en donde se sellaron las ventanas, y fueron aisladas del piso por una lona plástica y un tapete individual de cartón. La separación entre cajas fue de 70 cm, por disponibilidad logística. Durante todo el experimento, la temperatura de la sala de incubación fluctuó de 28 a 32 °C; este intervalo de temperatura ha sido reportado en los nidos naturales de cocodrilos (Deeming y Ferguson, 1989; Magnusson et al., 1992; Piña et al., 2003). La humedad ambiental relativa se proporcionó derramando agua directamente en el piso de la sala.
La duración del periodo de incubación se definió como el número de días trascurridos entre la fecha de puesta y la detección de los primeros llamados preeclosionales. Por su parte, la duración de la eclosión se definió como el tiempo transcurrido (en minutos) desde la detección del primer llamado preeclosional hasta que la última cría emergió completamente del cascarón. El éxito de eclosión se calculó como la razón entre el número de huevos incubados y el número de neonatos eclosionados multiplicado por cien. Se compararon los datos obtenidos entre los grupos (grande, mediano, pequeño) para la duración de eclosión, el éxito de eclosión y la duración del periodo de incubación mediante una prueba H de Kruskal-Wallis. Se usó también la prueba post-hoc de Newman-Keules para identificar las diferencias entre grupos. Los datos fueron analizados con la ayuda del programa estadístico de cómputo STATISTICA.
Para conocer la duración de las eclosiones y su cronología, en cada nidada se registró la hora de inicio de la actividad de eclosión con los llamados preeclosionales y la hora de salida del cascarón del último embrión, así como el final de la actividad de eclosión. Los intervalos de tiempo fueron obtenidos por diferencia.
Resultados
La duración en minutos de las eclosiones fue estadísticamente significativa entre los diferentes tamaños de nidada (Kruskal-Wallis: F(2,14)=9.1, p =0.01). Las nidadas de tamaño mediano (x̄ = 1844 ± 476) y pequeño (x̄ = 3340 ± 2794) tardaron el mismo tiempo en eclosionar, estadísticamente, pero ambas tardaron menos en eclosionar que las nidadas grandes (x̄ = 9431 ±768) (Fig. 1).
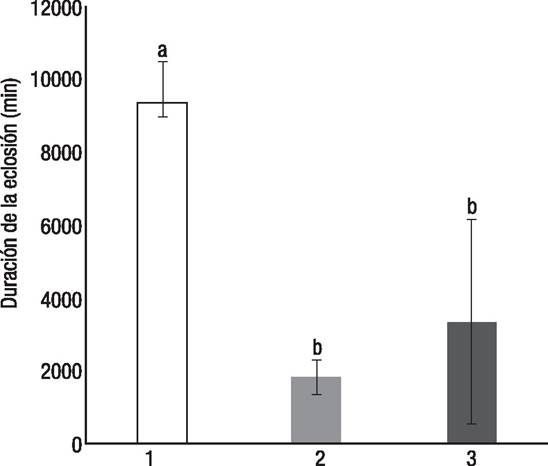
Figura 1 Duración en minutos (promedio ± error estándar) de las eclosiones de Crocodylus moreletii (Duméril & Bibron, 1851) de los tres tamaños de nidada (1 = nidada grande, 2 = nidada mediana, 3 = nidada pequeña). La letras (a, b) representan el resultado de la prueba post hoc Newman-Keuls.
Estadísticamente no hubo diferencias en el éxito de eclosión entre los tamaños de nidada (Kruskal-Wallis: F(2,14) = 0.3, p =0.8) (Fig. 2). Respecto al éxito de eclosión, las nidadas de tamaño grande tuvieron un promedio de 81.3 ±7.7% de éxito de eclosión; mientras que en las nidadas de tamaño mediano el promedio fue de 86 ±2.7%, y en las nidadas chicas, de 60 ±24%. La duración del periodo de incubación fue igual estadísticamente entre los tamaños de nidadas (Kruskal-Wallis: F(2,11) = 0.02, p =0.9), con un promedio de 83.2 ±0.8 días de incubación para la nidada grande, 83.2 ±0.7 días para la nidada mediana y de 85.8 ±3.6 días para la nidada pequeña.
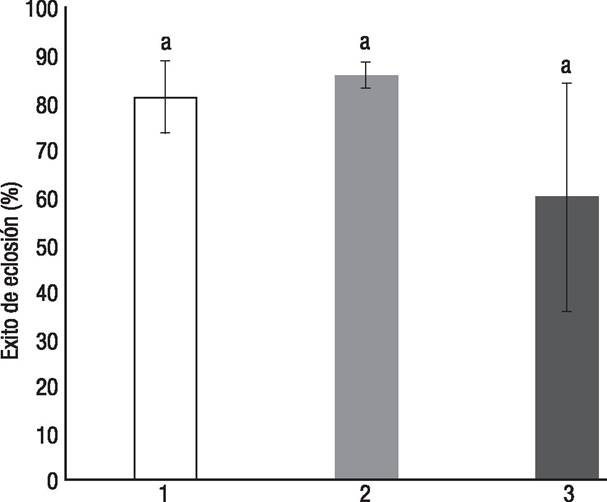
Figura 2 Éxito de eclosión (promedio ± error estándar) entre los tres tamaños de nidada de Crocodylus moreletii (Duméril & Bibron, 1851) (1 = nidada grande, 2 = nidada mediana, 3 = nidada pequeña). La letra “a” indica la diferencia no significativa entre los tratamientos de acuerdo con la prueba post hoc Newman-Keuls.
El proceso de eclosión de las nidadas inició con la emisión de los primeros llamados preeclosionales, los cuales se percibieron a simple oído 10080 min (7 días) antes de que los integrantes de la nidada eclosionaran en su totalidad. Solamente se identificaron dos individuos de la nidada chica que no emitieron llamados preeclosionales sino hasta el momento de ser extraídos manualmente del cascarón, y permanecieron dentro de éste hasta los 144000 min de incubación.
En una misma nidada se produjeron múltiples eventos de eclosión a intervalos de tiempo irregulares, ya sea de forma individual o por grupos de crías (Fig. 3). Los intervalos entre eclosiones más cortos fueron de 45 min, mientras que los más prolongados duraron 7090 min. Se presentaron hasta ocho eventos de eclosión en nidadas grandes, mientras que en nidadas medianas se presentaron cuatro eventos de eclosión.
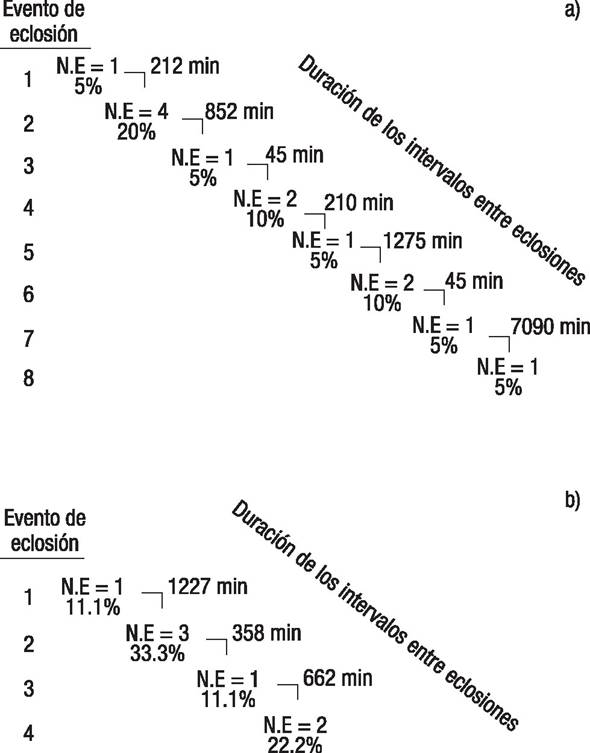
Figuras 3a-b Cronología de los eventos de eclosión de Crocodylus moreletii (Duméril & Bibron, 1851). a) Nidada grande (15 huevos); b) Nidada mediana (9 huevos). N. E.= número de eclosiones.
Dado que los embriones emiten los sonidos desde el interior del huevo, resulta difícil identificar cuántos individuos los producen. Eventualmente, algún individuo rompe el cascarón con ayuda de la carúncula ubicada en la punta del hocico, expone las narinas y respira aire del exterior. Estos individuos pueden permanecer emitiendo sonidos con las narinas fuera del cascarón, al igual que el resto de sus congéneres que no lo han roto. Otros pueden permanecer bajo la misma condición, pero sin emitir sonidos. Los individuos que ya eclosionaron continúan emitiendo sonidos y algunos de ellos se perchan sobre los cascarones que no han producido eclosiones.
El trabajo se desarrolló en condiciones de temperatura y humedad relativa de incubación estables dentro de cada repetición y no hubo diferencias estadísticas entre repeticiones. La temperatura promedio registrada al inicio de las eclosiones en los diferentes tamaños de nidadas fue (promedio ±error estándar): grandes, 32.5 ±0.2; medianas, 32.4 ±0.4, y pequeñas, 33.08 ±0.08 [Kruskal-Wallis: F(2, 14) =1.2, p =0.06]. Al final de las eclosiones, la temperatura promedio por tamaño de nidada fue (promedio ±error estándar): grandes, 32.5 ±0.2; medianos, 32.6 ±0.26, y pequeños, 32.7 ±0.26 [Kruskal-Wallis: F(2, 14) =1.3, p =0.5]. En el caso de la humedad relativa, al inicio de las eclosiones el promedio por tamaño de nidada fue de (promedio ±error estándar): grandes, 93.0 ±1.1; medianos, 93.5 ±0.5, y pequeños, 92.4 ±0.7 [Kruskal-Wallis: F(2, 14) =1.09, p =0.6]. Al final de las eclosiones la humedad relativa por tamaño de nidada fue (promedio ±error estándar): grandes, 93.2 ±1.1; medianas 93.5 ±0.5, y pequeñas, 92.8 ±0.8 [Kruskal-Wallis: F(2, 14) =0.13, p =0.9].
En las nidadas grandes se perdieron 14 huevos en total, lo que representó un promedio de 3.5 huevos por nidada. En las nidadas medianas se perdieron 5 huevos, que representaron en promedio 1.25 huevos por nidada. En las nidadas pequeñas no hubo pérdidas de huevos: todos los embriones sobrevivieron, pero sólo dos eclosionaron de forma natural; los otros dos alcanzaron los 100 días de incubación, uno permaneció con las narinas expuestas y otro fue extraído manualmente. Entonces, esto representó un promedio de 0.5 eclosiones por nidada.
Discusión
Las nidadas de tamaño pequeño y mediano tardaron el mismo tiempo en eclosionar mientras que el tamaño de nidada grande demoró más para completar la eclosión. Esto sugiere que entre más individuos se involucren emitiendo sonidos en el proceso de eclosión, les toma más tiempo acordar la decisión de eclosionar (Conradt & Roper, 2005), pero a la vez, que los individuos solitarios requieren del estímulo de sus congéneres (Álvarez, 1974). De hecho, en las nidadas pequeñas el tiempo de eclosión fue prolongado. Una explicación es que quizás el individuo espera a que otros congéneres vocalicen para tomar la decisión de abandonar el cascarón. Esto apunta a que el tamaño de grupo es importante en la eclosión para tomar decisiones, como acto de socialización (Sumpter & Pratt, 2009). Entonces, tomar la decisión en grupos relativamente grandes o de manera individual tiene consecuencias en el tiempo empleado. Para este experimento, el tamaño óptimo de grupo fue la nidada mediana, el cual equivale a una tercera parte del tamaño promedio reportado de 30 huevos en una nidada (Casas et al., 2011; Deeming & Ferguson, 1989; Magnusson et al., 1992; Mandujano et al., 2015; Piña et al., 2003).
Con base en la ausencia de estímulos mecánicos o auditivos mantenida en las cajas de incubación, es posible que el confort ambiental proporcionado por la temperatura y humedad haya sido el mecanismo que desencadenó la actividad de eclosión al dispararse la emisión de los llamados preeclosionales. Muchas conductas en los cocodrilos se disparan con base en la estabilidad de su tasa metabólica, la cual está asociada a la temperatura ambiente (Ferguson, 1985; Grigg & Gans 1993; Johnstone, 1998; Lance, 2003; Piña et al., 2003). Los llamados preeclosionales son empleados por los embriones como señales acústicas para atraer la atención de otros congéneres y eclosionar en grupo; de esta forma sincronizan la eclosión de la nidada o atraen la atención de la hembra para que destape el nido (Britton, 2000). Las características acústicas espectro-temporales de los sonidos emitidos por neonatos entre uno y cuatro días de edad son similares, lo que probablemente dificulte el reconocimiento individual entre ellos (Vergne et al., 2007). Entonces, es posible que los individuos no distingan entre los congéneres que están emitiendo sonidos y que esto influya en la duración de la eclosión.
El tamaño de nidada parece no tener influencia sobre el éxito de eclosión. Este resultado es consistente con otros estudios; por ejemplo, para la especie, López-Luna et al. (2011) reportaron 33.9% de éxito de eclosión, mientras que Casas et al. (2011) y Mandujano-Camacho et al. (2015) estimaron 40.74 y 33% respectivamente, en la misma área de estudio. Larriera (1991) reportó éxitos de eclosión de 43% en nidadas de diferente tamaño de C. latirostris (Daudin, 1802), mientras que Piña et al. (2003) refieren que los porcentajes de eclosión entre diferentes años son similares sin importar el tamaño de la nidada. El porcentaje de eclosión de una nidada, además de estar sujeto a aspectos intrínsecos del individuo en formación, como madurez, genética y salud, también está ligado a factores extrínsecos de la especie, por ejemplo, el sustrato de anidación y variaciones climáticas por fenómenos meteorológicos (Cresswell, 1997; Charruau et al., 2010; Kratochvíl & Kubička 2007; Van Dame et al., 1992; Larriera, 1994). Eclosionar representa un riesgo de depredación por salir del nido (Larriera & Piña, 1999-2000). De tal forma, si un individuo eclosiona solitario, el porcentaje de riesgo de depredación es de 100%, mientras que si eclosionan dos individuos, el riesgo disminuye a 50% cada uno, y entre más individuos eclosionen, más se diluye la posibilidad de depredación (Foster & Treherne, 1981). Entonces, en el caso de las nidadas pequeñas, esperar a que más congéneres emitan sonidos parece la estrategia más rentable (Couzin et al., 2005). El aislamiento físico de las nidadas pequeñas y no escuchar sonidos de congéneres en eclosión son factores que posiblemente hayan provocado que la duración de la eclosión se prolongara hasta los 100 días de incubación (144000 minutos). Se puede presumir, entonces, que en el caso de grupos numerosos, como las nidadas grandes, ponerse de acuerdo en el momento adecuado de eclosión a través de los llamados preeclosionales sea biológicamente complejo, y que esto prolongue el tiempo de eclosión, produciendo eclosiones en grupos relativamente pequeños dentro de la misma nidada.
El tamaño de nidada no influyó sobre la duración del periodo de incubación, puesto que los tres tamaños eclosionaron en un periodo de incubación similar. El inicio del proceso de eclosión ocurrió espontáneamente cuando alguno de los embriones de las nidadas comenzó a emitir llamados preeclosionales, sin necesidad de recibir algún estímulo externo a la caja de incubación o al cascarón (Kushlan & Kushlan, 1980; Magnusson, 1980; Allsteadt, 1994).
Los múltiples eventos de eclosión que se presentaron en los tamaños de nidada grande y mediana ocurrieron cuando se emitieron los llamados preeclosionales de manera conjunta por un grupo de embriones (Herzog, 1975; Vergne & Mathevon, 2008), y se manifestaron eclosiones tanto de forma individual como por grupos hasta de cuatro crías (Lee, 1968; Mandujano & Hénaut, 2014). Con base en que la temperatura de incubación y la humedad relativa de incubación fueron estables dentro de cada repetición del experimento, y en que hubo igualdad entre las repeticiones, las cajas de incubación proveyeron un ambiente idóneo tanto para el desarrollo embrionario como para disparar el proceso de eclosión. La humedad relativa permaneció por encima de 92.4 ±0.7, lo cual favoreció las condiciones de incubación, ya que son las condiciones de humedad relativa por debajo de 70% las que impactan negativamente en el desarrollo embrionario de la nidada (Lutz et al. 1980; Hernández-Hurtado et al., 2013).











 nueva página del texto (beta)
nueva página del texto (beta)


