Introducción
Las especies que conforman la familia Bothidae (Pleuronectiformes) se caracterizan por su naturaleza béntica. Generalmente habitan zonas someras y fondos suaves sobre las plataformas continental e insular hasta los 200 m de profundidad, aunque algunas especies han sido reportadas a más de 500 m (McEachran & Fechhelm, 2005; Nelson, 2006). Forman parte de la pesquería multiespecífica costera (Latour et al., 2008) como fauna de acompañamiento del camarón (López-Martínez et al., 2010) y utilizan los ambientes lagunares costeros de manera periódica u ocasional en alguna etapa de su ciclo de vida (Castro-Aguirre et al., 1999; Palacios-Sánchez et al., 2015). De hecho, la mayor diversidad de especies de lenguados se registra en las áreas costeras someras de la plataforma continental (Gibson, 2005).
El estudio de las dietas de los peces es un aspecto básico para la generación de conocimiento sobre el funcionamiento de los ecosistemas en que habitan, el desempeño que cumplen en los mismos y la posición que éstos ocupan en la trama trófica, proporcionando una idea aproximada de su entorno (Prejs & Colomine, 1981; King, 2005; Glass & Watts, 2009; Llamazares-Vegh, 2014). Debido a la morfología de la familia en general, las especies de lenguados están estrechamente vinculadas al componente bentónico para su alimentación (Gibson & Robb, 1992), en función de sus requerimientos nutricionales (Wootton, 1990) y con variaciones a través del crecimiento, cambio de hábitat o de preferencias en presas por sus características morfológicas (Reid et al., 2007, Sweeting et al., 2012). Algunas de las especies son generalistas u oportunistas al alimentarse de las fuentes presa disponibles y con mayor abundancia (Carlson et al., 1997; Esposito et al., 2010), o bien, durante una etapa de su ciclo de vida (Carpentieri et al., 2010).
Entre las especies de peces planos que se reportan con mayor frecuencia y abundancia en el sur del golfo de México (SGM), se encuentra la conocida como lenguado de punto, Trichopsetta ventralis (Goode & Bean, 1885) (Amezcua-Linares & Yáñez-Arancibia, 1985;Yáñez-Arancibia et al., 1985a; Yáñez-Arancibia et al., 1985b,Yáñez-Arancibia & Sánchez-Gil, 1986). El enfoque principal de estos reportes está relacionado con su presencia en la fauna de acompañamiento en la pesquería de camarón; mientras que en etapa larval se reporta como bioindicador de los sistemas de circulación en aguas superficiales del SGM (Futch, 1977), con una distribución oceánica (Flores-Coto et al., 1991).
La región del SGM es una cuenca de hidrocarburos prolífica, en la que la actividad petrolera surge como una alternativa económica en el país. Se sabe que las áreas de las plataformas funcionan como arrecifes artificiales, pues son utilizadas como centros de biodiversidad y conservación de especies amenazadas y sobreexplotadas en ambientes naturales; además, se ha argumentado que las plataformas incrementan las tasas de crecimiento y supervivencia de los peces, mediante el aumento de la disponibilidad de presas y refugio de los predadores (Cowan & Rose, 2016). Asimismo, funcionan como centros de dispersión y apoyan la producción bentónica incluso a grandes profundidades (Hooker & Pestana, 2012). Esta producción, aunada a la provisión de recursos, permite que se registren altas abundancias de peces cerca de las plataformas que de otra manera se encontrarían dispersos en zonas más amplias (Stanley & Wilson, 1996; Jørgensen et al., 2002; Joye et al., 2016).
No obstante, a pesar de la abundancia e importancia ecológica de T. ventralis en la región del SGM se desconocen aspectos de su biología (alimentación) y ecología. Debido a lo anterior, el presente estudio tiene como objetivos principales determinar las preferencias alimentarias de la especie, evaluar si existe variación ontogénica de estas preferencias, así como establecer su amplitud trófica. Este tipo de investigación contribuye a comprender los mecanismos implicados en la repartición de los recursos y el uso de hábitat para esta especie en zonas costeras y marinas.
Materiales y métodos
Los muestreos se realizaron en el SGM al final de la temporada de secas (junio, 2011) en 20 localidades situadas tanto en la zona de plataformas petroleras como fuera de ellas, a bordo del buque oceanográfico Justo Sierra, a profundidades de entre 41 y 355 m (Figura 1). Para la colecta de los ejemplares se utilizó una red de arrastre camaronera (18.3 m, 4.6 cm abertura de malla), cada lance con una duración y velocidad promedio de 30 minutos y 2.7 nudos. A bordo de la embarcación, se registraron las mediciones in situ con los datos de campo necesarios (fecha, hora de colecta, geoposición, profundidad). De cada muestra obtenida, los peces colectados fueron separados de los demás componentes y se conservaron en formaldehido (10%) para realizar posteriormente en el laboratorio una identificación más precisa con claves específicas (Fischer, 1978; Hoese & Moore, 1998).
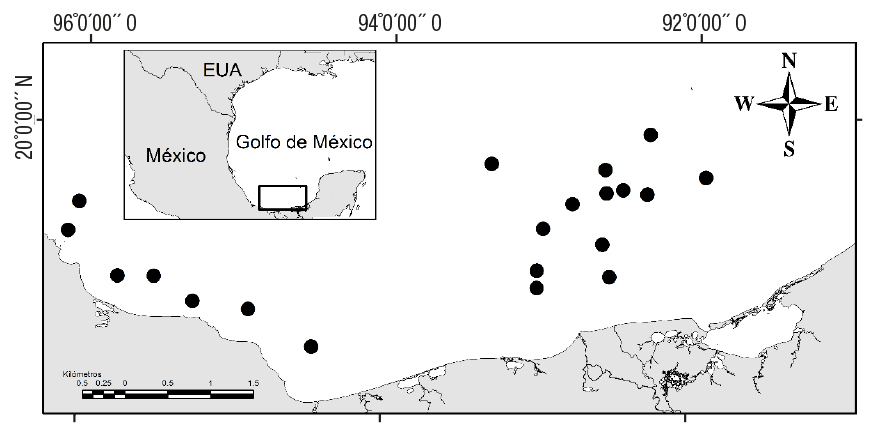
Figura 1 Ubicación de los sitios de muestreo de los peces de la familia Bothidae en el sur del Golfo de México.
Análisis del contenido estomacal. En el laboratorio, a cada ejemplar se le determinó la longitud estándar (LE) y peso total (g). Después se extrajo el sistema digestivo, el cual fue debidamente etiquetado y preservado en alcohol (80%). Los estómagos se revisaron con un microscopio estereoscópico y óptico y su contenido logró identificarse hasta el taxón de menor rango posible; para ello, se usaron claves específicas (Morris, 1973; Gurney, 1975; Fischer, 1978; Rodríguez, 1980; Williams, 1984; Hoese & Moore, 1998; Young et al., 2002).
Respecto al análisis de clasificación y abundancia de las presas, los contenidos alimenticios se examinaron con base en el índice de importancia relativa, desarrollado por Piankas (1966) y modificado por Yáñez-Arancibia (1975), Hyslop (1980) y Cortés (1997):
En esta fórmula se incorporaron los resultados de los métodos de área (%A), gravimétrico (%P) (que se refiere al peso relativo total de la presa con respecto al peso total del contenido estomacal) y la frecuencia de ocurrencia (FO= [(n/NE)*(100)], que consiste en contabilizar las veces que aparece una presa determinada en el contenido estomacal) (Hyslop, 1980; Silva et al., 2014), donde n es el número de veces en la que se presenta la presa y NE, el número total de estómagos analizados. El método de %A se refiere al porcentaje estimado del área total ocupado por el contenido alimenticio, calculado con ayuda de una gradilla milimétrica (Canto-Maza y Vega-Cendejas 2007). Esta medición es de gran utilidad sobre todo cuando la dieta está constituida por presas pequeñas (ostrácodos, foraminíferos) y fragmentos que impiden su cuantificación numérica (Vega-Cendejas, 1990; Ramírez Herrejón et al., 2013).
Las presas identificadas fueron clasificadas como: a) preferenciales, aquellas que son consumidas con una FO > 50%; b) secundarias, al presentar un 10% > FO < 50%; c) accidentales, presas cuyo consumo es escaso y ocasional con FO < 10% (Yáñez-Arancibia, 1975).
Para analizar la variación ontogénica en la dieta, los ejemplares se agruparon por clases de tallas, cuyo número e intervalo fueron calcula dos mediante la regla de Sturges (Scherrer, 1984): K= 1 + 3.32 (Log10 n); donde K= número de intervalos de clase, n= número total de muestras. La amplitud de los intervalos de talla se calculó con la siguiente fórmula: W = R/K, donde W es la amplitud de intervalo y R la talla máxima menos la mínima (Daniel, 1997). En seguida se determinaron los valores de la IIR de los diferentes componentes alimenticios entre rangos de talla, con el objetivo de precisar las presas representativas.
Para evaluar la significación estadística de las preferencias tróficas entre rangos de talla, se realizó un análisis de similaridad (ANOSIM) y un análisis SIMPER con el fin de especificar el porcentaje de similaridades por tipo de presa para cada clase de talla, por lo que se recurrió al programa estadístico Primer-E ver. 7 (Clarke y Gorley, 2015). Las diferencias de la dieta entre tallas se representaron gráficamente en diagramas de ordenación bidimensionales mediante escalamiento métrico multidimensional (MDS), utilizando como medida de similitud el índice de Bray Curtis, calculado con los datos del área relativa de los componentes alimenticios transformados a raíz cuadrada a fin de reducir la ponderación de los componentes dominantes (Clarke, 1993).
La amplitud trófica (de nicho) se determinó a partir del índice estandarizado de Levin (BA) (Krebs, 1999): B = 1(∑ p2)-1 y (BA) = B - 1 (n - 1)-1, donde B es el índice de amplitud nicho, p la proporción de cada grupo de presa en la dieta y n el número de grupos alimentarios posibles. El valor del rango calculado varía de 0 a 1, donde valores bajos indican que la alimentación se encuentra dominada por pocos grupos tróficos (especialista), mientras que valores altos sugieren una alimentación generalista u omnívora.
Resultados
Como resultado de la campaña oceanográfica se registraron 198 especies de peces, en donde Trichopsetta ventralis estuvo representada dentro de las dominantes (4.8% densidad total). Se revisó un total de 167 ejemplares con tallas comprendidas de entre 5.5 y 14.8 cm de LE, de los cuales se descartaron los estómagos vacíos (10.0%), o sea, se tomaron en cuenta únicamente los que presentaron algún tipo de alimento. También se excluyeron los contenidos estomacales cuyo alimento se encontraba en estado avanzado de digestión (15%), por la dificultad para determinar de los componentes alimenticios (10%).
Se identificaron en total 46 artículos alimenticios y se agruparon en seis categorías (Tabla 1). El componente alimenticio de los microcrustáceos incluyó a los Amphipoda, Euphausiacea y Miscidacea. El grupo otros, estuvo conformado por materia vegetal, moluscos, poliquetos, foraminíferos y estomatópodos. Hubo una alta preferencia alimentaria por el grupo peces (67.3% FO). Como componentes alimenticios secundarios, se registraron peces no identificados (39.5%), Brachyura (46.0%), Saurida sp. (21.1%), Crustacea no ident. (25.0%) y Euphausiacea (11.2%), mientras que los tipos de alimentos restantes fueron clasificados como accidental (Tabla 1).
Tabla 1 Contribución porcentual por área (A), peso (P), frecuencia de ocurrencia (FO) e índice de importancia relativa (IIR) de cada componente alimenticio de la dieta de Trichopsetta ventralis (Goode & Bean, 1885) en el sur del golfo de México (n=150).
| Componente | A | P | FO | IIR |
|---|---|---|---|---|
| Microcrustáceos | ||||
| Mysidacea | 0.54 | 0.14 | 1.32 | 0.02 |
| Eucarida | 0.18 | 0.09 | 0.66 | 0.00 |
| Crustacea no identificado | 11.86 | 4.43 | 25.00 | 9.49 |
| Gammaridae | 0.06 | 0.02 | 1.32 | 0.00 |
| Cerapus sp. | 0.06 | 0.02 | 0.66 | 0.00 |
| Euphausiacea | 5.12 | 2.52 | 11.18 | 1.99 |
| Subtotal | 17.82 | 7.22 | 41.33 | 9.47 |
| Decapoda | ||||
| Farfantepeneus sp. | 0.42 | 0.35 | 1.97 | 0.04 |
| Sicyonia sp. | 0.44 | 0.76 | 0.66 | 0.02 |
| Sergestidae | 0.08 | 0.03 | 0.66 | 0.00 |
| Alpheus sp. | 0.70 | 0.38 | 0.66 | 0.02 |
| Decapoda no identificado | 3.12 | 1.69 | 8.55 | 0.96 |
| Subtotal | 4.85 | 3.21 | 14.00 | 1.03 |
| Brachyura | ||||
| Raninoides sp. | 0.33 | 0.30 | 1.97 | 0.03 |
| Calappa sp. | 0.71 | 0.37 | 2.63 | 0.07 |
| Persephona sp. | 1.03 | 0.61 | 1.32 | 0.05 |
| Inachidae | 0.01 | 0.01 | 0.66 | 0.00 |
| Libinia sp. | 0.11 | 0.11 | 1.32 | 0.01 |
| Palicus sp. | 0.55 | 0.54 | 0.66 | 0.02 |
| Parthenope sp. | 0.41 | 0.14 | 0.66 | 0.01 |
| Portunidae | 2.51 | 1.36 | 6.58 | 0.59 |
| Callinectes sp. | 0.14 | 0.06 | 0.66 | 0.00 |
| Portunus sp | 3.00 | 1.85 | 3.29 | 0.37 |
| Speocarcinus sp. | 0.45 | 0.37 | 1.97 | 0.04 |
| Frevillea sp. | 0.27 | 0.06 | 1.32 | 0.01 |
| Larva | 0.09 | 0.00 | 1.32 | 0.00 |
| Leiolambrus sp. | 0.43 | 0.22 | 2.63 | 0.04 |
| Brachyura no identificado | 5.75 | 3.28 | 20.39 | 4.29 |
| Subtotal | 15.70 | 9.28 | 46.00 | 10.44 |
| Peces | ||||
| Bembrops sp. | 0.22 | 0.35 | 0.66 | 0.01 |
| Gobiidae | 0.41 | 1.25 | 0.66 | 0.03 |
| Bollmannia sp. | 0.26 | 0.39 | 0.66 | 0.01 |
| Paralichthyidae | 0.1 | 0.17 | 0.66 | 0.00 |
| Sciaenidae | 1.53 | 1.72 | 0.66 | 0.05 |
| Saurida sp. | 18.9 | 35.86 | 21.05 | 26.87 |
| Synodus sp. | 1.99 | 2.44 | 2.63 | 0.27 |
| Peces no identificados | 25.18 | 30.43 | 39.47 | 51.16 |
| Subtotal | 48.59 | 72.61 | 67.33 | 76.41 |
| Bivalvia | 0.12 | 0.02 | 1.32 | 0.00 |
| Gastropoda | 0.01 | 0.01 | 1.32 | 0.00 |
| Polychaeta | 0.35 | 0.09 | 3.95 | 0.04 |
| Foraminifera | ||||
| Globigerinidae | 0.11 | 0.03 | 2.63 | 0.01 |
| Alveolina sp. | 0.03 | 0.01 | 0.66 | 0.00 |
| Anomalina sp. | 0.06 | 0.01 | 2.63 | 0.00 |
| Rotaliidae | 0.24 | 0.05 | 6.58 | 0.04 |
| Nonionidae | 0.25 | 0.09 | 1.32 | 0.01 |
| Stomatopoda | ||||
| Squilla sp. | 0.70 | 0.53 | 0.66 | 0.02 |
| Squilla mantis | 0.92 | 2.21 | 0.66 | 0.05 |
| Subtotal | 2.98 | 3.17 | 23.33 | 1.31 |
| Otros | ||||
| Detritus | 10.06 | 4.51 | 10.007 | 1.33 |
| Materia vegetal | 0.19 | 0.12 | 1.32 | 0.01 |
De acuerdo con el área y peso, el grupo trófico que presentó los mayores valores fue el de los peces (48.6% y 72.6%, respectivamente). El artículo más representativo respecto al área fue el de peces no identificados (25.2%). Con respecto al peso, el género Saurida sp. presentó el mayor valor (35.9%), siguiéndole en importancia el componente peces no identificados (30.4%). Los ítems restantes presentaron valores en el porcentaje de peso y área menores al 5% y 12% respectivamente (Tabla 1).
El grupo que obtuvo el mayor porcentaje en el IIR fueron los peces con el 76.4% (Fig. 2); por otro lado, dentro del grupo de peces, se lo graron identificar presas de las familias Percophidae (Bembrops sp.), Gobiidae (Bollmannia sp.), Paralichthyidae, Sciaenidae y Synodontidae (Saurida sp., Synodus sp.), siendo ésta última la más representativa por su frecuencia y abundancia.

Figura 2 Valor del índice de importancia relativa (IIR) de los grupos tróficos de Trichopsetta ventralis (Goode & Bean, 1885) en el sur del golfo de México.
Variación ontogénica y amplitud de nicho. En el análisis ontogénico se manejaron siete intervalos de talla; la clase modal estuvo representada por los ejemplares de las tallas 11.1 a 12.4 cm LE (Tabla 2). Los componentes alimenticios peces estuvieron presentes en todas las clases, con una contribución cercana al 100% en las clases A y C (Tabla 3). Por su parte, los componentes Crustacea y Decapoda, fueron consumidos por los rangos de tallas de las clases C a la G (8.3-15.2 cm LE) con una contribución del 24.6 al 37%. El componente Detritus se determinó en las tallas de la C a G (7.8-13.8 cm LE). El componente otros se registró únicamente en especímenes con tallas de entre 9.7 a 15.2 cm LE (Fig. 3).
Tabla 2 Clases de talla con el número de ejemplares (n) analizados para cada intervalo de talla en longitud estándar (LE) e índice de Levin estandarizado de Trichopsetta ventralis (Goode & Bean, 1885) en el sur del golfo de México.
| Clases | n | LE (cm) | BA |
|---|---|---|---|
| A | 5 | 5.5 - 6.8 | 0.032 |
| B | 3 | 6.9 - 8.2 | 0.038 |
| C | 18 | 8.3 - 9.6 | 0.034 |
| D | 40 | 9.7 - 11.0 | 0.035 |
| E | 45 | 11.1 - 12.4 | 0.067 |
| F | 25 | 12.5 - 13.8 | 0.123 |
| G | 6 | 13.9 - 15.2 | 0.152 |
Tabla 3 Contribución porcentual de los componentes alimenticios que tipifican a las clases de talla de Trichopsetta ventralis (Goode & Bean, 1885) en el sur del golfo de México.
| Clases de talla | A | B | C | D | E | F | G |
|---|---|---|---|---|---|---|---|
| Porcentaje de similitud promedio | 47.19 | 14.06 | 33.3 | 34.61 | 34.39 | 33.47 | 24.08 |
| Peces | 68.81 | 100.00 | 55.48 | 38.65 | 46.42 | 40.75 | 38.92 |
| Saurida sp. | 31.19 | 18.28 | |||||
| Restos crustáceos | 24.64 | 33.01 | 31.44 | 36.77 | 29.54 | ||
| Decápodos | 100.00 | 100.00 | 80.12 | 71.66 | 77.87 | 77.52 | 86.74 |
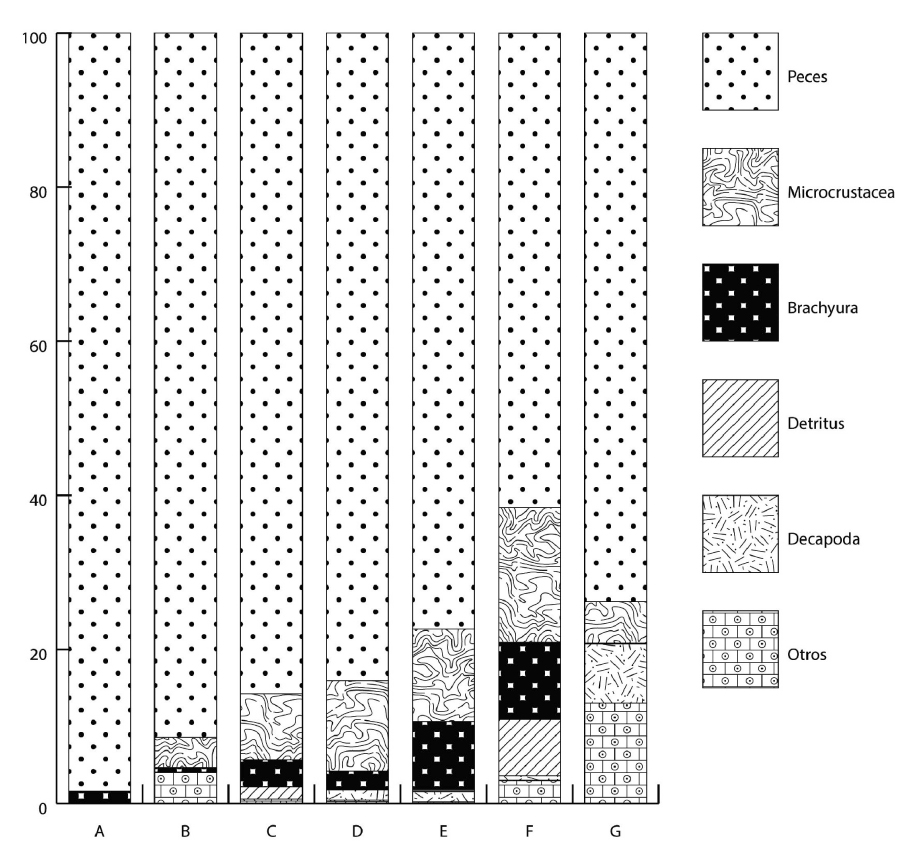
Figura 3 Variación trófica ontogenética de Trichopsetta ventralis (Goode & Bean, 1885) en el sur del golfo de México a través del valor del índice de importancia relativa (IIR).
No obstante, el gráfico MDS muestra una variación de la composición y frecuencia del alimento de las tallas A y B, con las de mayor talla (C-G) (Fig. 4), esta diferencia no es significativa (R = 0.02, p <0.029). En cuanto a la amplitud de nicho, se observa que ejemplares con tallas menores de 11.0 cm LE son más especialistas en el consumo de peces (0.03) y en donde el género Saurida sp. es el principal componente (Tabla 2). A tallas mayores (E, F y G), T. ventralis incrementa la amplitud de nicho al incorporar a los crustáceos en su alimentación. El índice de Levin estandarizado promedio (BA = 0.07) describe una alimentación con pocos grupos tróficos, y por tanto, con tendencia a la especialización.
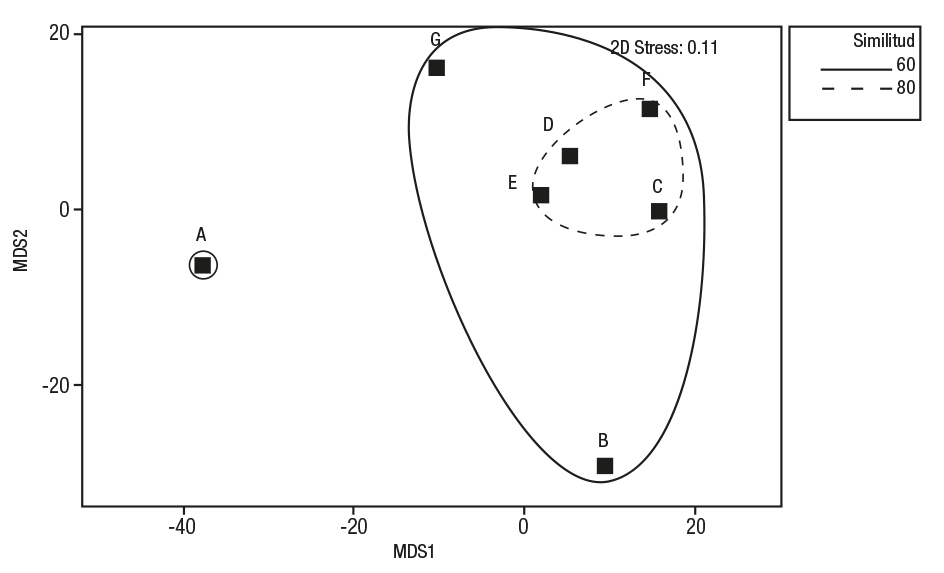
Figura 4 Análisis MDS en base a la similitud de la dieta entre clases de talla de Trichopsetta ventralis (Goode & Bean, 1885) en el sur del golfo de México. Las clases se especifican en la Tabla 2.
Discusión
Estructura trófica. Este estudio es el primero que reporta los hábitos alimenticios de la especie Trichopsetta ventralis en el SGM. Los estudios anteriores para esta especie se enfocan principalmente en la distribución y abundancia, ya sea en estado larval o como componentes en la fauna de acompañamiento en la pesquería del camarón (FAC) (Futch, 1977; Sánchez-Gil & Yañez-Arancibia, 1985; Caballero & Tello-Sandoval, 1992; Flores-Coto et al., 2009).
La elección entre los recursos disponibles de aquellos que maximizan la relación beneficio-costo, se conoce como la teoría del forrajeo óptimo (Hart, 1993). Los organismos de la familia Bothidae, al igual que otras especies del orden Pleuronectiformes, usualmente habitan enterrados en el sustrato, siempre al acecho de sus presas, por lo cual utilizan indicadores visuales para detectar el alimento, respondiendo primero a las presas en movimiento y de esta manera logran reducir el riesgo a ser depredados (Holmes & Gibson, 1983; Batty & Hoyt, 1995; Reibchert, 2003). La mayoría de las presas consumidas por especies de Bothidae, son organismos activos de hábitos bentónicos y peces demersales, o bien, de los que habitan sobre el fondo del mar, principalmente isópodos y gamáridos (Abid et al., 2013). En el Pacífico mexicano, Flores-Ortega et al. (2013) registraron un consumo significativo de crustáceos y peces para especies de esta familia de lenguados. Estos resultados coinciden con los obtenidos para T. ventralis, donde el componente peces constituye más del 67% de FO y el de mayor IIR (76.4%).
Variación ontogénica. La variación trófica a través del crecimiento es una característica común en las comunidades de peces, dicha variación en relación con la talla del predador se ha determinado en diversos estudios (Helfman, 1978; Livingston, 1984; Gerking, 1994). El análisis de los contenidos estomacales en relación con el tamaño de los peces, puso en evidencia dicha variación en la composición de la dieta de T. ventralis en el SGM. No obstante, en todas las clases de tallas se registra una mayor preferencia por el componente peces, los ejemplares de mayor tamaño presentaron una dieta con mayor amplitud trófica (0.23) en comparación con las tallas pequeñas (< 7.0 cm LE). Resultados similares se han encontrado en general para peces planos (Link et al., 2002 y 2005).
Amplitud de nicho. La amplitud del nicho trófico es un término que indica un cierto grado de generalización o especialización en los hábitos alimenticios. Trichopsetta ventralis presentó valores que refieren a una alimentación con poca amplitud de nicho trófico, por lo cual esta especie tiende a la especialización en el consumo de peces. Esta selectividad alimenticia, pero en relación a los crustáceos bénticos, también ha sido registrada para Bothus podas (Abid et al., 2013).
Estos resultados difieren de lo reportado para la mayoría de las especies de lenguados, donde se les considera oportunistas-generalistas (Beys et al., 1999; Cabral et al., 2002; Marques et al., 2009;Esposito et al., 2010), siendo capaces de aprovechar los recursos presentes sin discriminar en absoluto el alimento. Sin embargo, se tienen reportes de algunas especies que se especializan en cierto tipo de presas; este patrón en el comportamiento de la alimentación podría deberse a la capacidad de captura y su disponibilidad en el medio (Hourston et al., 2004; Teixiera et al., 2010; Flores-Ortega et al., 2013). De acuerdo con los resultados obtenidos, la relativa especialización y la dieta selectiva de T. ventralis podría ser típica de un pez que utiliza la visión o mecanismos de quimio-recepción y mecano-recepción para alimentarse, lo anterior ha sido reportado en otras especies de lenguados (Norbis & Galli, 2004).
T. ventralis presenta una alimentación especializada en el consu mo de peces, se observan variaciones ontogenéticas en relación con la frecuencia de ocurrencia para los diferentes grupos de presas. Al respecto se han registrado resultados preliminares para otras especies de bótidos que refleja un cambio en la preferencia alimenticia con el crecimiento, además de la capacidad de individuos de mayor tamaño de capturar presas más grades. La información de este estudio pue de ser útil para proporcionar una mejor comprensión del paradigma bottom-up y top-down, debido a que nos permite conocer los recursos disponibles que son utilizados por esta especie y con ello su posición dentro de la red trófica, lo que contribuye a comprender los flujos de energía y funcionalidad del gran ecosistema del golfo de México.
Trichopsetta ventralis en la región SGM es una especie con ten dencia a la especialización, con una alta preferencia alimentaria hacia el componente de peces, principalmente de la familia Synodontidae (Saurida sp.) sin variación significativa a nivel ontogénico. Sin embargo, ejemplares con tallas < 10 cm LE, presentan una menor variación en las presas consumidas con un valor del índice de Levin de 0.03, en comparación con los ejemplares de mayor talla que incluyen en su die ta, además de los peces, a diversos crustáceos, con una contribución desde un 26.6% hasta un 36.7%, que incrementa a su vez la amplitud de su dieta.











 nueva página del texto (beta)
nueva página del texto (beta)


